INTRODUCCIÓN Y OBJETIVOS: El objetivo de este estudio ha sido valorar la utilidad de la tomogammagrafía miocárdica de perfusión en los pacientes con miocardiopatía hipertrófica.
PACIENTES Y MÉTODOS: Se ha estudiado una serie consecutiva de 106 pacientes (53 ± 12 años, 50 mujeres, 66 con obstrucción dinámica) diagnosticados de miocardiopatía hipertrófica por ecocardiograma-Doppler a los que fue practicado un SPET de esfuerzo-reposo con 99mTc-tetrofosmina. De estos pacientes, 46 (43%) habían presentado dolor torácico y en 31 (29%) se indicó una coronariografía por criterios clínicos. Un 56% de enfermos seguían tratamiento con bloqueadores beta y un 23% con verapamilo.
RESULTADOS: Sólo un 8% de pacientes presentaron dolor torácico durante la prueba de esfuerzo. Se observaron defectos de perfusión en un 35% de los pacientes. Sólo 8 (26%) de los 31 enfermos cateterizados tenían enfermedad coronaria significativa (estenosis > 50%). Considerando como positivos los defectos fijos y reversibles, la sensibilidad de la tomogammagrafía para el diagnóstico de enfermedad coronaria fue del 50%, la especificidad del 65%, el valor predictivo positivo del 33% y el negativo del 79%.
CONCLUSIÓN: En más de una tercera parte de los pacientes con miocardiopatía hipertrófica, bajo tratamiento médico se observaron defectos de perfusión miocárdica. Sólo una cuarta parte de los enfermos cateterizados presentaron enfermedad coronaria a pesar de tener dolor torácico. La eficacia de la tomogammagrafía para el diagnóstico de enfermedad arterial coronaria en la miocardiopatía hipertrófica no fue aceptable, lo cual limita las posibilidades de esta exploración en este tipo de enfermos.
Palabras clave
Miocardiopatía
Gammagrafía
Isquemia
INTRODUCCIÓN
El dolor torácico es un síntoma relativamente frecuente en los pacientes con miocardiopatía hipertrófica (MH) 1, y se ha demostrado que algunos de estos enfermos pueden presentar una enfermedad arterial coronaria asociada 2-7 que, en algunos casos, puede llegar a ser la responsable de la presentación de un infarto agudo de miocardio 8,9.
La gammagrafía miocárdica de perfusión se utiliza desde hace muchos años para el diagnóstico y seguimiento de la cardiopatía isquémica 10, pero los resultados publicados con 201Tl acerca de la utilidad de esta exploración para el diagnóstico de lesiones aterosclerosas coronarias en la MH son poco concluyentes 11-21. El objetivo del presente trabajo ha sido valorar la prevalencia de defectos de perfusión en la miocardiopatía hipertrófica mediante la tomogammagrafía (SPET) miocárdica de esfuerzo con 99mTc-tetrofosmina y su utilidad para el diagnóstico de enfermedad coronaria asociada. PACIENTES Y MÉTODOS
Pacientes
De una serie consecutiva de 119 pacientes con MH, a 106 se les practicó un SPET de esfuerzo con 99mTc-tetrofosmina. Los 13 restantes fueron excluidos al no poder realizar ejercicio físico. Se apreció dolor torácico en 46 pacientes (43%) y a 31 (29%) se les había practicado una coronariografía por criterios clínicos (24 con angina ³ II y siete con disnea grado ³ III).
El diagnóstico de MH se basó en la demostración ecocardiográfica de hipertrofia ventricular izquierda (asimétrica o simétrica) en ausencia de cualquier enfermedad cardíaca o sistémica capaz de ocasionarla. Los criterios que definieron la hipertrofia fueron un grosor telediastólico de los segmentos septal y posterior ³ 15 mm y de los segmentos anterolateral y septal-posterior ³ 17 mm 22.
Prueba de esfuerzo
Todos los pacientes realizaron ejercicio en bicicleta ergométrica con monitorización electrocardiográfica continua y de presión arterial, comenzando con una carga inicial de 50 vatios e incrementos sucesivos de 25 vatios cada 3 min. La prueba se detuvo al alcanzar la frecuencia cardíaca máxima o por la aparición de angina progresiva, fatiga, arritmias graves o infradesnivel mayor de 2 mm del segmento ST.
Tomogammagrafía miocárdica de esfuerzo
Todos los casos se sometieron al protocolo de SPET con 99mTc-tetrofosmina de un solo día (protocolo corto). En el momento del máximo esfuerzo se inyectó una dosis de 8 mCi de 99mTc-tetrofosmina y se continuó el ejercicio entre 30 y 60 s. A los 30 min de finalizado el esfuerzo se obtuvieron las imágenes de ejercicio. Inmediatamente después de la adquisición de las imágenes correspondientes al esfuerzo se realizó una ingesta rica en alimentos grasos. Con un intervalo mínimo de 45 min después de la primera inyección, se administró en reposo una segunda dosis de 24 mCi de 99mTc-tetrofosmina. Las imágenes de reposo se adquirieron entre 30 y 60 min después.
Para la adquisisión de las imágenes se utilizó una gammacámara Elscint SP4, equipada con un colimador de alta resolución, baja energía y agujeros paralelos. Se obtuvieron 32 imágenes de 18 y 8 s cada una para esfuerzo y reposo, respectivamente, al recorrer 180¼ en órbita circular desde la posición oblicua anterior derecha hasta la posición oblicua posterior izquierda, en modo step-and-shoot. La ventana de energía del 20% fue centrada en los 140 keV del fotopico del 99mTc. Todas las proyecciones fueron almacenadas en un disco magnético mediante una matriz de 64 x 64 (8 bit). Las imágenes se procesaron empleando un filtro butterwoth de orden 5, frecuencia de corte 0,4 ciclos/píxel.
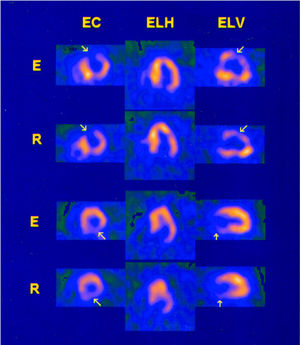
Se obtuvieron los cortes tomográficos de eje corto, eje largo horizontal y eje largo vertical, que fueron evaluados por dos expertos sin conocimiento de los resultados de la coronariografía. Se valoraron los segmentos anterobasal, anteromedial, anteroapical, inferoapical, inferior medio, inferobasal, septal basal, septal media y septal apical 10. Cuando se observó un defecto de perfusión ligero, moderado o severo en al menos dos de los tres ejes, o en tres cortes tomográficos consecutivos del mismo eje, tanto en las imágenes de esfuerzo como en las de reposo se consideraba como un «defecto fijo» (DF) (fig. 1). Si se normalizaba en las imágenes de reposo se consideraba un «defecto reversible» (DR) (fig. 2).
Fig. 1. Tomogammagrafías de esfuerzo (E) y reposo (R) de 2 pacientes con miocardiopatía hipertrófica y coronarias sanas en las que se observan defectos fijos (flechas) en la región anterior (superior) y en la región inferolateral (inferior). Obsérvese el predominio de la hipertrofia en la región septal en el primer caso y en las regiones septal y anterior en el segundo.
Fig. 2. Tomogammagrafías de esfuerzo (E) y reposo (R) de 2 pacientes con miocardiopatía hipertrófica y enfermedad coronaria de la descendente anterior (superior) y de la coronaria derecha (inferior) en las que se observan defectos reversibles (flechas) en las regiones septal e inferolateral, respectivamente. Obsérvese el predominio de la hipertrofia en la región septal en el primer caso y en las regiones septal y anterior en el segundo.
Coronariografía
A 31 pacientes se les practicó una coronariografía, indicada por criterios clínicos, mediante técnica de Seldinger, con un intervalo no superior a los 3 meses con respecto a la tomogammagrafía miocárdica. Todas las coronariografías fueron valoradas por dos hemodinamistas expertos que desconocían los resultados de la tomogammagrafía. Para el cálculo de la eficacia diagnóstica de la tomogammagrafía se consideraron las estenosis coronarias ³ 50 y ³ 70%.
Estadística
Para comparar la distribución de las variables continuas entre los pacientes con y sin dolor torácico y con y sin coronariografía se utilizó el test de la t de Student; para comparar la distribución de las variables categóricas se utilizó la prueba de la c<+f$>2<$>; para comparar la distribución de las variables dicotómicas se utilizó la prueba de la c<+f$>2<$> o la prueba exacta de Fisher si el número de individuos esperados en una o más casillas de la tabla de contingencia era inferior a cinco.
Se calcularon la sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo, el cociente de probabilidad positivo y el cociente de probabilidad negativo del SPET en relación con el resultado de la coronariografía, considerando primero los defectos fijos y reversibles como positivos de enfermedad coronaria y después sólo los reversibles. RESULTADOS
Población
No hubo diferencias significativas en las variables clínicas analizadas (sexo, edad, historia familiar de MH, historia familiar de muerte súbita, factores de riesgo coronario y obstrucción dinámica) entre los pacientes con o sin dolor torácico (tabla 1). Tampoco estas características clínicas eran diferentes entre aquellos enfermos a los que se les había practicado un cateterismo y los que no habían sido cateterizados, a excepción de la severidad de la angina, la cual predominaba en los primeros (tabla 2).
Cateterismo
Sólo 8 (26%) de los 31 pacientes con coronariografía tenían lesiones arteriales coronarias significativas. Cinco pacientes presentaban lesiones de un vaso (tres de CD y dos de DA) y 3 pacientes tenían lesiones de 2 vasos (DA más CD, DA más Cx y CD más Cx). Ningún paciente tenía enfermedad coronaria de 3 vasos ni del tronco común. Los 8 pacientes con enfermedad coronaria tenían por lo menos una estenosis coronaria ³ 70%.
Prueba de esfuerzo
Un 56% de pacientes estaban siendo tratados con bloqueadores beta en el momento de practicar la prueba de esfuerzo y un 23% con verapamilo. Sólo 9 enfermos (8%) presentaron opresión o dolor precordial durante la prueba. En un 33% de pacientes se registró un descenso del segmento ST > 1 mm durante la prueba, sin que predominara en los pacientes con dolor ni tampoco en los cateterizados. No hubo diferencias significativas en cuanto al tratamiento y parámetros ergométricos entre los pacientes con y sin dolor torácico, a excepción de un mayor porcentaje de pacientes tratados con bloqueadores beta (p < 0,000) y un menor consumo máximo de O 2 (p = 0,015) en los enfermos del primer grupo (tabla 1). Los pacientes a los que se practicó un cateterismo alcanzaron un menor consumo máximo de O 2 que los enfermos no cateterizados (tabla 2).
Tomogammagrafía miocárdica de perfusión
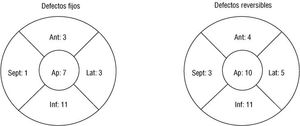
Se observaron defectos de perfusión en 37 pacientes (35%). En 18 enfermos (17%) se observaron DF y DR asociados, en 10 pacientes (10%) sólo se observaron DF y en 9 pacientes (8%) sólo se observaron DR. Ningún tipo de defecto predominó en los pacientes con descenso del segmento ST en la prueba de esfuerzo. La localización predominante, tanto de los DF como de los DR, fue la inferior y apical (fig. 3). No se observaron diferencias significativas en cuanto a la prevalencia de defectos en los pacientes con dolor torácico (tabla 1) ni tampoco en los que se practicó coronariografía (tabla 2). En 5 de los 9 pacientes que presentaron opresión o dolor torácico durante la prueba la tomogammagrafía fue negativa.
Fig. 3. Localización de los defectos fijos y de los defectos reversibles en la tomogammagrafía de perfusión de los pacientes con miocardiopatía hipertrófica.
Al considerar las estenosis coronarias ³ 50% como significativas y los DF y DR como positivos de enfermedad coronaria, la sensibilidad de la tomogammagrafía fue del 50% (IC del 95%, 17,4-82,6%), la especificidad del 65,2% (IC del 95%, 42,8-82,8%), el valor predictivo positivo del 33,3% (IC del 95%, 11,3- 64,6%), el valor predictivo negativo del 78,9% (IC del 95%, 53,9-93%), el cociente de probabilidad positivo 1,4 y el cociente de probabilidad negativo 0,77. Al considerar únicamente los DR como positivos de isquemia miocárdica la sensibilidad fue del 37,5% (IC del 95%, 10,2-74,1%), la especificidad del 87% (IC del 95%, 65,3-96,6%), el valor predictivo positivo del 50% (IC del 95%, 13,9-86,1%), el valor predictivo negativo del 80% (IC del 95%, 58,7-92,4%), el cociente de probabilidad positivo 2,9 y el cociente de probabilidad negativo 0,7. Estos resultados no variaron al considerar las estenosis coronarias ³ 70% como significativas puesto que todos los enfermos tenían, al menos, una estenosis con esta severidad.
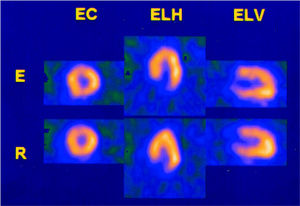
En cuatro de los cinco falsos negativos del SPET para DR el territorio de la arteria se vinculaba con la región hipertrófica más severa: un falso negativo de la DA tenía hipertrofia septal-anterior, en dos falsos negativos de la Cx la hipertrofia involucraba la región inferolateral y en un paciente con 2 vasos (DA + CD) la hipertrofia era concéntrica (fig. 4).
Fig. 4. Tomogammagrafía miocárdica de esfuerzo (E) y reposo (R) de un paciente con miocardiopatía hipertrófica concéntrica y enfermedad de 2 vasos (DA y CD) en la que no se observan defectos de perfusión.
DISCUSIÓN
Dolor torácico en los pacientes con MH
El dolor torácico es un síntoma frecuente en los pacientes con MH. Sin embargo, en la mayoría de estos enfermos no se demuestra una enfermedad arterial coronaria asociada 7. En nuestra serie, un 43% de pacientes habían presentado dolor torácico y únicamente en un 29% se había indicado una coronariografía por criterios clínicos (24 con angina y siete con disneas severas) y sólo en una cuarta parte de estos 31 pacientes cateterizados se demostró enfermedad arterial coronaria. En la bibliografía, la incidencia de lesiones coronarias superiores al 50% en los pacientes con MH oscila entre el 8 y el 19%, aunque puede llegar a afectar hasta una cuarta parte de los enfermos de más de 45 años 2,3,6.
Sólo el 8% de los pacientes estudiados presentó angina durante la prueba de esfuerzo. Esta baja prevalencia de angina durante la prueba, a pesar de tratarse de pacientes que en algún momento de su historia referían dolor torácico, podría explicarse por el alto porcentaje de enfermos que seguían tratamiento médico en el momento de realizar el estudio ergométrico: un 56% con bloqueadores beta y un 23% con verapamilo. La aparición de angina durante una prueba de esfuerzo limitada por síntomas se ha observado en una tercera parte aproximadamente de los enfermos con MH en los que se ha retirado por completo la medicación antes de la prueba 14,20,21. Aunque existen escasos datos acerca del tratamiento médico de los pacientes con MH y enfermedad coronaria asociada, se ha descrito que alrededor de dos terceras partes de los pacientes tratados con bloqueadores beta mejoran de manera significativa su sintomatología 23. Dilsizian et al 20 observaron que en un 88% de pacientes jóvenes la perfusión miocárdica mejoraba después del tratamiento.
Defectos de perfusión en los pacientescon MH
El porcentaje de defectos de perfusión observados en los pacientes con MH es variable de unos estudios a otros, desde un 39 16 hasta un 74% 18. Diversas circunstancias pueden explicar esta gran variabilidad: las diferentes características clínicas de la población, como la edad, el origen de la población, el porcentaje de formas no obstructivas, la técnica gammagráfica utilizada (planar frente a tomográfica), el tipo de estrés (esfuerzo o dipiridamol) y el tratamiento en el momento de la exploración. En nuestra serie hemos observado que los pacientes con dolor torácico recibían tratamiento con bloqueadores beta en mayor proporción que aquellos sin dolor torácico (p < 0,000), lo que ayudaría a explicar una menor sensibilidad de una prueba que está muy ligada al grado de taquicardización alcanzado 24.
Los defectos fijos observados en la MH pueden ser debidos a fibrosis o necrosis miocárdica, o también al denominado efecto de volumen parcial: la gran actividad generada en las regiones hipertróficas hace que pueda infravalorarse la captación en la zona contralateral 25. La mayor proporción de defectos fijos en las regiones inferior y lateral, que son las menos afectadas por la hipertrofia 26,27 apoyaría esta posibilidad. Se ha observado que una buena parte de los defectos fijos de pacientes con MH corresponden a formas con ventrículos más dilatados y con menor fracción de eyección, sugiriendo que la presencia de estas zonas fibróticas o necróticas favorecería la evolución de estos pacientes hacia fases más avanzadas de miocardiopatía dilatada o congestiva 15,16,21.
En nuestra serie se observaron defectos de perfusión en un 35% de los pacientes. Se observaron DF y DR en un 17% de los casos, DF en un 10% y DR en un 8%. No se observó una mayor proporción de defectos en los pacientes con dolor torácico ni tampoco en aquellos en los que se practicó coronariografía. O'gara et al 15 observaron defectos de perfusión en un 57% de los 72 pacientes estudiados mediante SPET de esfuerzo: el 24% correspondían a DF o parcialmente reversibles y el 33% a defectos totalmente reversibles. Yamada et al 21 evaluaron las tomogammagrafías miocárdicas con dipiridamol de 216 pacientes con MH y encontraron 86 (40%) con defectos, de los cuales el 25% correspondían a DF, el 22% a DR y el 7% con defectos combinados.
Se ha demostrado que los pacientes con MH tienen el flujo coronario y la reserva vascular coronaria disminuida en comparación con los sujetos normales y con pacientes con hipertrofia ventricular izquierda secundaria a hipertensión arterial sistémica 17. Debe tenerse en cuenta que, además de la arteriopatía aterosclerosa y de la reducción del flujo coronario como causa de dolor torácico en los pacientes con MH, se han descrito otros posibles mecanismos de isquemia: la reducción de la luz de las pequeñas arterias intramiocárdicas, el tamaño «inadecuado» de las arterias epicárdicas y también la compresión sistólica de las arterias perforantes septales 7.
Así pues, los defectos reversibles de perfusión en los pacientes con MH, una vez descartadas las posibles imágenes artefactuales, podrían corresponder a auténtica isquemia miocárdica. Von Dohlen et al 16 observaron una mayor incidencia de taquicardia ventricular y de trastornos de conducción que precisaron marcapasos en los pacientes con defectos de perfusión detectados mediante 201Tl planar de esfuerzo o dipiridamol, mientras que Yamada et al 21 observaron mayor incidencia de síncope en los pacientes con defectos fijos.
Limitaciones de la tomogammagrafíade perfusión para el diagnósticode enfermedad arterial coronaria asociadaa la miocardiopatía hipertrófica
Es bien conocido que en los pacientes con demostración ecocardiográfica y/o electrocardiográfica de hipertrofia ventricular izquierda, el descenso del segmento ST durante la prueba de esfuerzo convencional suele significar a menudo un falso positivo para el diagnóstico de enfermedad coronaria. Por esta razón la gammagrafía miocárdica de perfusión resultaría una exploración atractiva para este fin. Sin embargo, después de unos primeros resultados alentadores 11 se ha venido comunicando una eficacia diagnóstica baja para esta exploración 12,13. Nuestros resultados, obtenidos con tomogammagrafía de esfuerzo con 99mTc-tetrofosmina en una población de pacientes adultos y bajo tratamiento médico, parece confirmar estos resultados, ya que ha ofrecido valores bajos de sensibilidad (50%) y especificidad (65%) cuando se consideraban como positivos los defectos fijos y reversibles, y únicamente una aceptable especificidad (86%), pero con una muy baja sensibilidad (38%), cuando sólo se consideraban como positivos los defectos reversibles. El escaso número de pacientes cateterizados, la baja prevalencia de enfermedad coronaria y el subóptimo grado de esfuerzo alcanzado, que se explicaría por la misma naturaleza de la enfermedad y por el tratamiento médico con bloqueadores beta y verapamilo, contribuiría a justificar una menor sensibilidad. Otro factor importante que puede incidir en la baja sensibilidad de la técnica es la importante hipertrofia ventricular, que puede enmascarar ligeras hipocaptaciones que se detectarían claramente en presencia de un grosor normal de la pared. En nuestra serie, la mayoría de DR falsos negativos se ha observado en la región anterior, que es una de las más afectadas por la hipertrofia 26,27. CONCLUSIÓN
Nuestros resultados permiten concluir que la eficacia de la tomogammagrafía miocárdica de esfuerzo con 99mTc-tetrofosmina para el diagnóstico de enfermedad coronaria asociada a la MH en la población adulta tratada médicamente es limitada y que es probable que lo más adecuado sea recurrir directamente a la coronariografía ante una sospecha de enfermedad coronaria como causa de dolor torácico en estos enfermos.
Bibliografía
[1]
John Sutton MG, Tajik AJ, Smith HC, Ritman EL. Angina in idiopathic hypertrophic subaortic stenosis. Circulation 1980; 61: 561-568.
[2]
Spectrum of coronary artery disease in idiopathic hypertrophic subaortic stenosis. Am J Cardiol 1976; 38: 12-16.
[3]
Hemodynamics and coronary angiography in idiopathic hypertrophic subaortic stenosis. Am J Cardiol 1978; 41: 476-481.
[4]
Coexisting idiopathic hypertrophic subaortic stenosis and coronary artery disease. Clinical implication y operative management. J Thorac Cardiovasc Surg 1981; 82: 278-280.
[5]
Coronary artery disease in hypertrophic cardiomyopathy. Am J Cardiol 1985; 55: 1437-1438.
[6]
Clinical significance of coronary artery disease in hypertrophic cardiomyopathy. Am J Cardiol 1992; 70: 499-501.
[7]
Ischemia and atherosclerotic coronary artery disease in patients with hypertrophic cardiomyopathy: a review of incidence, pathophysiological mechanism, clinical implications and management strategies. Coronary Artery Dis 1996; 7: 183-187.
[8]
Acute myocardial infarction in idiopathic hypertrophic subaortic stenosis. Chest 1973; 64: 529-531.
[9]
Clinical improvement in hypertrophic cardiomyopathy after inferior myocardial infarction. J Am Coll Cardiol 1985; 5: 797-802.
[10]
Guías de actuación clínica de la Sociedad Española de Cardiología. Cardiología nuclear: bases técnicas y aplicaciones clínicas. Rev Esp Cardiol 1999; 52: 957-989.
[11]
Idiopathic hypertrophic subaortic stenosis: evaluation of anginal symptoms with thallium-201 myocardial imaging. Am J Cardiol 1979; 44: 1040-1045.
[12]
Assessment of chest pain in hypertrophic cardiomyopathy using exercise thallium-201 myocardial scintigraphy. Br Heart J 1980; 44: 650-656.
[13]
Myocardial thallium-201 imaging in hypertrophic obstructive cardiomyopathy. Eur Heart J 1981; 2: 177-185.
[14]
Thallium perfusion and cardiac enzyme abnormalities in patients with familial hypertrophic cardiomyopathy. Am Heart J 1985; 109: 1317-1322.
[15]
Myocardial perfusion abnormalities in patients with hypertrophic cardiomyopathy: assessment with thallium-201 emission computed tomography. Circulation 1987; 76: 1214-1223.
[16]
Significance of positive or negative thallium-201 scintigraphy in hypertrophic cardiomyopathy. Am J Cardiol 1989; 64: 498-503.
[17]
Decreased coronary vasodilatatory capacity in hypertrophic cardiomyopathy determined by split-dose thallium-dipyridamole myocardial scintigraphy. Am J Cardiol 1990; 65: 1131-1139.
[18]
Myocardial metabolic, hemodynamic and electrocardiographic significance of reversible thallium-201 abnormalities in hypertrophic cardiomyopathy. Circulation 1991; 83: 1660-1667.
[19]
Regional thallium-201 washout and myocardial hypertrophy in hypertrophic cardiomyopathy and its relation to exertional chest pain. Am J Cardiol 1993; 72: 211-217.
[20]
Myocardial ischemia detected by thallium scintigraphy is frequently related to cardiac arrest and syncope in young patients with hypertrophic cardiomyopathy. J Am Coll Cardiol 1993; 22: 796-804.
[21]
Dipyridamole stress thallium-201 perfusion abnormalities in patients with hypertrophic cardiomyopathy. Eur Heart J 1998; 19: 500-507.
[22]
Patterns and significance of distribution of left ventricular hypertrophy in hypertrophic cardiomyopathy. A wide-angle, two-dimensional echocardiographic study of 125 patients. Am J Cardiol 1981; 48: 418-428.
[23]
Idiopathic hypertrophic subaortic stenosis and associated coronary artery disease. Angiology 1979; 30: 585-593.
[24]
Importancia de los parámetros ergométricos en los resultados de la tomogammagrafía de perfusión miocárdica. Med Clin (Barc) 1997; 109: 406-409.
[25]
Artifacts in SPECT myocardial perfusion imaging. En: DePuey EG, Berman DS, Garcia EV, editores. Cardiac SPECT imaging. Artifacts in SPECT myocardial perfusion imaging. Nueva York: Raven Press, 1995; 169-200.
[26]
Clasificación de la miocardiopatía hipertrófica mediante ecocardiografía bidimensional. Rev Esp Cardiol 1986; 39: 358-363.
[27]
Clasificación morfológica de la miocardiopatía hipertrófica mediante tomogammagrafía miocárdica. Comparación con la clasificación ecocardiográfica. Rev Esp Cardiol 2000; 53: 511-516.