Los octogenarios representan el segmento de población de más rápida expansión en Europa; la prevalencia de la insuficiencia cardiaca (IC) en este grupo supera el 10%. Se evaluaron los cambios en las características clínicas, el tratamiento y los resultados a un año durante dos décadas en pacientes ambulatorios con IC crónica de edad ≥ 80 años incluidos en un registro nacional de cardiología.
MétodosSe incluyó a 2 520 octogenarios con mediciones de la fracción de eyección ecocardiográfica basal y seguimiento a 1 año disponibles, inscritos en 138 clínicas ambulatorias de IC (21% de los hospitales nacionales con unidades de cardiología), reclutados a lo largo de tres épocas (1999-2005, 2006-2011, 2012-2018).
ResultadosEn el momento de la inclusión, a lo largo de los 3 periodos de estudio, aumentaron la edad, el índice de masa corporal, la fracción de eyección, la prevalencia de obesidad, diabetes, dislipemia, hipertensión preexistente y la historia de fibrilación auricular. La proporción de pacientes con fracción de eyección conservada aumentó del 19,4% al 32,7% (p de tendencia <0,0001). Los marcadores de enfermedad avanzada se hicieron menos prevalentes. La prescripción de bloqueadores beta y antagonistas de los receptores de mineralocorticoides aumentó con el tiempo. Durante el seguimiento a un año, 308 pacientes fallecieron (12,2%) y 360 (14,3%) fueron ingresados por causas cardiovasculares; en total, 591 (23,5%) alcanzaron el objetivo primario combinado de mortalidad por todas las causas u hospitalización cardiovascular. Mediante un análisis multivariable ajustado, la inclusión en 2006-2011 (HR=0,70; IC95%, 0,55-0,90; p=0,004) y 2012-2018 (HR=0,61; IC95%, 0,47-0,79; p=0,0002), conllevó un menor riesgo del resultado primario que la inclusión en el periodo 1999-2005.
ConclusionesEntre los octogenarios, a lo largo de 2 décadas, la prevalencia de los factores de riesgo aumentó, las estrategias de tratamiento mejoraron, la supervivencia se mantuvo estable, pero la proporción de hospitalizados por causas cardiovasculares disminuyó. A pesar de la creciente complejidad clínica, en el ámbito de la cardiología la carga de hospitalizaciones en los ancianos con IC crónica está disminuyendo.
Palabras clave
La insuficiencia cardiaca (IC) afecta a más del 10% de las personas mayores de 80 años1. Este segmento poblacional, las personas de edad muy avanzada según la definición de la Organización Mundial de la Salud, es el grupo de más rápida expansión en Europa: se prevé que la proporción de europeos mayores de 80 años en 2019 (5,2%) aumente al 7,2% en 20302. En nuestro país, el porcentaje de octogenarios creció del 4,4 al 7,6% en las últimas 2 décadas. En el Reino Unido, la edad de los pacientes y la multimorbilidad en el cuadro clínico inicial de la IC aumentaron notablemente de 2002 a 20153. En EE. UU., se espera que el número de pacientes octogenarios con IC crezca el 66% de 2010 a 20304.
Los pacientes ancianos presentan un fenotipo de IC inconfundible, que se caracteriza por el predominio femenino, ventrículos más pequeños, valores más altos de la fracción de eyección del ventrículo izquierdo (FEVI), es decir, la IC con el fenotipo de la fracción de eyección conservada (ICFEc) y mayor carga de comorbilidad5–9. En los últimos años, en la población general con IC se ha confirmado un cambio de la IC con fracción de eyección reducida (ICFEr) al fenotipo de ICFEc10,11 simultáneamente con el aumento de la obesidad, la diabetes tipo 2, la dislipemia y la hipertensión, los factores de riesgo cardiometabólico que ofrecen el caldo de cultivo para el desarrollo de ICFEc12. No se ha descrito si en la población con IC de edad muy avanzada también se producen tendencias similares.
Los datos sobre la evolución del pronóstico en este grupo de pacientes también son limitados. Entre los pacientes ancianos ambulatorios con IC crónica13,14, la mortalidad a 1 año, aunque inferior a la de los pacientes hospitalizados por IC aguda, supera el 10%15, con mejor supervivencia en las cohortes de cardiología que en las cohortes transversales o de atención primaria.
Para contrarrestar la escasez de datos sobre las tendencias a lo largo del tiempo en el fenotipo clínico, el tratamiento y el pronóstico de los octogenarios con IC, analizamos los cambios en las características, el tratamiento farmacológico y con dispositivos, la mortalidad por cualquier causa a 1 año y las hospitalizaciones de pacientes ambulatorios mayores de 80 años inscritos en un registro nacional de IC crónica.
MÉTODOSDiseño y entorno del estudioEl IN-CHF (Italian Network on Chronic Heart Failure) es un registro nacional multicéntrico, estrictamente observacional, de pacientes con IC crónica remitidos a consultas externas de cardiología, creado en 1995 por el Grupo de Trabajo sobre Insuficiencia Cardiaca y por el Centro de Investigación de nuestra sociedad científica16. En los seminarios de formación se difundieron procedimientos normalizados para reunir e introducir datos mediante programas informáticos especiales. El protocolo fue aprobado por el comité de revisión institucional de cada centro participante. Todos los pacientes dieron su consentimiento informado para el uso científico de sus datos clínicos recopilados de forma anónima.
Este análisis se llevó a cabo con pacientes ≥ 80 años con diagnóstico de IC crónica, según la definición de las guías actualizadas de la Sociedad Europea de Cardiología17–21, a quienes se hizo un seguimiento como pacientes ambulatorios de 138 consultas externas de IC de nuestra red. Las unidades participantes representaban el 21% de los hospitales con unidades de cardiología en nuestro país y la mayor parte (59%) estaban ubicados en centros de referencia de cardiología generales o especializados con unidades coronarias y laboratorio de cateterismo; una cuarta parte también tenía instalaciones de cirugía cardiaca, y el 10% eran centros universitarios. La distribución de los centros fue el 51% en el norte, el 24% en el centro y el 25% en el sur, con un ligero desequilibrio respecto a la distribución geográfica de la población (46% en el norte, 20% en el centro y 34% en el sur).
Los pacientes se incluían en el registro cuando presentaban el cuadro clínico inicial en la consulta externa de IC, independientemente de la etapa o duración de la enfermedad. El tratamiento clínico se basó en el criterio del médico.
Se revisaron las características clínicas de los pacientes inscritos entre el 1 de enero de 1999 y el 31 de mayo de 2018 que tenían documentación ecocardiográfica basal de FEVI y datos de seguimiento prospectivo disponibles durante el primer año después de la selección.
Según el momento de la inscripción, se dividió el tiempo de estudio en 3 periodos, correspondientes aproximadamente a la implementación en el tratamiento de la IC de los ensayos históricos sobre bloqueadores beta (1999-2005) y al tratamiento con dispositivos (2006-2011) y al auge clínico de los inhibidores de la neprilisina y del receptor de la angiotensina II (2012-2018), respectivamente.
Variables y fuentes de datosEn la base de datos se introdujeron los datos personales, la historia clínica (incluida la duración de los síntomas de IC y los ingresos hospitalarios previos por IC), la clase NYHA y la etiología principal de la IC de cada paciente. Cuando había varios factores etiológicos, se identificó como causa principal la que el cardiólogo remitente consideraba predominante. La etiología isquémica de la IC se definió como antecedentes de infarto de miocardio, angina estable o inestable, revascularización coronaria percutánea o injerto de revascularización coronaria. La hipertensión previa se definió como valores altos de presión arterial (sistólica>140mmHg o diastólica>90mmHg) o uso de fármacos antihipertensivos antes del diagnóstico de IC. Los pacientes recién diagnosticados con diabetes o con hipoglucemiantes orales o insulina se definieron como diabéticos. La IC de nuevo diagnóstico se definió como un antecedente de IC<6 meses y sin ingreso por IC el año anterior.
Los fenotipos de IC se clasificaron según los valores de FEVI como ICFEr (< 40%), IC con fracción de eyección ligeramente reducida (ICFElr; 40-49%) o ICFEc (≥ 50%)21.
Los datos de laboratorio se recogieron sistemáticamente a partir de 2006. La tasa de filtrado glomerular estimado (TFGe) se calculó utilizando la fórmula del Chronic Kidney Disease Epidemiology Collaboration, que incluye edad, sexo y creatinina.
El tratamiento farmacológico dirigido por recomendaciones de IC (guideline-directed medical therapy [GDMT]) se definió como la ingesta diaria de ≥ 3 fármacos recomendados por las directrices, inhibidores del sistema renina-angiotensina (ISRA) (como los inhibidores de la enzima de conversión de la angiotensina, antagonistas de los receptores de la angiotensina, inhibidores de la neprilisina y del receptor de la angiotensina II), bloqueadores beta (BB) y antagonistas de los receptores mineralocorticoides (ARM). Las tasas de prescripción de IC-GDMT a lo largo del tiempo se compararon con las de la población general, las del subconjunto de pacientes con ICFEr y las de aquellos con FEVI ≥ 40%, que tenían una indicación clínica (hipertensión previa, diabetes, infarto de miocardio previo) de estos fármacos. El IC-GDMT se recodificó como porcentaje de las dosis objetivo22 de ISRA, BB y ARM; los pacientes se reclasificaron en función de la consecución de ≥ 50% del objetivo.
La polimedicación no relacionada con la IC se definió como la ingesta diaria de ≥ 5 fármacos, excluyendo del cálculo los fármacos GDMT23.
Resultados del estudioEl objetivo principal del estudio fue la mortalidad por cualquier causa o el ingreso hospitalario durante>24horas (pernoctación) por causas cardiovasculares (tabla 1 del material adicional). Aunque no hubo disposiciones para la validación de los objetivos, al inicio del estudio se impartió una formación específica para estandarizar la recopilación de datos. Los datos sobre ingresos se obtuvieron de los códigos de alta hospitalaria y las consultas a los médicos de atención primaria.
Características clínicas, tratamiento farmacológico y con dispositivos, y resultados por fenotipo
| ICFErn=1.226 | ICFElrn=603 | ICFEcn=691 | p de tendencia | |
|---|---|---|---|---|
| Características clínicas | ||||
| Edad (años) | 83±3 | 84±3 | 84±4 | <0,0001 |
| Sexo femenino | 377 (30,8) | 239 (39,6) | 394 (57,0) | <0,0001 |
| Fumador en activo (n=1.976) | 44 (4,6) | 26 (5,6) | 18 (3,3) | 0,31 |
| Hipertensión previa | 770 (62,8) | 428 (71,0) | 533 (77,1) | <0,0001 |
| Dislipemia | 253 (20,6) | 145 (24,1) | 135 (19,5) | 0,78 |
| Diabetes | 316 (25,8) | 193 (32,0) | 200 (28,9) | 0,07 |
| Obesidad | 121 (9,9) | 89 (14,8) | 137 (19,8) | <0,0001 |
| Ictus/AIT previo | 121 (9,9) | 60 (10,0) | 69 (10,0) | 0,93 |
| Antecedentes de IC ≥ 6 meses | 849 (69,3) | 415 (68,8) | 484 (70,0) | 0,76 |
| ≥1 ingreso por IC, año anterior | 626 (51,1) | 248 (41,1) | 297 (43,0) | 0,0001 |
| IC de nuevo diagnósticoa | 135 (11,0) | 85 (14,1) | 74 (10,7) | 0,92 |
| Etiología isquémica (n=1.067) | 630 (51,4) | 290 (48,1) | 147 (21,3) | <0,0001 |
| NYHA IIII-IV (%) | 375 (30,6) | 132 (21,9) | 192 (27,8) | 0,07 |
| Antecedentes de fibrilación auricular | 468 (38,2) | 261 (43,3) | 389 (56,3) | <0,0001 |
| Bloqueo de la rama izquierda | 304 (24,8) | 90 (14,9) | 63 (9,1) | <0,0001 |
| TFG <30 ml/min/1,73 m2 (n=1.365) | 107 (17,2) | 45 (14,1) | 44 (10,5) | 0,002 |
| Índice de masa corporal | 25,0±3,8 | 25,7±4,0 | 26,0±4,4 | <0,0001 |
| Presión arterial sistólica (mmHg) | 125±19 | 129±20 | 130±21 | <0,0001 |
| Presión arterial diastólica (mmHg) | 73±10 | 74±10 | 73±10 | 0,20 |
| Frecuencia cardiaca (lpm) | 72±14 | 71±13 | 72±14 | 0,59 |
| TFGe (ml/min/1,73 m2) (n=1.365) | 43,3±14,3 | 46,0±14,4 | 47,4±14,9 | <0,0001 |
| FEVI (%) | 30,5±5,7 | 43,0±2,8 | 57,8±6,4 | <0,0001 |
| Tratamiento farmacológico | ||||
| Polimedicación no relacionada con la ICb | 491 (40,1) | 232 (38,5) | 256 (37,1) | 0,19 |
| Furosemida | 1.141 (93,1) | 527 (87,4) | 597 (86,4) | <0,0001 |
| Furosemida ≥ 75 mg/día (n=1.823) | 364 (41,3) | 151 (36,1) | 203 (38,8) | 0,27 |
| Digitálicos | 293 (23,9) | 125 (20,7) | 155 (22,4) | 0,36 |
| Nitratos | 371 (30,3) | 163 (27,0) | 150 (21,7) | <0,0001 |
| Ivabradina | 48 (3,9) | 26 (4,3) | 8 (1,2) | 0,003 |
| Anticoagulantes orales | 467 (38,1) | 239 (39,6) | 342 (49,5) | <0,0001 |
| ISRA | 1.014 (82,7) | 477 (79,1) | 525 (76,0) | 0,0003 |
| BB | 896 (73,1) | 400 (66,3) | 429 (62,1) | <0,0001 |
| ARM | 666 (54,3) | 285 (47,3) | 303 (43,9) | <0,0001 |
| ISRA y BB | 335 (27,3) | 165 (27,4) | 187 (27,1) | 0,91 |
| ISRA y BB y ARM | 409 (33,4) | 148 (24,5) | 132 (19,1) | <0,0001 |
| Dispositivos | ||||
| TRS-E | 22 (1,8) | 11 (1,8) | 3 (0,4) | 0,02 |
| TRS-D | 89 (7,3) | 19 (3,2) | 7 (1,0) | <0,0001 |
| DAI | 193 (15,7) | 35 (5,8) | 12 (1,7) | <0,0001 |
| Resultados a 1 año | ||||
| Mortalidad por cualquier causa | 170 (13,9) | 73 (12,1) | 65 (9,4) | 0,004 |
| Mortalidad por cualquier causa u hospitalización CV | 325 (26,5) | 129 (21,4) | 137 (19,8) | 0,0005 |
| Hospitalización por cualquier causa | 294 (24,0) | 113 (18,7) | 122 (17,7) | 0,0006 |
| Hospitalización no CV | 117 (9,5) | 47 (17,8) | 52 (7,5) | 0,11 |
| Hospitalización CV | 202 (16,5) | 76 (12,6) | 82 (11,9) | 0,003 |
| Hospitalización por IC | 117 (9,5) | 41 (6,8) | 52 (7,5) | 0,08 |
AIT, accidente isquémico transitorio; ARM, antagonistas de los receptores mineralocorticoides; BB, bloqueadores beta; CV, cardiovascular; DAI, desfibrilador automático implantable; FEVI, fracción de eyección del ventrículo izquierdo; IC, insuficiencia cardiaca; ICFEc, insuficiencia cardiaca con fracción de eyección conservada; ICFElr, insuficiencia cardiaca con fracción de eyección ligeramente reducida; ICFEr, insuficiencia cardiaca con fracción de eyección reducida; ISRA, inhibidores del sistema renina-angiotensina; lpm, latidos por minuto; NYHA, New York Heart Association; TFGe, tasa de filtrado glomerular estimado; TRS-D, terapia de resincronización cardiaca con desfibrilador; TRS-E, terapia de resincronización cardiaca con electroestimulación.
Los datos se expresan como números (%) o media±desviación estándar.
Las variables cualitativas se presentan en forma de número y porcentajes, y se compararon mediante la prueba de la χ2; las variables continuas se expresan como medias y desviaciones estándar, y se compararon mediante el análisis de la varianza si la distribución es normal o la prueba de Kruskall-Wallis, en caso contrario. Las tendencias temporales se evaluaron mediante la prueba de Cochran-Armitage (variables binarias) y con el coeficiente de corrección del rango de la tau de Kendall y la prueba de Jonkheere-Terpstra (variables continuas).
Se hizo un análisis de regresión logística multivariante sobre la prescripción de ISRA que incluyó como covariables: TFGe (<30; ≥30ml/min/1,73 m2; desconocida), hiperpotasemia (<5,5; ≥5,5 mEq/l, desconocida), prescripción de ARM y BB, presión arterial sistólica y FEVI; no se tuvieron en cuenta la edad y el sexo ya que están incluidos en la fórmula.
Todos los pacientes permanecieron en observación hasta el final del duodécimo mes desde la selección o hasta su fallecimiento. Se realizó un análisis multivariante de Cox para modelar el impacto del periodo de selección en el criterio de valoración principal combinado de muerte por cualquier causa u hospitalización cardiovascular, lo que ocurriera primero, y en el objetivo secundario de mortalidad por cualquier causa, después del ajuste de las covariables que se habían asociado con el pronóstico en la bibliografía previa. Estas incluían datos personales (edad, sexo), antecedentes de IC (etiología hipertensiva, isquémica u otra de la IC, antecedentes de IC>6 meses, ≥1 ingreso por IC el año anterior), comorbilidades (antecedentes de fibrilación auricular, hipertensión previa, diabetes o ictus/accidente isquémico transitorio previo), manifestaciones clínicas (clase III-IV de la NYHA, índice de masa corporal, presión arterial sistólica, frecuencia cardiaca o FEVI), tratamientos de la IC (furosemida, ISRA, BB, ARM, implante de desfibrilador automático/terapia de resincronización cardiaca-desfibrilador) y polimedicación no relacionada con la IC. Además, en un segundo modelo, los fármacos recomendados por las guías se consideraron juntos como la variable binaria IC-GDMT.
Los pacientes se clasificaron en función de la toma de IC-GDMT o polimedicación no relacionada con la IC, como una variable cualitativa de 4 entradas: ninguna (grupo de referencia), IC-GDMT (solo), polimedicación no relacionada con la IC (solo) o ambas. Las curvas de Kaplan-Meier ajustadas directamente por mortalidad por cualquier causa u hospitalización cardiovascular de acuerdo con la variable anterior de polimedicación se obtuvieron mediante un análisis de regresión de Cox estratificado. El modelo se ajustó para las variables que fueron estadísticamente significativas en un análisis previo de Cox con selección retrospectiva. Se obtuvo un valor de p simultáneo para probar la hipótesis nula de no diferencia entre las curvas.
Todas las pruebas fueron bilaterales; un valor p <0,05 se consideró estadísticamente significativo. Todos los análisis se hicieron con el software del sistema SAS, versión 9.4.
RESULTADOSCaracterísticas clínicasDe 1999 a 2018, se incluyó a 2.520 pacientes con IC crónica ≥ 80 años en el registro IN-CHF; 1.010 (40,1%) eran mujeres. En total, 1.226 (48,7%) tenían ICFEr, 691 (27,4%) tenían ICEFc y 603 (23,9%) tenían ICFElr. Como se muestra en la tabla 1, los grupos de fenotipos se diferenciaban principalmente en datos sociodemográficos y características como la prevalencia de obesidad, hipertensión previa, fibrilación auricular, etiología isquémica y disfunción renal. Los tratamientos farmacológicos, específicamente los fármacos moduladores neurohormonales, eran diferentes. Los pacientes con ICFEr tuvieron las peores tasas de resultados.
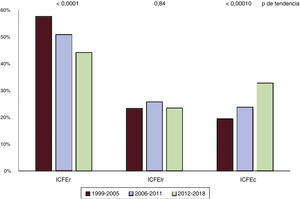
La tabla 2 describe las tendencias de las características clínicas durante los 3 periodos de estudio. Con el tiempo, la distribución por sexo, el tabaquismo, la prevalencia de ictus previo/accidente isquémico transitorio, el infarto de miocardio, el hemibloqueo del ventrículo izquierdo y la proporción de pacientes con IC de nuevo diagnóstico no cambiaron considerablemente. Al contrario, de acuerdo con el cambio fenotípico observado de ICFEr a ICFEc (figura 1), la media de edad, el índice de masa corporal y la FEVI aumentaron gradualmente, mientras que la prevalencia de obesidad, diabetes, dislipemia, hipertensión previa y antecedentes de fibrilación auricular, así como la proporción de pacientes isquémicos a quienes se les había revascularizado percutánea o quirúrgicamente, aumentaron progresivamente a lo largo de los periodos.
Cambios en las características clínicas a lo largo del tiempo
| 1999-2005n=547 | 2006-2011n=659 | 2012-2018n=1.314 | p de tendencia | |
|---|---|---|---|---|
| Edad (años) | 83±3 | 84±3 | 84±3 | <0,0001 |
| Sexo femenino | 211 (38,6) | 270 (41,0) | 529 (40,3) | 0,59 |
| Fumador en activo (n=1.976) | 10 (3,1) | 27 (5,7) | 51 (4,3) | 0,72 |
| Hipertensión previa | 286 (52,3) | 442 (67,1) | 1.003 (76,3) | <0,0001 |
| Dislipidemia | 54 (9,9) | 131 (19,9) | 348 (26,5) | <0,0001 |
| Diabetes | 120 (21,9) | 181 (27,5) | 408 (31,1) | <0,0001 |
| Obesidad | 53 (9,8) | 85 (13,1) | 209 (16,0) | 0,0003 |
| Ictus/AIT previo | 53 (9,8) | 69 (10,5) | 128 (9,7) | 0,93 |
| Antecedentes de IC ≥6 meses | 321 (58,7) | 463 (70,3) | 964 (73,4) | <0,0001 |
| ≥1 ingreso por IC el año anterior | 334 (61,1) | 304 (46,1) | 533 (40,6) | <0,0001 |
| IC de nuevo diagnóstico* | 75 (13,7) | 74 (11,2) | 145 (11,0) | 0,13 |
| Etiología isquémica (n=1.067) | 250 (45,7) | 292 (44,3) | 525 (40,0) | 0,01 |
| Isquémica, IM previo | 179 (71,6) | 238 (81,5) | 391 (74,5) | 0,74 |
| Isquémica, ICP previa | 40 (16,0) | 97 (33,2) | 266 (50,7) | <0,0001 |
| Isquémica, revascularización coronaria | 40 (16,0) | 79 (27,1) | 140 (26,7) | 0,004 |
| NYHA IIII-IV (%) | 182 (33,3) | 185 (28,1) | 332 (25,3) | ,0005 |
| Antecedentes de fibrilación auricular | 142 (26,0) | 282 (42,8) | 694 (52,8) | <0,0001 |
| Bloqueo de la rama izquierda | 101 (18,5) | 122 (18,5) | 234 (17,8) | 0,70 |
| TFG <30 ml/min/1,73 m2(n=1.365) | ND | 50 (14,7) | 146 (14,3) | 0,85 |
| Índice de masa corporal | 24,8±3,6 | 25,4±4,1 | 25,7±4,2 | <0,0001 |
| Presión arterial sistólica (mmHg) | 134±22 | 128±20 | 124±18 | <0,0001 |
| Presión arterial diastólica (mmHg) | 77±10 | 74±9 | 71±10 | <0,0001 |
| Frecuencia cardiaca | 75±15 | 73±14 | 70±13 | <0,0001 |
| TFGe (ml/min/1,73 m2) (n=1.365) | ND | 45±13 | 45±15 | 0,48 |
| FEVI | 38±13 | 40±12 | 43±13 | <0,0001 |
AIT, accidente isquémico transitorio; FEVI, fracción de eyección del ventrículo izquierdo; IC, insuficiencia cardiaca; ICP, intervención coronaria percutánea; IM, infarto de miocardio; ND, no disponible; NYHA, New York Heart Association; TFGe, tasa de filtrado glomerular estimado.
Los datos se expresan como números (%) o media±desviación estándar.
aPacientes sin ingreso el año anterior; inicio de síntomas <6 meses.
La proporción de pacientes con marcadores clínicos de enfermedad grave, como los ingresos recientes por IC y los síntomas de la clase III-IV de la NYHA, se redujo. En los últimos periodos, había más pacientes que tenían un largo historial de síntomas de IC y niveles más bajos de presión arterial y frecuencia cardiaca.
Tratamientos farmacológico y con dispositivosSe observaron cambios temporales importantes (tabla 3) en los tratamientos prescritos en las 3 cohortes.
Cambios en el tratamiento farmacológico y con dispositivos a lo largo del tiempo
| 1999-2005 n=547 | 2006-2011 n=659 | n=1.314 | p de tendencia | |
|---|---|---|---|---|
| Tratamiento farmacológico | ||||
| Polimedicación no relacionada con la ICa | 133 (24,3) | 200 (30,4) | 646 (49,2) | <0,0001 |
| Furosemida | 474 (86,7) | 588 (89,2) | 1.203 (91,6) | 0,001 |
| Furosemida ≥75 mg/día (n=1.823) | 47 (27,3) | 155 (34,1) | 516 (43,1) | <0,0001 |
| Digitálicos | 244 (44,6) | 168 (25,5) | 161 (12,3) | <0,0001 |
| Nitratos | 263 (48,1) | 223 (33,8) | 198 (15,1) | <0,0001 |
| Ivabradina | 0 (0,0) | 3 (0,5) | 79 (6,0) | <0,0001 |
| Anticoagulantes orales | 112 (20,5) | 228 (34,6) | 708 (53,9) | <0,0001 |
| ISRA (dosis para n=1.390) | 471 (86,1) | 553 (83,9) | 992 (75,5) | <0,0001 |
| En ISRA a una dosis objetivo ≥50% | 32 (19,1) | 62 (16,9) | 103 (12,0) | 0,004 |
| BB (dosis disponible n=1.442) | 211 (38,6) | 435 (66,0) | 1.079 (82,1) | <0,0001 |
| En BB a una dosis objetivo ≥ 50% | 3 (2,9) | 16 (4,8) | 82 (8,2) | 0,007 |
| ARM | 257 (47,0) | 277 (42,0) | 720 (54,8) | <0,0001 |
| ISRA + BB | 99 (18,1) | 216 (32,8) | 372 (28,3) | 0,0004 |
| ISRA + BB + ARM | 82 (15,0) | 152 (23,1) | 455 (34,6) | <0,0001 |
| Indicación de tratamiento farmacológico de clase I | ||||
| ACO, antecedents de FA (n=1.118) | 64 (45,1) | 166 (58,9) | 609 (87,8) | <0,0001 |
| ISRA ICFEr (n=1.226) | 273 (86,9) | 288 (86,2) | 453 (78,4) | 0,0004 |
| ISRA, FEVI ≥40%b (n=1.092) | 147 (89,6) | 228 (82,9) | 490 (75,0) | <0,0001 |
| BB, ICFEr (n=1.226) | 144 (45,9) | 248 (74,3) | 504 (87,2) | <0,0001 |
| ARM, FEVI <35% (n=801) | 114 (51,4) | 101 (47,4) | 235 (64,2) | 0,0007 |
| ISRA + BB, ICFEr (n=1.226) | 62 (19,8) | 117 (35,0) | 156 (27,0) | 0,0896 |
| ISRA + BB + ARM, ICFEr (n=1.226) | 65 (20,7) | 99 (29,6) | 245 (42,4) | <0,0001 |
| Dispositivos | ||||
| TRS-E | 2 (0,4) | 4 (0,6) | 30 (2,3) | 0,0004 |
| TRS-D | 0 0 (0,0) | 18 (2,7) | 97 (7,4) | <0,0001 |
| DCI | 16 (2,9) | 40 (6,1) | 184 (14,0) | <0,0001 |
ACO, anticoagulantes orales; ARM, antagonistas de los receptores mineralocorticoides; BB, bloqueadores beta; DAI, desfibrilador automático implantable; FA, fibrilación auricular; FEVI, fracción de eyección del ventrículo izquierdo; IC, insuficiencia cardiaca; ICFEr, insuficiencia cardiaca con fracción de eyección reducida; ISRA, inhibidores del sistema renina-angiotensina; TRS-D, terapia de resincronización cardiaca con desfibrilador; TRS-E, terapia de resincronización cardiaca con electroestimulación
Los datos se expresan como números (%).
La prescripción de digoxina y nitrato disminuyó, mientras que se trató a más pacientes con furosemida y, entre estos, la proporción de aquellos que recibieron ≥75mg/d mostró una tendencia al aumento. La prescripción de anticoagulantes orales, ARM y BB aumentó considerablemente por término medio, mientras que la consecución de las dosis de GDMT objetivo, aunque en aumento, continuó siendo limitada.
En particular, se observó una tendencia opuesta en el caso de las recetas de ISRA y la proporción en la dosis objetivo, que disminuyó significativamente en la cohorte de 2012 a 2018. Para explorar los posibles motivos de esta tendencia divergente, se llevó a cabo una regresión logística multivariante en la prescripción de ISRA. Entre las covariables detalladas en el apartado «Métodos», la prescripción de ISRA se asoció independientemente con la función renal (TFGe <30ml/min/1,73 m2; odds ratio [OR], 0,27; intervalo de confianza del 95% [IC95%], 0,20-0,38; p <0,0001), presión arterial sistólica (OR por un aumento de 5mmHg, 1,08; IC95%, 1,05-1,11; p <0,0001), FEVI (OR por un aumento de 5 unidades, 0,91; IC 95%, 0,87-0,94; p <0,0001) y ARM (OR, 0,81; IC95%, 0,66-1,00; p=0,049).
La prescripción de IC-GDMT y, sobre todo, el tratamiento combinado de ISRA-BB-ARM fue coherentemente más alta en todos los momentos en pacientes con ICFEr cuando se ajustó a la cohorte general (tabla 3). El porcentaje de polimedicación no relacionada con la IC también aumentó considerablemente a lo largo de los periodos.
La proporción de pacientes que llevaban dispositivos implantados en el momento de la incorporación reflejaba las decisiones de tratamiento tomadas antes de la selección, es decir, a una edad más temprana y posiblemente en una etapa previa de la enfermedad, y creció notablemente a lo largo de los periodos.
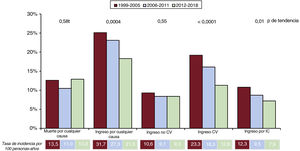
Incidencia y predictores de resultadosDurante el seguimiento a 1 año, 308 pacientes murieron (12,2%) y 529 (21,0%) fueron hospitalizados al menos una vez: 216 (8,6%) por causas no cardiovasculares, 360 (14,3%) por causas cardiovasculares y 210 (8,3%) por empeoramiento de la IC. La mortalidad por cualquier causa no cambió en los 3 periodos (figura 2). La proporción de pacientes hospitalizados durante 1 año, en general, por causas cardiovasculares y por descompensaciones por IC disminuyó considerablemente (figura 2), mientras que el porcentaje de pacientes admitidos por causas no cardiovasculares fue similar en todas las cohortes.
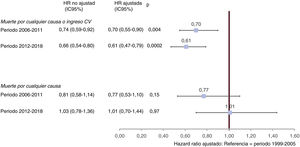
En total, 591 pacientes (23,5%) alcanzaron el objetivo principal combinado de mortalidad por cualquier causa u hospitalización cardiovascular. En el análisis multivariante, la inscripción de 2006-2011 (hazard ratio [HR] 0,70; IC95%, 0,55-0.90; p=0,004) y de 2012-2018 (HR, 0,61; IC95%, 0,47-0,79; p=0,0002) conllevó menor riesgo de objetivo principal que la inscripción en 1999-2005 después del ajuste de los factores pronósticos reconocidos, considerando la FEVI como una variable continua (figura 3, tabla 2 del material adicional). Los resultados fueron semejantes cuando los valores de corte de la FEVI de diferentes fenotipos de IC se incluyeron en el modelo (HR de la cohorte 2006-2011, 0,69; IC95%, 0,54-0,88; p=0,003; y HR de la cohorte 2012-2018, 0,60; IC95%, 0,47-0,78; p <0,0001).
Asociación del periodo de selección con el resultado. Modelos de Cox ajustado y no ajustado. * Ajustado por edad, sexo, etiología de la insuficiencia cardiaca (IC), duración de los antecedentes de IC, ingreso por IC el año anterior, antecedentes de fibrilación auricular, hipertensión previa, diabetes, ictus previo/accidente isquémico transitorio, clase III-IV de la NYHA, índice de masa corporal, presión arterial sistólica, frecuencia cardiaca (lpm), FEVI (%), furosemida, inhibidores del sistema renina-angiotensina, betabloqueantes, antagonistas de los receptores mineralocorticoides, terapia de cardioversión-desfibrilador automático implantable/resincronización cardiaca con desfibrilador y polimedicación no relacionada con la IC; las covariables se seleccionaron en función de la relevancia clínica y los resultados previos de la bibliografía.
La IC-GDMT incluida en el mismo modelo que una variable compuesta se asoció con menor riesgo de mortalidad u hospitalización cardiovascular (HR, 0,76; IC95%, 0,63-0,91; p=0,002).
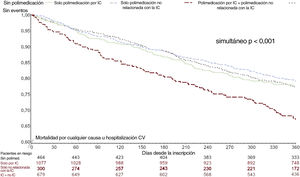
La figura 4 presenta las curvas de supervivencia ajustadas directas del objetivo principal en los 4 grupos de ingesta de polimedicación: los pacientes con polimedicación no relacionada con la IC sola tuvieron el peor pronóstico (HR, 1,57 frente a sin polimedicación, IC95%, 1,18-2,09; p=0,002).
Curvas de Kaplan-Meier de mortalidad por cualquier causa u hospitalización cardiovascular según la complejidad del tratamiento farmacológico, ajustadas por edad, fracción de eyección, presión arterial sistólica, periodo de estudio, etiología de la insuficiencia cardiaca, clase de la NYHA, hospitalización por insuficiencia cardiaca el último año, antecedentes de hipertensión (covariables significativas por selección de pasos hacia atrás en regresión de Cox multivariante). IC, insuficiencia cardiaca.
Los datos del registro nacional cierran una brecha de evidencia al proporcionar nueva evidencia sobre la evolución de las características y resultados durante las últimas 2 décadas de los octogenarios, un segmento poblacional en auge en los países occidentales que lleva el mayor peso de mortalidad y morbilidad de la IC (figura 5).
Nuestra cohorte octogenaria comparte el peculiar perfil clínico descrito anteriormente en los ancianos, aunque, según la selección y el seguimiento en el entorno de la cardiología especializada, la prevalencia femenina (40%) fue inferior a la de la población anciana general con IC5–9. Nuestros nuevos hallazgos confirman en los pacientes de edad más avanzada el aumento comunicado de la ICFEc10,11 como efecto propio del envejecimiento de la población, el aumento de la prevalencia de factores de riesgo cardiometabólico16 y la disminución de los niveles de incidencia de ICFEr con la mejora en el tratamiento del infarto de miocardio. El descenso de la presión arterial y los niveles de la frecuencia cardiaca, probablemente la expresión de una enfermedad de larga duración y una aplicación más estricta del tratamiento farmacológico, sugieren que a los octogenarios se les ha administrado un tratamiento más agresivo en los últimos periodos, con un mayor consumo de BB e ISRA, y estrategias de descongestión potenciadas.
Cambios en el tratamientoLos pacientes mayores de 80 años han estado infrarrepresentados en los ensayos clínicos, lo que genera incertidumbre sobre la eficacia de los tratamientos fundamentales de la ICFEr en esta población24. Es posible que la aplicación estricta de las guías no mejore los resultados de los pacientes muy ancianos, cuyo pronóstico está más seriamente afectado por la comorbilidad concurrente25. El seguimiento cuidadoso y la adaptación terapéutica derivada de la implementación de cambios institucionales en las consultas externas multidisciplinarias de IC, a través de una red nacional y educación dirigida por personal de enfermería, así como las intervenciones terapéuticas, merecen gran parte del mérito, del progreso en la atención a una población tan delicada.
En nuestros octogenarios, se aplicaron de manera coherente a lo largo del tiempo 2 tratamientos fundamentales para la IC, ARM y BB, y anticoagulantes en pacientes con fibrilación auricular.
Los niveles de tratamiento fueron superiores a los de la población general con IC del Reino Unido3 y a los del registro PINNACLE de EE. UU.26, y se equiparaban a los datos del
European Observational Research Program Heart Failure Long-Term Registry 2011-
2016 de pacientes con una mediana de edad de 66 años14, excepto en el caso de ISRA. Los investigadores de CHECK8 también notificaron niveles de prescripción más altos de BB que de ISRA entre los octogenarios con ICFEr visitados en las consultas externas de Países Bajos de IC de 2013 a 2016,. La descongestión agresiva, como sugiere la prescripción más frecuente de furosemida a dosis altas27 en 2012-2018, y sus efectos adversos concomitantes de hipotensión en el contexto de la insuficiencia renal ofrecen una posible justificación de la reducción a lo largo del tiempo de la prescripción y dosificación de ISRA: en nuestra serie, las probabilidades de una prescripción de ISRA más baja se asociaron con variables que reflejan una combinación de posible intolerancia, interferencia de fármacos e indicación dudosa28. Si se tiene en cuenta que 1 de cada 5 de nuestros octogenarios no recibió ISRA o BB, la evidencia de la evolución del beneficio y los bajos niveles de eventos adversos de los inhibidores de SGLT2 en pacientes con IC, independientemente del nivel de la FEVI29,30, allanan el camino22 a nuevas estrategias de priorización de fármacos para mejorar el tratamiento de pacientes ancianos con IC.
Evolución del pronósticoNumerosas muestras de cohortes comunitarias de 1990 a 2013 han comunicado constantemente resultados muy desfavorables en los ancianos con IC15 sin cambios en la mortalidad 15,26,31. La mortalidad a 1 año en nuestra cohorte más reciente (2012-2018) fue del 12,9%, un exceso de mortalidad relativamente pequeño en comparación con la cifra del 11,6% de nuestro Censo Nacional de 201732 entre los pacientes de 80 a 94 años. En la población general de este grupo de edad, la IC puede representar una de las muchas comorbilidades y síndromes geriátricos que influyen en la supervivencia, mientras que los pacientes frágiles confinados en casa, aquellos con problemas logísticos y de transporte u otras comorbilidades más graves y priorizadas, tienen menos probabilidades de asistir a las consultas externas y recibir un tratamiento especializado.
Nuestros datos del registro muestran una reducción considerable a lo largo de 2 décadas de la proporción de octogenarios con IC que ingresaron de nuevo durante el primer año después de la selección. De acuerdo con los hallazgos previos en los ensayos de cardiología33, las causas no cardiovasculares representaron más de una tercera parte de los reingresos, una proporción que no cambió con el tiempo. La disminución de las hospitalizaciones, paralela al consumo de anticoagulantes orales, BB y ARM, y, en menor medida, a la terapia de resincronización cardiaca, estuvo íntegramente ligada a los reingresos por causas cardiovasculares y, en especial, por descompensación de la IC. Además, dado que el riesgo de ictus y la hospitalización por IC son semejantes en pacientes con fibrilación auricular e ICFEr o ICFEc34, el uso de la anticoagulación podría haber contribuido sustancialmente a la reducción de la proporción de hospitalizaciones cardiovasculares en los fenotipos de nuestra serie. La reducción de la morbilidad representa un logro fundamental en un grupo de pacientes que puede centrarse en la calidad en lugar de hacerlo en la cantidad de vida restante, sobre todo cuando es altamente sintomática35.
Las tendencias favorables en los resultados observadas en las últimas 2 décadas de nuestra serie probablemente se verán profundamente alteradas por el impacto desproporcionado de la pandemia en los pacientes ancianos con IC36,37. Además, aunque la intervención de la telemedicina puede ser factible durante los periodos de acceso personal restringidoa las consultas externas, sin aumentos en los encuentros hospitalarios posteriores o la mortalidad38, es probable que los pacientes de mayor edad, que se enfrentan a barreras sensoriales y cognitivas en el uso de la tecnología, requieran condiciones específicas para acceder a la atención a distancia.
Desentrañar el impacto de la polimedicaciónLa fragilidad y la polimedicación son muy prevalentes y están relacionadas con resultados adversos en los ancianos39,40. Para explicar la doble importancia de la polimedicación, un marcador de mayor prescripción de GDMT y de complejidad clínica, en nuestro entorno de clínica ambulatoria de IC, se analizaron por separado los 2 componentes del tratamiento. El aumento al doble de la proporción de pacientes con polimedicación no relacionada con la IC apunta a la creciente multimorbilidad y complejidad clínica de los pacientes seleccionados en estas 2 décadas. Los pacientes con polimedicación no relacionada con la IC que no recibieron IC-GDMT tuvieron el peor pronóstico incluso después del ajuste multivariante, lo que sugiere que en nuestra cohorte esta categoría puede abarcar factores de confusión no medidos vinculados a la fragilidad. Además, dado que la polimedicación puede provocar un descenso del cumplimiento terapéutico y conllevar mayor riesgo de eventos adversos relacionados con los fármacos, una conciliación precisa y completa de la medicación y no prescribir medicamentos innecesarios deben ser el objetivo principal durante el seguimiento ambulatorio, para evitar hospitalizaciones innecesarias en este estrato de edad.
LimitacionesNuestros datos provienen de un registro observacional a largo plazo, que no permite conclusiones sobre la causalidad. No pueden aplicarse a la población octogenaria general, ya que estar en seguimiento por especialistas podría representar per se un sesgo de selección. Los cambios en los métodos diagnósticos a lo largo del tiempo podrían haber tenido un impacto en los valores de FEVI, junto con una mayor concienciación de la ICFEc como entidad clínica en la práctica de la cardiología y cambios en la precisión de la codificación del alta hospitalaria. Los datos de laboratorio se recopilaron sistemáticamente solo en las 2 cohortes más recientes. Los péptidos natriuréticos, que parecen mantener su valor como marcador de gravedad y resultados en los ancianos, no estaban disponibles. No se recogió información sobre la privación socioeconómica, la calidad de vida o el deterioro cognitivo, sensorial o motor, que son dimensiones importantes con valor pronóstico en la evaluación de las poblaciones geriátricas41.
CONCLUSIONESDurante un periodo de 20 años, las características y los resultados de los octogenarios inscritos en un registro nacional de IC han cambiado considerablemente y reflejan las variaciones demográficas, la evolución de los factores de riesgo cardiovascular y una mejora en la aplicación del tratamiento con BB, ARM y dispositivos eléctricos. La supervivencia de los octogenarios se ha mantenido estable a lo largo del tiempo y, por término medio, cercana a la de la población general del mismo grupo de edad, mientras que la proporción de ingresos en el hospital por causas cardiovasculares se redujo. Estos datos sugieren que, a pesar de la creciente complejidad del paciente, en el contexto de la cardiología la carga de la IC en los ancianos está disminuyendo.
FINANCIACIÓNDesde el inicio de la Red Italiana sobre la Insuficiencia Cardiaca en línea (anteriormente registro IN-CHF), las siguientes empresas han apoyado en parte el registro: Merck Sharpe & Dohme (1995-2015); Novartis (2004-2010); Abbott, Medtronic (2007-2010); Abbott, Daiichi Sankyo, Medtronic, Servier y Vifor (2017-2019).
CONTRIBUCIÓN DE LOS AUTORESR. De Maria y L. Gonzini tuvieron acceso completo a todos los datos en el estudio y se responsabilizan de la integridad de los datos y de la precisión del análisis de los datos. Concepción y diseño: R. De Maria, M. Iacoviello, M. Gori y M. Marini. Obtención, análisis e interpretación de datos: M. Benvenuto, L. Cassaniti, A. Municinò, A. Navazio, E. Ammirati, G. Leonardi, N. Pagnoni, L. Montagna, M. Catalano, P. Midi, A.M. Floresta y G. Pulignano. Redacción del original: R. De Maria, M. Gori y L. Gonzini. Revisión crítica del original sobre contenido intelectual importante: M. Benvenuto, L. Cassaniti, A. Municinò, A. Navazio, E. Ammirati, G. Leonardi, N. Pagnoni, L. Montagna, M. Catalano, P. Midi, A.M. Floresta y G. Pulignano. Análisis estadístico: L. Gonzini. Supervisión: M. Iacoviello.
CONFLICTO DE INTERESESM. Benvenuto, L. Cassaniti, M. Catalano, R. De Maria, A.M. Floresta, L. Gonzini, M. Gori, M. Iacoviello, G. Leonardi, M. Marini, L. Montagna, A. Municinò, P. Midi, A. Navazio, N. Pagnoni y G. Pulignano no tienen ningún conflicto de intereses que declarar. E. Ammirati informa de honorarios personales de KINIKSA PHARMACEUTICAL durante la realización del estudio.
La insuficiencia cardiaca (IC) afecta a más del 10% de las personas mayores de 80 años, el segmento poblacional de más rápido crecimiento en Europa. Los datos sobre la tendencia de la prevalencia de los factores de riesgo, el tratamiento farmacológico y los resultados entre los octogenarios con IC crónica son escasos.
¿QUÉ APORTA DE NUEVO?Durante 2 décadas, la prevalencia de los factores de riesgo cardiovascular y el fenotipo de IC conservada aumentaron, mientras que los tratamientos recomendados se aplicaron de manera constante. Aunque la edad en el momento de la selección y la polimedicación aumentaron, la supervivencia a 1 año permaneció estable, mientras que la proporción de pacientes hospitalizados por causas cardiovasculares se redujo. Cada vez se trata más a los octogenarios en entornos de cardiología, con una reducción de la morbilidad, a pesar de la creciente complejidad clínica.
Los autores desean expresar su gratitud a los profesores Luigi Tavazzi y Aldo P. Maggioni, por plantar la semilla y atender a la Red Italiana sobre la Insuficiencia Cardiaca con un compromiso incesante durante un cuarto de siglo.