Palabras clave
INTRODUCCION
La hemocromatosis es una enfermedad que cursa con un anormal depósito de ferritina en una serie de órganos (corazón, hígado, páncreas y gónadas) y que puede aparecer como consecuencia de una alteración genética o idiopática, en asociación con un defecto en la síntesis de hemoglobina con eritropoyesis ineficaz, en hepatopatías crónicas y como resultado de importantes cantidades de aporte de hierro durante varios años como consecuencia de repetidas transfusiones de sangre. Una acumulación significativa de ferritina en el miocardio puede producir disfunción ventricular sistólica y diastólica, así como arritmias1.
Las manifestaciones cardíacas aparecen en un tercio de los pacientes y casi en la misma proporción fallecen por una complicación cardíaca, especialmente en jóvenes2.
CASO CLINICO
Mujer de 36 años con anemia sideroblástica congénita tratada con múltiples transfusiones desde la infancia, que le había ocasionado secundariamente una hemosiderosis hepática, hipogonadismo hipogonadotropo, diabetes mellitus insulinodependiente, tromboflebitis de repetición, un síndrome de Banti que requirió esplenectomía y desde el punto de vista cardíaco había presentado varios episodios de fibrilación auricular paroxística y episodios aislados de taquicardia ventricular no sostenida, con estudios ecocardiográficos que demostraban una función ventricular normal y ecogenicidad septal, estando en tratamiento con flecainida, bloqueadores beta y acenocumarol, junto con quelantes de hierro en el momento del ingreso.
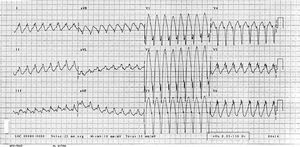
Acudió al servicio de urgencias por un cuadro de palpitaciones acompañadas de reacción vegetativa y síncope. En la exploración física inicial presentó: hipotensión (90/50 mmHg), signos de hipoperfusión periférica, auscultación cardíaca con latidos cardíacos rítmicos a una frecuencia aproximada de 200 lat/min y auscultación pulmonar normal, hepatomegalia de 3 cm y edemas en extremidades. El electrocardiograma demostró una taquicardia de complejos QRS anchos a una frecuencia de 200 lat/min con eje a 60º, morfología de bloqueo completo de rama izquierda con algunos complejos de fusión (fig. 1). El diagnóstico inicial fue de taquicardia ventricular con inestabilidad hemodinámica, por lo que se procedió a cardioversión eléctrica con 100 julios pasando a ritmo sinusal a 70 lat/min con eje a 60º y con isquemia subepicárdica en derivaciones precordiales (que desapareció a las pocas horas). Fue ingresada en la unidad coronaria y se inició tratamiento con amiodarona intravenosa.
Fig. 1. ECG en el ingreso en el que se observa una taquicardia regular de QRS ancho.
En la analítica realizada destacaban 10 g/dl de hemoglobina y 545.000 plaquetas; la curva de marcadores de necrosis miocárdica era normal; así mismo, se halló glucosuria, una ligera proteinuria y un aumento de la ferritina y del porcentaje de saturación de la transferrina.
La ecocardiografía puso de manifiesto un diámetro diastólico de ventrículo izquierdo de 58 mm y un diámetro sistólico de 41 mm, fracción de eyección (FE) de 50%, ecorrefringencia septal, patrón de llenado diastólico restrictivo con E > A, insuficiencia mitral y tricuspídea de grado II/IV, dilatación de ventrículo derecho con defectos de repleción (imágenes «en mordisco») en la punta, presión arterial pulmonar sistólica estimada de 32 mmHg y pericardio posterior con aumento de ecogenicidad.
El cateterismo cardíaco practicado pocos días después demostró una dilatación de las 4 cavidades cardíacas, ventrículo izquierdo dilatado con FE 23%, insuficiencia mitral y tricuspídea de grado II/IV, zonas de hipodensidad en la pared libre de ventrículo derecho y punta de ventrículo izquierdo (fig. 2), presiones pulmonares sistólica, media y diastólica de 35/21/18, índice cardíaco de 2,5 l/min/m, presiones de ventrículo izquierdo de 125/18, ventrículo derecho de 35/5, aurícula derecha 2, aurícula izquierda 16 y arterias coronarias normales.
Fig. 2. Ventriculografía derecha e izquierda y en proyección oblicua anterior derecha en la que se aprecia la dilatación biventricular, así como defectos de repleción en el ventrículo derecho.
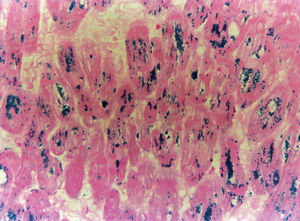
Se realizó una biopsia endomiocárdica en el ápex, tracto de salida de ventrículo derecho y septo, que demostró depósitos de hierro con la tinción de Perls (fig. 3).
Fig. 3. Biopsia endomiocárdica del ventrículo derecho en la que se aprecian depósitos de pigmento férrico en el miocardio con tinción de Perls.
La resonancia magnética nuclear toracoabdominal demostró imágenes de depósito de hierro en el hígado, pero no en el miocardio.
Con estos datos se estableció el diagnóstico de miocardiopatía dilatada secundaria a depósitos de hierro con deterioro severo de la función ventricular sistólica y alteración restrictiva diastólica.
Se realizó un estudio electrofisiológico (EEF), en el que con 3 extraestímulos en el ápex (ciclos de 500-260-200-200) se desencadenó una taquicardia ventricular monomorfa sostenida a 170 lat/min, con morfología de bloqueo de rama izquierda con eje derecho que se suprimía con sobrestimulación ventricular; tras la infusión de procainamida se volvió a desencadenar una taquicardia ventricular sostenida a 190 lat/min, con morfología de bloqueo de rama izquierda y distinto eje a la anterior, con hipotensión y síncope.
Ante la presencia de taquicardias ventriculares sostenidas sincopales, tanto espontáneas como inducibles en el estudio electrofisiológico, en una paciente con una miocardiopatía dilatada con una clase funcional I de la NYHA y función sistólica severamente deprimida, se valoraron las distintas opciones de tratamiento de las taquicardias ventriculares, una vez descartada la ablación por presentar TV de más de 2 morfologías y la posibilidad de presentar varios focos. Finalmente se decidió la implantación de un desfibrilador automático implantable que se llevó a cabo sin complicaciones.
DISCUSION
La hemocromatosis es una enfermedad relativamente rara que está originada por un excesivo depósito de hierro en diversos órganos. Puede tener un origen primario, por un defecto genético transmitido con carácter autosómico recesivo en el cromosoma 6, o ser secundaria a hepatopatía crónica, defectos en la síntesis de hemoglobina o transfusiones repetidas en pacientes con anemias, generalmente congénitas presentes desde la infancia, como es el caso que presentamos, con una anemia sideroblástica que había precisado múltiples transfusiones.
Para que aparezcan manifestaciones cardíacas se precisan concentraciones elevadas de depósito de ferritina en el músculo cardíaco que sean capaces de originar una alteración en la función ventricular o alteraciones en el estado electrofisiológico en las aurículas y/o los ventrículos3.
En nuestro caso, las repetidas transfusiones desde la edad infantil habían facilitado la acumulación excesiva de hierro en el miocardio, como pudo comprobarse en el estudio histopatológico. La manifestación clínica más habitual de la hemocromatosis cardíaca es una insuficiencia cardíaca congestiva en forma de disfunción sistólica, aunque también puede manifestarse con un patrón restrictivo3.
Otras manifestaciones clínicas, no infrecuentes, son taquiarritmias supraventriculares, bloqueo auriculoventricular, extrasistolia ventricular (excepcionalmente taquicardia ventricular sostenida), síncope y muerte súbita4,5.
Nuestro caso había presentado, con anterioridad al ingreso, episodios recurrentes de taquiarritmias supraventriculares controladas con flecainida y se había constatado una función ventricular conservada en la ecocardiografía. Sin embargo, meses más tarde, aunque la paciente no manifestaba síntomas ni presentaba signos de insuficiencia cardíaca, la función ventricular se deterioró, tanto la sistólica como la diastólica, y se generaron arritmias ventriculares potencialmente letales. Una posible explicación del deterioro de la función ventricular de un ingreso a otro puede haber sido las frecuentes transfusiones recibidas en este período que determinaron una acumulación mayor de hierro ventricular, aunque la discrepancia existente entre la FE ecocardiográfica y la ventriculografía que apareció en pocos días bien podría ser debida a los distintos métodos de cálculo. La taquicardia ventricular sostenida no es una arritmia frecuente4,5, pero puede ser letal, especialmente cuando es sincopal y se acompaña de un deterioro severo de función ventricular, como es el caso que presentamos.
El diagnóstico de hemocromatosis se sospecha cuando existe una elevación de ferritina sérica y un aumento en la relación entre sideremia total y capacidad total de unión al hierro. La afección cardíaca puede sospecharse en pacientes con el diagnóstico de hemocromatosis que presentan en la ecocardiografía un patrón anormal de función ventricular asociado a engrosamiento de paredes y ecogenicidad de las mismas6, o bien, en la resonancia magnética nuclear (RMN) por imágenes sugestivas con una especificidad todavía por establecer; pero el diagnóstico definitivo se hace por biopsia endomiocárdica, en la que se aprecia depósito de hierro en el sarcoplasma de los miocitos, siendo más frecuente encontrar depósitos en aquellos pacientes con deterioro de la función ventricular7.
Como sucedió en nuestro caso, la RMN no detectó datos de depósito de hierro y, sin embargo, la biopsia demostró inequívocamente el exceso de acumulación del mismo.
El tratamiento de la hemocromatosis secundaria por transfusiones repetidas se lleva a cabo con quelantes de hierro. La insuficiencia cardíaca se trata de forma convencional, la prevención de taquiarritmias auriculares con fármacos antiarrítmicos del grupo IA o IC, si no existe disfunción ventricular sistólica, o tipo III si se acompaña de disfunción.
En relación al tratamiento de las taquiarritmias ventriculares sostenidas sincopales, existen pocos casos descritos en la bibliografía5,8, por lo que el tratamiento más adecuado está por establecer; así sólo se ha comunicado un caso con una fibrilación ventricular desencadenada en un estudio electrofisiológico en un paciente que había presentado como manifestación inicial un síncope, implantándose finalmente un desfibrilador automático8.
Consideramos que nuestro caso, portador de una hemocromatosis cardíaca significativa confirmada, reunía criterios de alto riesgo para muerte súbita como edad temprana, disfunción ventricular sistólica y taquicardia ventricular espontánea e inducida de tipo sincopal, por lo que se decidió la implantación de un desfibrilador automático. Además, otras alternativas como la ablación se descartaron por presentar una taquicardia ventricular de dos morfologías diferentes, con alta probabilidad de generarse en otras áreas teniendo en cuenta la amplia infiltración miocárdica en el ventrículo derecho.
Correspondencia: Dr. J.L. Moríñigo Muñoz. Torres Villarroel, 16, 6.° A. 37005 Salamanca. Correo electrónico: jlmori@eresmas.com Recibido el 26 de enero de 2001. Aceptado para su publicación el 5 de abril de 2001.