La eficacia angiográfica y clínica de los stents liberadores de rapamicina sin polímero frente a los liberadores de paclitaxel con polímero sigue siendo motivo de debate. En nuestro estudio se compararon las medidas de eficacia angiográficas y clínicas de los stents liberadores de rapamicina sin polímero frente a los liberadores de paclitaxel con polímero.
MétodosSe combinaron los datos de pacientes procedentes del estudio clínico aleatorizado ISAR-TEST (prueba de equivalencia entre dos stents farmacoactivos respecto al implante de stent intracoronario y reestenosis angiográfica) y el estudio clínico LIPSIA Yukon (comparación aleatorizada de stents farmacoactivos liberadores de rapamicina sin polímero frente a liberadores de paclitaxel con polímero en pacientes con diabetes mellitus). El criterio de valoración angiográfico (primario) fue la pérdida luminal tardía en el stent entre los 6 y los 9 meses. Los criterios de valoración clínicos (secundarios) fueron: infarto de miocardio o muerte, muerte cardiaca o infarto de miocardio, revascularización de la lesión tratada e infarto de miocardio.
ResultadosEl estudio incluyó a un total de 686 pacientes (stents liberadores de rapamicina sin polímero [n=345] frente a stents liberadores de paclitaxel con polímero [n=341]) y 751lesiones (stents liberadores de rapamicina sin polímero [n=383] frente a stents liberadores de paclitaxel con polímero [n=368]). La angiografía de control (606 lesiones [80,6%]) mostró una pérdida luminal tardía en el stent comparable entre los dos tipos de stents estudiados (0,53 ± 0,59mm en los stents sin polímero frente a 0,46 ± 0,57mm en stents con polímero; p=0,15). La mediana de seguimiento fue de 34,8 meses. Los stents liberadores de rapamicina sin polímero y los liberadores de paclitaxel con polímero se asociaron con similares riesgos de muerte o infarto de miocardio (riesgo relativo =1,17; intervalo de confianza del 95%, 0,49-2,80; p=0,71); muerte cardiaca o infarto de miocardio (riesgo relativo =1,17; intervalo de confianza del 95%, 0,72-1,89; p=0,50); revascularización de la lesión que hay que tratar (riesgo relativo =0,98; intervalo de confianza del 95%, 0,65-1,47; p=0,93) e infarto de miocardio (riesgo relativo =1,79; intervalo de confianza del 95%, 0,85 3,76; p=0,12).
ConclusionesEn este análisis combinado, los valores de eficacia angiográfica y clínica fueron similares para los stents liberadores de rapamicina sin polímero y los liberadores de paclitaxel con polímero.
Palabras clave
Los stents farmacoactivos (SFA), comparados con los metálicos no farmacoactivos, reducen la necesidad de nueva revascularización durante el seguimiento1. Sin embargo, en ocasiones hay que volver a intervenir el vaso tratado, y el entusiasmo inicial despertado por los SFA se ha mitigado un poco ante los resultados obtenidos en estudios de seguimiento a largo plazo2. Los principales componentes de los SFA son el fármaco, la estructura de soporte, metálica o inorgánica, y el polímero3. Los polímeros permanentes (no degradables) se utilizan para ligar el fármaco (ya sea de la familia limus o no) a la estructura, lo que permite que se libere paulatinamente para prolongar la duración de su efecto contra la reestenosis. Sin embargo, los polímeros permanentes no se degradan tras la elución del fármaco y están implicados en respuestas inflamatorias crónicas en el sitio del implante y en el desarrollo de eventos clínicos adversos tardíos4,5.
Entre las estrategias para evitar las consecuencias de los polímeros permanentes, se puede destacar el uso de polímeros biodegradables, los SFA bioabsorbibles y los SFA sin polímero. A diferencia de los SFA con polímero, los SFA sin polímero utilizan la superficie del filamento (strut) mecánicamente modificada para ligar el fármaco sin recurrir a un polímero. Varios ensayos han estudiado stents sin polímero que liberan el fármaco inmunosupresor rapamicina7. Sin embargo, publicaciones recientes han puesto en duda su eficacia angiográfica y clínica respecto a los stents liberadores de paclitaxel con polímero (polymer-based paclitaxel-eluting stents [PB-PES]), especialmente en subgrupos de población de alto riesgo.
Nuestro grupo realizó un análisis actualizado y combinado, con datos de pacientes (individual patient-level), a partir de los ensayos clínicos aleatorizados ISAR-TEST (prueba de equivalencia entre dos SFA respecto al implante de stent intracoronario y reestenosis angiográfica) y LIPSIA Yukon9,10—comparación aleatorizada de stents liberadores de rapamicina sin polímero (polymer-free sirolimus-eluting stents [PF-SES]) frente a PB-PES, en pacientes con diabetes mellitus—. El objetivo principal de nuestro estudio es comparar las medidas de eficacia angiográficas y clínicas de los PF-SES frente a los PB-PES8. Además, se compararon estas medidas en ciertos subgrupos de especial interés.
MÉTODOSPoblación de pacientes y protocolo del estudioEl diseño de los ensayos clínicos ISAR-TEST y LIPSIA Yukon, así como las características de los pacientes incluidos en ellos, ya se han descrito con anterioridad9,10 y se enumeran en detalle en la tabla 1 del material adicional. De forma resumida, ambos ensayos clínicos eran prospectivos, multicéntricos y controlados, se asignó al azar a los pacientes a recibir un PF-SES (Yukon o Yukon Choice, Translumina GmbH; Hechingen, Alemania) o un PB-PES (Taxus Express 2 o Taxus Liberté, Boston Scientific; Natick, Massachusetts, Estados Unidos). La inclusión se completó en el año 2006 para el ISAR-TEST y en 2008 para el LIPSIA Yukon. Se consideró candidatos a los pacientes con edad ≥ 18 años que presentaran angina estable o inestable o resultados positivos en la prueba de esfuerzo; por último, la intervención coronaria percutánea estaba indicada para lesiones de novo (≥50%) en una arteria coronaria nativa. En el ensayo LIPSIA Yukon, sólo se incluyó a pacientes con diabetes mellitus. En ambos ensayos clínicos se estableció obligatoriamente el uso del mismo tipo de stent aleatorizado en los casos en que había múltiples lesiones o era preciso utilizar múltiples stents. Los principales criterios de exclusión fueron: infarto de miocardio (IM) reciente (≤48h después de la aparición de los síntomas), una lesión que tratar o estenosis significativa (≥50%) en el tronco principal izquierdo y contraindicaciones o alergias conocidas a medios de contraste, ácido acetilsalicílico, heparina, tienopiridinas, rapamicina, paclitaxel o acero inoxidable. Los trastornos graves de agregación plaquetaria o de hemostasis, el embarazo, la participación en otro estudio y las comorbilidades graves (p. ej., cáncer) también se consideraron criterios de exclusión.
Proceso de aleatorización e intervenciónAmbos estudios recibieron la aprobación del comité de ética de las instituciones participantes y los pacientes dieron su consentimiento informado por escrito. Después de confirmar los criterios de inscripción y pasar la guía de angioplastia a través de la lesión, se aleatorizó a los pacientes a los distintos grupos de tratamiento. En el ensayo ISAR-TEST se usó un ordenador para generar de manera aleatoria una lista que se precintó en sobres opacos; en el ensayo LIPSIA Yukon se utilizó un sistema de aleatorización a través de internet. La asignación al azar no se estratificó en ninguno de los ensayos. Se asignó a los pacientes a recibir un PF-SES o un PB-PES: ya se ha descrito detalladamente el PF-SES en otras publicaciones6,11. El ensayo ISAR-TEST utilizó una estructura de soporte Yukon de primera generación, mientras que el LIPSIA Yukon usó la plataforma de segunda generación (Yukon Choice). Aunque hubo diferencias triviales en el espesor del filamento (115μm en la primera generación y 87μm en la segunda), la cantidad total de fármaco utilizada para el proceso de recubrimiento se mantuvo uniforme (el 2% de solución de rapamicina). Dicha concentración de rapamicina ha mostrado la mayor eficacia contra la reestenosis en hallazgos anteriores6. Las dos plataformas de PB-PES utilizadas en los dos ensayos (Taxus Express 2 en ISAR-TEST y Taxus Liberté en LIPSIA Yukon) se han demostrado equivalentes en varias ocasiones12. Para el propósito de estos ensayos, los PF-SES tenían diámetros de 2,0-3,5mm y longitudes de 8-25mm; los PB-PES, diámetros de 2,25-3,50mm y longitudes de 8-32mm. El tratamiento periprocedimiento estándar consistió en ácido acetilsalicílico y heparina no fraccionada (100UI/kg), además de la administración de inhibidores de la glucoproteína IIb/IIIa, si estaba clínicamente indicada. Se administró una dosis de carga de 600mg de clopidogrel antes de la intervención. Se administraron otros fármacos cardioactivos a criterio del médico responsable. Después del alta, los pacientes recibieron tratamiento de antiagregación doble durante un mínimo de 6 meses y hasta 12 meses. La terapia con ácido acetilsalicílico se prescribió de por vida.
Seguimiento y gestión de datosA todos los pacientes se les pidió realizar seguimiento con angiografía coronaria transcurridos entre 6 y 9 meses desde la aleatorización, o antes si sufrieran angina de pecho. El análisis coronario cuantitativo de las angiografías al inicio del estudio, tras el implante y durante el seguimiento (v. material adicional para más detalles) lo realizó personal especializado sin conocimiento del tratamiento asignado. Se recogieron los datos clínicos pertinentes, se verificaron con la documentación de origen y se introdujeron en una base de datos informática. Los eventos adversos se adjudicaron mediante comités establecidos para este propósito y enmascarados respecto al proceso de aleatorización de pacientes9,10.
Para el presente análisis, los datos de todos los pacientes incluidos en las publicaciones originales se combinaron en una base de datos diseñada específicamente para este estudio. Los datos individuales se transfirieron sin identificación del paciente al centro de investigación ISAR (Deutsches Herzzentrum; Múnich, Alemania). Se verificó el conjunto de datos final en cuanto a integridad y coherencia y se comparó los resultados con las publicaciones originales. Los datos se gestionaron según el principio de intención de tratar.
Definiciones de los criterios de valoraciónEn las publicaciones originales, tanto en el ensayo ISAR-TEST como en el LIPSIA Yukon se determinó que el tamaño de la muestra era adecuado para estudiar la no inferioridad angiográfica de los PF-SES respecto a los PB-PES. Para los fines del presente análisis, el objetivo de valoración angiográfico (primario) fue la pérdida luminal tardía (PLT) en el stent entre los 6 y los 9 meses, determinada mediante examen invasivo. Los objetivos de valoración clínicos (secundarios) fueron: muerte o IM, muerte cardiaca o IM y revascularización de la lesión tratada e IM. Las definiciones por protocolo se adoptaron según el seguimiento más largo disponible (tabla 2 del material adicional). ISAR-TEST publicó la incidencia de trombosis del stent (TS) confirmada (mediante angiografía), mientras que LIPSIA Yukon publicó tanto la TS confirmada como la probable. Para facilitar un mayor grado de especificidad13, en nuestro análisis combinado sólo se consideraron las TS confirmadas14.
Análisis estadísticoSe combinaron las bases de datos de pacientes (patient-level data) de ambos ensayos. La combinación de datos se consideró factible porque los criterios de inclusión y exclusión y la definición de los objetivos de valoración eran comparables en ambos ensayos. Además, los grupos de tratamiento en los ensayos originales estaban perfectamente equilibrados, de acuerdo con la asignación aleatoria de los tratamientos9,10.
Los datos de las variables categóricas se expresan como recuentos y porcentajes y se compararon mediante la prueba de la χ2 o la exacta de Fisher, donde los valores esperados de las celdas eran < 5. Los datos de variables continuas se expresan como media ± desviación estándar y se compararon mediante la prueba de la t de Student, cuando los datos presentaban una distribución normal, o la prueba de la suma de rangos de Wilcoxon.
Se utilizó el método de Mantel-Cox para estratificar el ensayo y ayudar con el análisis de los criterios de valoración clínicos. Los resultados se agruparon de acuerdo con el método de DerSimonian y Laird para efectos aleatorios15. No se pudo evaluar los efectos del tratamiento en los ensayos en que no se había observado el evento de interés en ninguno de los grupos de tratamiento. En los ensayos en que sólo uno de los grupos de tratamiento no presentaba eventos de interés, la aproximación de la estimación del efecto del tratamiento y su error estándar se realizó a partir de tablas de contingencia 2×2, después de añadir 0,5 a cada celda. Se censuraron los datos de pacientes que no habían presentado el evento de interés en la última visita de seguimiento. El riesgo relativo (RR) y su intervalo de confianza del 95% (IC95%) se utilizaron como estadístico de resumen. La heterogeneidad en los estudios se comprobó mediante el índice I2. Esta prueba describe el porcentaje de variaciones totales en un ensayo que surgen debido a la heterogeneidad en vez de al azar. Como guía, los valores de I2 < 25% indican heterogeneidad baja; en 25-50% indican heterogeneidad moderada, y valores >50% indican que la heterogeneidad es elevada16. Debido al reducido número de ensayos incluidos, no se consideró el sesgo de publicación. Un análisis exploratorio evaluó los criterios de valoración angiográficos y clínicos en los subgrupos de interés. Los subgrupos se expresan como variables dicotómicas. En cada subgrupo, la primera variable sirvió de referencia para los cálculos. En concreto, el grado de PLT, así como el RR y su IC95% de muerte o IM, muerte cardiaca o IM, revascularización de la lesión e IM se evaluaron según el sexo, la edad (por debajo/por encima del valor de la mediana), la existencia de diabetes mellitus, el tratamiento con insulina, presentación inestable y tamaño del vaso (por debajo/por encima del valor medio). Además, se exploró la posible interacción entre el efecto del tratamiento (recibir un PF-SES o un PB-PES) y la pertenencia o no a cada subgrupo mediante un modelo de regresión lineal para la PLT en el stent, y el método de Mantel-Cox para otros criterios de valoración. Todos los análisis se realizaron por intención de tratar.
En los pacientes del ensayo ISAR-TEST que presentaban lesiones múltiples, se incluyó en el análisis sólo la primera lesión tratada. Aunque este método puede introducir un sesgo, se aplicó para reducir la dependencia entre lesiones del riesgo de reestenosis en los pacientes sometidos a implante de stents coronarios en varias lesiones17. En el ensayo LIPSIA Yukon, se adoptó una ligera modificación del análisis por intención de tratar para los datos angiográficos: sólo se incluyó en el análisis a los pacientes que recibieron al menos un stent del estudio en la lesión que tratar.
Este análisis combinado de los ensayos ISAR-TEST y LIPSIA Yukon se realizó post-hoc. Además, puesto que en el momento de la asignación aleatoria en cada ensayo no había estratificación, la utilidad de los resultados de los análisis de subgrupos se limita a la generación de hipótesis.
Todas las pruebas fueron bilaterales y un valor de p<0,05 indicaba significación. Los análisis estadísticos se realizaron con el software estadístico Stata 10.0 (STATA Corp.; College Station, Texas, Estados Unidos).
RESULTADOSEn el ensayo ISAR-TEST, tras la asignación aleatoria en dos centros participantes, 225 pacientes recibieron PF-SES y otros 225, PB-PES9. En el ensayo LIPSIA Yukon10, tres centros asignaron aleatoriamente a 120 pacientes a recibir PF-SES y a otros 120 a PB-PES. No se pudo incluir en el análisis a 4 de los pacientes inscritos en el ensayo LIPSIA Yukon (2 retiraron su consentimiento y a otros 2 se los había aleatorizado dos veces). Por lo tanto, y para el presente estudio, se incluyó a un total de 686 pacientes (99,4%) de los 690 originalmente asignados al azar en el análisis (PF-SES, n=345 frente a PB-PES, n=341) (fig., material suplementario). El número total de lesiones tratadas fue de 751 (PF-SES, n=383 frente a PB-PES, n=368).
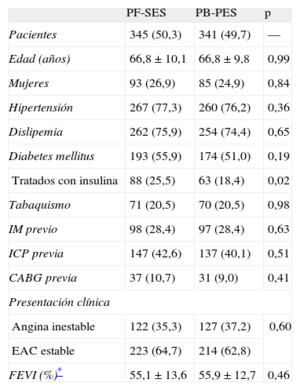
Las características clínicas al inicio del estudio estaban bien equiparadas entre los grupos (tabla 1). Se observó una elevada prevalencia de diabetes mellitus en la población combinada (el 55,9% para PF-SES y el 51,0% para PB-PES; p=0,19) y la proporción de pacientes tratados con insulina fue mayor entre los pacientes aleatorizados a PF-SES que entre los PB-PES (el 25,5 frente al 18,4%; p=0,02).
Análisis combinado de los ensayos clínicos ISAR-TEST y LIPSIA Yukon. Características clínicas
| PF-SES | PB-PES | p | |
| Pacientes | 345 (50,3) | 341 (49,7) | — |
| Edad (años) | 66,8 ± 10,1 | 66,8 ± 9,8 | 0,99 |
| Mujeres | 93 (26,9) | 85 (24,9) | 0,84 |
| Hipertensión | 267 (77,3) | 260 (76,2) | 0,36 |
| Dislipemia | 262 (75,9) | 254 (74,4) | 0,65 |
| Diabetes mellitus | 193 (55,9) | 174 (51,0) | 0,19 |
| Tratados con insulina | 88 (25,5) | 63 (18,4) | 0,02 |
| Tabaquismo | 71 (20,5) | 70 (20,5) | 0,98 |
| IM previo | 98 (28,4) | 97 (28,4) | 0,63 |
| ICP previa | 147 (42,6) | 137 (40,1) | 0,51 |
| CABG previa | 37 (10,7) | 31 (9,0) | 0,41 |
| Presentación clínica | |||
| Angina inestable | 122 (35,3) | 127 (37,2) | 0,60 |
| EAC estable | 223 (64,7) | 214 (62,8) | |
| FEVI (%)* | 55,1 ± 13,6 | 55,9 ± 12,7 | 0,46 |
CABG: cirugía de revascularización aortocoronaria; EAC: enfermedad de la arteria coronaria; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IM: infarto de miocardio; PB-PES: stents liberadores de paclitaxel con polímero; PF-SES: stents liberadores de rapamicina sin polímero.
Los datos se expresan como n (%) o media ± desviación estándar. Se consideró significativo p<0,05.
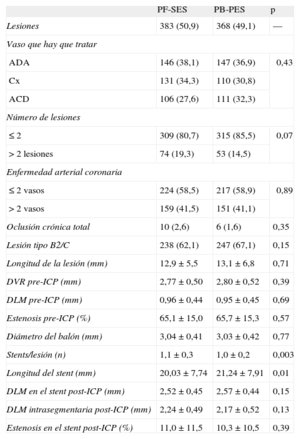
Los datos angiográficos se aparearon adecuadamente entre los grupos de tratamiento (tabla 2); sólo hubo pequeñas diferencias respecto a la razón stents/lesiones (1,1 ± 0,3 frente a 1,0 ± 0,2; p=0,003) y la longitud media del stent (20,03 ± 7,74mm los PF-SES frente a 21,24 ± 7,91mm los PB-PES; p=0,01). Estas discrepancias se debieron a diferencias en las dimensiones de los stents disponibles en los ensayos; consideramos poco probable que tengan importancia clínica. Es de señalar que se trató una gran proporción de lesiones complejas (B2/C): el 62,1% en el grupo de PF-SES frente al 67,1% en el de PB-PES (p=0,15).
Análisis combinado de los ensayos de ISAR-TEST y LIPSIA Yukon. Características angiográficas y de procedimiento
| PF-SES | PB-PES | p | |
| Lesiones | 383 (50,9) | 368 (49,1) | — |
| Vaso que hay que tratar | |||
| ADA | 146 (38,1) | 147 (36,9) | 0,43 |
| Cx | 131 (34,3) | 110 (30,8) | |
| ACD | 106 (27,6) | 111 (32,3) | |
| Número de lesiones | |||
| ≤2 | 309 (80,7) | 315 (85,5) | 0,07 |
| >2 lesiones | 74 (19,3) | 53 (14,5) | |
| Enfermedad arterial coronaria | |||
| ≤2vasos | 224 (58,5) | 217 (58,9) | 0,89 |
| >2 vasos | 159 (41,5) | 151 (41,1) | |
| Oclusión crónica total | 10 (2,6) | 6 (1,6) | 0,35 |
| Lesión tipo B2/C | 238 (62,1) | 247 (67,1) | 0,15 |
| Longitud de la lesión (mm) | 12,9 ± 5,5 | 13,1 ± 6,8 | 0,71 |
| DVR pre-ICP (mm) | 2,77 ± 0,50 | 2,80 ± 0,52 | 0,39 |
| DLM pre-ICP (mm) | 0,96 ± 0,44 | 0,95 ± 0,45 | 0,69 |
| Estenosis pre-ICP (%) | 65,1 ± 15,0 | 65,7 ± 15,3 | 0,57 |
| Diámetro del balón (mm) | 3,04 ± 0,41 | 3,03 ± 0,42 | 0,77 |
| Stents/lesión (n) | 1,1 ± 0,3 | 1,0 ± 0,2 | 0,003 |
| Longitud del stent (mm) | 20,03 ± 7,74 | 21,24 ± 7,91 | 0,01 |
| DLM en el stent post-ICP (mm) | 2,52 ± 0,45 | 2,57 ± 0,44 | 0,15 |
| DLM intrasegmentaria post-ICP (mm) | 2,24 ± 0,49 | 2,17 ± 0,52 | 0,13 |
| Estenosis en el stent post-ICP (%) | 11,0 ± 11,5 | 10,3 ± 10,5 | 0,39 |
ACD: arteria coronaria derecha; ADA: arteria coronaria descendente anterior izquierda; Cx: arteria circunfleja izquierda; DLM: diámetro luminal mínimo; DVR: diámetro del vaso de referencia; ICP: intervención coronaria percutánea; PB-PES: stents liberadores de paclitaxel con polímero; PF-SES: stents liberadores de rapamicina sin polímero.
Los datos expresan n (%) o media±desviación estándar. Se consideró significativo p<0,05.
De los 686 pacientes sometidos a implante de PF-SES o PB-PES, 552 (80,4%) regresaron para someterse a angiografía de seguimiento. De los que no regresaron, 24 pacientes habían fallecido (13 [19,4%] en el grupo PF-SES y 11 [16,4%] en el de PP-PSE; p=0,94). Así pues, se midió un total de 606 lesiones (80,6%).
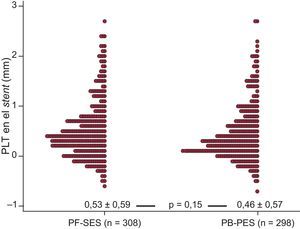
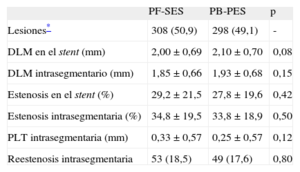
En cuanto a la PLT en el stent, no hubo diferencias significativas entre los grupos de PF-SES y PB-PES (0,53 ± 0,59 frente a 0,46±0,57mm; p=0,15) (fig. 1). Otros elementos de la evaluación angiográfica se enumeran en la tabla 3. Llama la atención que la reestenosis binaria intrasegmentaria sea similar en los grupos de PF-SES y PB-PES (el 18,5 frente al 17,6%; p=0,80).
Distribución de la pérdida luminal tardía en el stent (diagrama de puntos) en el seguimiento angiográfico de los dos grupos de estudio.
PB-PES: stents liberadores de paclitaxel con polímero; PF-SES: stents liberadores de rapamicina sin polímero; PLT: pérdida luminal tardía. Los datos acumulados se presentan como media ± desviación estándar y se compararon con la prueba de suma de rangos de Wilcoxon.
Análisis combinado de los ensayos ISAR-TEST y LIPSIA Yukon. Otros elementos de la evaluación angiográfica
| PF-SES | PB-PES | p | |
| Lesiones* | 308 (50,9) | 298 (49,1) | - |
| DLM en el stent (mm) | 2,00 ± 0,69 | 2,10 ± 0,70 | 0,08 |
| DLM intrasegmentario (mm) | 1,85 ± 0,66 | 1,93 ± 0,68 | 0,15 |
| Estenosis en el stent (%) | 29,2 ± 21,5 | 27,8 ± 19,6 | 0,42 |
| Estenosis intrasegmentaria (%) | 34,8 ± 19,5 | 33,8 ± 18,9 | 0,50 |
| PLT intrasegmentaria (mm) | 0,33 ± 0,57 | 0,25 ± 0,57 | 0,12 |
| Reestenosis intrasegmentaria | 53 (18,5) | 49 (17,6) | 0,80 |
DLM: diámetro luminal mínimo; PB-PES: stents liberadores de paclitaxel con polímero; PF-SES: stents liberadores de rapamicina sin polímero; PLT: pérdida luminal tardía.
Los datos expresan n (%) o media ± desviación estándar. Se consideró significativo p<0,05.
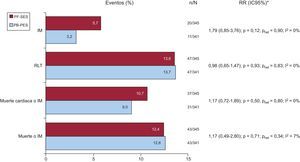
El seguimiento clínico se completó en todos los pacientes (mediana, 34,8meses). No se observaron diferencias significativas en los resultados de PF-SES frente a PB-PES con respecto a muerte o IM (el 12,4 frente al 12,6%; RR=1,17; IC95%, 0,49-2,80; p=0,71), muerte cardiaca o IM (el 10,7 frente al 9,0%; RR=1,17; IC95%, 0,72-1,89; p=0,50), revascularización de la lesión tratada (el 13,6 frente al 13,7%; RR=0,98; IC95%, 0,65-1,47; p=0,93) e IM (el 5,7 frente al 3,2%; RR=1,79; IC95%, 0,85-3,76; p=0,12). No hubo heterogeneidad significativa entre los estudios (fig. 2). Se observó TS confirmada en 4 pacientes del ensayo ISAR-TEST (el 0,2% [1] en el grupo PF-SES frente al 0,8% [3] en el PB-PES; p=0,37). No se informó de ninguna TS confirmada entre los pacientes incluidos en el ensayo LIPSIA Yukon.
Eventos adversos en el seguimiento clínico de los dos grupos de estudio.
IC95%: intervalo de confianza del 95%; IM: infarto de miocardio; n: eventos; N: total pacientes; PB-PES: stents liberadores de paclitaxel con polímero; PF-SES: stents liberadores de rapamicina sin polímero; phet: p para la heterogeneidad; RLT: revascularización de la lesión tratada; RR: riesgo relativo. Los datos se presentan como porcentajes (gráficos de barras), n/N y RR (IC95%) según Mantel-Cox (método de efectos aleatorios de DerSimonian y Laird). * Se proporcionan los valores para el índice I2 y phet.
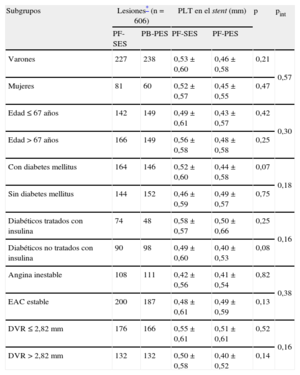
Con fines de exploración, se utilizaron los métodos de regresión lineal y Mantel-Cox para evaluar si la PLT en el stent y los resultados clínicos asociados a los PF-SES frente a los PB-PES concordaban dentro de los diferentes subgrupos (tablas 4 y 5). Es de señalar que en el grupo de PF-SES el mayor grado de PLT en el stent se observó en pacientes con diabetes mellitus tratados con insulina (0,58 ± 0,57mm), mientras que en el de PB-PES el mayor grado de PLT en el stent se observó en los pacientes con microangiopatía (0,51 ± 0,61mm). No hubo interacción entre el efecto del tratamiento (PF-SES frente a PB-PES) y la pertenencia a cualquiera de los subgrupos de interés.
Análisis combinado de los ensayos ISAR-TEST y LIPSIA Yukon. Criterios de valoración angiográficos según el análisis de subgrupos
| Subgrupos | Lesiones* (n=606) | PLT en el stent (mm) | p | pint | ||
| PF-SES | PB-PES | PF-SES | PF-PES | |||
| Varones | 227 | 238 | 0,53 ± 0,60 | 0,46 ± 0,58 | 0,21 | 0,57 |
| Mujeres | 81 | 60 | 0,52 ± 0,57 | 0,45 ± 0,55 | 0,47 | |
| Edad ≤67 años | 142 | 149 | 0,49 ± 0,61 | 0,43 ± 0,57 | 0,42 | 0,30 |
| Edad >67 años | 166 | 149 | 0,56 ± 0,58 | 0,48 ± 0,58 | 0,25 | |
| Con diabetes mellitus | 164 | 146 | 0,52 ± 0,60 | 0,44 ± 0,58 | 0,07 | 0,18 |
| Sin diabetes mellitus | 144 | 152 | 0,46 ± 0,59 | 0,49 ± 0,57 | 0,75 | |
| Diabéticos tratados con insulina | 74 | 48 | 0,58 ± 0,57 | 0,50 ± 0,66 | 0,25 | 0,16 |
| Diabéticos no tratados con insulina | 90 | 98 | 0,49 ± 0,60 | 0,40 ± 0,53 | 0,08 | |
| Angina inestable | 108 | 111 | 0,42 ± 0,56 | 0,41 ± 0,54 | 0,82 | 0,38 |
| EAC estable | 200 | 187 | 0,48 ± 0,61 | 0,49 ± 0,59 | 0,13 | |
| DVR ≤2,82mm | 176 | 166 | 0,55 ± 0,61 | 0,51 ± 0,61 | 0,52 | 0,16 |
| DVR >2,82mm | 132 | 132 | 0,50 ± 0,58 | 0,40 ± 0,52 | 0,14 | |
DVR: diámetro del vaso de referencia; EAC: enfermedad de las arterias coronarias; PB-PES: stents liberadores de paclitaxel con polímero; PF-SES: stents liberadores de rapamicina sin polímero; pint: p de la interacción (modelo de regresión lineal con término de interacción); PLT: pérdida luminal tardía.
Por edad y subgrupos de DVR, se utilizaron los valores medios para definir los puntos de corte. Se consideró significativo p<0,05.
Los datos expresan n o media ± desviación estándar.
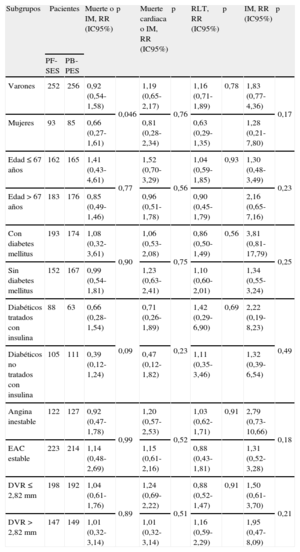
Análisis combinado de los ensayos clínicos ISAR-TEST y LIPSIA Yukon. Riesgo relativo de muerte o infarto de miocardio, muerte cardiaca o infarto de miocardio, revascularización de la lesión tratada e infarto de miocardio en los diferentes subgrupos
| Subgrupos | Pacientes | Muerte o IM, RR (IC95%) | p | Muerte cardiaca o IM, RR (IC95%) | p | RLT, RR (IC95%) | p | IM, RR (IC95%) | p | |
| PF-SES | PB-PES | |||||||||
| Varones | 252 | 256 | 0,92 (0,54-1,58) | 0,046 | 1,19 (0,65-2,17) | 0,76 | 1,16 (0,71-1,89) | 0,78 | 1,83 (0,77-4,36) | 0,17 |
| Mujeres | 93 | 85 | 0,66 (0,27-1,61) | 0,81 (0,28-2,34) | 0,63 (0,29-1,35) | 1,28 (0,21-7,80) | ||||
| Edad ≤67 años | 162 | 165 | 1,41 (0,43-4,61) | 0,77 | 1,52 (0,70-3,29) | 0,56 | 1,04 (0,59-1,85) | 0,93 | 1,30 (0,48-3,49) | 0,23 |
| Edad > 67 años | 183 | 176 | 0,85 (0,49-1,46) | 0,96 (0,51-1,78) | 0,90 (0,45-1,79) | 2,16 (0,65-7,16) | ||||
| Con diabetes mellitus | 193 | 174 | 1,08 (0,32-3,61) | 0,90 | 1,06 (0,53-2,08) | 0,75 | 0,86 (0,50-1,49) | 0,56 | 3,81 (0,81-17,79) | 0,25 |
| Sin diabetes mellitus | 152 | 167 | 0,99 (0,54-1,81) | 1,23 (0,63-2,41) | 1,10 (0,60-2,01) | 1,34 (0,55-3,24) | ||||
| Diabéticos tratados con insulina | 88 | 63 | 0,66 (0,28-1,54) | 0,09 | 0,71 (0,26-1,89) | 0,23 | 1,42 (0,29-6,90) | 0,69 | 2,22 (0,19-8,23) | 0,49 |
| Diabéticos no tratados con insulina | 105 | 111 | 0,39 (0,12-1,24) | 0,47 (0,12-1,82) | 1,11 (0,35-3,46) | 1,32 (0,39-6,54) | ||||
| Angina inestable | 122 | 127 | 0,92 (0,47-1,78) | 0,99 | 1,20 (0,57-2,53) | 0,52 | 1,03 (0,62-1,71) | 0,91 | 2,79 (0,73-10,66) | 0,18 |
| EAC estable | 223 | 214 | 1,14 (0,48-2,69) | 1,15 (0,61-2,16) | 0,88 (0,43-1,81) | 1,31 (0,52-3,28) | ||||
| DVR≤2,82 mm | 198 | 192 | 1,04 (0,61-1,76) | 0,89 | 1,24 (0,69-2,22) | 0,51 | 0,88 (0,52-1,47) | 0,91 | 1,50 (0,61-3,70) | 0,21 |
| DVR>2,82mm | 147 | 149 | 1,01 (0,32-3,14) | 1,01 (0,32-3,14) | 1,16 (0,59-2,29) | 1,95 (0,47-8,09) | ||||
DVR: diámetro del vaso de referencia; EAC: enfermedad de las arterias coronarias; IC95%: intervalo de confianza del 95%; IM: infarto de miocardio; PB-PES: stents liberadores de paclitaxel con polímero; PF-SES: stents liberadores de rapamicina sin polímero; RLT: revascularización de la lesión; RR: riesgo relativo.
RR e IC95% se utilizaron como estadísticos de resumen; los valores de p para la interacción entre los efectos del tratamiento (PF-SES frente a PB-PSE) y los subgrupos se obtuvieron mediante un modelo de Mantel-Cox. Para los subgrupos por edad y DVR, los valores medios se utilizaron para definir los puntos de corte. Los subgrupos se expresaron como variables dicotómicas. En cada subgrupo, la primera variable es la referencia para los cálculos. Se consideró significativo p<0,05.
Este es el primer análisis combinado de datos de pacientes procedentes de dos ensayos controlados, aleatorizados y multicéntricos que estudia la revascularización coronaria con PF-SES y PB-PES. Los principales hallazgos son: a) el tratamiento con PF-SES, comparado con PB-PES, condujo a un grado de PLT similar en las angiografías de seguimiento realizadas transcurridos 6-9meses; b) el tratamiento con PF-SES, comparado con PB-PES, condujo a riesgos similares en cuanto a eventos clínicos en el seguimiento a largo plazo; c) en el subgrupo generador de hipótesis no se observó ninguna variación en los efectos del tratamiento de los criterios de valoración clínicos y angiográficos de los subgrupos (sexo, edad, diabetes mellitus, tratamiento con insulina, presentación clínica y tamaño de los vasos), y d) de manera constante, no se observó interacción alguna entre el efecto del tratamiento y la pertenencia a cualquiera de los subgrupos.
Los estudios en animales han documentado inflamación continua de la pared vascular durante >12meses después del implante del SFA con polímero permanente18. Se considera que esta inflamación es causa de un amplio espectro de síndromes clínicos, entre ellos reacciones de hipersensibilidad sistémica19, mala aposición tardía y TS tardía20. Además, este proceso crónico podría ser causa de la proliferación neointimal y del fenómeno de recuperación tardía asociado a los SFA con polímero21. Tanto los SFA sin polímero como los polímeros biodegradables son estrategias alternativas a los SFA con polímero: una vez completada la elución del fármaco, la ausencia de polímero sobre el strut del stent podría ayudar a impedir la aparición una reacción adversa a este5.
El ensayo ISAR-TEST documentó una eficacia angiográfica y clínica no inferior de los PF-SES frente a los PB-PES a los 9meses de seguimiento. Más recientemente, también se ha informado de eficacia y seguridad similares a los 5 años de seguimiento22. Estos resultados son compatibles con hallazgos anteriores que indicaban que la eficacia contra la reestenosis se conserva en los PF-SES respecto a los PF-PES, independientemente del fármaco eluido (rapamicina o paclitaxel)23. Los datos angiográficos a los 2 años procedentes de los ensayos ISAR-TEST 224 e ISAR-TEST 325 mostraron reestenosis persistente, significativa y progresiva en los vasos tratados con stents con polímero, mientras que en las plataformas sin polímero no se observó reestenosis entre los 6 meses y los 2 años. Sin embargo, otras observaciones ponen en duda la eficacia de las plataformas sin polímero; este es el caso de los PF-SES en personas diabéticas. La diabetes mellitus puede erosionar las ventajas antiproliferativas de los stents liberadores de rapamicina frente a los PB-PES26,27. En el ensayo LIPSIA Yukon, que sólo incluyó a pacientes con diabetes mellitus, los PF-SES fueron inferiores a los PB-PES en cuanto a rendimiento angiográfico, si bien no se observaron consecuencias clínicas10. Por el contrario, un estudio aleatorizado reciente observó mejor eficacia contra la reestenosis en una plataforma sin polímero que eluía rapamicina que con los PB-PES28. Lo más importante es que esta superioridad también se confirmó en pacientes con diabetes mellitus.
El presente estudio incluye la mayor población aleatorizada a tratamiento con PF-SES o PB-PES que se haya analizado hasta el momento. En la evaluación angiográfica y el seguimiento clínico de casi 3 años, ambos sistemas de stent mostraron similar eficacia contra la reestenosis. En comparación con los ensayos originales9,10, en nuestro análisis se ha considerado un periodo de seguimiento superior en una población con mayor riesgo de reestenosis, lo que es fundamental para cuestionar la eficacia contra la reestenosis de los distintos sistemas de SFA29. Además, a pesar de su naturaleza exploratoria, un objetivo de los análisis de subgrupos fue investigar más a fondo el rendimiento angiográfico y clínico de los PF-SES en comparación con los PB-PES en subgrupos de pacientes complicados, tales como las personas mayores, con diabetes mellitus o con una presentación inestable o microangiopatía.
Los hallazgos angiográficos de nuestro estudio requieren un cuidadoso examen. La proporción relativamente elevada de lesiones complejas y de pacientes de alto riesgo puede haber conducido a un mayor grado de PLT que en otros estudios28,30. En concreto, en los pacientes que recibieron PF-SES, el grado de PLT en el stent observado en diabéticos, especialmente en los que requieren insulina, podría resultar preocupante. Por un lado, una característica de los análogos de la insulina es que reducen la eficacia antiproliferativa de los fármacos de la familia limus26. Por otro, queda por establecer si la falta de diferencias significativas entre los PF-SES y los PB-PES en nuestro análisis se debió al tamaño de la muestra o al uso de los PB-PES como comparador (débil). Sin embargo, en ensayos recientes se ha observado una eficacia superior o comparable de los stents sin polímero y formulaciones de rapamicina muy lipófilas, frente a los PB-PES28 y los SFA de segunda generación31, respectivamente.
El riesgo de eventos clínicos adversos observado tras el implantede PF-SES y PB-PES fue similar. Es importante destacar que el riesgo notificado de revascularización de la lesión tratada refleja los resultados de estudios anteriores con un seguimiento comparable25. En ese sentido, aunque el curso temporal de la supresión neointimal es dinámico y varía entre los distintos SFA en virtud de la cinética de liberación de fármaco dependiente del polímero, las interacciones entre los factores que afectan al rendimiento del stent a largo plazo no se pueden resolver en seguimientos angiográficos a corto plazo. Esto podría explicar por qué los diferentes grados de PLT con PF-SES frente a PB-PES no se traducen en diferencias clínicas en los seguimientos a largo plazo.
Para los fines de este estudio, sólo se consideró la TS confirmada. De acuerdo con informes anteriores, este análisis combinado reveló una incidencia muy baja de TS confirmada entre los pacientes asignados a los grupos de PF-SES y PB-PES. Aunque este estudio no se diseñó para investigar la ocurrencia de un evento tan raro y la hipótesis de que los SFA sin polímero podrían presentar menos trombogenicidad sigue sin demostrarse32, la reducida tasa de TS observada puede resultar tranquilizadora.
En el presente estudio, se evaluaron los resultados principales en la población del estudio en su conjunto y en determinados subgrupos. Aunque no hubo indicios de modificaciones en el efecto del tratamiento en ninguno de los subgrupos de interés especial, este análisis tenía un carácter exploratorio y se basa en una muestra de tamaño insuficiente para establecer conclusiones definitivas. Se necesita más investigación para arrojar luz sobre las posibles diferencias en la eficacia entre los PF-SES y los PB-PES en subgrupos específicos.
Limitaciones del estudioEste análisis combinado presenta algunas limitaciones. En primer lugar, los ensayos clínicos ISAR-TEST y LIPSIA Yukon evaluaron la no inferioridad de la eficacia angiográfica de los PF-SES respecto a los PB-PES. Por lo tanto, todos los resultados actuales deben considerarse como post-hoc y exploratorios. Además, el presente estudio tiene poco poder estadístico a la hora de evaluar adecuadamente efectos adversos relativamente poco frecuentes, como muerte, IM y TS. En segundo lugar, se comparó los PF-SES con los PB-PES. Los PB-PES son los dispositivos de primera generación implantados con más frecuencia y se los consideraba un comparador adecuado en la fecha en que se iniciaron los ensayos ISAR-TEST y LIPSIA Yukon. Sin embargo, el PB-PES ya no está disponible en la mayoría de los países, lo que puede limitar la relevancia clínica de los análisis actuales, aunque estudios recientes siguen utilizándolo para el grupo de control28,30. Por otra parte, las investigaciones de PB-PES con seguimiento a largo plazo y en subgrupos de pacientes de alto riesgo (pacientes diabéticos) tienen cierto interés, ya que en estos subgrupos la eficacia de los SFA de la familia limus sigue siendo una cuestión controvertida26,27. En tercer lugar, no se realizó un seguimiento angiográfico a largo plazo, que podría haber sido útil para determinar el curso temporal de la regeneración endotelial y la relación entre los resultados angiográficos y clínicos. Por otra parte, es necesario admitir que los datos de las evaluaciones angiográficas realizadas entre los 6 y los 9 meses se basan en observaciones incompletas procedentes del 80,4% de los pacientes de la cohorte total. No obstante, los datos sobre la PLT parecen concordar con los datos de revascularización de lesiones tratadas disponibles para toda la cohorte. En cuarto lugar, un seguimiento a muy largo plazo habría sido de cierto interés para arrojar más luz sobre los últimos sucesos relacionados con los recubrimientos de polímero. Por último, aunque la población inscrita podría percibirse como de alto riesgo, es el resultado de dos ensayos aleatorizados en los que se aplicaron criterios de inclusión y exclusión bastante estrictos.
CONCLUSIONESEste análisis combinado indica que los PF-SES, comparados con los PB-PES, pueden conducir a un grado similar de PLT en las evaluaciones angiográficas y suponen similar riesgo de muerte, revascularización de la lesión e IM.
CONFLICTO DE INTERESESLos profesores titulares Kastrati y Schömig son propietarios de una patente para una superficie microporosa de stent. El Dr. Desch y el profesor titular Thiele recibieron una subvención sin restricciones de Translumina GmbH (Hechingen, Alemania). El resto de los autores declara no tener conflictos de intereses.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en http://dx.doi.org/10.1016/j.recesp.2012.11.017.