El objetivo del estudio es evaluar la utilidad de un protocolo diagnóstico escalonado mediante estudio electrofisiológico (EEF) y registrador de eventos implantable (REI) en pacientes con síncope y bloqueo de rama (BR).
MétodosSe realizó un EEF con provocación farmacológica con procainamida en 85 pacientes consecutivos remitidos por síncope y BR tras una evaluación inicial no diagnóstica. En aquellos sin indicación de desfibrilador implantable, se implantó un REI. Se realizó seguimiento hasta el diagnóstico o el agotamiento de la batería del dispositivo.
ResultadosEl EEF fue diagnóstico en 36 pacientes (42%); el mecanismo más frecuente fue el bloqueo auriculoventricular (BAV) paroxístico (n=27), seguido por la taquicardia ventricular (TV) (n=6). Todos los pacientes con TV tuvieron cardiopatía estructural y mayor prevalencia de BR izquierda. Se implantó un REI a 38 pacientes, y se alcanzó un diagnóstico en 13 (34%); el BAV paroxístico fue el más frecuente (n=10). La mediana de seguimiento hasta el diagnóstico de BAV paroxístico mediante el REI fue 97 días (intervalo intercuartilo, 60-117 días). El BAV paroxístico fue más frecuente en los pacientes con BR derecha y PR prolongado y/o desviación del eje. No se observaron TV o muertes arrítmicas durante el seguimiento.
ConclusionesEn pacientes con síncope y BR, la etiología principal está representada por el BAV paroxístico, seguido por la TV. El uso escalonado del EEF y del REI en los casos negativos permite alcanzar un rendimiento diagnóstico alto y con seguridad, dado que la TV suele identificarse durante el EEF.
Palabras clave
El síncope es un cuadro clínico común que representa una alta tasa de visitas a los servicios de urgencias y un importante número de ingresos hospitalarios para diagnóstico y tratamiento. Aunque la mayoría de los pacientes tienen un pronóstico benigno, ya que la etiología neuromediada es la más frecuente, las altas tasas de mortalidad en ciertos subgrupos hacen necesario alcanzar un diagnóstico preciso y un tratamiento adecuado1.
Un subgrupo de particular interés son los pacientes que consultan por síncope y presentan un trastorno de la conducción intraventricular (TCIV) que compromete uno o más de los fascículos del haz de His. La presencia de bloqueo de rama (BR) en el electrocardiograma (ECG) de 12 derivaciones sugiere bloqueo auriculoventricular (BAV) paroxístico como mecanismo del síncope2,3,4. El estudio electrofisiológico (EEF) con provocación farmacológica y la monitorización prolongada mediante registradores de eventos implantables (REI) son las dos herramientas básicas para el diagnóstico de estos pacientes cuando la evaluación inicial no permite conocer la causa del síncope.
La aproximación diagnóstica y terapéutica de estos pacientes con síncope y BR fue revisada recientemente en las guías de práctica clínica de la Sociedad Europea de Cardiología. Las guías europeas de estimulación cardiaca y terapia de resincronización cardiaca de 20075 recomiendan la estimulación cardiaca en los pacientes con EEF positivo (clase I, nivel de evidencia C) y en los pacientes con intervalo His-ventrículo (HV) normal consideran una estrategia aceptable el implante de marcapasos en lugar de un registrador de eventos (clase IIa, nivel de evidencia C) y hacen referencia a una exclusión previa de otras causas de sincope, especialmente la taquicardia ventricular. En las guías europeas de síncope actualizadas en 2009 se recomienda la estimulación cardiaca permanente en los pacientes con síncope y BR tras un EEF positivo (clase IIa, nivel del evidencia B). Hacen referencia a que también se debe considerar el implante de marcapasos en los pacientes con síncope no explicado y BR (clase IIa, nivel de evidencia C)6,7.
Como se observa, las recomendaciones actuales en los pacientes sin un EEF diagnóstico surgen principalmente del consenso de expertos y el alto riesgo de evolución a BAV avanzado observado en pequeñas series8. Sin embargo, no existen hasta el momento largas series prospectivas que demuestren la seguridad de dicho enfoque. En el presente estudio describimos el rendimiento diagnóstico y la seguridad de un protocolo de estudio de síncope en una serie de pacientes consecutivos con TCIV.
MétodosSe incluyó a todos los pacientes remitidos a la unidad de arritmias de nuestro hospital en el periodo comprendido entre enero de 2005 y junio de 2009 para evaluación electrofisiológica invasiva por presentar al menos un episodio sincopal o presincopal en presencia de TCIV y en quienes no se alcanzó un diagnóstico luego de la evaluación clínica inicial6,7.
Se definió TCIV como la presencia de un complejo QRS de duración ≥ 120 ms. El BR izquierda y BR derecha se diagnosticaron según los criterios estándar9. El hemibloqueo anterosuperior se definió como la presencia de un eje frontal ≤ –45° con rS en DII y DIII y el hemibloqueo posteroinferior como la presencia de un eje frontal ≥ +100° con qR en DII y DIII, en ausencia de hipertrofia ventricular derecha.
Protocolo de estudioLa evaluación inicial de los pacientes consistió en anamnesis, exploración física, masaje del seno carotídeo, electrocardiograma (ECG) de 12 derivaciones, ecocardiograma Doppler transtorácico y pruebas ortostáticas. Otras pruebas complementarias (test de esfuerzo, cateterismo, electroencefalograma, tomografía computarizada craneal, etc.) se llevaron a cabo en pacientes concretos cuando, según la aproximación inicial, se creyó que eran necesarias para el diagnóstico. Se excluyó a los pacientes que presentaban QRS estrecho (< 120 ms) o diagnóstico claro de la causa del síncope tras la evaluación inicial.
El EEF utilizado consistió en: a) registro basal de los tiempos de conducción auriculoventricular; b) masaje de los senos carotídeos derecho e izquierdo con monitorización continua del ECG y de la tensión arterial; c) estimulación auricular a frecuencias crecientes para determinar el punto de Wenckebach de la conducción auriculoventricular y el tiempo de recuperación sinusal; d) test de extraestímulo auricular; e) estimulación ventricular a frecuencias crecientes; f) test de extraestímulo ventricular en el ápex y el tracto de salida del ventrículo derecho a dos ciclos, con hasta tres extraestímulos; g) si el intervalo HV basal era<70 ms y no se observaba BAV infrahisiano con la estimulación auricular a frecuencias crecientes, se realizaba sobrecarga farmacológica con procainamida 10 mg/kg i.v. a 100 mg/min. En los pacientes estudiados hasta julio de 2008 se realizó test de ATP (adenosintrifosfato) mediante la administración de un bolo rápido de 20mg i.v.
El estudio se consideró diagnóstico de disfunción sinusal en presencia de un tiempo de recuperación sinusal corregido > 550 ms; de BAV paroxístico, en presencia de: a) un intervalo HV basal ≥ 70 ms o evidencia de bloqueo intrahisiano o infrahisiano basalmente o con la estimulación auricular a frecuencias crecientes, y b) alguno de los siguientes hallazgos tras la infusión de procainamida: aparición de bloqueo intrahisiano o infrahisiano durante el ritmo espontáneo o tras la estimulación auricular o ventricular, alargamiento del intervalo HV por encima de 100 ms o un aumento del 100% respecto al HV basal. Se consideró diagnóstico de taquicardia supraventricular o ventricular cuando la estimulación programada indujo reproduciblemente alguna de estas arritmias de forma constante. En un caso, el diagnóstico electrofisiológico fue de BAV paroxístico por sensibilidad exagerada del nodo auriculoventricular al ATP por presentar una pausa ventricular > 9 s tras su administración.
Tras la realización del EEF se implantó un REI (REVEAL®, Medtronic Inc., Minneapolis, Minnesota, Estados Unidos) a los pacientes sin diagnóstico y que según las guías de práctica clínica en vigencia no tenían indicación de implantación de un desfibrilador automático implantable (DAI). El seguimiento ambulatorio se realizó a los 3 meses y luego cada 6 meses o ante la presencia de síntomas que motivaran el adelanto de la visita. El diagnóstico del mecanismo del síncope se estableció cuando una recurrencia sincopal se documentó electrocardiográficamente con el REI. Se consideró BAV paroxístico a los de segundo grado de tipo II o de tercer grado no precedidos de bradicardia sinusal progresiva, dado que esta es una respuesta habitualmente observada durante reacciones neuromediadas.
Análisis estadísticoLos datos categóricos se presentan como número de casos y porcentaje. Los datos continuos se presentan como media±desviación estándar o mediana [percentiles 25-75] según corresponda. Para la comparación de las variables continuas de distribución normal, se utilizó el test de la t de Student. Para aquellas con distribución no normal, se utilizó el test de Mann-Whitney. Las variables categóricas se compararon mediante la prueba de la χ2 o el test exacto de Fisher según correspondiese. Se consideró estadísticamente significativo un valor de p<0,05.
Con el objetivo de evaluar predictores de BAV paroxístico, se realizó un modelo de regresión logística múltiple. La variable dependiente fue el diagnóstico de BAV paroxístico en el EEF o mediante el REI en el seguimiento. Se incluyeron en el modelo las variables con significación estadística en el análisis univariado o las de interés clínico. Se construyó el modelo usando el método por pasos hacia adelante con probabilidades de entrada de 0,05 y de salida de 0,1. Para evaluar la bondad de ajuste del modelo, se utilizó el test de Hosmer-Lemeshow. Para evaluar la capacidad de discriminación del modelo, se estimó el área bajo la curva ROC, su intervalo de confianza (IC) del 95% y el valor de p (χ2). Se utilizó el software SPSS 16.0. 2004. (SPSS, Inc., Chicago, Illinois, Estados Unidos).
ObjetivosEl objetivo primario preestablecido del estudio fue evaluar la utilidad diagnóstica del EEF y del REI en la población incluida. Los objetivos secundarios fueron describir las características de los pacientes con diagnóstico de BAV paroxístico tanto en el EEF como mediante el REI, el tiempo hasta el diagnóstico, las recurrencias sincopales hasta el diagnóstico, las características basales de los distintos subgrupos de TCIV y su evolución.
ResultadosEntre enero de 2005 y junio de 2009 se remitieron al laboratorio de electrofisiología 85 pacientes que cumplían con los criterios de inclusión. Las características basales de la población se muestran en la Tabla 1. La media de edad fue 72,6±9,8 años y el 71,8% eran varones.
Tabla 1. Características basales de la población *
| Edad, años±DE | 72,6±9,8 |
| Sexo masculino | 61 (71,8) |
| Diabetes | 25 (29,4) |
| Dislipemia | 28 (32,9) |
| Hipertensión | 56 (65,9) |
| Tabaquismo | 8 (9,4) |
| FA/AA | 18 (21,2) |
| Cardiopatía | 56 (67,5) |
| Hipertensiva | 28 (33,7) |
| Isquémica | 19 (22,9) |
| Infarto previo | 11 (13,3) |
| Dilatada | 5 (6) |
| Hipertrófica | 6 (7,2) |
| Valvulopatía mod/sev | 7 (8,4) |
| FEVI ≥ 45% | 69 (80,7) |
| FEVI<45% | 16 (19,3) |
| BRD, sin hemibloqueo | 16 (18,8) |
| BRI | 31 (36,5) |
| BRD+HAS | 30 (35,3) |
| BRD+HPI | 4 (4,7) |
| T. inespecífico | 4 (4,7) |
| Presíncope | 4 (4,7) |
| Síncope único | 29 (34,1) |
| 2 o más síncopes | 52 (61,2) |
| QRS, ms | 148,9 (18,3) |
| PR, ms | 193,9 (53,8) |
AA: aleteo auricular; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; HAS: hemibloqueo anterosuperior; HPI: hemibloqueo posteroinferior.
* Los valores están expresados en media±desviación estándar (DE) o n (%).
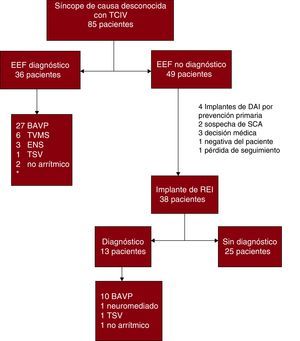
En 36 pacientes (42,3%) se alcanzó un diagnóstico mediante el EEF (Figura 1). El BAV paroxístico fue el diagnóstico más frecuente en el EEF observado en 27 pacientes (31,7%), seguido por la taquicardia ventricular monomorfa sostenida (TVMS) en 6 (7%). Otras causas detectadas fueron: disfunción sinusal en 3 pacientes (3,5%), taquicardia supraventricular en 1 (1,1%) y seudosíncope de origen vascular en 1 (1,1%); en 1 paciente (1,1%) remitido por síncope con alodromía inicial en el QRS, la exclusión de preexitación ventricular se consideró diagnóstica de síncope no arrítmico.
Figura 1. Resultados del estudio electrofisiológico y del registrador de eventos. Diagrama de flujo.BAVP: bloqueo auriculoventricular paroxístico; DAI: desfibrilador automático implantable; EEF: estudio electrofisiológico; ENS: enfermedad del nodo sinusal; REI: registrador de eventos implantable; SCA: síndrome coronario agudo; TCIV: trastorno de conducción intraventricular; TSV: taquicardia supraventricular; TVMS: taquicardia ventricular monomorfa sostenida. *En el cuadro se mencionan números de diagnósticos y no números de pacientes, ya que algunos pacientes tuvieron más de un diagnóstico.
Del total de pacientes diagnosticados mediante EEF, 3 (8,3%) cumplieron criterios para más de una etiología: 2 para BAV paroxístico y TVMS y 1 para BAV paroxístico y disfunción sinusal.
Registrador de eventos implantableDe los 85 pacientes evaluados, en 49 (57,6%) no se llegó a un diagnóstico etiológico mediante el EEF. De ellos, a 38 pacientes (44,7%) se les implantó un REI. En 11 pacientes de los 49 inicialmente candidatos, el REI no se implantó debido a que eran candidatos a DAI por disfunción ventricular severa (4 pacientes), sospecha clínica de síndrome coronario agudo como causa del cuadro sincopal (2), decisión del facultativo (3), negativa del paciente (1) y pérdida de seguimiento (1). Se alcanzó un diagnóstico en 13 pacientes (el 34,2% de los que recibieron el dispositivo); el más frecuente fue el BAV paroxístico, documentado en 10 pacientes. Otras causas fueron: síncope neuromediado (1 paciente), taquicardia supraventricular (1) y síncope no arrítmico (1).
Bloqueo auriculoventricular paroxísticoEl diagnóstico etiológico más frecuente fue el BAV paroxístico, encontrado en 37 pacientes (43,5%). De ellos, 27 (73%) fueron diagnosticados en el EEF y 10 (27%), mediante el REI. El tiempo al diagnóstico con el REI varió de 25 a 152 días, con una mediana de 97 [intervalo intercuartílico, 60-117] días, y 4 de los pacientes presentaron recurrencias sincopales antes de ser diagnosticados. El tiempo de seguimiento de los pacientes sin diagnóstico mediante REI tuvo una mediana de 449 [123-641] días, con un mínimo de 52 y un máximo de 902 días.
En el análisis univariado (Tabla 2), se encontró significativamente más proporción de pacientes con diabetes mellitus, dislipemia, BR derecha y BAV de primer grado entre los pacientes con diagnóstico final de BAV paroxístico (tanto con EEF como con REI). Se excluyeron del análisis multivariado 11 pacientes, ya que no completaron la evaluación diagnóstica (Figura 1). Se identificaron como predictores independientes de BAV paroxístico la diabetes mellitus, el BR derecha y la prolongación del intervalo PR (Tabla 3). El test de Hosmer-Lemeshow muestra que no hay evidencia de falta de ajuste del modelo propuesto (χ2=9,344; p=0,314). El área bajo la curva ROC del modelo final como predictor de BAV paroxístico fue de 0,81 (IC del 95%, 0,71-0,91; p<0,001).
Tabla 2. Variables asociadas a bloqueo auriculoventricular paroxístico. Análisis univariado
| BAVP (37 pacientes) | No BAPV (37 pacientes) | P | |
| Edad (años) | 73±7 | 71±12 | NS |
| Sexo masculino | 30 (81) | 27 (73) | NS |
| Diabetes | 17 (46) | 5 (13) | 0,002 |
| Hipertensión arterial | 22 (59) | 27 (73) | NS |
| Dislipemia | 18 (48) | 8 (21) | 0,01 |
| Cardiopatía | 22 (61) | 25 (69) | NS |
| FEVI<45% | 5 (14) | 6 (17) | NS |
| BRD | 30 (81) | 18 (51) | 0,009 |
| BRI | 7 (19) | 17 (46) | |
| PR (ms) | 218±61 | 176±39 | 0,001 |
| QRS (ms) | 150±19 | 147±16 | NS |
| ≥ 2 síncopes | 27 (73) | 21 (57) | NS |
BAVP: bloqueo auriculoventricular paroxístico; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; FEVI: fracción de eyección del ventrículo izquierdo.
Los valores están expresados en media±DE o n (%).
Tabla 3. Resultados del análisis multivariado para el diagnóstico de bloqueo auriculoventricular paroxístico
| OR | IC del 95% | P | |
| BRD | 3,80 | 1,12-12,80 | 0,03 |
| PR (cada 10ms de cambio del PR) | 1,19 | 1,03-1,37 | 0,01 |
| Diabetes | 3,89 | 1,06-14,20 | 0,03 |
BRD: bloqueo de rama derecha; IC: intervalo de confianza; OR: odds ratio.
Al analizar los subgrupos de pacientes con distintas formas de TCIV en presencia o ausencia de BAV de primer grado se observó mayor proporción de pacientes con diagnóstico de BAV paroxístico en aquellos con BR derecha asociado a hemibloqueo anterosuperior y/o a BAV de primer grado, mientras que la menor proporción de diagnósticos de BAV paroxístico se observó en aquellos con TCIV inespecífico o con BR izquierda no asociado a prolongación patológica del intervalo PR. En la Tabla 4 se puede apreciar la información correspondiente a cada forma de TCIV.
Tabla 4. Diagnóstico de bloqueo auriculoventricular paroxístico según tipo de trastorno de conducción
| N | Diagnóstico de BAVP | Diagnóstico en el EEF | Diagnóstico en REI | |
| BRD+HAS+BAV1° | 18 | 13 (72,2%) | 11 | 2 |
| BRD+BAV 1° | 4 | 3 (75%) | 3 | 0 |
| BRD+HAS | 12 | 7 (58,3%) | 5 | 2 |
| BRD aislado | 12 | 5 (41,6%) | 2 | 3 |
| BRD+HPI | 4 | 2 (50%) | 0 | 2 |
| BRI+BAV 1° | 8 | 3 (37,5) | 3 | 0 |
| BRI aislado | 23 | 4 (17,3%) | 3 | 1 |
| TCIV inespecífico | 4 | 0 (0%) | 0 | 0 |
| Total | 85 | 37 (43,5%) | 27 | 10 |
BAV1°: bloqueo auriculoventricular de primer grado; BAVP: bloqueo auriculoventricular paroxístico; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; EEF: estudio electrofisiológico; HAS: hemibloqueo antero-superior; HPI: hemibloqueo postero-inferior; REI: registrador de eventos implantable; TCIV: trastorno de conducción intraventricular. Los valores están expresados en n (%).
Del total de pacientes incluidos en el estudio, el diagnóstico final fue TVMS en 6 pacientes (7%). Todos presentaron algún tipo de cardiopatía estructural (5 pacientes, cardiopatía isquémica y 1, miocardiopatía hipertrófica) y sólo 1 paciente tuvo una FEVI > 45%. La presencia de BR izquierda fue significativamente mayor en aquellos con TVMS que en los que no la tuvieron (el 66 y el 36% respectivamente; p=0,03). Todos los diagnósticos de TVMS se realizaron durante el EEF y no se documentaron episodios de taquicardia ventricular en el seguimiento mediante REI ni fallecimientos adjudicables a dicha causa.
Se registraron 2 muertes (2,3%) durante el seguimiento, ninguna de causa arrítmica. Un paciente perdido de seguimiento tras un EEF no diagnóstico falleció de causa coronaria y otro paciente falleció a causa de leucemia mientras se encontraba en seguimiento portando un REI.
DiscusiónEl hallazgo principal de nuestro estudio es la alta prevalencia de síncope arrítmico (57%) encontrada en nuestra población, representada principalmente por el BAV paroxístico y la TVMS, así como lo adecuado de la secuencia de exploraciones diagnósticas utilizadas, permitiendo alcanzar una elevada tasa de diagnósticos sin suponer un aumento de riesgos para los pacientes.
La existencia de TCIV en pacientes con síncopes alienta la sospecha de BAV paroxístico como su causa10,11,12. El EEF y la monitorización prolongada del ECG, con REI si es preciso, son las herramientas disponibles para alcanzar el diagnóstico.
La afección de la rama contralateral del sistema His-Purkinje en pacientes con BR se considera directamente relacionada con la evolución hacia el BAV de alto grado13. Dicha afección puede demostrarse durante el EEF mediante la medición del intervalo HV, tanto basalmente como tras diversas sobrecargas, como la estimulación programada o la administración de fármacos bloqueadores de los canales de sodio14. Sin embargo, como se observó en el estudio ISSUE, un gran porcentaje de pacientes con síncope, BR y EEF no diagnóstico posteriormente requieren estimulación cardiaca permanente, ya sea por BAV o por disfunción sinusal2.
La frecuente necesidad de estimulación cardiaca en el seguimiento a mediano plazo de estos pacientes justifica la tendencia observada en las guías de práctica clínica a considerar el implante de marcapasos a pesar de un EEF no diagnóstico. Incluso algunos autores han abogado por la implantación directa de marcapasos, sin previa evaluación electrofisiológica invasiva8. Sin embargo, hasta el momento no existen largas series prospectivas que demuestren la seguridad de dicho enfoque.
Una estrategia alternativa, con el fin de diagnosticar casos que requieren de estimulación cardiaca permanente y evitar implantes innecesarios, es el uso de un REI.
Hace tiempo que se describieron las características anatómicas del sistema trifascicular de His-Purkinje, objetivándose la división anterosuperior de la rama izquierda como la más delgada y frágil y la posteroinferior como la menos vulnerable. De hecho, según Elizari et al, la presencia de BR derecha asociado a hemibloqueo posteroinferior debe considerarse un precursor del BAV completo15. Sin embargo, el riesgo de evolución a BAV de alto grado tras un evento sincopal en las distintas formas de TCIV no es del todo conocido y las guías de práctica clínica en vigencia no hacen referencia en cuanto a si debe haber un enfoque diferencial5,6,7,16. En nuestros casos, el análisis multivariado detectó al BR derecha con prolongación del intervalo PR como el marcador más frecuentemente asociado al diagnóstico de BAV paroxístico tanto en el EEF como mediante el REI. Este hecho contrasta con la falta de patrones predictivos comunicada por Tabrizi et al8, aunque en su estudio sólo se consideraron bloqueos bifasciculares y no se analizó el intervalo PR. Tampoco en el ISSUE2, en el que sólo se incluyeron pacientes con EEF negativo seguidos mediante REI, se identificaron características basales asociadas al desarrollo de BAV paroxístico, aunque se observó una tendencia «protectora» para el BR derecha sin desviación del eje o para una historia de episodios sincopales de más de 2 años de evolución. En nuestra serie, el único rasgo clínico asociado significativamente al diagnóstico de BAV paroxístico fue la diabetes mellitus, lo que tal vez exprese una población con mayor comorbilidad y, por lo tanto, con mayor afección fibrosa del sistema de conducción. La escasez de pacientes en nuestra serie con TCIV, tradicionalmente asociados a mayor riesgo de BAV de alto grado, como el BR derecha con hemibloqueo posteroinferior, puede ser la causa de su falta de representación en el modelo multivariado. La búsqueda de factores predictivos de BAV en un modelo multivariado podría llevar a conocer variables clínicas (esencialmente comorbilidad) o derivadas de pruebas diagnósticas (esencialmente electrocardiográficas) asociadas a mayor riesgo y que, por lo tanto, podrían simplificar la aproximación terapéutica. El número de pacientes incluidos en nuestra serie no permite explorar a fondo estas posibilidades.
Se ha observado que en este subgrupo de pacientes otra causa importante y grave de síncope es la taquicardia ventricular, particularmente en aquellos con deterioro de la función sistólica del ventrículo izquierdo17. En nuestro estudio ha representado un 7% de los casos. El BR izquierda fue el TCIV más frecuentemente asociado al diagnóstico de TVMS, probablemente traduciendo su asociación a la cardiopatía estructural.
Esta prevalencia no despreciable de arritmia ventricular justifica una estrategia como la seguida en nuestro estudio, en la que no se realiza una implantación directa de marcapasos, ya que ello supondría implantar a pacientes que no lo requieren y, sobre todo, pasar por alto diagnósticos más peligrosos como la TVMS. De hecho, en la serie de 27 pacientes con BR bifascicular y síncope publicada por Tabrizi et al8, en la que se procedió al implante directo de marcapasos (sin previo EEF), durante el seguimiento se apreció una mortalidad súbita del 19%. El EEF y la posterior implantación de un REI en los casos negativos se ha mostrado, en cambio, una estrategia rentable y segura en pacientes con sospecha de síncope arrítmico18,19.
En efecto, los EEF diagnósticos fueron el 45,8% (36 pacientes), el 75% por BAV paroxístico y el 16,6% por TVMS. De los pacientes con EEF negativo a los que se les implantó un REI (38) el 26% sufrió BAV paroxístico en el seguimiento, cifra similar a la encontrada en estudios previos2. También importante es el hecho de que todos los diagnósticos de TVMS se realizaron durante el EEF (6 pacientes; 7%), en pacientes con algún tipo de cardiopatía y disfunción sistólica del ventrículo izquierdo, aunque 3 no cumplían criterios para implantación de desfibrilador como prevención primaria. Esto, junto al hecho de que durante el seguimiento de los pacientes a los que se implantó un REI no se observara mortalidad arrítmica, confirma la seguridad de la estrategia empleada y pone de manifiesto que, a pesar de una sensibilidad diagnóstica subóptima, el EEF tiene la virtud de excluir del seguimiento a los pacientes con mayor riesgo.
De hecho, si imaginamos un hipotético escenario alternativo en el cual la presencia de síncope con BR bifascicular fuese suficiente motivo para implantar un marcapasos, en nuestra serie nos encontraríamos con lo siguiente: tras implantar un desfibrilador a 7 pacientes con criterios de prevención primaria, 59 de los 78 pacientes restantes habrían recibido el implante de un marcapasos, incluidos los 3 pacientes en quienes se indujo una taquicardia ventricular en el EEF y excluidos los 8 pacientes sin BR bifascicular en quienes se demostró BAV paroxístico en el seguimiento con REI.
Por último, la alta prevalencia de síncope arrítmico (57%) y de BAV de alto grado (43,5%) encontrada en nuestro trabajo contrasta con prevalencias menores halladas en otros estudios. Cabe destacar un estudio recientemente publicado por Romero et al20, en el cual se estudiaron en una consulta especializada en síncope 82 pacientes dados de alta de urgencias con dos o más criterios de riesgo según la escala OESIL (edad>65 años, síncope sin pródromos, ECG basal anormal, enfermedad cardiovascular conocida). Tras un seguimiento medio de 2,1 años, sólo el 12% tuvo un diagnóstico final de síncope arrítmico. Esta diferencia observada podría deberse a la distinta población incluida, más seleccionada en nuestro caso. En el trabajo de Romero et al menos de la mitad de los pacientes presentaban TCIV y los procedimientos diagnósticos realizados fueron en su mayoría los utilizados en nuestra «evaluación inicial». El uso de procedimientos invasivos fue escaso (4 EEF y 2 REI) y los diagnósticos más frecuentes fueron los síncopes neuromediados y ortostáticos. En nuestra serie, por el contrario, la presencia de TCIV fue un criterio de inclusión y se excluyó sistemáticamente a los pacientes con diagnóstico claro tras una evaluación inicial.
LimitacionesNuestro estudio se ha realizado sobre una serie de un solo centro, reclutada en una unidad de arritmias con dedicación especial al estudio del síncope, lo que puede implicar un cierto sesgo. No obstante, el principal sesgo que puede afrontarse es la sobrerrepresentación de causas arrítmicas de síncope, lo que no debería plantear problema, dado que se analiza precisamente la búsqueda de síncope arrítmico.
Una de las limitaciones de nuestro estudio es que 11 pacientes con EEF negativo no completaron el esquema diagnóstico al no implantárseles el REI por diversas razones. En más de la mitad de estos casos, el implante no se realizó bien por existir indicación de implante de desfibrilador por prevención primaria, bien por haber alcanzado un diagnóstico alternativo que hacía innecesaria la continuación del proceso diagnóstico. Al no seguirse a estos pacientes con REI, es posible que se haya reducido el número de diagnósticos alcanzados con dicho dispositivo, lo que subestimaría su capacidad diagnóstica.
Debido al tamaño muestral de nuestro estudio, no fue posible evaluar con precisión si la presencia de HAI añadido al BRD podría significar un mayor riesgo de BAV paroxístico. Sería de interés explorar esta hipótesis en futuros estudios. Además, probablemente debido al pequeño tamaño muestral, los IC del 95% de las OR hallados en la regresión logística múltiple son amplios y, por lo tanto, poco precisos.
Por último, como en otros estudios de síncope, un resultado anormal en el EEF o en el REI se consideró equivalente a diagnóstico de la causa real del síncope. Aunque los criterios diagnósticos utilizados en el presente estudio están ampliamente aceptados, se debería aclarar el significado de dichos criterios en subgrupos específicos de pacientes, en el futuro, por el resultado de ensayos clínicos con mayor número de pacientes y con largo seguimiento.
ConclusionesEn pacientes con TCIV, el BAV paroxístico es la causa más frecuente de síncope y el BR derecha con intervalo PR prolongado y la diabetes mellitus, los marcadores más relevantes. La taquicardia ventricular es la siguiente causa, siendo el BR izquierda más frecuente en estos casos. El uso escalonado del EEF en primer lugar y del REI en los casos negativos permite alcanzar un porcentaje elevado de diagnósticos con seguridad, dado que la taquicardia ventricular suele identificarse en el EEF.
Conflicto de interesesNinguno.
Agradecimientos
El más sincero agradecimiento a la Dra. Mariana Galante por el asesoramiento y la colaboración en el análisis estadístico.
Recibido 30 Junio 2010
Aceptado 17 Octubre 2010
Autor para correspondencia: Unidad de Arritmias, Servicio de Cardiología, Hospital Clínico Universitario, Avda. Blasco Ibáñez 17, 46010, Valencia, España. damiazo@gmail.com