La amiloidosis cardiaca por transtirretina (ATTR-CA) es una miocardiopatía infiltrativa grave causada por el depósito de transtirretina en forma de fibras amiloides. Puede tener un origen genético (ATTRv) o ser adquirida (ATTRwt)1.
El tafamidis es un estabilizador de transtirretina que ha demostrado aumentar la supervivencia y disminuir las hospitalizaciones por ATTR-CA. El diflunisal es un antiinflamatorio no esteroideo que estabiliza la transtirretina in vitro y que ha demostrado retrasar la afección neurológica en la ATTRv2. Aunque la información acerca de su efectividad en el ámbito de la cardiología es limitada y se basa en estudios de tamaño reducido, se ha utilizado en pacientes con ATTR-CA en ausencia de otras alternativas terapéuticas3–5. Al ser un tratamiento antiinflamatorio crónico, existe preocupación acerca de sus posibles efectos secundarios en pacientes con ATTR-CA que suelen presentar insuficiencia cardiaca, cierto grado de insuficiencia renal y uso frecuente de anticoagulantes.
El objetivo fue evaluar la tolerabilidad, la seguridad y la eficacia del tratamiento con diflunisal en ATTR-CA.
Se realizó un análisis retrospectivo y longitudinal de los pacientes con ATTR-CA tratados con diflunisal en un centro español desde junio de 2018 hasta marzo de 2023. Se evaluó la tolerancia, la evolución electrocardiográfica y ecocardiográfica, así como la incidencia de eventos adversos. Los parámetros de seguridad incluyeron: empeoramiento de la función renal (aumento de creatinina >0,3mg/dl), hemorragias relevantes, e intolerancia digestiva que requiriera la suspensión del fármaco.
Se administró diflunisal 250mg/12h a 30 pacientes (28 varones; edad media 77,5±10 años). De estos, 2 eran pacientes con ATTRv (Val50Met y Ala65Thr) y 28 padecían ATTRwt. Asimismo, 13 (43%) presentaban síndrome del túnel carpiano, 11 (36,7%) rotura del tendón bicipital y 5 (16,7%) estenosis de canal lumbar. La mayoría se encontraba en una fase temprana de la enfermedad (86,2% en estadio I del National Amyloid Center). Al inicio del tratamiento, 13 pacientes (43,3%) estaban en clase I de la New York Heart Association (NYHA), 16 (53,3%) en NYHA II y 1 (3,3%) en NYHA III. Además, 11 pacientes (36,7%) tenían fibrilación auricular y 5 (16,7%) portaban marcapasos.
A 22 pacientes (73%) se les administró un inhibidor de la bomba de protones y 11 (36,6%) recibían tratamiento anticoagulante (3 con acenocumarol y 8 con anticoagulantes de acción directa). Solo 1 paciente recibía patisirán por polineuropatía. Un total de 20 pacientes (66,7%) recibían tratamiento diurético, la mayoría con dosis bajas de furosemida: mediana de 30 [intervalo intercuartílico, 10-40] mg.
La mediana de seguimiento fue de 260 [intervalo intercuartílico, 123-483] días. Se suspendió el tratamiento a 7 pacientes (23,3%) por eventos adversos y a 4 (13,3%) para participar en ensayos clínicos. En 1 paciente se suspendió por futilidad. Se produjeron 4 episodios de hemorragia, 3 no vitales (epistaxis, gingivorragia y hematoma espontáneo del brazo) y 1 con hematomas subdurales múltiples tras experimentar varias caídas. En 8 casos (26,7%) se observó un deterioro significativo de la función renal, pero solo se suspendió el tratamiento por criterio médico en 2 pacientes. En 1 paciente se suspendió por parestesias. No se comunicaron muertes durante el seguimiento, y solo 1 paciente ingresó por insuficiencia cardiaca tras 97 días de tratamiento.
Se analizó la evolución de los biomarcadores (n=28) tras una mediana de tratamiento de 260 [intervalo intercuartílico, 128-529] días, y se observó un leve aumento de los valores de creatinina (0,92±0,16 frente a 1,08±0,27mg/dl; p<0,01); de la fracción aminoterminal del propéptido natriurético cerebral (tipo B) (NT-proBNP) 925 [281-1.686] pg/ml frente a 1.692,5 [580,5-2.438,5] pg/ml; p<0,01- y de la hemoglobina (14,9±1,2 frente a 15,3±1,3g/dl; p=0,02), así como un descenso en las cifras de plaquetas (189 [157-235]×103/μl frente a 173 [136-215]×103/μl; p=0,01). No se observaron cambios en los parámetros electrocardiográficos (n=26; mediana de seguimiento, 324 días) ni en los ecocardiográficos (n=14; mediana de seguimiento, 453 días) (tabla 1).
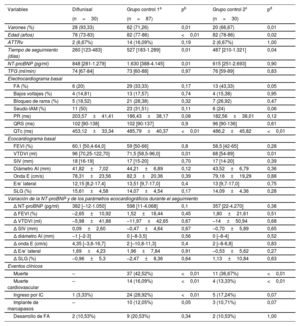
Características basales y seguimiento de los pacientes tratados con diflunisal y de los que no reciben un tratamiento específico
| Variables | Diflunisal | Grupo control 1a | pb | Grupo control 2c | pd |
|---|---|---|---|---|---|
| (n=30) | (n=87) | (n=30) | |||
| Varones (%) | 28 (93,33) | 62 (71,26) | 0,01 | 20 (66,67) | 0,01 |
| Edad (años) | 78 (73-83) | 82 (77-86) | <0,01 | 82 (78-86) | 0,02 |
| ATTRv | 2 (6,67%) | 14 (16,09%) | 0,19 | 2 (6,67%) | 1,00 |
| Tiempo de seguimiento (días) | 260 [123-483] | 527 [183-1.289] | 0,01 | 487 [210-1.321] | 0,04 |
| NT-proBNP (pg/ml) | 848 [281-1.279] | 1.630 [388-4.145] | 0,01 | 615 [251-2.693] | 0,90 |
| TFG (ml/min) | 74 [67-84] | 73 [60-88] | 0,97 | 76 [59-89] | 0,83 |
| Electrocardiograma basal | |||||
| FA (%) | 6 (20) | 29 (33,33) | 0,17 | 13 (43,33) | 0,05 |
| Bajos voltajes (%) | 4 (14,81) | 13 (17,57) | 0,74 | 4 (15,38) | 0,95 |
| Bloqueo de rama (%) | 5 (18,52) | 21 (28,38) | 0,32 | 7 (26,92) | 0,47 |
| Seudo-IAM (%) | 11 (50) | 23 (31,51) | 0,11 | 6 (24) | 0,06 |
| PR (ms) | 203,57±41,41 | 186,43±38,17 | 0,08 | 182,56±38,01 | 0,12 |
| QRS (ms) | 102 [90-138] | 102 [90-137] | 0,9 | 96 [90-136] | 0,61 |
| QTc (ms) | 453,12±33,34 | 485,79±40,37 | <0,01 | 486,2±45,82 | <0,01 |
| Ecocardiograma basal | |||||
| FEVI (%) | 60,1 [50,4-64,0] | 59 [50-66] | 0,8 | 58,5 [42-65] | 0,28 |
| VTDVI (ml) | 96 [70,25-122,70] | 71,5 [58,5-96,0] | 0,01 | 68 [54-89] | 0,01 |
| SIV (mm) | 18 [16-19] | 17 [15-20] | 0,70 | 17 [14-20] | 0,39 |
| Diámetro AI (mm) | 41,82±7,02 | 44,21±6,89 | 0,12 | 43,52±6,79 | 0,36 |
| Onda E (cm/s) | 78,31±23,56 | 82,3±20,36 | 0,39 | 79,16±19,29 | 0,88 |
| E/e’ lateral | 12,15 [8,2-17,4] | 13,51 [9,7-17,0] | 0,4 | 13 [9,7-17,0] | 0,75 |
| SLG (%) | 15,61±4,58 | 14,07±4,54 | 0,17 | 14,09±4,36 | 0,28 |
| Variación de la NT-proBNP y de los parámetros ecocardiográficos durante el seguimiento | |||||
| Δ NT-proBNP (pg/ml) | 382 [–12-1.050] | 598 [11-4.068] | 0,1 | 357 [22-4.270] | 0,38 |
| Δ FEVI (%) | –2,65±10,92 | 1,52±18,44 | 0,45 | 1,80±21,61 | 0,51 |
| Δ VTDVI (ml) | –5,98±41,88 | –11,97±42,65 | 0,67 | –14±50,94 | 0,68 |
| Δ SIV (mm) | 0,09±2,60 | –0,47±4,64 | 0,67 | –0,70±5,89 | 0,65 |
| Δ diámetro AI (mm) | –1 [–2-3] | 0 [–8-3,5] | 0,56 | 0 [–8-4] | 0,52 |
| Δ onda E (cm/s) | 4,35 [–3,6-16,7] | 2 [–10,8-11,3] | 0,4 | 2 [–8-6,8] | 0,83 |
| Δ E/e’ lateral | 1,69±4,23 | 1,96±7,84 | 0,91 | –0,53±5,62 | 0,27 |
| Δ SLG (%) | –0,96±5,3 | –2,47±8,36 | 0,64 | 1,13±10,84 | 0,63 |
| Eventos clínicos | |||||
| Muerte | – | 37 (42,52%) | <0,01 | 11 (36,67%) | <0,01 |
| Muerte cardiovascular | – | 14 (16,09%) | <0,01 | 4 (13,33%) | <0,01 |
| Ingreso por IC | 1 (3,33%) | 24 (28,92%) | <0,01 | 5 (17,24%) | 0,07 |
| Implante de marcapasos | – | 10 (12,05%) | 0,05 | 3 (10,71%) | 0,07 |
| Desarrollo de FA | 2 (10,53%) | 9 (20,53%) | 0,34 | 2 (10,53%) | 1,00 |
AI: aurícula izquierda; ATTR-CA: amiloidosis cardiaca por trastirretina; ATTRv: ATTR hereditaria; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral (tipo B); seudo-IAM: patrón de seudoinfarto; SIV: septo interventricular; SLG: strain longitudinal global; TAPSE: excursión sistólica del plano del anillo tricuspídeo; TFG: tasa de filtrado glomerular; VTDVI: volumen telediastólico ventricular izquierdo.
Los datos expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
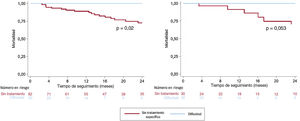
Se comparó la evolución de los pacientes tratados con la de todos los que presentaban ATTR-CA que no recibieron ningún tratamiento específico (ni se incluyeron en ensayos clínicos) y que en nuestro centro habrían sido elegibles para recibir diflunisal (tasa de filtrado glomerular [TFG] ≥ 45ml/min) en el mismo periodo (n=87). También se comparó con un segundo grupo control emparejado uno a uno por la TFG (≥ 45ml/min), NT-proBNP (> 3.000 frente a ≤ 3.000 pg/ml) y subtipo de amiloidosis (ATTRwt frente a ATTRv) (tabla 1). El análisis de supervivencia mostró una menor mortalidad en los pacientes que recibieron diflunisal con respecto a los del grupo control total y una tendencia a menor mortalidad con respecto al grupo control emparejado (figura 1). Debido al tamaño limitado de la muestra, no fue posible incorporar la edad como variable de emparejamiento.
Supervivencia en pacientes con amiloidosis cardiaca por transtirretina en función del tratamiento. Tiempo hasta la muerte en pacientes con amiloidosis cardiaca por trantirretina tratados con diflunisal en comparación con un grupo control de pacientes con tasa de filtrado glomerular ≥45ml (izquierda) y con un grupo control emparejado por tasa de filtrado glomerular, fracción aminoterminal del propéptido natriurético cerebral (tipo B) y subtipo de amiloidosis (derecha).
En este estudio se describe nuestra experiencia con diflunisal en pacientes con ATTR-CA. Pese a contar con menor evidencia acerca de su eficacia y tener un perfil de seguridad inferior al de tafamidis, el tratamiento con diflunisal es una opción significativamente más económica. Su uso puede ser razonable en situaciones de ausencia de accesibilidad a tafamidis por motivos económicos o en pacientes que no puedan recibirlo por otros motivos, como en el caso de fenotipos subclínicos o en pacientes con alta sospecha de ATTR-CA pero sin un diagnóstico definitivo. Hasta la fecha, el trabajo con mayor número de pacientes con ATTR-CA tratados con diflunisal incluyó a 35 pacientes6. En él, la mediana de seguimiento fue de 3,2 años y en 14 pacientes (40%) se interrumpió debido a los efectos secundarios, la mayoría (57%) por empeoramiento de la función renal. Los resultados obtenidos están en consonancia y confirman que es necesario llevar a cabo una selección cuidadosa de los candidatos y un seguimiento estrecho de la función renal. En este estudio se documenta una menor incidencia de hemorragia (solo 1 caso) que podría deberse a que la edad de nuestros pacientes era mayor y el 36% recibía tratamiento anticoagulante. Asimismo, no se observaron cambios significativos en los parámetros ecocardiográficos y se confirmó una menor mortalidad que en los pacientes no tratados. Estos resultados deben interpretarse con precaución, ya que los estudios comparativos no aleatorizados presentan inevitables sesgos de selección.
En conclusión, en esta cohorte, diflunisal demostró una tolerancia moderada con una tasa de suspensión del 23% por eventos adversos. Los más comunes fueron empeoramiento de la función renal, epigastralgia y hemorragia menor. La mayoría fue de carácter leve y aparecieron durante los primeros meses de tratamiento. Aunque el número de pacientes analizado es pequeño, no se observaron cambios significativos en los parámetros electrocardiográficos o ecocardiográficos. Por el contrario, el tratamiento con diflunisal se asoció a una menor mortalidad con respecto a los pacientes que no recibieron tratamiento específico.
FINANCIACIÓNEste trabajo ha contado con financiación del ISCIII (Instituto de Salud Carlos III) mediante los proyectos «PI18/0765 & PI20/01379» (Co-funded by European Regional Development Fund/European Social Fund «A way to make Europe»/«Investing in your future»). El CNIC (Centro Nacional de Investigaciones Cardiovasculares) recibe financiación del ISCIII, el Ministerio de Ciencia e Innovación y la Fundación Pro-CNIC, y es un centro Severo Ochoa (CEX2020-001041-S).
CONSIDERACIONES ÉTICASEl estudio recibió la aprobación del Comité de ética del Hospital Puerta de Hierro, que permitió el uso retrospectivo de los datos de los participantes para la realización del estudio. No se han tenido en cuenta las directrices SAGER (Sex and Gender Equity in Research) para las variables de sexo y género.
DECLARACION SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se han usado herramientas de inteligencia artificial en el desarrollo de este trabajo.
CONTRIBUCIÓN DE LOS AUTORESB. Peiró-Aventín, E. Cabrera-Romero, N. Mora-Ayestarán, F. Domínguez y E. González-López recogieron los datos; B. Peiró-Aventín redactó la primera versión; E. González-López obtuvo financiación, y P. García-Pavía supervisó el estudio, realizó una revisión del trabajo y obtuvo financiación.
CONFLICTO DE INTERESESF. Domínguez ha recibido honorarios de Pfizer por ponencias y actividad de asesoría y de Alnylam por ponencias. E. González-López ha participado como ponente en actividades organizadas por Pfizer, Alnylam y Eidos, y ha recibido honorarios de Pfizer, Proclara, Novo Nordisk y Akcea por consultoría. P. García-Pavía ha recibido honorarios como ponente de Alnylam Pharmaceuticals, AstraZeneca, Bridgebio, Intellia, Ionis Pharmaceuticals, NovoNordisk y Pfizer; así como honorarios por consultoría de Alexion, Alnylam Pharmaceuticals, AstraZeneca, ATTRalus, Bridgebio, General Electric, Intellia, Neurimmune, NovoNordisk y Pfizer. Todos los autores declaran que su institución ha recibido financiación para investigación/actividades educativas de Alnylam Pharmaceuticals, AstraZeneca, Bridgebio, Intellia, NovoNordisk y Pfizer. P. García-Pavía es editor asociado de Revista Española de Cardiología; para garantizar la gestión imparcial del manuscrito, se ha seguido el procedimiento editorial establecido en la revista.