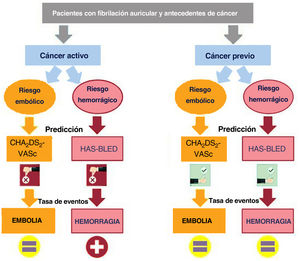
El impacto del cáncer en los eventos de los pacientes con fibrilación auricular (FA) no está claro. El objetivo de este estudio es evaluar cómo el cáncer influye en el riesgo de eventos embólicos y hemorrágicos de los pacientes con FA.
MétodosConformaron la población del estudio 16.056 pacientes de un área sanitaria española diagnosticados de FA entre 2014 y 2018. De ellos, 1.137 (7,1%) tenían antecedentes de cáncer. Durante una mediana de seguimiento de 4,9 años, se evaluó mediante un análisis de riesgos competitivos la relación entre el cáncer y las embolias y hemorragias.
ResultadosNo se detectó asociación entre un mayor riesgo de eventos embólicos y cáncer en general (sHR=0,73; IC95%, 0,41-1,26). Sin embargo, el cáncer se asoció con un mayor riesgo hemorrágico, aunque solo en pacientes con cáncer activo (sHR=1,42; IC95%, 1,20-1,67) o radioterapia previa (sHR=1,40; IC95%, 1,19-1,65). Las escalas CHA2DS2-VASc y HAS-BLED mostraron un rendimiento subóptimo para predecir el riesgo, respectivamente, embólico y hemorrágico (estadístico c <0,50) de los pacientes no anticoagulados con cáncer activo. La relación entre el aumento de las hemorragias y la disminución de las embolias con anticoagulación fue similar en pacientes con y sin cáncer (5,6 frente a 7,8; p <0,001).
ConclusionesEl cáncer no se asoció con un mayor riesgo de eventos embólicos en pacientes con FA, solo con un mayor riesgo de hemorragia. Sin embargo, el cáncer activo empeoró la capacidad predictiva de las escalas CHA2DS2-VASc y HAS-BLED para predecir eventos en pacientes no anticoagulados.
Palabras clave
A nivel mundial, 1 de cada 5 personas presenta un cáncer a lo largo de la vida1. Por fortuna, los avances recientes en la detección, el diagnóstico y el tratamiento de muchos cánceres han conducido a una disminución progresiva de la mortalidad. Muchos pacientes oncológicos viven 5 años o más después del diagnóstico inicial, y ello conduce a un aumento de la atención prestada a sus necesidades médicas y psicológicas a largo plazo. Según los datos de la International Agency for Research on Cancer, en 2020 habrá en el mundo más de 50 millones de personas que vivan con un diagnóstico de cáncer realizado en los 5 años anteriores1.
Estudios recientes han puesto de relieve que los pacientes con antecedentes de cáncer tienen el doble de riesgo de desarrollar una enfermedad cardiovascular que los pacientes sin cáncer2. La fibrilación auricular (FA) es una comorbilidad cardiovascular frecuente en los pacientes con cáncer3, y la presencia conjunta de estos dos trastornos plantea varios retos clínicos. Las tasas de prevalencia de la FA varían notablemente de un estudio a otro, dependiendo de si se han centrado en pacientes con cáncer activo, pacientes con antecedentes de cáncer o pacientes a los que se practica una intervención quirúrgica oncológica. En el estudio REGARDS3, los pacientes con cáncer presentaron una probabilidad de tener FA un 20% superior a la de los pacientes sin cáncer, y se alcanzó una prevalencia de FA del 15%. Dado que muchos cánceres interaccionan con la cascada de la coagulación, el uso de tratamiento anticoagulante en los pacientes con FA y cáncer puede resultar difícil, dados los cambios impredecibles que puede haber en el riesgo de trombosis y de hemorragia4,5. Con objeto de facilitar la toma de decisiones en este dilema clínico, sería de gran utilidad proporcionar información sobre cómo influye un diagnóstico previo de cáncer en el riesgo de episodios embólicos y hemorrágicos en los pacientes con FA. Así pues, llevamos a cabo el presente estudio teniendo en cuenta la influencia de la actividad, el tiempo, el estadio y el tratamiento del cáncer en el riesgo embólico y hemorrágico de los pacientes con FA.
MÉTODOSPoblación del estudioSe realizó un estudio de cohorte retrospectivo basado en un registro en el que se incluyó a todos los pacientes consecutivos (n=16.202) con un diagnóstico de FA entre enero de 2014 y enero de 2018 en el área sanitaria de Vigo, Galicia, (registro CardioCHUVI-AF; identificador de ClinicalTrials.gov: NCT04364516).6,7 Se excluyó a los pacientes en los que faltaban datos basales o de seguimiento (n=146); por consiguiente, la cohorte final la formaron 16.056 pacientes con FA. El estudio se llevó a cabo cumpliendo los principios de la Declaración de Helsinki y fue aprobado por el comité de ética de investigación local (Comité Autónomo de Ética de Investigación de Galicia, código HAC-ACO-2018-01, registro 2018/258). Dado el carácter retrospectivo y de base poblacional del estudio, el comité de ética no consideró necesario un consentimiento informado.
Participación de los pacientes y del públicoLos pacientes y el público no participaron en ningún modo en el estudio.
Diagnóstico del cáncerEl cáncer se definió como cualquier enfermedad neoplásica maligna diagnosticada antes de la evaluación del paciente respecto a la FA, e incluyó los tumores sólidos y los cánceres hemáticos. Las neoplasias mieloproliferativas, así como el cáncer cutáneo distinto del melanoma, los tumores benignos y las lesiones precancerosas in situ (por ejemplo, displasia de alto grado), no se incluyeron en este análisis, dado que se preveía que tuvieran una trascendencia clínica baja durante el horizonte temporal del estudio. Los cánceres se clasificaron según su actividad, estadio y ubicación. El cáncer activo se definió según la definición más reciente propuesta por el Comité Científico y de Estandarización de la International Society on Thrombosis and Haemostasis, como cáncer diagnosticado en los 6 meses previos a la evaluación médica realizada por la FA, cáncer con progresión local, metástasis o falta de remisión completa en los últimos 6 meses, y pacientes tratados con una terapia específica para el cáncer en los 6 meses previos8. La determinación del estadio se basó en la clasificación del American Joint Committee on Cancer9. Además, se clasificaron los tipos de cáncer según la afectación anatómica y sistémica primaria, incluyendo tan solo las localizaciones en las que la frecuencia del cáncer fue de ≥ 40 pacientes (≥ 3,5% del total de cánceres en nuestro estudio).
Criterios de valoraciónLos criterios de valoración principales fueron los episodios embólicos y hemorrágicos durante el seguimiento. Los episodios embólicos se definieron en función de las definiciones de eventos cardiovasculares y de ictus para los ensayos clínicos establecidas por la Standardized Data Collection for Cardiovascular Trials Initiative y la Food and Drug Administration de los Estados Unidos10. Los episodios hemorrágicos fueron las hemorragias mayores y las hemorragias no mayores de trascendencia clínica, definidas según lo establecido por la International Society on Trombosis and Haemostasis11,12.
Análisis estadísticoUtilizamos modelos de riesgo de subdistribución proporcional de Fine-Gray para estimar la asociación del cáncer con los episodios embólicos y hemorrágicos. La muerte se consideró un riesgo competidor. Las estimaciones del efecto se presentaron mediante valores de HR de subdistribución (sHR) junto con los intervalos de confianza del 95% (IC95%). La incidencia de ambos criterios de valoración se calculó con el empleo de curvas de incidencia acumulada ponderadas. En todos los análisis se aplicó un ajuste según las variables de edad, sexo, puntuación CHA2DS2-VASc, puntuación HAS-BLED y tratamiento anticoagulante. Complementamos nuestro análisis con un análisis de emparejamiento por puntuación de propensión. Para el emparejamiento de los pacientes utilizamos el criterio del vecino más próximo en una relación 1:1 con un margen de 0,1. Se obtuvo una población emparejada de 2270 pacientes (1135 con cáncer y 1135 sin cáncer) (tabla 1 del material adicional). Tras el emparejamiento mediante puntuación de propensión, la asociación entre el cáncer y los episodios embólicos o hemorrágicos se evaluó con modelos de riesgos competidores convencionales. Se evaluó el rendimiento predictivo de las puntuaciones de riesgo incluidas mediante su capacidad de discriminación y de calibración. La discriminación se evaluó mediante el índice de concordancia (estadístico c), que refleja la medida en la que la puntuación de riesgo diferencia a los pacientes con y sin el criterio de valoración de interés. Para la calibración, se examinaron todas las medidas de ajuste global, incluida la puntuación de Brier, que se calculó mediante el promedio de la desviación cuadrática entre el riesgo predicho y el observado. Los análisis estadísticos se realizaron con los programas informáticos STATA y R. Se consideró estadísticamente significativo un valor de p bilateral < 0,05.
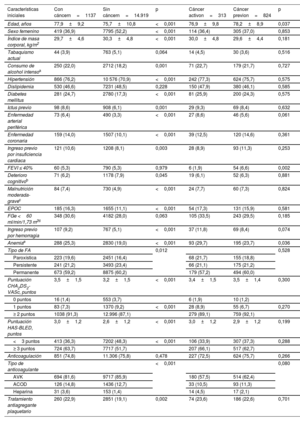
RESULTADOSPoblación del estudio y características inicialesDe los 16.056 pacientes con FA, 1.137 (7,1%) tenían un diagnóstico actual o previo de cáncer. Del total de cánceres, 313 (27,5%) eran cánceres activos (figura 1del material adicional). Un total de 419 (36,9%) se encontraban en estadios avanzados (III-IV), con metástasis en 86 pacientes (7,6%). Las ubicaciones más frecuentes del cáncer fueron la de próstata (n=339; 29,8%), seguida de las de colon-recto (n=192; 16,9%), mama (n=155; 13,6%), riñón-vejiga urinaria (n=93; 8,2%), sangre (n=63; 5,5%) y pulmón (n=42; 3,7%). Se trató con radioterapia a 344 pacientes (30,3%), y 234 pacientes (20,6%) recibieron quimioterapia (puede consultarse información más detallada en las tablas 2 y 3 del material adicional). En la tabla 1 se muestran las características iniciales de la población del estudio, comparando a los pacientes con cáncer con los pacientes sin cáncer.
Características iniciales de la población del estudio y comparación de los pacientes con y sin cáncer
| Características iniciales | Con cáncern=1137 | Sin cáncern=14.919 | p | Cáncer activon=313 | Cáncer previon=824 | p |
|---|---|---|---|---|---|---|
| Edad, años | 77,9±9,2 | 75,7±10,8 | <0,001 | 76,9±9,8 | 78,2±8,9 | 0,037 |
| Sexo femenino | 419 (36,9) | 7795 (52,2) | <0,001 | 114 (36,4) | 305 (37,0) | 0,853 |
| Índice de masa corporal, kg/m2 | 29,7±4,6 | 30,3±4,8 | <0,001 | 30,0±4,8 | 29,6±4,4 | 0,181 |
| Tabaquismo actual | 44 (3,9) | 763 (5,1) | 0,064 | 14 (4,5) | 30 (3,6) | 0,516 |
| Consumo de alcohol intensoa | 250 (22,0) | 2712 (18,2) | 0,001 | 71 (22,7) | 179 (21,7) | 0,727 |
| Hipertensión | 866 (76,2) | 10 576 (70,9) | <0,001 | 242 (77,3) | 624 (75,7) | 0,575 |
| Dislipidemia | 530 (46,6) | 7231 (48,5) | 0,228 | 150 (47,9) | 380 (46,1) | 0,585 |
| Diabetes mellitus | 281 (24,7) | 2780 (17,3) | <0,001 | 81 (25,9) | 200 (24,3) | 0,575 |
| Ictus previo | 98 (8,6) | 908 (6,1) | 0,001 | 29 (9,3) | 69 (8,4) | 0,632 |
| Enfermedad arterial periférica | 73 (6,4) | 490 (3,3) | <0,001 | 27 (8,6) | 46 (5,6) | 0,061 |
| Enfermedad coronaria | 159 (14,0) | 1507 (10,1) | <0,001 | 39 (12,5) | 120 (14,6) | 0,361 |
| Ingreso previo por insuficiencia cardiaca | 121 (10,6) | 1208 (8,1) | 0,003 | 28 (8,9) | 93 (11,3) | 0,253 |
| FEVI ≤ 40% | 60 (5,3) | 790 (5,3) | 0,979 | 6 (1,9) | 54 (6,6) | 0,002 |
| Deterioro cognitivob | 71 (6,2) | 1178 (7,9) | 0,045 | 19 (6,1) | 52 (6,3) | 0,881 |
| Malnutrición moderada-gravec | 84 (7,4) | 730 (4,9) | <0,001 | 24 (7,7) | 60 (7,3) | 0,824 |
| EPOC | 185 (16,3) | 1655 (11,1) | <0,001 | 54 (17,3) | 131 (15,9) | 0,581 |
| FGe <60 ml/min/1,73 m2d | 348 (30,6) | 4182 (28,0) | 0,063 | 105 (33,5) | 243 (29,5) | 0,185 |
| Ingreso previo por hemorragia | 107 (9,2) | 767 (5,1) | <0,001 | 37 (11,8) | 69 (8,4) | 0,074 |
| Anemiae | 288 (25,3) | 2830 (19,0) | <0,001 | 93 (29,7) | 195 (23,7) | 0,036 |
| Tipo de FA | 0,012 | 0,528 | ||||
| Paroxística | 223 (19,6) | 2451 (16,4) | 68 (21,7) | 155 (18,8) | ||
| Persistente | 241 (21,2) | 3493 (23,4) | 66 (21,1) | 175 (21,2) | ||
| Permanente | 673 (59,2) | 8875 (60,2) | 179 (57,2) | 494 (60,0) | ||
| Puntuación CHA2DS2-VASc, puntos | 3,5±1,5 | 3,2±1,5 | <0,001 | 3,4±1,5 | 3,5±1,4 | 0,300 |
| 0 puntos | 16 (1,4) | 553 (3,7) | 6 (1,9) | 10 (1,2) | ||
| 1 puntos | 83 (7,3) | 1370 (9,2) | <0,001 | 28 (8,9) | 55 (6,7) | 0,270 |
| ≥ 2 puntos | 1038 (91,3) | 12.996 (87,1) | 279 (89,1) | 759 (92,1) | ||
| Puntuación HAS-BLED, puntos | 3,0±1,2 | 2,6±1,2 | <0,001 | 3,0±1,2 | 2,9±1,2 | 0,199 |
| <3 puntos | 413 (36,3) | 7202 (48,3) | <0,001 | 106 (33,9) | 307 (37,3) | 0,288 |
| ≥ 3 puntos | 724 (63,7) | 7717 (51,7) | 207 (66,1) | 517 (62,7) | ||
| Anticoagulación | 851 (74,8) | 11.306 (75,8) | 0,478 | 227 (72,5) | 624 (75,7) | 0,266 |
| Tipo de anticoagulante | <0,001 | 0,080 | ||||
| AVK | 694 (81,6) | 9717 (85,9) | 180 (57,5) | 514 (62,4) | ||
| ACOD | 126 (14,8) | 1436 (12,7) | 33 (10,5) | 93 (11,3) | ||
| Heparina | 31 (3,6) | 153 (1,4) | 14 (4,5) | 17 (2,1) | ||
| Tratamiento antiagregante plaquetario | 260 (22,9) | 2851 (19,1) | 0,002 | 74 (23,6) | 186 (22,6) | 0,701 |
IECA/ARA, inhibidores de la enzima de conversión de la angiotensina/antagonistas de los receptores de angiotensina; FA, fibrilación auricular; EPOC, enfermedad pulmonar obstructiva crónica; ACOD, anticoagulante oral directo; FGe: filtración glomerular estimada; FEVI, fracción de eyección ventricular izquierda; AVK, antagonista de la vitamina K.
Los datos se expresan en forma de número (%) o de media ± desviación estándar.
Definido por el National Institute on Alcohol Abuse and Alcoholism como el consumo de ≥ 4 bebidas alcohólicas en cualquier día o el de ≥ 14 bebidas alcohólicas por semana en los varones, o el consumo de ≥ 3 bebidas alcohólicas en cualquier día o de ≥ 7 bebidas alcohólicas por semana en las mujeres, durante el mes anterior.
Equivalente a la demencia moderada a grave, definida como un deterioro cognitivo entre los estadios 5 y 7 de la Reisberg Global Deterioration Scale, lo cual corresponde a los estadios ≥ 5 de la escala Functional Assessment Staging.
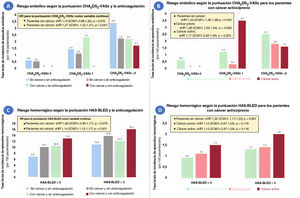
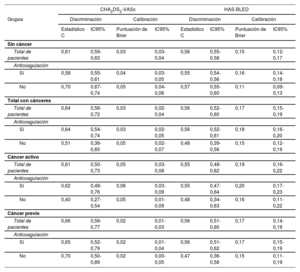
A diferencia de lo observado en los pacientes no oncológicos, no se detectó un aumento progresivo de la tasa de episodios embólicos y hemorrágicos en los pacientes con cáncer a medida que aumentaban las puntuaciones CHA2DS2-VASc y HAS-BLED, respectivamente (figura 2 del material adicional). Ninguno de los pacientes con cáncer y una puntuación CHA2DS2-VASc de 0 presentó episodios embólicos; sin embargo, con una puntuación CHA2DS2-VASc=1, los pacientes con un cáncer activo no anticoagulados tuvieron aún más episodios que los pacientes con una puntuación CHA2DS2-VASc ≥ 2 (figura 1). En relación con la puntuación HAS-BLED, los pacientes con cáncer y un riesgo bajo de hemorragia (puntuación HAS-BLED <3) presentaron unas tasas de hemorragia similares a las de los pacientes sin cáncer y con un riesgo hemorrágico alto (puntuación HAS-BLED ≥ 3) (figura 1). El rendimiento de las 2 puntuaciones de riesgo se resume en la tabla 2. La discriminación proporcionada tanto por la puntuación CHA2DS2-VASc como por la puntuación HAS-BLED fue óptima y similar (p> 0,05) entre los pacientes con cáncer previo y los que no tenían cáncer, pero fue mala en los pacientes no anticoagulados con un cáncer activo (estadístico c 0,40 y 0,48 para la puntuación CHA2DS2-VASc y la puntuación HAS-BLED, respectivamente).
Riesgo embólico y hemorrágico según las puntuaciones CHA2DS2-VASc y HAS-BLED, respectivamente, en pacientes con fibrilación auricular con y sin cáncer, diferenciando a los pacientes con un cáncer previo o un cáncer activo. Tasas brutas de episodios embólicos en pacientes anticoagulados en comparación con los no anticoagulados (A) y en los pacientes con un cáncer previo o activo (B). Tasas brutas de episodios hemorrágicos en pacientes anticoagulados en comparación con los no anticoagulados (C) y en los pacientes con un cáncer previo o activo (D).
Rendimiento de las puntuaciones CHA2DS2-VASc y HAS-BLED en la predicción de los episodios embólicos y hemorrágicos, respectivamente, en pacientes con y sin cáncer, según el estado de anticoagulación
| CHA2DS2-VASc | HAS-BLED | |||||||
|---|---|---|---|---|---|---|---|---|
| Grupos | Discriminación | Calibración | Discriminación | Calibración | ||||
| Estadístico C | IC95% | Puntuación de Brier | IC95% | Estadístico C | IC95% | Puntuación de Brier | IC95% | |
| Sin cáncer | ||||||||
| Total de pacientes | 0,61 | 0,59-0,63 | 0,03 | 0,03-0,04 | 0,56 | 0,55-0,58 | 0,15 | 0,12-0,17 |
| Anticoagulación | ||||||||
| Sí | 0,58 | 0,55-0,61 | 0,04 | 0,03-0,05 | 0,55 | 0,54-0,56 | 0,16 | 0,14-0,18 |
| No | 0,70 | 0,67-0,74 | 0,05 | 0,04-0,06 | 0,57 | 0,55-0,60 | 0,11 | 0,09-0,13 |
| Total con cánceres | ||||||||
| Total de pacientes | 0,64 | 0,56-0,72 | 0,03 | 0,02-0,04 | 0,56 | 0,52-0,60 | 0,17 | 0,15-0,19 |
| Anticoagulación | ||||||||
| Sí | 0,64 | 0,54-0,74 | 0,03 | 0,02-0,05 | 0,56 | 0,52-0,61 | 0,18 | 0,16-0,20 |
| No | 0,51 | 0,36-0,65 | 0,05 | 0,02-0,07 | 0,48 | 0,39-0,56 | 0,15 | 0,12-0,19 |
| Cáncer activo | ||||||||
| Total de pacientes | 0,61 | 0,50-0,73 | 0,05 | 0,03-0,08 | 0,55 | 0,48-0,62 | 0,19 | 0,16-0,22 |
| Anticoagulación | ||||||||
| Sí | 0,62 | 0,48-0,76 | 0,06 | 0,03-0,09 | 0,55 | 0,47-0,64 | 0,20 | 0,17-0,23 |
| No | 0,40 | 0,27-0,54 | 0,05 | 0,01-0,09 | 0,48 | 0,34-0,63 | 0,16 | 0,11-0,22 |
| Cáncer previo | ||||||||
| Total de pacientes | 0,66 | 0,56-0,77 | 0,02 | 0,01-0,03 | 0,56 | 0,51-0,60 | 0,17 | 0,14-0,19 |
| Anticoagulación | ||||||||
| Sí | 0,65 | 0,52-0,79 | 0,02 | 0,01-0,04 | 0,56 | 0,51-0,62 | 0,17 | 0,15-0,19 |
| No | 0,70 | 0,50-0,89 | 0,02 | 0,00-0,05 | 0,47 | 0,36-0,58 | 0,15 | 0,11-0,19 |
Un total de 3.846 pacientes fallecieron (un 38,9% por un trastorno cardiovascular) durante una mediana de seguimiento de 4,9 años (rango intercuartílico, 2,8-5,9 años). Se documentaron episodios embólicos en 1464 pacientes (9,1%) y episodios hemorrágicos en 5595 (34,8%; 1402 fueron de hemorragia mayor).
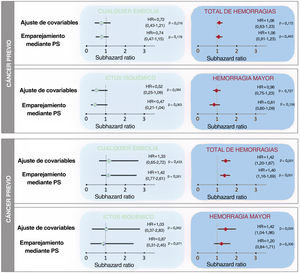
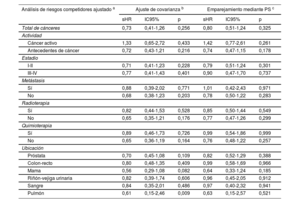
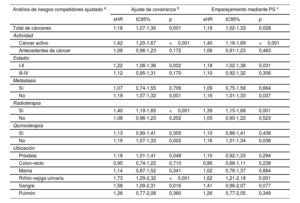
Tras un ajuste respecto a edad, sexo, puntuación CHA2DS2-VASc, puntuación HAS-BLED y tratamiento anticoagulante, el cáncer no mostró una asociación con un mayor riesgo de episodios embólicos (sHR = 0,73; IC95%, 0,41-1,26; p=0,256). La ausencia de asociación entre el cáncer y los episodios embólicos fue similar en los pacientes anticoagulados (sHR = 0,73; IC95%, 0,36-1,46; p=0,372) y en los no anticoagulados (sHR = 0,70; IC95%, 0,28-1,79; p=0,459). Después de analizar los resultados según la actividad, el estadio, la presencia de metástasis, el uso de quimioterapia o radioterapia y la ubicación, no observamos una asociación significativa entre el cáncer y el riesgo embólico (tabla 3). Sin embargo, en comparación con los pacientes sin cáncer, los pacientes con cáncer presentaron un riesgo hemorrágico superior (sHR para el total de hemorragias, 1,18; IC95%, 1,07-1,30; p=0,001), que fue coherente en los pacientes anticoagulados (sHR = 1,15; IC95%, 1,03-1,29; p=0,014) y en los no anticoagulados (sHR = 1,28; IC95%, 1,02-1,60; p=0,031). El aumento del riesgo de hemorragia se debió principalmente al cáncer activo (sHR = 1,42; IC95%, 1,20-1,67; p <0,001). La radioterapia mostró también una asociación con un mayor riesgo hemorrágico (sHR = 1,19; IC95%, 1,07-1,33; p=0,002), y las localizaciones más frecuentes del cáncer en los pacientes tratados con radioterapia fueron la próstata (24,8%), el tracto gastrointestinal (23,8%) y las vías urinarias (11,1%). La información relativa a la ubicación del cáncer y el riesgo hemorrágico se presenta en la tabla 4. La ausencia de asociación entre el cáncer y la embolia, y la asociación entre el cáncer activo y la hemorragia, se mantuvieron tras los análisis con emparejamiento mediante puntuación de propensión (figura 2).
Asociación entre el cáncer y los episodios embólicos según lo indicado por 3 análisis ajustados diferentes (grupo de referencia: pacientes sin cáncer)
| Análisis de riesgos competidores ajustado a | Ajuste de covarianza b | Emparejamiento mediante PS c | ||||
|---|---|---|---|---|---|---|
| sHR | IC95% | p | sHR | IC95% | p | |
| Total de cánceres | 0,73 | 0,41-1,26 | 0,256 | 0,80 | 0,51-1,24 | 0,325 |
| Actividad | ||||||
| Cáncer activo | 1,33 | 0,65-2,72 | 0,433 | 1,42 | 0,77-2,61 | 0,261 |
| Antecedentes de cáncer | 0,72 | 0,43-1,21 | 0,216 | 0,74 | 0,47-1,15 | 0,178 |
| Estadio | ||||||
| I-II | 0,71 | 0,41-1,23 | 0,228 | 0,79 | 0,51-1,24 | 0,301 |
| III-IV | 0,77 | 0,41-1,43 | 0,401 | 0,90 | 0,47-1,70 | 0,737 |
| Metástasis | ||||||
| Sí | 0,88 | 0,39-2,02 | 0,771 | 1,01 | 0,42-2,43 | 0,971 |
| No | 0,68 | 0,38-1,23 | 0,203 | 0,78 | 0,50-1,22 | 0,283 |
| Radioterapia | ||||||
| Sí | 0,82 | 0,44-1,53 | 0,528 | 0,85 | 0,50-1,44 | 0,549 |
| No | 0,65 | 0,35-1,21 | 0,176 | 0,77 | 0,47-1,26 | 0,299 |
| Quimioterapia | ||||||
| Sí | 0,89 | 0,46-1,73 | 0,726 | 0,99 | 0,54-1,86 | 0,999 |
| No | 0,65 | 0,36-1,19 | 0,164 | 0,76 | 0,48-1,22 | 0,257 |
| Ubicación | ||||||
| Próstata | 0,70 | 0,45-1,08 | 0,109 | 0,82 | 0,52-1,29 | 0,388 |
| Colon-recto | 0,80 | 0,48-1,35 | 0,409 | 0,99 | 0,58-1,69 | 0,966 |
| Mama | 0,56 | 0,29-1,08 | 0,082 | 0,64 | 0,33-1,24 | 0,185 |
| Riñón-vejiga urinaria | 0,82 | 0,39-1,74 | 0,606 | 0,96 | 0,45-2,05 | 0,912 |
| Sangre | 0,84 | 0,35-2,01 | 0,486 | 0,97 | 0,40-2,32 | 0,941 |
| Pulmón | 0,61 | 0,15-2,46 | 0,009 | 0,63 | 0,15-2,57 | 0,521 |
IC95%, intervalo de confianza del 95%; PS, puntuación de propensión; sHR: subhazard ratio.
Asociación entre el cáncer y los episodios hemorrágicos según lo indicado por 3 análisis ajustados diferentes (grupo de referencia: pacientes sin cáncer)
| Análisis de riesgos competidores ajustado a | Ajuste de covarianza b | Emparejamiento mediante PS c | ||||
|---|---|---|---|---|---|---|
| sHR | IC95% | p | sHR | IC95% | p | |
| Total de cánceres | 1,18 | 1,07-1,30 | 0,001 | 1,16 | 1,02-1,33 | 0,028 |
| Actividad | ||||||
| Cáncer activo | 1,42 | 1,20-1,67 | <0,001 | 1,40 | 1,16-1,69 | <0,001 |
| Antecedentes de cáncer | 1,09 | 0,96-1,23 | 0,172 | 1,06 | 0,91-1,23 | 0,463 |
| Estadio | ||||||
| I-II | 1,22 | 1,08-1,38 | 0,002 | 1,18 | 1,02-1,38 | 0,031 |
| III-IV | 1,12 | 0,95-1,31 | 0,170 | 1,10 | 0,92-1,32 | 0,306 |
| Metástasis | ||||||
| Sí | 1,07 | 0,74-1,55 | 0,706 | 1,09 | 0,75-1,58 | 0,664 |
| No | 1,19 | 1,07-1,32 | 0,001 | 1,16 | 1,01-1,33 | 0,037 |
| Radioterapia | ||||||
| Sí | 1,40 | 1,19-1,65 | <0,001 | 1,39 | 1,15-1,68 | 0,001 |
| No | 1,08 | 0,96-1,23 | 0,202 | 1,05 | 0,90-1,22 | 0,523 |
| Quimioterapia | ||||||
| Sí | 1,13 | 0,90-1,41 | 0,305 | 1,10 | 0,86-1,41 | 0,438 |
| No | 1,19 | 1,07-1,33 | 0,002 | 1,16 | 1,01-1,34 | 0,036 |
| Ubicación | ||||||
| Próstata | 1,18 | 1,01-1,41 | 0,048 | 1,10 | 0,92-1,33 | 0,294 |
| Colon-recto | 0,95 | 0,74-1,22 | 0,710 | 0,86 | 0,66-1,11 | 0,238 |
| Mama | 1,14 | 0,87-1,52 | 0,341 | 1,02 | 0,76-1,37 | 0,884 |
| Riñón-vejiga urinaria | 1,73 | 1,29-2,32 | <0,001 | 1,62 | 1,21-2,18 | 0,001 |
| Sangre | 1,58 | 1,09-2,31 | 0,016 | 1,41 | 0,96-2,07 | 0,077 |
| Pulmón | 1,26 | 0,77-2,08 | 0,360 | 1,26 | 0,77-2,05 | 0,349 |
IC95%, intervalo de confianza del 95%; PS, puntuación de propensión; sHR: subhazard ratio.
Asociación entre el cáncer previo y el cáncer activo y los episodios embólicos y hemorrágicos en un análisis de riesgos competidores según 3 métodos de ajuste diferentes, tomando la muerte como riesgo competidor. El ajuste para las covariables convencionales incluyó las de edad, sexo, puntuación CHA2DS2-VASc, puntuación HAS-BLED y tratamiento anticoagulante. El ajuste mediante emparejamiento por PS analizó la relación simple entre el cáncer y la embolia tras el emparejamiento mediante la puntuación de propensión (PS). Se presentan los valores de subhazard ratio (sHR) con sus intervalos de confianza del 95% (IC95%), tomando como grupo de referencia los pacientes sin cáncer.
Analizamos la repercusión de los antecedentes de cáncer en los resultados clínicos en una muestra de base población amplia y heterogénea de pacientes con FA. Los principales resultados de nuestro estudio fueron los siguientes: a) el riesgo de embolia en los pacientes con y sin cáncer fue similar, si bien el riesgo de hemorragia fue mayor en los pacientes con un cáncer activo; b) ni la radioterapia ni la quimioterapia aumentaron el riesgo de eventos embólicos, aunque la radioterapia sí se asocia a un aumento del riesgo hemorrágico; c) el rendimiento, tanto de la puntuación CHA2DS2-VASc como de la puntuación HAS-BLED en la predicción de los episodios embólicos y hemorrágicos, respectivamente, fue bajo en los pacientes con cáncer, en especial en los pacientes no anticoagulados con cáncer activo (figura 3); d) los riesgos tanto de infarto agudo de miocardio como de insuficiencia cardiaca fueron similares en los pacientes con FA con y sin cáncer, si bien los pacientes con cáncer tratados con quimioterapia presentaron un riesgo de insuficiencia cardiaca considerablemente superior al de los pacientes no oncológicos; e) no se observaron diferencias de mortalidad cardiovascular entre los pacientes con FA con y sin cáncer; f) la anticoagulación fue beneficiosa tanto en los pacientes con cáncer como en los pacientes sin cáncer, con un perfil embólico-hemorrágico similar.
Cáncer y riesgo de episodios embólicosA pesar de los enormes avances realizados en cardio-oncologia en los últimos años, es poco lo que se sabe acerca del riesgo de episodios cardiovasculares en los pacientes con FA y cáncer. Dadas las anomalías de la cascada de la coagulación y el estado proinflamatorio crónico que se produce de manera secundaria a diversos cánceres, parece razonable prever un mayor riesgo de episodios embólicos y hemorrágicos en los pacientes con FA que tienen un cáncer activo5. En poblaciones generales sin FA, se ha observado que el cáncer se asocia a un estado protrombótico, con aumento del riesgo de complicaciones tromboembólicas arteriales12,13. Sin embargo, aunque nuestros resultados confirman el aumento del riesgo de hemorragia en los pacientes con cáncer, no observamos un aumento del riesgo de eventos embólicos ni de infarto agudo de miocardio en nuestra población de pacientes con FA. Aunque estos resultados pueden parecer sorprendentes y contradictorios con los de los pacientes sin FA, son coherentes con los de los pocos estudios llevados a cabo en pacientes con FA y cáncer. En un estudio prospectivo de 294.989 pacientes suecos hospitalizados por un diagnóstico primario de FA, incluidos 71.882 con cáncer, se observó que ni el diagnóstico de cáncer en general ni el de ningún cáncer específico se asociaba a un aumento del riesgo de ictus isquémico14. Este resultado es coherente con los resultados de un análisis de ámbito nacional de Dinamarca en 68.119 pacientes con FA hospitalizados (11.855 de ellos con cáncer), en el que se observó que el riesgo de complicaciones tromboembólicas fue casi el mismo en los pacientes con y sin cáncer15. Nuestro estudio amplia los resultados más allá del contexto hospitalario, al incluir no solo a pacientes hospitalizados, sino también a pacientes ambulatorios. Además, nuestros resultados están desglosados según la actividad, extensión, ubicación y tratamiento del cáncer, con resultados concordantes en todos estos casos. Sin embargo, a pesar de los ajustes multivariantes y el emparejamiento mediante puntuación de propensión, debemos tener precaución por cuanto el porcentaje de pacientes anticoagulados fue significativamente inferior en el grupo de pacientes con cáncer, y ello podría haber influido en nuestros resultados. Además, a diferencia de lo ocurrido en estudios previos, nuestros resultados se basan en un análisis de riesgos competidores, con independencia del tratamiento de anticoagulación y de la puntuación CHA2DS2-VASc.
Cáncer y riesgo de hemorragiaObservamos un aumento del 18% en el riesgo de hemorragia en los pacientes con FA y cáncer. Sin embargo, no todos los pacientes con cáncer presentaron un aumento del riesgo de hemorragia. La relación entre el cáncer y el aumento del riesgo de hemorragia se observó solo en los pacientes con un cáncer activo y en los tratados con radioterapia. Este resultado es coherente con los de estudios previos que han mostrado una mayor incidencia de hemorragia en los pacientes con un cáncer activo debido a una enfermedad maligna subyacente, que causaba un crecimiento local invasivo y anomalías de la hemostasia14. En una cohorte de ámbito nacional de 2.435.541 pacientes con FA, el cáncer aumentó el riesgo de hemorragia mayor (HR, 1,27; IC95%, 1,26-1,28)16. La hemorragia en los pacientes oncológicos puede estar relacionada con anomalías plaquetarias cuantitativas o cualitativas que, a su vez, pueden deberse al propio cáncer subyacente o a intervenciones terapéuticas como la quimioterapia, la radioterapia o la cirugía. En nuestro estudio, la radioterapia —pero no así la quimioterapia— fue un factor predictivo potente para la hemorragia. Estos resultados podrían haberse visto influidos por la ubicación de los cánceres tratados con radioterapia, si bien se ha descrito que la aparición de telangiectasias en la mucosa irradiada constituye la principal alteración anatomopatológica causante del aumento del riesgo de hemorragia17. A diferencia de lo ocurrido en otros estudios, no se observó ninguna asociación entre la hemorragia y el estadio del cáncer o la presencia de metástasis18; sin embargo, esto podría deberse al tamaño limitado de la muestra.
Consecuencias clínicas de nuestros resultadosEl tratamiento de anticoagulación en los pacientes con FA y cáncer resulta especialmente difícil debido al carácter complejo de esta población19. La incertidumbre y la falta de ensayos aleatorizados de los tratamientos se reflejan en la escasez de recomendaciones basadas en la evidencia para los pacientes oncológicos con FA en las guías clínicas20,21, aun cuando existe ya evidencia de estudios observacionales sobre el beneficio aportado por el tratamiento anticoagulante oral en los pacientes con FA y un cáncer activo22. Nuestros resultados tienen varias consecuencias clínicas a las que debe prestarse especial atención. En nuestro estudio, en el que participaron todos los pacientes con FA del área de salud, la tasa de anticoagulación en los pacientes con cáncer fue alta (74,8%). Otros estudios, basados en pacientes de centros oncológicos, han descrito tasas de anticoagulación oral inferiores en esa población23. Es probable que nuestros resultados se vieran influenciados por el origen diferente de los pacientes analizados. Un resultado novedoso de nuestro estudio es el de que ni la puntuación CHA2DS2-VASc ni la puntuación HAS-BLED predijeron bien los episodios embólicos y hemorrágicos, respectivamente, en los pacientes con un cáncer activo. En un estudio anterior, Pastori et al.24 observaron que la discriminación de la puntuación CHA2DS2-VASc era deficiente en los pacientes con FA y cáncer, con un estadístico c de entre 0,56 y 0,61, dependiendo de la localización del cáncer. Aunque en nuestro estudio la puntuación CHA2DS2-VASc como variable continua no tuvo valor predictivo del riesgo embólico, podría ocurrir que fuera útil como variable discreta. En este sentido, nuestros resultados sugieren que la presencia de un solo factor de riesgo de embolia (CHA2DS2-VASc=1 punto) en pacientes con cáncer identifica ya a pacientes con un riesgo embólico muy alto que requerirían anticoagulación. Sin embargo, serán necesarios nuevos estudios para identificar qué pacientes con cáncer y FA pueden obtener un efecto beneficioso con el tratamiento anticoagulante. Por lo que respecta al riesgo de hemorragia, los pacientes con FA y cáncer, y en especial los que tienen un cáncer activo o un cáncer tratado con radioterapia, presentan un riesgo elevado de hemorragia, con independencia de la puntuación HAS-BLED. De hecho, en nuestro estudio, un paciente con cáncer activo y una puntuación HAS-BLED <3 tenía el mismo riesgo de hemorragia que un paciente sin cáncer con una puntuación HAS-BLED ≥ 3. De manera coherente con lo indicado por un estudio previo25, observamos que la discriminación proporcionada por la puntuación HAS-BLED para la predicción de la hemorragia mayor y no mayor clínicamente trascendentes combinada era baja, incluso en los pacientes sin cáncer. Serán necesarios nuevos estudios que analicen de manera independiente el riesgo de episodios embólicos y hemorrágicos en los pacientes con cáncer, con objeto de crear nuevas puntuaciones de riesgo predictivas específicas para los pacientes con cáncer.
LimitacionesEl carácter observacional de este estudio comporta necesariamente una serie de precauciones al interpretar sus consecuencias clínicas. En primer lugar, dado que no hubo un protocolo de detección sistemática del cáncer, reconocemos que algunos pacientes pueden haber tenido una enfermedad subclínica en el momento de la evaluación de la FA y pueden haber desarrollado el cáncer en una fecha posterior. En segundo lugar, puede haber habido factores de confusión residuales no medidos que hayan influido en algunos de los resultados. En tercer lugar, el tamaño de la muestra y las tasas de episodios fueron bajos, en especial en el grupo de cáncer activo y en los pacientes con cáncer metastásico, lo cual limita la robustez del análisis y nuestra capacidad de explorar los resultados según el tipo de cáncer o según el fármaco de quimioterapia. En cuarto lugar, tan solo hubo 99 pacientes con cáncer que tuvieran una puntuación CHA2DS2-VASc ≤ 1 (16 con una CHA2DS2-VASc de 0 y 83 con una CHA2DS2-VASc de 1); por consiguiente, es difícil llegar a conclusiones sólidas en este grupo de pacientes. Por último, al evaluar las repercusiones de la anticoagulación en los pacientes con cáncer, debemos tener precaución ya que nuestro estudio no es un ensayo clínico aleatorizado.
CONCLUSIONESEn los pacientes con FA, el cáncer podría asociarse a un aumento del riesgo de hemorragia —en especial en los pacientes con cáncer activo y en los tratados con radioterapia— pero no a un aumento del riesgo de episodios embólicos. Ni la puntuación CHA2DS2-VASc ni la HAS-BLED mostraron un buen rendimiento en la predicción de los episodios embólicos y hemorrágicos, respectivamente, en los pacientes con FA y un cáncer activo.
FINANCIACIÓNEl registro electrónico fue financiado de forma no condicionada por Daiichi Sankyo, Pfyzer-BMS, Bayer y Boehringer Ingelheim.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores participaron en la creación del registro CardioCHUVI-AF, hasta la fecha del análisis, y también en la redacción y revisión del presente manuscrito.
CONFLICTOS DE INTERESESS. Raposeiras-Roubín ha recibido honorarios por presentaciones y participación en consejos asesores de Amgen, Sanofi, AstraZeneca, Daichii, Pfyzer, Bayer y Boehringer.
- -
En los pacientes en ritmo sinusal, el cáncer se asocia a un aumento del riesgo embólico y hemorrágico. Sin embargo, son pocos los estudios que han analizado la influencia del cáncer en el riesgo real de episodios embólicos y hemorrágicos o la repercusión de las puntuaciones de riesgo en su predicción.
- -
Los pacientes con FA y cáncer tienen un riesgo hemorrágico más alto que el de los pacientes sin cáncer. Sin embargo, su riesgo embólico es similar.
- -
A diferencia de lo que ocurre en los pacientes sin cáncer, la puntuación de riesgo CHA2DS2-VASc no permite predecir los episodios embólicos en los pacientes con FA y cáncer.
- -
La capacidad predictiva de la puntuación de riesgo HAS-BLED fue baja en los pacientes con FA con o sin cáncer.