La implantación de prótesis valvular aórtica por vía transfemoral con los dispositivos Edwards-SAPIEN (ES) y Medtronic-CoreValve (MCV) es una alternativa al reemplazo quirúrgico en pacientes con estenosis aórtica severa y alto riesgo quirúrgico. Nuestro objetivo es comparar los resultados obtenidos con uno y otro dispositivo.
MétodosEstudio prospectivo de las prótesis implantadas por vía transfemoral en nuestro centro.
ResultadosDe los 76 pacientes (edad, 83±6 años; el 63% mujeres; EuroSCORE logístico, 18±9), Se seleccionó a 50 para ES y a 26 para MCV. No se observaron diferencias entre grupos en edad, sexo, clase funcional, área valvular, enfermedades asociadas o EuroSCORE. Se consiguió implantar la prótesis en el 84% del grupo ES y el 100% del grupo MCV (p=0,04); hubo 3 casos de taponamiento, 2 disecciones aórticas y 1 malposición en la serie ES. Las complicaciones vasculares fueron similares (el 26 frente al 23%), pero la necesidad de marcapasos fue mayor con la MCV (el 10 frente al 39%; p=0,003). Las mortalidades totales a 30 días fueron del 12 y el 20% (sin diferencia significativa) y a 1 año, del 24 y el 20% en los grupos ES y MCV respectivamente. Tras un seguimiento de 367±266 días para ES y 172±159 para MCV, 3 pacientes fallecieron; los demás mantienen la mejoría clínica y no se observan cambios ecocardiográficos.
ConclusionesLa mortalidad hospitalaria, la tasa de complicaciones y la evolución a medio plazo han sido similares con ambos dispositivos; las únicas diferencias encontradas han sido una tasa de implantación con éxito mayor con la MCV, aunque a expensas de una mayor frecuencia de bloqueo auriculoventricular.
Palabras clave
La implantación percutánea de prótesis aórtica es una alternativa a la cirugía en pacientes con estenosis aórtica severa y alto riesgo quirúrgico (ARQ). Se han desarrollado dos tipos de válvulas para implantación percutánea, una expandible con balón (primera implantación en 20021) y otra autoexpandible (primera implantación en 20052). Los resultados de los estudios iniciales de factibilidad y seguridad2,3,4,5,6,7 llevaron en 2008 a la aprobación en Europa de las válvulas Edwards-SAPIENTM (ES) (Edwards Lifesciences LLC, Irvine, California, Estados Unidos) y Medtronic CoreValve™ System (MCV) (Medtronic CoreValve LLC, Minneapolis, Minnesota, Estados Unidos). A finales de 2009 se habían implantado más de 10.000 prótesis, aproximadamente dos tercios por vía transfemoral (TF) y un tercio por vía transapical (TA).
Tras su comercialización, varios registros multicéntricos8,9,10 y unicéntricos11,12,13, algunos de centros españoles14,15,16,17, han proporcionado información de cada uno de estos dispositivos.
Sin embargo, muy pocos centros han incorporado ambas válvulas. De hecho, sólo hemos encontrado dos series publicadas18,19 de estas características. En nuestro hospital hemos implantado ambos dispositivos por vía TF, por lo que el objetivo del presente trabajo es describir los resultados a corto y medio plazo de nuestro programa de implantación TF, destacando los aspectos diferenciales entre ambos dispositivos.
MétodosInicio del programaComenzamos la selección de pacientes en febrero de 2007. En agosto de 2007, se implantó la primera prótesis de Cribier-Edwards por vía TF, que fue sustituida en 2008 por la ES y en 2010 por la ES XT. El programa con la prótesis MCV se inició en marzo de 2008, y el primer dispositivo se implantó en julio de 2008.
Selección de pacientesSe consideró candidatos a los pacientes con área valvular < 0,6cm2/m2, grado funcional NYHA > 2 y ARQ, definido por al menos uno de los siguientes cuatro criterios: EuroSCORE logístico > 20%, comorbilidad grave (enfermedad pulmonar, renal, hepática, hemática o cerebrovascular, fragilidad), edad > 85 años o rechazado para cirugía.
La evaluación incluyó un ecocardiograma transesofágico, coronariografía y aortografía en raíz aórtica y bifurcación iliaca y, en algunos pacientes, tomografía computarizada (TC) del eje iliofemoral. Se midió el diámetro luminal mínimo de cada uno de los segmentos arteriales (aorta distal, iliaca común, iliaca externa y femoral común) de ambos lados20. La tortuosidad y la calcificación se clasificaron en leve, moderada o grave.
Selección del dispositivoSe siguieron las recomendaciones establecidas para cada dispositivo (Tabla 1).
Tabla 1. Criterios anatómicos de selección de pacientes para implantación de prótesis percutánea recomendados por los fabricantes
| ES | MCV | |
| Anillo aórtico (ETE/TC) | 18-25 | 19-27 |
| Altura de los senos de Valsalva (ETE/TC) | — | > 10 mm |
| Unión sinotubular (ETE/TC) | — | 30-40 |
| Aorta ascendente (ETE/TC) | — | < 42 |
| Ángulo del tracto de salida-aorta ascendente (angiografía/TC) | — | < 45° |
| Diámetro del tracto de salida (ETE) | > 18 | > 19 |
| DLM eje iliofemoral (angiografía/TC) | > 7mm (ES-23) | > 6 mm |
| > 8mm (ES-26) | ||
| Tortuosidad (angiografía/TC) | < moderada | < moderada |
| Calcificación (angiografía/TC) | < moderada | < moderada |
DLM: diámetro luminar mínimo; ES: prótesis Edwards-SAPIEN; ETE: ecocardiografía transesofágica; MCV: prótesis Medtronic CoreValve; TC: tomografía computarizada.
Durante el primer año sólo estuvo disponible la válvula ES, de forma que, cuando el eje iliofemoral era inapropiado, la implantación se realizó por vía TA. Con la incorporación de la MCV, y tras realizar los primeros procedimientos sin utilizar ningún criterio específico de selección, decidimos implantar la ES en casos con femorales favorables y utilizar la MCV en pacientes con anillos de 26-27 mm (grandes para ES, apropiados para MCV) o femorales de 6-7,5 mm (pequeños para ES, aceptables para MCV), utilizando la vía TA en los pacientes con arterias < 6mm.
La selección del tamaño de cada uno de los dispositivos se hizo de acuerdo con las recomendaciones establecidas (ES-23 para anillos de 18-21mm, ES-26 para anillos de 22-25mm, MCV-26 para anillos de 20-23mm y MCV-29 para anillos de 24-27mm).
Logística del procedimientoLos procedimientos se realizaron en una sala de hemodinámica, aplicándose las medidas de asepsia y antisepsia apropiadas para el procedimiento. Intervinieron en todos los casos dos cardiólogos intervencionistas, tres enfermeras, una anestesióloga (AC) y un ecocardiografista (CA), y en los casos de ES, además, un cirujano vascular. Se realizó profilaxis antibiótica (cefazolina+gentamicina). Al inicio el protocolo anestésico fue de sedación (remifentanilo+propofol), después de anestesia general y actualmente hemos vuelto a la sedación. La estabilidad en la presión arterial es esencial durante la implantación, ya que la hipotensión no permite una buena apertura valvular y la hipertensión favorece la embolización.
Aunque la principal guía del procedimiento fue la fluoroscopia, la ecocardiografía transesofágica convencional y 3D resultó muy útil para medir el anillo aórtico, localizar el calcio, valorar la apertura y la regurgitación tras la valvuloplastia, la posición durante la implantación, el funcionamiento protésico y la presencia de fugas perivalvulares, así como en el diagnóstico de complicaciones (taponamiento, disección aórtica).
InstrumentaciónAccesos no terapéuticosAcceso venoso para marcapasos transitorio por vía femoral en casos de ES (electrocatéter < 24h) y por vía yugular en casos de MCV (electrocatéter 48h). Acceso arterial femoral con introductor de 6 Fr para monitorización de presión y angiografías.
Acceso terapéuticoEn los casos de ES (excepto en los casos de ES XT), el cirujano expuso la arteria femoral y al final del procedimiento suturó la arteria y reparó el daño vascular. En los casos de implantación de MCV o de ES XT, el cierre se realizó con dispositivo Prostar XLTM (Abbot Vascular, Chicago, Illinois, Estados Unidos).
ValvuloplastiaSe realizó valvuloplastia con balón (NuMed NucleusTM PTV, Numed Inc., Hopkinton, New York, Estados Unidos) durante estimulación ventricular a alta frecuencia (PACELTM, St. Jude Medical, Minneapolis, Minnesota, Estados Unidos).
Preparación de la válvulaAmbas prótesis vienen preservadas en glutaraldehído y expandidas. La prótesis de ES se montó en un balón y la de MCV se preparó en suero helado para constreñirla de forma progresiva hasta su introducción en la vaina liberadora.
DispositivosLa válvula de ES se compone de un stent de acero inoxidable al que se cose la válvula (pericardio bovino). Requiere introductores de 25 y 28 Fr de diámetro externo, excepto el modelo ES XT, que requiere introductores de 20 y 22 Fr. La válvula de MCV es de pericardio porcino cosida a un stent autoexpandible de nitinol. Tiene tres regiones; la inferior, con gran fuerza radial, permite el anclaje; la media, de menor diámetro, respeta la salida de las coronarias, y la superior, de mayor diámetro, ayuda a orientar la prótesis. Requiere un introductor 18 Fr.
ImplantaciónAmbos dispositivos se avanzaron retrógradamente y se posicionaron con control fluoroscópico, angiográfico y ecocardiográfico. En el caso de la ES, la referencia fue la línea del calcio valvular. La mejor proyección suele ser la oblicua izquierda craneal. La implantación se realizó durante estimulación ventricular a 180-220 lat/min, sin posibilidad de rectificación una vez iniciado el inflado. Con la válvula de MCV la liberación se inició cuando el extremo distal de la vaina estaba 3-4 mm por debajo de los senos de Valsalva en una proyección (habitualmente oblicua izquierda caudal) en la que los tres senos se veían alineados. Al inicio de la liberación, el dispositivo puede reposicionarse y hasta la liberación del tercio distal aún puede reintroducirse en su vaina y posicionarse de nuevo.
Protocolo tras la implantaciónEn ausencia de complicaciones, los pacientes pasaron a la unidad de críticos cardiovasculares durante 24h (ES) o 48h (MCV) y fueron dados de alta a los 5-6 días en tratamiento con clopidogrel 75mg y ácido acetilsalicílico 100mg (3 meses).
A los pacientes con bloqueo auriculoventricular (AV) completo se les implantó un marcapasos definitivo.
SeguimientoSe indicaron revisiones a los 30 días y a los 3, 6 y 12 meses, y después cada año. A los 30 días y en las revisiones anuales, además se realizó un ecocardiograma.
Recogida de datosLos datos se recogieron de forma prospectiva y se introdujeron en una base de datos para su análisis.
Análisis estadísticoLas variables continuas se presentan como media±desviación estándar y se comparan con la prueba de la t de Student. Las variables categóricas se presentan como porcentaje y se comparan con el test de χ2 o con corrección de Fisher cuando fue necesario. La mortalidad en relación con el tiempo se presenta como curvas de Kaplan-Meier.
ResultadosSelección de pacientesEntre mayo de 2007 y abril de 2010, se evaluó a 159 pacientes: 7 fueron rechazados por estar poco sintomáticos, 12 por síntomas atribuibles a otra enfermedad, 6 por estenosis aórtica no severa, 7 por ausencia de criterios de ARQ, 2 por contraindicaciones (deterioro cognitivo, esperanza de vida < 1 año), 2 por insuficiencia aórtica predominante, 7 por anillo aórtico demasiado grande o demasiado pequeño y 23 por arterias femorales inapropiadas; en 7 pacientes no se completó la evaluación y 10 pacientes fallecieron durante ésta. Finalmente se aceptó a 76: 50 para ES y 26 para MCV.
Características de los pacientesLa Tabla 2 describe sus características. Las poblaciones son comparables, a excepción del diámetro iliofemoral, que fue menor en el grupo MCV.
Tabla 2. Datos clínicos basales
| Todos (n=76) | ES (n=50) | MCV (n=26) | p | |
| Edad (años) | 83±6 | 82±6 | 84±5 | 0,16 |
| Mujeres | 48 (63) | 34 (68) | 14 (54) | 0,22 |
| Superficie corporal (m2) | 1,8±0,2 | 1,81±0,2 | 1,77±0,2 | 0,47 |
| Clase funcional NYHA III-IV | 58 (76) | 40 (80) | 18 (69) | 0,3 |
| Fibrilación auricular | 19 (25) | 14 (28) | 5 (19) | 0,4 |
| Fracción eyección (%) | 62±13 | 63±14 | 59±12 | 0,19 |
| Comorbilidad | ||||
| Enfermedad coronaria | 38 (50) | 25 (50) | 13 (50) | 1 |
| Cirugía coronaria previa | 6 (8) | 5 (10) | 1 (4) | 0,66 |
| Angioplastia previa | 25 (33) | 15 (30) | 10 (39) | 0,46 |
| Fracción de eyección < 40% | 7 (9) | 5 (10) | 2 (8) | 1 |
| Insuficiencia mitral ≥ moderada | 8 (11) | 6 (12) | 2 (8) | 0,71 |
| Hipertensión pulmonar > 60 mmHg | 27 (36) | 15 (30) | 12 (46) | 0,16 |
| Enfermedad pulmonar | 15 (20) | 11 (22) | 4 (15) | 0,49 |
| Enfermedad cerebrovascular | 6 (8) | 4 (8) | 2 (8) | 1 |
| Enfermedad vascular periférica | 2 (2) | 1 (2) | 1 (4) | 1 |
| Insuficiencia renal | 14 (18) | 10 (20) | 4 (15) | 0,76 |
| Edad > 85 años | 30 (39) | 16 (32) | 14 (54) | 0,06 |
| Estimación de riesgo quirúrgico | ||||
| EuroSCORE | 17,7±9 | 17,3±7,9 | 18,6±10 | 0,55 |
| STS score | 6,34±1,8 | 6,31±1,9 | 6,69±2,1 | 0,73 |
| Rechazados para cirugía | 52 (68) | 37 (74) | 15 (58) | 0,15 |
| Valoración valvular (ETE) | ||||
| Gradiente transaórtico medio | 48,6±14,9 | 47,4±14,4 | 51±15,9 | 0,33 |
| Gradiente transaórtico pico | 79,8±22,8 | 78,8±23,7 | 81,8±21,45 | 0,6 |
| Área valvular (cm2) | 0,5±0,2 | 0,54±0,16 | 0,57±0,29 | 0,46 |
| Insuficiencia aórtica | 45 (59) | 26 (52) | 19 (73) | 0,08 |
| Diámetro del anillo (mm) | 21,3±2,4 | 21,6±2,5 | 20,6±2,2 | 0,09 |
| Valoración del eje iliofemoral | ||||
| Diámetro luminal mínimo (mm) | ||||
| Izquierdo | 7,4±0,8 | 7,6±0,7 | 6,5±0,6 | 0,009 |
| Derecho | 7,5±0,8 | 7,8±0,6 | 6,5±1,3 | 0,15 |
| Tortuosidad > leve | 47(62) | 29 (58) | 18 (69) | 0,34 |
| Calcificación > leve | 28 (37) | 16 (32) | 12 (46) | 0,23 |
ES: prótesis Edwards-SAPIEN; ETE: ecocardiografía transesofágica previa al procedimiento; MCV: prótesis Medtronic CoreValve; NYHA: New York Heart Association; STS: Society of Thoracic Surgeons.
Los datos expresan n (%) o media±desviación estándar.
Los datos del procedimiento se detallan en la Tabla 3. En 7 pacientes no se logró implantar la prótesis de ES: en 1 por fallecimiento (taponamiento secundario a perforación del ventrículo derecho por marcapasos), en 5 por imposibilidad de avanzar el introductor y en 1 por imposibilidad de cruzar la válvula. De los 43 pacientes con ES implantadas, 1 requirió una segunda prótesis por implantación alta de la primera y en 1 la válvula fue explantada por disección aórtica.
Tabla 3. Datos del procedimiento
| Todos (n=76) | ES (n=50) | MCV (n=26) | p | |
| Descripción general del procedimiento | ||||
| Anestesia general | 29 (38) | 22 (44) | 7 (27) | 0,16 |
| Acceso quirúrgico | 44 (58) | 44 (88) | 0 | 0,0001 |
| Duración (min) | 140±47 | 131±46 | 156±44 | 0,03 |
| Tiempo de escopia (min) | 25±15 | 24±17 | 28±8 | 0,27 |
| Contraste (ml) | 188±94 | 165±88 | 232±89 | 0,002 |
| Implantación y funcionamiento valvular (ETT) | ||||
| Tamaño de la válvula | 23: 32 (64) | 26: 7 (27) | ||
| 26: 18 (36) | 29: 19 (73) | |||
| Implantación | 68 (90) | 42 (84) | 26 (100) | 0,045 |
| Gradiente post (mmHg) | 9,6±5 | 8,8±4 | 10,9±6 | 0,21 |
| Área post (cm2) | 1,7±0,4 | 1,6±0,3 | 1,8±0,5 | 0,1 |
| Insuficiencia aórtica severa post | 1 (1,3) | 1 (2) | 0 | 1 |
| Complicaciones perioperatorias (no excluyentes) | ||||
| Taponamiento | 3 (3,9) | 3 (6) | 0 | 0,55 |
| Disección aórtica | 2 (2,6) | 2 (4) | 0 | 0,54 |
| Malposición | 1 (1,3) | 1 (2) | 0 | 1 |
| Arritmia grave | 1 (1,3) | 1 (2) | 0 | 1 |
| Accidente cerebrovascular | 2 (2,6) | 2 (4) | 0 | 0,54 |
| Complicación vascular | 19 (25) | 13 (26) | 6 (23) | 0,78 |
| Cirugía cardiaca | 3 (3,9) | 3 (6) | 0 | 0,55 |
| Cirugía vascular | 12 (16) | 10 (20) | 2 (8) | 0,2 |
| Necesidad de marcapasos | 15 (20) | 5 (10) | 10 (38) | 0,003 |
| Ventilación > 48 h | 4 (5) | 4 (8) | 0 | 0,29 |
| Diálisis | 3 (3,9) | 3 (6) | 0 | 0,55 |
| Mortalidad intrahospitalaria | ||||
| Fallecidos | 12 (16) | 7 (14) | 5 (19) | 0,74 |
| Causa cardiaca | 3 (4) | 2 (4) | 1 (4) | 1 |
| Causa vascular | 4 (5) | 2 (4) | 2 (8) | 0,63 |
| Causa pulmonar | 2 (3) | 1 (2) | 1 (4) | 1 |
| Sepsis | 1 (1) | 0 | 1 (4) | 1 |
| Fracaso multiorgánico | 3 (4) | 2 (4) | 0 | 0,55 |
ES: prótesis Edwards-SAPIEN; ETT: ecocardiograma transtorácico; MCV: prótesis Medtronic CoreValve.
Los datos expresan n (%) o media±desviación estándar.
Se pudieron implantar todas las prótesis de MCV. En 1 paciente, portador de una endoprótesis toracoabdominal, la válvula quedó excesivamente alta tras la liberación de la parte distal, por lo que se decidió retirarla. Ante el riesgo de dañar la endoprótesis, se decidió liberar la válvula en posición segura y se implantó una segunda válvula en posición correcta sin incidencias.
ComplicacionesTaponamientoEn la serie de ES hubo 3 casos de taponamiento, 2 por perforación del marcapasos y 1 por disección aórtica. Todos requirieron punción y drenaje pericárdico, pero sólo 1 falleció por este motivo.
Disección aórticaAdemás del caso descrito, 1 paciente presentó una disección localizada a 8cm del plano valvular, que evolucionó bien con manejo conservador.
MalposiciónUn paciente de la serie ES requirió una segunda válvula por implantación alta de la primera.
ArritmiasTras implantación de una ES, 1 paciente desarrolló fibrilación ventricular que inicialmente fue refractaria, pero tras unos minutos de masaje cardiaco se consiguió cardioversión.
Accidente cerebrovascularDos pacientes del grupo ES presentaron déficit neurológico en las primeras 24 h, y uno de ellos quedó con secuelas leves.
Trastornos de la conducción auriculoventricularEn la serie de ES, 5 pacientes (10%) presentaron bloqueo AV completo durante el procedimiento. No hubo ningún caso de bloqueo AV tardío.
En la serie de MCV, 10 pacientes (38%) requirieron marcapasos. El desarrollo de bloqueo AV fue frecuentemente tardío y progresivo y se precedió del desarrollo o la progresión de un bloqueo de rama. El bloqueo AV más tardío que hemos observado ha sido a las 48 h del procedimiento.
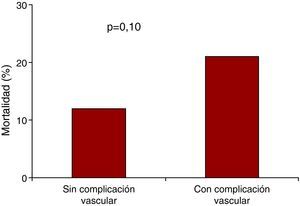
Daño vascularEn la serie de ES se presentaron 12 complicaciones vasculares hemorrágicas (10 por rotura/disección femoral o iliaca, 2 por sangrado en el sitio de punción) de las que 9 requirieron cirugía vascular y 3, tratamiento endovascular. Otro paciente requirió bypass iliofemoral por isquemia. En la serie de MCV, hubo 3 complicaciones vasculares, 2 por sangrado tras cierre con ProstarTM, y un tercero requirió angioplastia por disección con compromiso de flujo. Las complicaciones vasculares aumentaron la mortalidad del 12 al 21%, si bien la diferencia no alcanzó significación estadística debido al pequeño tamaño de la muestra (Figura 1).
Figura 1. Mortalidad a 30 días de los pacientes con y sin complicación vascular.
Mortalidad hospitalariaEn el grupo ES fallecieron 7 pacientes: 2 durante el procedimiento (1 taponamiento, 1 shock cardiogénico tras valvuloplastia), otro en las primeras 24 h (complicación vascular) y 4 más tarde (3 por fallo multiorgánico, a los 7, 10 y 28 días, y 1 por insuficiencia respiratoria a los 65 días). En el grupo MCV hubo 3 muertes precoces (2 por complicación vascular y 1 por shock cardiogénico tras la implantación en una paciente con hipertrofia ventricular izquierda muy severa) y 2 tardías, una por neumonía a los 6 días (paciente con enfermedad pulmonar previa) y otra por sepsis de origen urológico a los 8 días. No se observaron diferencias significativas en la mortalidad entre ambas series.
Curva de aprendizajeLa Tabla 4 compara los resultados intrahospitalarios de la primera y la segunda mitad de la serie ES. Los resultados tendieron a ser más favorables en la segunda parte, si bien sólo el aumento de la tasa de implantación alcanzó significación estadística.
Tabla 4. Curva de aprendizaje de la serie de Edwards-SAPIEN
| Casos 1-25 | Casos 26-50 | p | |
| Características basales | |||
| Edad (años) | 82±6 | 82±6 | 0,7 |
| Mujeres | 19 (76) | 15 (60) | 0,22 |
| Clase funcional III-IV | 21 (84) | 19 (76) | 0,48 |
| Gradiente pico (mmHg) | 78±23 | 79±30 | 0,86 |
| Gradiente medio (mmHg) | 48±16 | 46±15 | 0,71 |
| Área valvular (cm2) | 0,58±0,1 | 0,49±0,2 | 0,06 |
| Enfermedad coronaria | 15 (60) | 10 (40) | 0,16 |
| EuroSCORE | 19±7 | 16±8 | 0,13 |
| Diámetro del eje iliofemoral | 7,5±0,7 | 7,7±0,6 | 0,76 |
| Tortuosidad ≥ moderada | 4 (20) | 4 (20) | 0,33 |
| Calcificación ≥ moderada | 7 (35) | 6 (39) | 0,14 |
| Procedimiento | |||
| Implantación | 18 (72) | 24 (96) | 0,049 |
| Gradiente post ETT (mmHg) | 8,9±3 | 8,8±5 | 0,97 |
| Insuficiencia aórtica post ≥ moderada (ETT) | 3 (15) | 2 (10) | 1 |
| Tiempo de escopia (min) | 24±10 | 24±21 | 0,96 |
| Contraste (ml) | 198±105 | 131±51 | 0,007 |
| Complicaciones (no excluyentes) | |||
| Taponamiento | 3 (12) | 0 | 0,24 |
| Disección aórtica | 1 (4) | 1 (4) | 1 |
| Cirugía cardiaca | 3 (12) | 0 | 0,24 |
| Cirugía vascular | 7 (28) | 3 (12) | 0,16 |
| Bloqueo auriculoventricular completo | 2 (8) | 3 (12) | 1 |
| Diálisis | 2 (10) | 1 (4) | 0,34 |
| Mortalidad hospitalaria | 5 (20) | 2 (8) | 0,67 |
ETT: ecocardiograma transtorácico.
Los datos expresan n (%) o media±desviación estándar.
Ambas prótesis dejaron gradientes pequeños, aunque el área valvular fue levemente mayor con la prótesis de MCV. La regurgitación aórtica leve periprotésica fue frecuente con ambos dispositivos.
En la serie de ES, se documentaron alteraciones en la función valvular en 5 pacientes: 2 pacientes con válvula bien expandida y en posición correcta tenían regurgitación periprotésica moderada por mala aposición valvular debida a nódulos de calcio; en 2 pacientes la válvula estaba insuficientemente expandida y generaba una mala coaptación de las valvas, con regurgitación central en los 2, con gradiente de 20 mmHg en uno de ellos. Finalmente, en 1 paciente con una ES-23 aparentemente bien expandida y posicionada, se documentó un gradiente pico de 39 y medio de 22 mmHg a nivel valvular. De los 26 pacientes con prótesis de MCV, 2 presentaron insuficiencia aórtica periprotésica moderada.
Resultados a medio plazoLa mayoría de los pacientes mejoraron su grado funcional y permanecieron en grado I o II (Tabla 5).
Tabla 5. Evolución a medio plazo de los pacientes dados de alta con prótesis
| Todos (n=58) | ES (n=37) | MCV (n=21) | p | |
| Seguimiento 1 mes | ||||
| Clase funcional | 1,38±0,6 | 1,45±0,9 | 1,31±0,5 | 0,2 |
| Clase funcional III-IV | 2 (4) | 2 (5) | 0 | 1 |
| Gradiente (mmHg) * | 7,9±3 | 7,1±3 | 10,5±5 | 0,08 |
| Area valvular (cm2) * | 1,7±0,4 | 1,6±0,3 | 2,0±0,5 | 0,04 |
| Regurgitación ≥ moderada * | 1 (2) | 1 (3) | 0 | 1 |
| Mortalidad alta-día 30 | 0 | 0 | 0 | — |
| Último seguimiento | ||||
| Seguimiento medio (días) | 281±244 | 343±265 | 172±159 | 0,003 |
| Clase funcional | 1,34±0,6 | 1,41±0,8 | 1,17±0,4 | 0,16 |
| Clase funcional III-IV | 3 (7) | 3 (11) | 0 | 0,29 |
| Area valvular (cm2) * | 1,7±0,4 | 1,7±0,3 | 1,9±0,4 | 0,01 |
| Regurgitación ≥ moderada * | 2 (3,4) | 2 (5,4) | 0 | 0,53 |
| Muerte (desde día 30) | 3 (5) | 3 (8) | 0 | 0,55 |
| Causa cardiaca | 1 (2) | 1 (3) | 0 | 1 |
| Causa no cardiaca | 2 (3) | 2 (5) | 0 | 0,53 |
ES: prótesis Edwards-SAPIEN; MCV: prótesis Medtronic CoreValve.
Los datos expresan n (%) o media±desviación estándar.
* La valoración del gradiente, el área y la regurgitación se realizó por ecocardiografía transtorácica.
No se han observado cambios ni en el área ni en la regurgitación aórtica, salvo reducción del grado de regurgitación en 2 pacientes con ES. Tampoco se han observado cambios en las 2 pacientes con gradientes significativos, y ambas permanecen en buena situación funcional. El paciente con la disección aórtica localizada permanece en buena situación clínica.
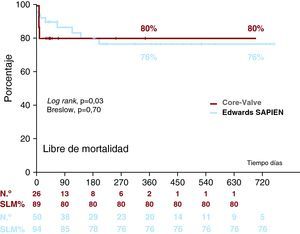
Tras el alta, fallecieron 3 pacientes del grupo ES, 2 por neumonía a los 3 y 6 meses y otro por disección aórtica (no documentada previamente ni en la ecocardiografía transesofágica ni en aortograma tras la implantación) a los 4 meses. La necropsia realizada en otro hospital mostró una disección aórtica, de la que no tenemos más detalles. La Figura 2 muestra las curvas de supervivencia con una y otra prótesis.
Figura 2. Curva de Kaplan-Meier de mortalidad con cada uno de los dispositivos. MFS: supervivencia libre de mortalidad.
DiscusiónLa presente serie describe nuestra experiencia inicial con la implantación de prótesis aórticas por vía TF e incluye sólo a pacientes con ARQ. Las características basales y los resultados obtenidos están dentro de lo descrito en otras publicaciones5,8,10,11,12,13,14,15,16,17,18,19, si bien hay amplias variaciones entre ellas.
Su principal novedad es la utilización de los dos dispositivos comercializados, lo que permite, a pesar del pequeño número de pacientes, resaltar sus diferencias en el entorno homogéneo del mismo hospital y los mismos operadores. Hasta la fecha sólo hay dos series mixtas publicadas, una que recoge la experiencia conjunta de dos hospitales en Toulouse19 e incluye 21 MCV y 24 ES, y otra de Múnich18 que incluye 105 MCV y ES implantadas por vía TF.
La racionalidad del uso de dos dispositivos en un mismo centro se basa en que actualmente no hay evidencia de que una prótesis sea superior a la otra en cuanto a la mortalidad perioperatoria, el funcionamiento y la durabilidad, y una gran parte de la curva de aprendizaje es común a ambos dispositivos.
Aumento del número pacientes tratables por vía transfemoralLa disponibilidad de ambos dispositivos permite ampliar el número de pacientes tratables por vía TF, no tanto en lo que a la anatomía del anillo aórtico se refiere, sino por la ampliación que supone el menor diámetro femoral requerido por la MCV. En la serie de Rouen20 sólo el 71% de los pacientes que precisaban ES-23 y el 39% de los de E-26 tenían un diámetro femoral adecuado para implantación TF. Igualmente, en el registro canadiense de ES10 sólo se pudo tratar por vía TF al 50% de los pacientes. En la serie mixta de Múnich18 se pudo tratar por vía TF al 80% de los pacientes y en la de Toulouse, al 71%19. En nuestra serie no se habría podido tratar por vía TF a más de la mitad de los pacientes tratados con MCV en caso de disponer sólo de la prótesis de ES.
Aspectos específicos del procedimiento con uno y otro dispositivoEl problema de la válvula ES es su tamaño (22-24 Fr), que condiciona problemas vasculares y fallos de implantación. En nuestro caso, el fallo de implantación bajó del 28 al 4% en la última parte de la serie cuando se aplicaron criterios más estrictos de selección. El dispositivo ES XT (18 Fr) reduce de forma importante la dificultad de avance y previsiblemente las complicaciones vasculares.
La otra dificultad que plantea la prótesis ES es su posicionamiento correcto, para lo cual es preciso utilizar referencias radiológicas adecuadas y realizar correctamente la secuencia de estimulación-inflado-desinflado; además, puede ser de ayuda la ecocardiografía transesofágica.
La prótesis de MCV plantea menos problemas de acceso y su liberación gradual permite corregir la posición al principio de la liberación.
En casos de mala aposición, la implantación de una segunda válvula en posición correcta es una opción posible con ambos dispositivos.
ComplicacionesAl igual que en otras series, las complicaciones vasculares fueron frecuentes con ambos dispositivos, al tratarse de disecciones y/o rotura vascular en el caso de las ES y de sangrados en la zona de punción por fallo del cierre percutáneo (casos MCV y ES XT). Es de destacar que en la única publicación que hemos encontrado que aporta datos del tamaño de las arterias femorales, la serie de Toulouse19, el diámetro de los pacientes de ES fue de 8,9mm, frente a 7,8mm de los nuestros, y de 7,8mm frente a 6,5mm en el caso de los pacientes con prótesis de MCV. Los criterios más estrictos de selección de pacientes21,22,23,24, la experiencia en el manejo de los dispositivos, el diagnóstico precoz de las complicaciones y la incorporación de técnicas percutáneas para su manejo contribuyen a la reducción del número de complicaciones y su impacto clínico21,22,23,24.
Las complicaciones cardiacas (perforaciones, disecciones). aunque graves, fueron poco frecuentes y, la mayoría, no relacionadas directamente con la implantación valvular.
Los trastornos de la conducción AV fueron más frecuentes con la prótesis de MCV8,9,13,17. En algunos casos el trastorno apareció durante el procedimiento, pero en otros progresó más tarde, y más de un tercio de los pacientes precisó marcapasos. El tamaño grande, la implantación baja, la hipertrofia ventricular y la preexistencia de trastornos de la conducción son factores que han favorecido los trastornos de la conducción en otras series25. La necesidad de prolongar la permanencia del marcapasos transitorio alarga la estancia de estos pacientes en unidades especiales, retrasa la retirada de sondas y catéteres y favorece las infecciones, causa directa de muerte de 2 de los 5 fallecidos con prótesis de MCV implantadas sin problemas.
Con la válvula de ES, el bloqueo AV es menos frecuente11,12,13,26 y sin tendencia a la progresión, lo que permite retirar antes el cable de marcapasos transitorio.
Mortalidad intrahospitalariaLa mortalidad de nuestra serie es algo superior a las de las últimas series publicadas26, y no se ha observado diferencias entre ambos dispositivos. De los 12 fallecidos (1 por perforación del cable de marcapasos, 5 por complicaciones vasculares, 1 por insuficiencia respiratoria, 2 por infecciones, 2 por shock cardiogénico), sólo en 1 el fallecimiento se relacionó directamente con la válvula. Del análisis de las causas de mortalidad se deduce que es importante extremar el cuidado con la instrumentación; es preferible evitar la intubación al menos en pacientes con enfermedad pulmonar; se debe minimizar el tiempo de permanencia de sondas y catéteres para evitar infecciones, y hay que prevenir y tratar lo más precozmente posible las complicaciones vasculares, ya que con frecuencia se siguen de una situación de fallo multiorgánico que termina en la muerte del paciente.
La experiencia del operador es un factor importante en la tasa de éxito, complicaciones y mortalidad del procedimiento12, pero también lo es la coordinación de todo el equipo multidisciplinario implicado en la evaluación, la realización y el manejo de estos pacientes tras el procedimiento.
El procedimiento con cualquiera de los dispositivos tiene todavía un riesgo no despreciable. Un documento de consenso entre las asociaciones europeas de cirujanos y cardiólogos intervencionistas y la Sociedad Europea de Cardiología27 ha recomendado la adherencia estricta a las recomendaciones iniciales de estenosis aórtica severa sintomática y ARQ.
ConclusionesLa implantación de prótesis aórtica por vía TF es un procedimiento que ya se ha incorporado a la práctica clínica para pacientes con estenosis aórtica severa sintomática y ARQ. La utilización de los dos dispositivos comercializados permite aumentar el porcentaje de pacientes tratables por vía TF. Aunque hay aspectos técnicos específicos de cada dispositivo, como su preparación e implantación, hay otros muchos que son comunes a ambos, como la selección de los pacientes, la instrumentación durante el procedimiento y la prevención, el diagnóstico y el tratamiento de las complicaciones. Las complicaciones vasculares son frecuentes con ambos dispositivos; en el caso de ES, debidas a disección o rotura femoral por el alto perfil del dispositivo, y en el caso de MCV, por fallo del sistema de cierre percutáneo. El bloqueo AV es más frecuente con la prótesis de MCV y puede producirse tardíamente, a diferencia del que se produce con la prótesis de ES, que es precoz. Aunque la morbimortalidad del procedimiento con cada una de las válvulas es aceptable para el tipo de pacientes, el riesgo de complicaciones graves y la falta de datos sobre la durabilidad de los dispositivos comercializados aconsejan reservar por el momento su indicación a pacientes con alto riesgo. Los estudios aleatorizados en marcha, cuyos resultados se conocerán pronto, aclararán la eficacia y la seguridad de las diversas técnicas de reemplazo valvular aórtico (cirugía, vía TA o TF) en el tratamiento de estos pacientes.
Conflicto de interesesEl Dr. García es proctor de la compañía Edwards Lifesciences.
Agradecimientos
A la Dra. Pepa Pérez-Vizcayno por su inestimable ayuda en el tratamiento de los datos de estos pacientes. A las enfermeras de la Unidad de Hemodinámica del Hospital Clínico San Carlos por su implicación y su entusiasmo en el desarrollo de esta nueva técnica.
Recibido 28 Enero 2010
Aceptado 20 Julio 2010
Autor para correspondencia. Unidad de Hemodinámica y Cardiología Intervencionista, Hospital Clínico San Carlos, Martín Lagos, s/n. 28040 Madrid, España. rhernandez_antolin@hotmail.com