Los patrones de distribución de placa en las lesiones en bifurcación coronaria son poco conocidos, y se ha especulado que la carina es inmune a la arteriosclerosis, debido al efecto ateroprotector derivado del high wall shear stress. El objetivo fue analizar con ecografía intracoronaria (EIC) la distribución de placa en lesiones en bifurcación coronaria y su prevalencia en la carina.
MétodosEn 195 bifurcaciones coronarias, se hizo una EIC sobre el vaso principal (VP), y en 91 también sobre el ramo secundario (RS). Se consideró que había placa en la carina cuando el grosor era ≥ 0,3mm. Se midió la carga de placa en distintos puntos: referencia proximal, carina, punto de área luminal mínima (ALM) y referencia distal. Tras implantar el stent en el VP se realizó una EIC.
ResultadosLa prevalencia de placa en la carina fue del 32% y su grosor, 0,8±0,36mm, menor que el observado en la contracarina (1,22±0,54mm; p<0,01). La prevalencia de placa fue mayor (52%) cuando el punto de ALM estaba localizado distal a la carina. La presencia de placa en la carina se asoció a menor incidencia de daño del ostium del RS tras tratar el VP (el 32 frente al 54%; p=0,04).
ConclusionesLa carina no es inmune a la arteriosclerosis y hay placa en un tercio de las bifurcaciones. La prevalencia de placa es mayor en bifurcaciones con ALM distal a la carina y parece asociarse a menor incidencia de daño del ostium del RS.
Palabras clave
Actualmente los patrones de desarrollo de enfermedad aterosclerótica coronaria son más conocidos en los segmentos no bifurcados que en las bifurcaciones coronarias1,2. Desde una perspectiva anatómica, las bifurcaciones coronarias están constituidas por tres componentes que confluyen en el área carinal: el vaso principal (VP) proximal, el VP distal y el ramo secundario (RS), por lo que es necesaria una clasificación que defina si hay o no enfermedad en cada uno de estos componentes3,4. Es preciso tener en cuenta, sin embargo, que las lesiones en bifurcación coronaria tienen atributos adicionales que son relevantes desde la perspectiva del tratamiento endoluminal, como la orientación espacial del RS con respecto al VP (ángulo de la bifurcación), la longitud del RS y su importancia (cantidad de miocardio irrigado) y, por último, la longitud de la lesión en el RS5,6. El estudio con ecografía intracoronaria (EIC) de estas lesiones, además de aportar información anatómica precisa acerca de la distribución de la placa y la morfología de la carina visible en la reconstrucción longitudinal de la EIC7,8,9, permite observar la presencia o ausencia de placa en este elemento singular de la bifurcación.
En este sentido, observaciones anatomopatológicas aisladas han descrito como excepcional la presencia de placa en la carina10, en tanto que los estudios con EIC que han analizado la distribución de la placa en lesiones en bifurcación no han proporcionado datos acerca de la prevalencia de placa en la carina11,12,13. Además, en este componente de la bifurcación se ha descrito un mecanismo ateroprotector como consecuencia de un high wall shear stress (HWSS)14,15, en contraposición al low wall shear stress (LWSS) observado en la contracarina. Que la comunidad intervencionista presuma que la carina está libre de placa probablemente sea consecuencia de lo señalado anteriormente. No obstante, desde nuestra perspectiva, la aterogénesis es un fenómeno complejo, poco conocido y multifactorial, por lo que sería sorprendente que un solo factor ateroprotector fuese suficiente para conferir inmunidad a la carina.
El objetivo del presente estudio es analizar mediante EIC (combinando el estudio de las secciones transversales y la reconstrucción longitudinal) la distribución de la placa de ateroma en las lesiones que afectan a una bifurcación y determinar la prevalencia de placa en la carina. Asimismo es objeto de este estudio analizar en el subgrupo de bifurcaciones sin afección del origen del RS5 (_,_,0) el impacto que pudiera tener la presencia de placa en la carina en relación con la inducción de daño en el ostium del RS una vez implantado el stent en el VP.
MétodosPacientesSe incluyó en este estudio a 185 pacientes consecutivos que presentaban 195 lesiones de novo en una bifurcación coronaria. Todas las lesiones fueron tratadas percutáneamente en el periodo que abarca desde junio de 2007 hasta junio de 2009. Se excluyeron las lesiones en bifurcación en que el RS tuviera un diámetro < 2,25mm. Las características clínicas de los pacientes se resumen en la Tabla 1. La mayoría de los pacientes eran varones (74%) y la prevalencia de diabetes mellitus fue del 29%. A todos se les realizó un cateterismo cardiaco diagnóstico. Tras la fase diagnóstica y una vez documentada la enfermedad en una bifurcación coronaria, se efectuó en todos los casos un estudio con EIC del VP. El estudio con EIC del RS se realizó en 91/195 lesiones (47%). El estudio en el VP se repitió tras el implante del stent.
Tabla 1. Características clínicas de los pacientes (n=185) *
| Edad (años) | 61±10 |
| Varones | 145 (74) |
| Hipertensión arterial | 119 (61) |
| Diabetes mellitus | 56 (29) |
| Dislipemia | 91 (48) |
| Fumador activo | 81 (42) |
| ICP previo | 12 (17) |
| Situación inestable | 121 (62) |
| EAC multivaso (≥ 2 vasos) | 96 (49) |
| Fracción de eyección (%) | 55±9 |
EAC: enfermedad arterial coronaria; ICP: intervencionismo coronario percutáneo.
* Los datos expresan n (%) o media±desviación estándar.
En el cateterismo diagnóstico, a todos los pacientes se les realizó una ventriculografía izquierda en proyección oblicua anterior derecha 30° y una coronariografía en múltiples proyecciones. En todos los casos se efectuó la filmación de dos proyecciones ortogonales con el objetivo de visualizar con la máxima claridad posible el ostium del RS. Una vez finalizado el estudio diagnóstico, se administró una dosis de heparina sódica de 10.000 UI. Tras posicionar una guía en el VP y otra en el RS, se realizó un estudio basal con EIC. El stent farmacoactivo empleado se seleccionó en función de los diámetros de referencia del VP, y su implante se efectuó a 14-16 atm. Una vez implantado el stent, se repitieron las dos angiografías seleccionadas en la fase diagnóstica con la finalidad de evaluar el estado del ostium del RS. A continuación se realizó un nuevo estudio con EIC sobre el VP.
En los casos en que se documentó estenosis significativa en el RS (≥ 70%), se trató mediante angioplastia y, cuando fue preciso a criterio del operador, se procedió al implante de un segundo stent. Al finalizar el procedimiento, se neutralizó parcialmente la heparina con sulfato de protamina16 y se procedió al cierre de la punción femoral con un dispositivo de cierre percutáneo (Angioseal®). Para las mediciones angiográficas, incluido el ángulo de la bifurcación, se utilizó el sistema dedicado CMS 7.1, MEDIS (Países Bajos). Todas las mediciones las realizaron off-line dos cardiólogos intervencionistas expertos.
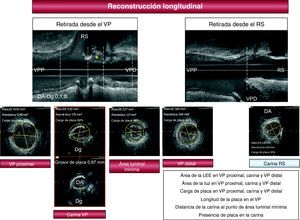
Estudio con ecografía intracoronariaEl protocolo del estudio con EIC queda ilustrado en la Figura 1. Tras la coronariografía diagnóstica, se administró un bolo de nitroglicerina intracoronario y se realizó un estudio ultrasónico basal del VP (Atlantis SR, Boston Scientific, 2,5 F, 40MHz) a todos los pacientes, con retirada motorizada a 0,5 mm/s desde el segmento de referencia distal. A criterio del operador, se realizó en 91 de las 195 lesiones (47%) una retirada motorizada también desde el RS. Se determinó el área de la lámina elástica externa, el área luminal y la carga de placa en distintos puntos: segmento de referencia proximal, carina, punto de área luminal mínima y segmento de referencia distal. Se calculó, asimismo, el índice de remodelado (área de la lámina elástica externa a nivel de la carina/área de la lámina elástica externa en el segmento de referencia distal). Con la reconstrucción longitudinal de la EIC (Figura 1), se analizó la morfología de la carina y la distribución de la placa de ateroma en la bifurcación (en el VP proximal, área carinal, VP distal y RS) y se midió además la distancia desde la carina hasta el punto con área luminal mínima. Cuando se documentó presencia de placa en la carina, el grosor se midió en la sección transversal correspondiente utilizando un caliper que incluye el software de la EIC. Se consideró que había placa en la carina cuando el grosor de la placa de ateroma a ese nivel era ≥ 0,3mm.
Figura 1. Protocolo del estudio ultrasónico. El asterisco señala placa en la carina. Carga de placa=(área LEE – área de la luz) / área LEE. DA: arteria descendente anterior; Dg: arteria diagonal; LEE: lámina elástica externa; RS: ramo secundario; VP: vaso principal; VPD: vaso proximal distal; VPP: vaso principal proximal.
La prevalencia de placa en la carina se analizó en función de: a) la localización de la bifurcación en el árbol coronario (tronco coronario izquierdo [TCI] o bifurcaciones coronarias distales); b) la localización del punto de máxima estenosis en el VP, y c) el tipo de bifurcación según la clasificación de Medina. Tras el implante del stent en el VP, se repitió el estudio con EIC al objeto de observar el comportamiento de la carina.
Análisis estadísticoLas variables cuantitativas se expresan como media±desviación típica y los datos cualitativos, en porcentaje. En la comparación de medias, se utilizó el test de la t de Student para datos independientes. En la comparación de variables cualitativas se empleó el test de la χ2. Se aceptó como estadísticamente significativo un valor de p<0,05. Para los cálculos estadísticos se aplicó el programa informático SPSS versión 15.0.
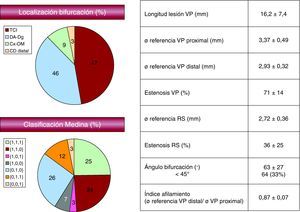
ResultadosLos hallazgos angiográficos basales se muestran en la Figura 2. Como puede observarse, la lesión se hallaba localizada en la mitad de los casos en el TCI y en el resto era distal; la bifurcación entre la arteria descendente anterior y la arteria diagonal era la localización más prevalente en este subgrupo.
Figura 2. Datos angiográficos basales. CD: arteria coronaria derecha; Cx-OM: arteria circunfleja-arteria oblicua marginal; DA-Dg: arteria descendente anterior-arteria diagonal; RS: ramo secundario;TCI: tronco coronario izquierdo; VP: vaso principal.
Respecto al tipo de bifurcación, en el 40% de los casos estaba afectado el RS (lesiones tipo 1,1,1; 0,1,1; 1,0,1). El ángulo de la bifurcación era de 63°±27°. En 64/195 lesiones (33%), el ángulo de la bifurcación era < 45°.
En todos los casos se implantó un stent liberador de fármacos. En 80 lesiones (41%) se implantó un stent en el VP sin realizar manipulaciones ulteriores a nivel del ostium del RS. En 26 lesiones (13%) se realizó angioplastia con balón en el RS tras el implante del stent en el VP. Se finalizó el procedimiento con inflado simultáneo con dos balones (kissing balloon) en 67 casos (34%). En 22 bifurcaciones (11%) se consideró necesario implantar un segundo stent en el RS (stent en T). No se documentó ningún caso de trombosis aguda o subaguda del stent.
Los datos cuantitativos del estudio ultrasónico se detallan en la Tabla 2. La carga de placa en el segmento de máxima estenosis fue del 73±12% y la longitud ultrasónica de la lesión, 18±7mm.
Tabla 2. Características ultrasónicas basales (n=195) *
| Referencia proximal del VP | |
| Área de la LEE (mm 2 ) | 17,33±5,14 |
| Área luminal (mm 2 ) | 11,99±4,61 |
| Carga de placa (%) | 31±14 |
| Carina | |
| Área de la LEE (mm 2 ) | 11,06±4,28 |
| Área luminal (mm 2 ) | 4,32±2,43 |
| Carga de placa (%) | 59±17 |
| Presencia de placa en la carina | 32 (63/195) |
| Grosor de placa en la carina (n=63) (mm) | 0,81±0,36 |
| Grosor de placa en contracarina (mm) | 1,22±0,54 |
| Referencia distal del VP | |
| Área de la LEE (mm2) | 11,22±4,27 |
| Área luminal (mm2) | 7,86±3,18 |
| Carga de placa (%) | 28±15 |
| Índice de remodelado (ostium) | 0,8±0,21 |
| Área luminal mínima | |
| Área de la LEE (mm2) | 11,83±3,99 |
| Área luminal (mm2) | 3,04±1,48 |
| Carga de placa (%) | 73±12 |
| Distancia a la carina (mm) | 3,27±3,5 |
| Ostium del ramo secundario (n=91) | |
| Área de la LEE (mm2) | 8,28±4,37 |
| Área luminal (mm2) | 4,5±2,63 |
| Carga de placa (%) | 42±19 |
LEE: lámina elástica externa; VP; vaso principal.
* Índice de remodelado=área LEE ostium / área LEE referencia distal.Los datos expresan media±desviación estándar o n (%).
Se documentó la presencia de placa en la carina en el 32% de las lesiones (63/195), con un grosor de 0,8±0,36mm. En la mayoría de los casos, el grosor de la placa a nivel de la carina fue menor que el observado en la contracarina (1,22±0,54; p<0,01), aunque en 10/63 casos (16%) se observó lo contrario.
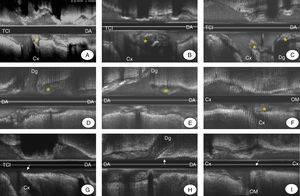
La prevalencia de placa en la carina en el TCI fue similar a la observada en las bifurcaciones con una localización más distal (el 33 frente al 31%). La Figura 3 muestra diversos ejemplos de lesiones en bifurcación de TCI y bifurcaciones distales con y sin placa en la carina.
Figura 3. Ejemplos de ecografía intracoronaria que muestran la presencia de placa en la carina (asterisco) a nivel del tronco coronario izquierdo (TCI) distal (A-C), de la arteria descendente anterior-arteria diagonal (DA-Dg) (D y E) y de la arteria circunfleja-arteria oblicua marginal (Cx-OM) (F). También se muestran ejemplos de bifurcaciones coronarias sin placa en la carina (flecha) a nivel del TCI (G), de la DA-Dg (H) y de la Cx-OM (I).
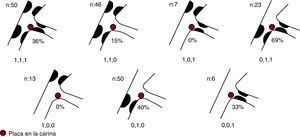
La Figura 4 muestra la diferente prevalencia de placa en la carina según el tipo de bifurcación establecido en la clasificación de Medina. Esta fue del 15% en lesiones 1,1,0 y no se observó placa en las lesiones 1,0,0 y 1,0,1.
Figura 4. Prevalencia de placa en la carina según el tipo de bifurcación.
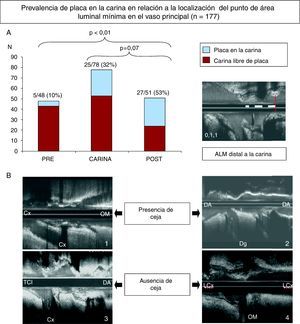
En la Figura 5A puede advertirse que las lesiones con el punto de máxima estenosis (área luminal mínima) localizado distal a la carina presentaban mayor prevalencia de placa que las lesiones en las que el punto de máxima estenosis se localizaba en la propia carina o proximal a ella.
Figura 5. A: la gráfica muestra la prevalencia de placa en la carina en función de la localización del punto con área luminal mínima en el vaso principal; nótese que la prevalencia de placa fue mayor cuando la localización del área luminal mínima era distal a la carina. B: ejemplos de bifurcación con signo de la ceja con placa (1) y sin placa (2) en la carina; también se muestran ejemplos con ausencia de signo de la ceja, con placa en la carina (3) y sin placa (4). ALM: área luminal mínima; Cx/LCx: arteria circunfleja; DA: arteria descendente anterior; Dg: arteria diagonal; OM: arteria oblicua marginal;TCI: tronco coronario izquierdo.
En las bifurcaciones coronarias cuya carina presentaba una morfología ultrasónica puntiaguda (signo de la ceja)7, la prevalencia de placa fue menor, aunque sin alcanzar la significación estadística (el 27 frente al 37%) (Figura 5B).
En lo que respecta al ángulo angiográfico de la bifurcación, no se observaron diferencias en la prevalencia de placa en la carina en las bifurcaciones con ángulos agudos (≤ 45°) respecto al resto (el 33 frente al 29%). El ángulo de las bifurcaciones con placa en la carina fue de 61°±25° y el de aquellas sin placa, 65°±23° (diferencias no significativas).
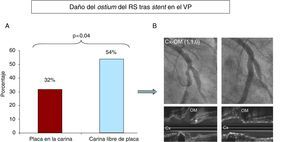
En el subgrupo de lesiones en bifurcación con ausencia de enfermedad en el RS (_,_,0), se analizó el impacto que la presencia de placa en la carina pudiera tener en la inducción de daño del ostium del RS (estenosis resultante angiográfica ≥ 50%) tras el implante del stent en el VP. Así, la prevalencia de daño en el ostium del RS fue menor en las lesiones que presentaban placa en la carina (el 32 frente al 54%; p=0,04) (Figura 6).
Figura 6. A: la gráfica muestra la menor incidencia de daño en el ostium del ramo secundario cuando había placa en la carina. B: ejemplo de bifurcación con placa en la carina (asterisco) y ausencia de daño en el ostium del ramo secundario tras implantar el stent en el vaso principal. Cx: arteria circunfleja; OM: arteria oblicua marginal.
El examen ultrasónico mostró que el mecanismo del daño ostial del RS tras el implante del stent en el VP siempre se debió al desplazamiento de la carina. En ningún caso se documentó desplazamiento de la placa en dirección al ostium del RS (fenómeno de «snow plow»)17.
DiscusiónLos patrones de desarrollo de la enfermedad arteriosclerótica coronaria siguen siendo poco conocidos, especialmente en las bifurcaciones coronarias1,2. Recientemente y con base en observaciones anatómicas post mórtem, la comunidad intervencionista ha asumido como excepcional la presencia de placa en la carina de la bifurcación10. Nuestro estudio muestra que la carina no es inmune al desarrollo de arterioesclerosis y que un tercio de las lesiones en bifurcación coronaria, tratadas en la práctica clínica, presentan placa de ateroma a ese nivel. Esta discrepancia puede explicarse por las características del diseño de nuestro estudio ultrasónico, realizado en una serie consecutiva de lesiones en bifurcación tratadas percutáneamente, en contraposición a las observaciones post mórtem, que obviamente no pueden representar la realidad clínica.
En contraposición a los resultados obtenidos en nuestro estudio, Oviedo et al18 han publicado recientemente un estudio con EIC en 126 bifurcaciones de TCI, con retirada motorizada desde el VP y desde el RS, y concluyen que la carina está libre de placa. Quizá estas discrepancias se expliquen por la distinta metodología utilizada en uno y otro estudio. Oviedo et al estudiaron la distribución de la placa a nivel de la carina analizando cortes transversales, mientras que en nuestro estudio se utilizó tanto el análisis del eje transversal como el del longitudinal que, como muestra la Figura 3, determina de forma inequívoca la presencia o ausencia de placa en la carina. En este sentido, Van der Giessen et al15 publican resultados similares de prevalencia de placa en la carina en un estudio realizado con angiotomografía computarizada, que es una técnica con menor resolución que la EIC para el estudio de este fenómeno, y en una serie de casos menor.
Nuestros hallazgos también concuerdan con las observaciones ultrasónicas referidas por Shimada et al13, que observaron en los casos con presencia de placa en la carina un grosor de placa inferior al objetivado en la contracarina.
Por otro lado, es reseñable el comportamiento similar de las lesiones localizadas en el TCI en lo relativo a la distribución de la placa de ateroma y, especialmente, la prevalencia similar de placa en la carina, cuando se comparan con las bifurcaciones distales del árbol coronario. También es destacable la escasa influencia que el ángulo angiográfico parece tener en la formación de placa a nivel de la carina.
En lo concerniente a las lesiones en bifurcación tipo 1,1,0, se constató, además, una baja prevalencia de placa en la carina e incluso ausencia de placa en las lesiones 1,0,0 y 1,0,1, difícilmente explicable con los datos de que disponemos.
Consideramos importante que la presencia de placa en la carina fuese mayor en las bifurcaciones que presentaban una estenosis máxima localizada distal a la carina en el VP. En este sentido, se podría plantear que una estenosis distal a la carina pudiera alterar los patrones de velocidad de flujo en ella y promover el desarrollo de placa al atenuar el efecto ateroprotector transformando una región de HWSS en una de LWSS.
Recientemente hemos descrito en lesiones ostiales de la DA, una morfología peculiar puntiaguda de la carina (signo de la ceja)7 que la hace vulnerable al tratamiento con stent provisional debido a su desplazamiento, afectando al ostium de la arteria circunfleja (Cx). La presencia de este patrón morfológico de carina se asoció en nuestro estudio a menor prevalencia de placa, si bien no alcanza significación estadística.
Con respecto a la implicación que la presencia de placa en la carina pudiera tener en la inducción de daño en el ostium del RS tras el implante de un stent en el VP, hemos observado que, paradójicamente, cuando hay placa en la carina se daña menos el ostium del RS. Este hecho podría relacionarse con la mayor resistencia que la placa confiere a la carina y, por lo tanto, a su desplazamiento por el stent, ya que este es el mecanismo dominante que causa daño en el ostium del RS7. Es interesante resaltar que, en el examen con EIC realizado tras el implante del stent en el VP, no observamos en ningún caso desplazamiento de la placa presente en la carina en dirección al ostium del RS.
Por último, aún no existen estudios aleatorizados que demuestren el beneficio de la EIC en el tratamiento de las lesiones en bifurcación. Muchos estudios utilizan la EIC para definir la calidad del andamiaje tras el tratamiento con stent, supuesto en el que es una herramienta de utilidad ampliamente reconocida. Dado que se va a realizar un uso posterior de la EIC, consideramos que la evaluación basal de las lesiones que afectan a una bifurcación coronaria aporta una información cualitativa y cuantitativa de gran interés que enriquece los datos aportados por la angiografía y podría ayudar a su tratamiento. Idealmente, el estudio con EIC debería realizarse en ambos vasos de la bifurcación; en este sentido, Oviedo et al han publicado, en un estudio sobre bifurcaciones de TCI, las limitaciones de la valoración del ostium del RS cuando se hace a expensas de la información obtenida con la retirada desde el VP19.
Limitaciones del estudioUna limitación apreciable es que el número de bifurcaciones estudiadas es relativamente pequeño para analizar un fenómeno de tanta complejidad como la presencia o ausencia de placa en la carina, dada la pluralidad de los tipos de bifurcación estudiados y la variabilidad de su localización. Consideramos conveniente, en este sentido, un estudio con una serie mayor de lesiones en bifurcación. También es una limitación de este estudio que no se dispuso de la información ultrasónica basal del RS en la mitad de los pacientes.
ConclusionesNuestro estudio ultrasónico de lesiones en bifurcación coronaria muestra una prevalencia de placa en la carina del 32%. Dicha prevalencia parece ser mayor cuando el punto de máxima estenosis en el VP se localiza distal a la carina, lo que podría estar en relación con una atenuación del efecto ateroprotector que un HWSS confiere a la carina.
Desde el punto de vista terapéutico, al implantar un stent en el VP, la presencia de placa en la carina parece tener un efecto protector para el ostium del RS. Este hecho podría tener relación con la mayor resistencia que la placa confiere a la carina, lo que limita su desplazamiento al implantar el stent.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecimientos
A Charina Medina por su ayuda en la redacción y corrección del texto.
Recibido 12 Abril 2010
Aceptado 26 Julio 2010
Autor para correspondencia: Servicio de Cardiología, Hospital Universitario de Gran Canaria Dr. Negrín. Barranco de la Ballena, s/n. 35010 Las Palmas de Gran Canaria, España. pemarlor@hotmail.com