En aproximadamente un 5-10% de los casos de infarto de miocardio (IM) no se detecta enfermedad obstructiva (≥ 50%) en las arterias coronarias epicárdicas principales1. Esta condición se conoce como IM con enfermedad coronaria no obstructiva (MINOCA, por sus siglas en inglés). Desde el punto de vista clínico, su presentación se asemeja a la de un IM y cumple con la definición universal de «infarto de miocardio» de 20182. Dada la incorporación de métodos diagnósticos cada vez más precisos, como es el caso de la troponina de alta sensibilidad, el diagnóstico inicial de esta entidad es cada vez más común. Sin embargo, existe una gran heterogeneidad entre las causas que se debe tener en cuenta en este contexto; las más frecuentes son la miocarditis, la isquemia miocárdica por mecanismos distintos de la rotura o erosión de una placa ateroesclerótica (disección coronaria espontánea, vasoespasmo coronario, etc.) o el síndrome de tako-tsubo, entre otras3. La enfermedad coronaria microvascular es otra potencial causa que tener en cuenta en el diagnóstico inicial de un MINOCA consecuencia de una disfunción microvascular o la obliteración de la microvasculatura en casos de embolia coronaria o por espasmo microvascular, que se evalúa fundamentalmente con estudios invasivos funcionales3,4. La importancia de dilucidar la etiología radica en los diferentes abordaje y pronóstico de estas entidades1. De hecho, el pronóstico es especialmente desfavorable en caso de que no se identifique la causa, lo que llevaría a considerarlo como MINOCA sin diagnóstico etiológico5.
A este respecto, el potencial de la resonancia magnética cardiovascular (RMC) para la caracterización del miocardio y la detección de alteraciones en la contractilidad y otros defectos estructurales y funcionales le otorgan un papel fundamental en el diagnóstico etiológico de esta entidad3,6. Además, recientes desarrollos tecnológicos en RMC posibilitan la medición cuantitativa de la perfusión miocárdica y la detección de defectos de perfusión global en la enfermedad coronaria microvascular7. Una característica común en la mayoría de las causas que pueden originar un cuadro de MINOCA es su carácter o manifestación transitoria. Por lo tanto, no solo es crucial el uso de medios diagnósticos adecuados como la RMC que orienten al diagnóstico final, sino también el momento en que se emplean con el fin de mejorar la rentabilidad diagnóstica de dichas pruebas.
En un artículo reciente publicado en Revista Española de Cardiología, Juncà et al. se proponen establecer el rendimiento diagnóstico de la RMC, así como el momento idóneo para su realización en pacientes con diagnóstico inicial de MINOCA8. Para ello se estudió una cohorte de 207 pacientes consecutivos (mediana de edad, 50 años; el 60% varones) evaluados mediante RMC tras el diagnóstico inicial de MINOCA en un centro público español de alta complejidad entre los años 2009 y 2022. Los datos se recogieron retrospectivamente y se excluyó a los pacientes cuya presentación fuera en forma de insuficiencia cardiaca aguda, un ritmo distinto del sinusal o ante cualquier contraindicación para la RMC. Se basaron en el documento de 20182 para la definición de IM y, con el fin de descartar enfermedad obstructiva significativa en las arterias coronarias, se realizó angiografía coronaria por cateterismo cardiaco o por tomografía computarizada.
El diagnóstico final tras la RMC se alcanzó en el 91% de los casos: miocarditis en el 45% de ellos, IM en el 20%, síndrome de tako-tsubo en el 19% y otras miocardiopatías en el 7%. Para dilucidar el momento idóneo para la realización de la RMC en este contexto, la muestra de estudio se dividió en 2 grupos: estrategia precoz frente a tardía. El tiempo hasta la RMC se definió como el número de días desde el ingreso hospitalario hasta la realización de dicha prueba, el cual fue de 5 [intervalo intercuartílico, 4-6] días para los pacientes del grupo de estrategia precoz y 10 [8-12] días para el grupo con estrategia de realización tardía. Cuando la RMC fue precoz, permitió un mayor rendimiento diagnóstico en comparación con la RMC realizada más tarde (el 96 frente al 86%). Aunque la miocarditis fue el diagnóstico más frecuente en ambos grupos, su frecuencia fue mayor entre los pacientes con la RMC precoz (el 53 frente al 35%). Los autores concluyen que la RMC tiene un rendimiento diagnóstico muy alto en pacientes con diagnóstico inicial de MINOCA y más aún si se realiza en la primera semana desde la presentación.
Estos resultados son relevantes para la práctica clínica. Por un lado, manifiestan el beneficio de realizar una RMC para el diagnóstico etiológico del MINOCA teniendo en cuenta su buena rentabilidad diagnóstica, en línea con la evidencia previa5. Por otro lado, señalan que es preferible realizar la RMC durante la primera semana, pues tiene una rentabilidad diagnóstica aún mayor. Sin embargo, este segundo punto debe interpretarse con cautela y merece un debate más amplio.
Entre los hallazgos que valorar en la RMC de estos pacientes, se encuentran la presencia de focos de realce tardío o alteraciones en la contractilidad segmentaria, y emergen el edema y la inflamación miocárdica como denominador común en la mayoría de las causas de MINOCA6. La manifestación de esta respuesta edematosa o inflamatoria a menudo presenta un comportamiento dinámico, por lo que es importante realizar la RMC en una ventana temporal óptima, ya que de lo contrario se puede perder información relevante. Sin embargo, así como las posibilidades etiológicas son muy variadas, su comportamiento también lo es. Por ejemplo, en el caso del IM se ha demostrado que el edema que se desarrolla en este contexto muestra un comportamiento bimodal9. La primera onda de edema, que aparece abruptamente tras la reperfusión y se disipa alrededor de las 24 h, está directamente relacionada con el propio proceso de reperfusión, mientras que la segunda onda de edema, que aparece progresivamente días después del IM y alcanza una meseta entre los días 4 y 7, está originada fundamentalmente por los procesos de cicatrización del tejido miocárdico9,10. En el caso del síndrome de tako-tsubo, se ha demostrado la presencia de edema y alteraciones de la contractilidad cuando la RMC se realiza tempranamente (2-4 días), pero estas alteraciones se normalizan rápidamente en estudios de imagen realizados en el seguimiento (1-4 meses)11. Por último, en el caso de la miocarditis, la RMC ha demostrado una buena rentabilidad diagnóstica en la detección de edema en los pacientes estudiados en las primeras 2 semanas tras el inicio de los síntomas, y su rentabilidad diagnóstica disminuye a partir del día 146,12.
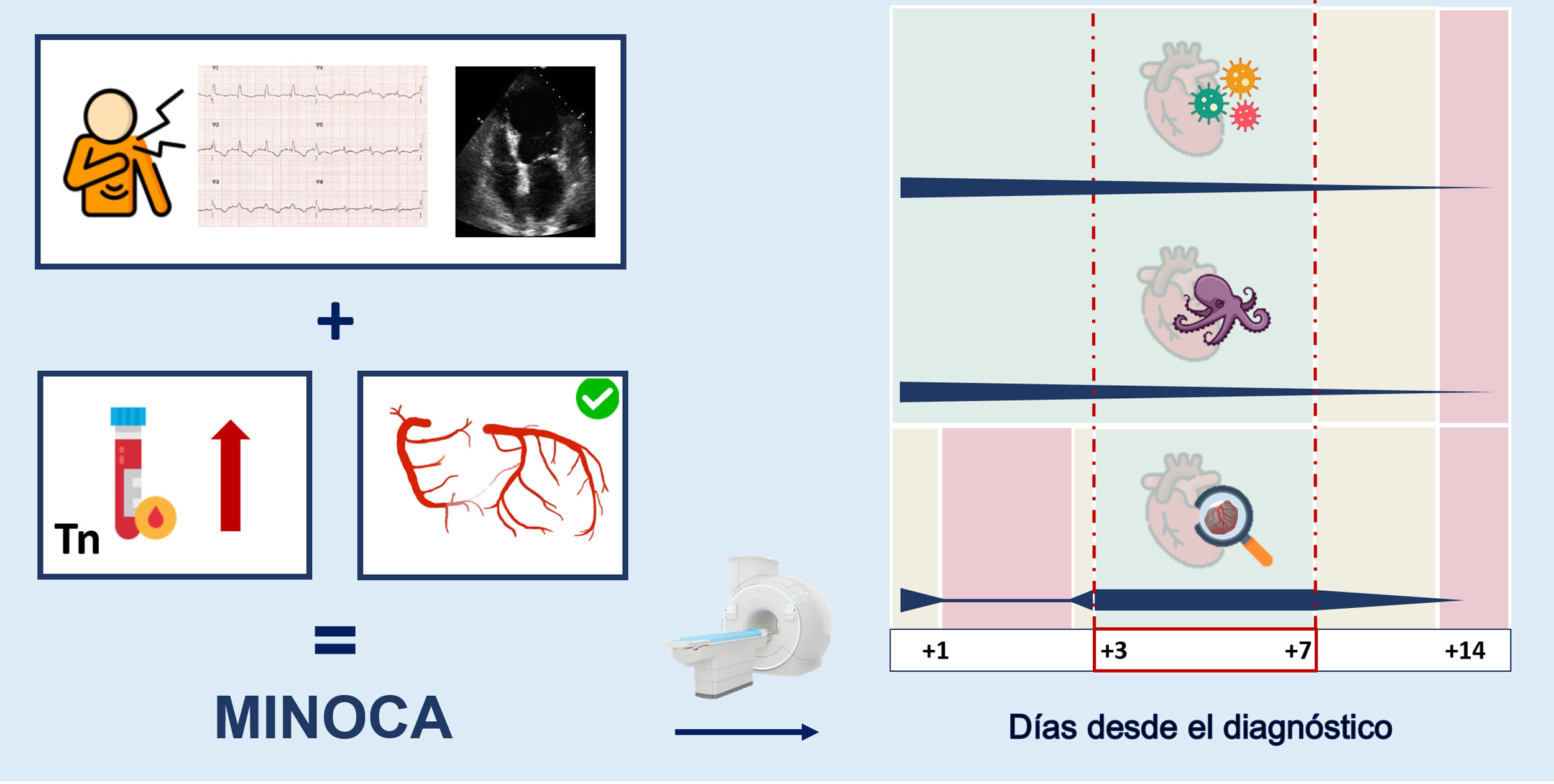
A día de hoy no existen recomendaciones claramente establecidas sobre el momento idóneo para la realización de la RMC dentro del espectro del MINOCA. La mayoría de las guías y los documentos de consenso indican llevar a cabo la prueba durante el ingreso hospitalario o en las primeras 2 semanas3,13. No obstante, con base en los resultados del artículo de Juncà et al.8 y la literatura previa14, se podría proponer un intervalo para la realización de RMC que abarque del tercer al séptimo día tras el inicio de los síntomas para un rendimiento óptimo en pacientes con diagnóstico inicial de MINOCA (figura 1). El protocolo de RMC debería incluir idealmente técnicas de perfusión miocárdica y de caracterización tisular con mapeo T1 y T2, que aportan mayores sensibilidad y especificidad que otras técnicas clásicas a la hora de detectar edema miocárdico y que, por lo tanto, es esperable que aumenten aún más la rentabilidad diagnóstica de la RMC en este contexto6,15. En cualquier caso, todo ello debería adaptarse a la disponibilidad y la logística de cada centro.
En la parte izquierda de la figura se resumen los criterios para el diagnóstico inicial de infarto de miocardio con enfermedad coronaria no obstructiva (MINOCA): a) síntomas de isquemia miocárdica, alteraciones electrocardiográficas compatibles con isquemia y/o alteraciones en la contractilidad segmentaria en el ecocardiograma; b) aumento y/o disminución del valor de troponina con al menos un valor por encima del percentil 99, y c) ausencia de enfermedad coronaria epicárdica obstructiva ≥ 50%. Una vez se llega al diagnóstico inicial de MINOCA, es fundamental ahondar en la causa etiológica. La resonancia magnética cardiovascular es una prueba cuyo rendimiento diagnóstico varía según el momento en que se realice. En la parte derecha de la figura se muestra una representación gráfica de los tiempos (en días desde el diagnóstico) para una mayor rentabilidad diagnóstica, dependiendo de la etiología. Se incluyen las causas más frecuentes de MINOCA: miocarditis, síndrome de tako-tsubo e infarto de miocardio. Se propone realizar la resonancia magnética cardiovascular entre los días 3 y 7. Tn: troponina. Esta figura ha sido diseñada con imágenes obtenidas de Flaticon.com.
No se ha recibido ninguna para este artículo. C. Real recibe financiación de la Fundación «la Caixa» bajo el proyecto con código LCF/PR/HR22/52320018. R. Fernández-Jiménez es beneficiario de un Proyecto de Investigación en Salud con referencia PI22/01560 financiado por el Instituto de Salud Carlos III (ISCIII) y cofinanciado por la Unión Europea. El CNIC cuenta con el apoyo del ISCIII, el Ministerio de Ciencia, Innovación y Universidades y la Fundación Pro CNIC y es Centro de Excelencia Severo Ochoa (subvención CEX2020-001041-S financiada por MICIN/AEI/10.13039/501100011033).
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto de intereses en relación con el contenido de este artículo.