Se presentan las características y resultados del trasplante cardiaco en España desde que empezó su actividad en mayo de 1984.
MétodosSe realiza un análisis descriptivo de las características de los receptores, los donantes, el procedimiento quirúrgico y los resultados de los trasplantes cardiacos realizados en España hasta el 31 de diciembre de 2014.
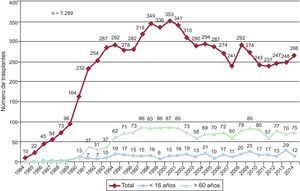
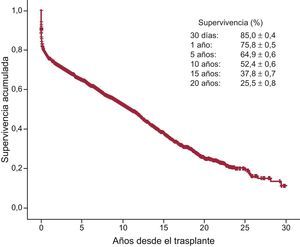
ResultadosDurante 2014 se han realizado 266 procedimientos, con lo que la serie histórica consta de 7.289 trasplantes. El análisis temporal confirma un empeoramiento significativo del perfil clínico de los receptores (mayor porcentaje de pacientes añosos, con insuficiencia renal grave, diabetes insulinodependiente, cirugía cardiaca previa y ventilación mecánica), de los donantes (mayor porcentaje de donantes añosos y con mayor discordancia de peso) y del procedimiento (mayor porcentaje de trasplante urgente, que en 2014 alcanza el 41,4%, y con tiempo de isquemia > 240min). El uso de dispositivos de asistencia mecánica ha disminuido respecto a 2013, y en 2014 supone el 18,8% del total de pacientes. La supervivencia a 1, 5, 10 y 15 años es del 76, el 65, el 52 y el 38% respectivamente, y permanece estable desde 1995.
ConclusionesLa actividad de trasplante cardiaco en España permanece estable en los últimos años, con alrededor de 250 procedimientos al año. A pesar del claro empeoramiento de las características de donantes, receptores y tiempos quirúrgicos, se mantienen unos resultados en mortalidad comparables a los del entorno y se confirma un uso creciente de los dispositivos de asistencia circulatoria antes del trasplante.
Palabras clave
Desde 1991, el Registro Español de Trasplante Cardiaco viene publicando la descripción de las características clínicas y quirúrgicas y los resultados globales de los procedimientos de trasplante cardiaco que se realizan en España1–25. El presente artículo describe los datos referentes a la población trasplantada hasta el 31 de diciembre de 2014. Como ya es conocido, la mayor fortaleza del Registro Español de Trasplante Cardiaco reside en la inclusión y actualización exhaustiva de todos los procedimientos de trasplante cardiaco realizados en todos los hospitales españoles desde mayo de 1984, independientemente de sus características y resultados. Además, la recogida de datos se realiza prospectivamente en una base de datos común consensuada y actualizada por todos los grupos.
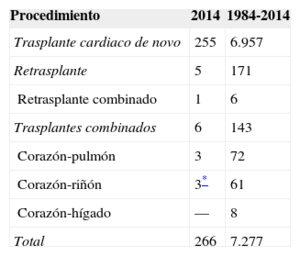
MÉTODOSPacientes y centrosDe los 19 centros que han aportado datos al Registro Español de Trasplante Cardiaco, actualmente permanecen activos 18 (tabla 1). Dos centros se dedican únicamente al trasplante pediátrico y otros tres mantienen actividad tanto en trasplante pediátrico como del adulto. El número de procedimientos realizados anualmente se resume en la figura 1. El total de la serie consta de 7.289 procedimientos. En 12 casos se ha producido pérdida de datos, incluida información sobre el seguimiento. Estos no se incluyeron en los análisis, y el tamaño muestral finalmente quedó formado por 7.277 casos. De los 266 procedimientos realizados en 2014, 12 casos (4,5%) se realizaron en pacientes pediátricos (edad < 16 años). Los tipos de procedimientos realizados en 2014 y en la serie total se resumen en la tabla 2.
Centros participantes (por orden de realización del primer trasplante) en el Registro Español de Trasplante Cardiaco (1984-2014)
| 1. | Hospital de la Santa Creu i Sant Pau, Barcelona |
| 2. | Clínica Universitaria de Navarra, Pamplona |
| 3. | Clínica Puerta de Hierro, Majadahonda, Madrid |
| 4. | Hospital Marqués de Valdecilla, Santander |
| 5. | Hospital Reina Sofía, Córdoba (adulto y pediátrico) |
| 6. | Hospital Universitario y Politécnico La Fe, Valencia |
| 7. | Hospital Gregorio Marañón, Madrid (adulto y pediátrico) |
| 8. | Fundación Jiménez Díaz, Madrid (1989-1994) |
| 9. | Hospital Virgen del Rocío, Sevilla |
| 10. | Hospital 12 de Octubre, Madrid |
| 11. | Hospital Universitario de A Coruña, A Coruña (adulto y pediátrico) |
| 12. | Hospital Bellvitge, L’Hospitalet de Llobregat, Barcelona |
| 13. | Hospital La Paz, Madrid (pediátrico) |
| 14. | Hospital Central de Asturias, Oviedo |
| 15. | Hospital Clínic, Barcelona |
| 16. | Hospital Virgen de la Arrixaca, El Palmar, Murcia |
| 17. | Hospital Miguel Servet, Zaragoza |
| 18. | Hospital Clínico, Valladolid |
| 19. | Hospital Vall d’Hebrón, Barcelona (pediátrico) |
Registro Español de Trasplante Cardiaco (1984-2014). Tipo de procedimiento
| Procedimiento | 2014 | 1984-2014 |
|---|---|---|
| Trasplante cardiaco de novo | 255 | 6.957 |
| Retrasplante | 5 | 171 |
| Retrasplante combinado | 1 | 6 |
| Trasplantes combinados | 6 | 143 |
| Corazón-pulmón | 3 | 72 |
| Corazón-riñón | 3* | 61 |
| Corazón-hígado | — | 8 |
| Total | 266 | 7.277 |
La base de datos consta de 175 variables clínicas preestablecidas de manera consensuada por todos los grupos y que recogen datos de receptor, donante, técnica quirúrgica, inmunosupresión y seguimiento. Desde 2013 los datos se introducen y se actualizan en formato electrónico en tiempo real mediante una aplicación disponible en internet específicamente diseñada para tal propósito. El soporte de la base de datos es un archivo de Microsoft Excel. Este procedimiento sustituye al anterior, en el que cada centro enviaba los datos al director del registro en formato Microsoft Access mediante correo electrónico. Una CRO (contract research organization) externa —actualmente ODDS, S.L.— se encarga del mantenimiento de la base de datos, el control de calidad y el análisis estadístico.
La aprobación por el comité ético, la auditoría y el registro en el Ministerio de Sanidad se han realizado según lo dispuesto en la Ley Orgánica de Protección de Datos 15/1999.
EstadísticaLas variables cuantitativas continuas se presentan como media ± desviación estándar y las categóricas, como porcentaje. Los resultados se categorizan según el año del trasplante dividiendo la muestra total en tres grupos (1984-1993, 1994-2003 y 2004-2014). En algunas variables (como edad del donante, trasplantes urgentes y tiempo de isquemia), también se analizaron los datos anuales de toda la serie. Las diferencias entre grupos se analizan mediante un test no paramétrico para la tendencia temporal (tau de Kendall) en el caso de variables categóricas y test de análisis de la varianza con ajuste polinómico para las variables cuantitativas. Las curvas de supervivencia se han calculado mediante el test de Kaplan-Meier y la comparación entre ellas, con el método de log rank test. Se ha considerado diferencia significativa en las comparaciones con valor de p<0,05.
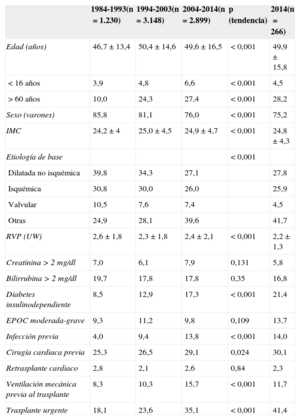
RESULTADOSCaracterísticas de los receptoresEn 2014, los receptores tenían 50±16 (0,02-73) años de edad; el 75% eran varones, con diagnósticos basales mayoritarios de miocardiopatía isquémica (25,9%), dilatada no isquémica (27,8%), miocardiopatía de origen valvular (4,5%) y otras etiologías (41,7%). Las características de los pacientes trasplantados por periodo de trasplante se resumen en la tabla 3. Se observan tendencias significativas a mayor edad de los receptores, sexo femenino y etiologías no usuales de la cardiopatía de base y un aumento de las condiciones previas al trasplante de reconocido efecto pronóstico como la diabetes insulinodependiente y la infección, la cirugía cardiaca y la ventilación mecánica previas al trasplante. La frecuencia del retrasplante se mantiene estable en torno al 2,4% en el periodo 1984-2014. Por el contrario, hay una disminución significativa de las resistencias vasculares pulmonares previas al trasplante a lo largo de la serie temporal.
Características del receptor en el Registro Español de Trasplante Cardiaco (1984-2014)
| 1984-1993(n=1.230) | 1994-2003(n=3.148) | 2004-2014(n=2.899) | p (tendencia) | 2014(n=266) | |
|---|---|---|---|---|---|
| Edad (años) | 46,7±13,4 | 50,4±14,6 | 49,6±16,5 | < 0,001 | 49,9 ± 15,8 |
| < 16 años | 3,9 | 4,8 | 6,6 | < 0,001 | 4,5 |
| > 60 años | 10,0 | 24,3 | 27,4 | < 0,001 | 28,2 |
| Sexo (varones) | 85,8 | 81,1 | 76,0 | < 0,001 | 75,2 |
| IMC | 24,2±4 | 25,0±4,5 | 24,9±4,7 | < 0,001 | 24,8±4,3 |
| Etiología de base | < 0,001 | ||||
| Dilatada no isquémica | 39,8 | 34,3 | 27,1 | 27,8 | |
| Isquémica | 30,8 | 30,0 | 26,0 | 25,9 | |
| Valvular | 10,5 | 7,6 | 7,4 | 4,5 | |
| Otras | 24,9 | 28,1 | 39,6 | 41,7 | |
| RVP (UW) | 2,6±1,8 | 2,3±1,8 | 2,4±2,1 | < 0,001 | 2,2±1,3 |
| Creatinina > 2 mg/dl | 7,0 | 6,1 | 7,9 | 0,131 | 5,8 |
| Bilirrubina > 2 mg/dl | 19,7 | 17,8 | 17,8 | 0,35 | 16,8 |
| Diabetes insulinodependiente | 8,5 | 12,9 | 17,3 | < 0,001 | 21,4 |
| EPOC moderada-grave | 9,3 | 11,2 | 9,8 | 0,109 | 13,7 |
| Infección previa | 4,0 | 9,4 | 13,8 | < 0,001 | 14,0 |
| Cirugía cardiaca previa | 25,3 | 26,5 | 29,1 | 0,024 | 30,1 |
| Retrasplante cardiaco | 2,8 | 2,1 | 2,6 | 0,84 | 2,3 |
| Ventilación mecánica previa al trasplante | 8,3 | 10,3 | 15,7 | < 0,001 | 11,7 |
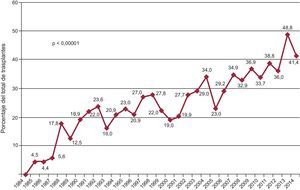
| Trasplante urgente | 18,1 | 23,6 | 35,1 | < 0,001 | 41,4 |
IMC: índice de masa corporal; EPOC: enfermedad pulmonar obstructiva crónica; RVP: resistencias vasculares pulmonares.
Los valores expresan media ± desviación estándar o porcentajes.
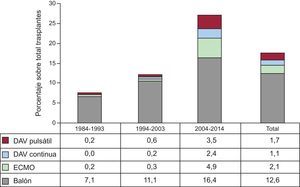
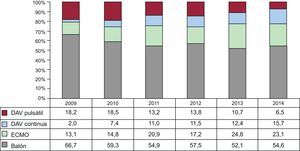
Aunque en 2014 se ha producido una ligera disminución de los trasplantes con carácter de urgencia respecto a 2013, hay una fuerte tendencia al incremento de este tipo de trasplantes a lo largo de la serie temporal (p<0,00001) (figura 2). Concomitantemente, hay un incremento significativo (p < 0,00001) del uso de dispositivos mecánicos de asistencia circulatoria más allá del tradicional balón de contrapulsación, que aparecen de manera significativa en la última década (figura 3). El uso de oxigenador extracorpóreo de membrana (ECMO) y de dispositivos de asistencia ventricular tanto pulsátil como de flujo continuo es particularmente evidente a partir de 2009 (figura 4). Entre 2009 y 2014, el uso de ECMO se ha duplicado y el de asistencia de flujo continuo ha aumentado exponencialmente (del 2,0% en 2009 al 15,7% en 2014).
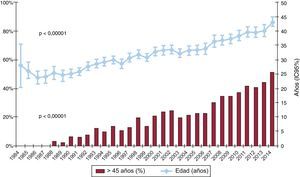
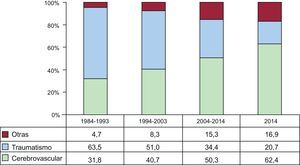
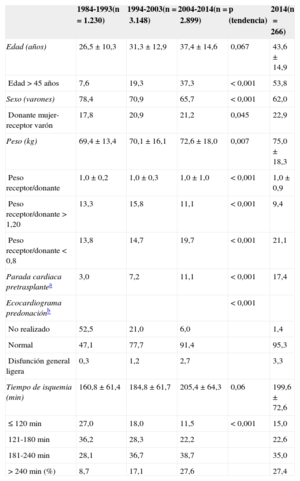
Las características de los donantes según el intervalo de tiempo y en 2014 se resumen en la tabla 4. La edad del donante ha ido incrementándose significativamente a lo largo de la serie, con un porcentaje de donantes considerados subóptimos (edad > 45 años) > 50% en 2014 (figura 5). También se aprecia el aumento progresivo de los donantes de sexo femenino y del porcentaje de trasplantes realizados a receptor varón con donante mujer (el 22,9% en 2014), con parada cardiaca previa a la donación (el 17,4% en 2014) y con disfunción ventricular en el ecocardiograma previo a la extracción (el 3,3% en 2014). Asimismo, hay un aumento de los donantes fallecidos por accidente cerebrovascular en detrimento de los fallecidos por traumatismo (figura 6).
Características de los donantes y tiempos de isquemia en el Registro Español de Trasplante Cardiaco (1984-2014)
| 1984-1993(n=1.230) | 1994-2003(n=3.148) | 2004-2014(n=2.899) | p (tendencia) | 2014(n=266) | |
|---|---|---|---|---|---|
| Edad (años) | 26,5±10,3 | 31,3±12,9 | 37,4±14,6 | 0,067 | 43,6±14,9 |
| Edad > 45 años | 7,6 | 19,3 | 37,3 | < 0,001 | 53,8 |
| Sexo (varones) | 78,4 | 70,9 | 65,7 | < 0,001 | 62,0 |
| Donante mujer-receptor varón | 17,8 | 20,9 | 21,2 | 0,045 | 22,9 |
| Peso (kg) | 69,4±13,4 | 70,1±16,1 | 72,6±18,0 | 0,007 | 75,0±18,3 |
| Peso receptor/donante | 1,0±0,2 | 1,0±0,3 | 1,0±1,0 | < 0,001 | 1,0±0,9 |
| Peso receptor/donante > 1,20 | 13,3 | 15,8 | 11,1 | < 0,001 | 9,4 |
| Peso receptor/donante < 0,8 | 13,8 | 14,7 | 19,7 | < 0,001 | 21,1 |
| Parada cardiaca pretrasplantea | 3,0 | 7,2 | 11,1 | < 0,001 | 17,4 |
| Ecocardiograma predonaciónb | < 0,001 | ||||
| No realizado | 52,5 | 21,0 | 6,0 | 1,4 | |
| Normal | 47,1 | 77,7 | 91,4 | 95,3 | |
| Disfunción general ligera | 0,3 | 1,2 | 2,7 | 3,3 | |
| Tiempo de isquemia (min) | 160,8 ± 61,4 | 184,8 ± 61,7 | 205,4 ± 64,3 | 0,06 | 199,6 ± 72,6 |
| ≤ 120 min | 27,0 | 18,0 | 11,5 | < 0,001 | 15,0 |
| 121-180 min | 36,2 | 28,3 | 22,2 | 22,6 | |
| 181-240 min | 28,1 | 36,7 | 38,7 | 35,0 | |
| > 240min (%) | 8,7 | 17,1 | 27,6 | 27,4 |
Los valores expresan media ± desviación estándar o porcentajes.
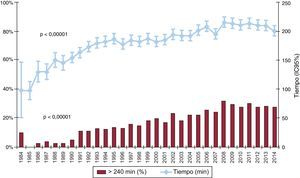
El tiempo de isquemia se ha incrementado a lo largo de la serie temporal. En 2014, tal como ocurrió en la década previa, más de un cuarto de los pacientes fueron trasplantados con un tiempo de isquemia > 240min (tabla 4, figura 7).
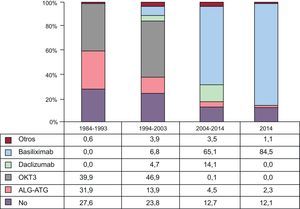
InmunosupresiónEn 2014, el 87,9% de los receptores recibieron algún tratamiento inmunosupresor de inducción, en su inmensa mayoría basiliximab (84,5%). En la figura 8 se aprecia cómo la inducción ha ido incrementándose progresivamente hasta su uso mayoritario actual. En el periodo 2009-2014, se indujo al 80% de los pacientes con inhibidores de la interleucina 2 (basiliximab o daclizumab, fundamentalmente el primero), sustituyendo al uso mayoritario del OKT3 de los periodos anteriores.
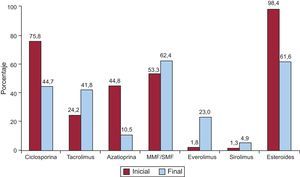
La inmunosupresión de inicio en 2014 se realizó mayoritariamente con tacrolimus (86,7%) como inhibidor de la calcineurina, micofenolato mofetilo o ácido micofenólico (96,1%) como antiproliferativo y esteroides (96,9%). En la figura 9 se resumen los fármacos usados en la inmunosupresión inicial y al final del seguimiento para la serie total. En un seguimiento promedio de 7 años, el 61,6% de los pacientes continuaban en tratamiento con corticoides. Como se puede apreciar, tacrolimus tiende a igualarse con la ciclosporina en la inmunosupresión al final del seguimiento, a pesar del predominio de la segunda en las pautas de inmunosupresión al inicio del trasplante. La azatioprina mantiene un uso apenas testimonial y, llamativamente, el 27,9% de los pacientes estaba en tratamiento con inhibidores de la mTOR (everolimus o sirolimus) en el último seguimiento.
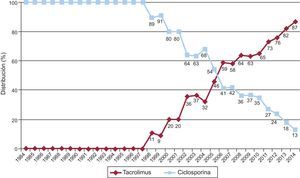
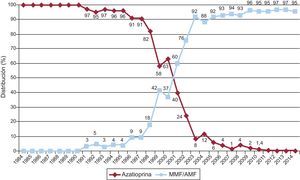
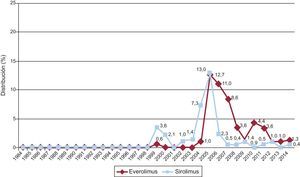
La evolución anual del uso de los distintos inhibidores de la calcineurina y antimitóticos se muestra en las figuras 10 y 11 respectivamente. El uso de tacrolimus igualó al uso de ciclosporina en 2005, manteniendo una tendencia ascendente desde entonces para convertirse en el inhibidor de la calcineurina predominante en la inmunosupresión de inicio. Similar tendencia se observa entre micofenolato mofetilo y azatioprina, cuyo uso se igualó entre 1999 y 2001; a partir de 2009 el micofenolato pasó a ser el antimitótico predominante en la inmunosupresión de inicio, relegando a la azatioprina a un uso mínimo. La evolución anual del uso de inhibidores de mTOR (sirolimus, everolimus) en la inmunosupresión de inicio se muestra en la figura 12. Estos fármacos se usaron inicialmente en un porcentaje apreciable entre los años 2005 y 2007, y después decayeron hasta un porcentaje mínimo.
Evolución anual del uso de inhibidores de mTOR (sirolimus y everolimus) en la inmunosupresión de inicio en la muestra total (1984-2014). Las diferencias en los valores respecto a informes de años previos se deben al redondeo o a diferencias surgidas por la continua actualización de la base de datos por los grupos participantes.
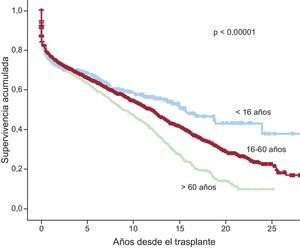
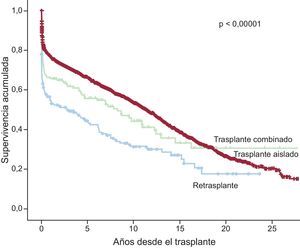
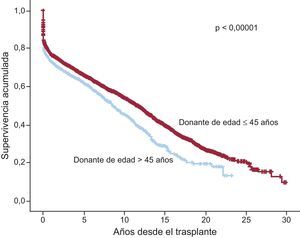
Al 31 de diciembre de 2014, la supervivencia actuarial en el conjunto de la serie a 1, 5, 10, 15 y 20 años se resume en la figura 13. Esto supone una mortalidad promedio de 2-3%/año aproximadamente después del primer año postrasplante, con una mediana de supervivencia de 10,9 años. Hubo diferencias significativas según la edad del receptor en el momento del trasplante y tipo de procedimiento. La supervivencia de los pacientes con menos de 16 años fue significativamente mejor que la de los pacientes con edad entre 16 y 60 años y la de estos con respecto a los pacientes mayores de 60 años (figura 14). Igualmente hubo diferencias muy significativas entre los trasplantes cardiacos solos, los trasplantes cardiacos combinados con trasplante renal, hepático o pulmonar y los retrasplantes (figura 15). La edad del donante mayor de 45 años afectó también y muy significativamente a la supervivencia (figura 16).
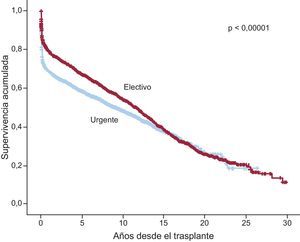
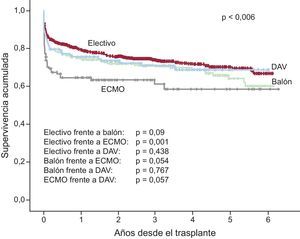
En la serie total, se observan diferencias muy significativas (p<0,00001) para la supervivencia entre los trasplantes realizados de manera electiva y los urgentes (figura 17). Analizando el periodo 2009-2014, en el cual el uso de dispositivos de asistencia mecánica se ha incrementado de manera apreciable, se observa que la peor supervivencia es la del trasplante urgente realizado con asistencia tipo ECMO, sin que haya diferencias significativas respecto al trasplante electivo en los trasplantes realizados con balón de contrapulsación o dispositivos de asistencia ventricular (figura 18). Las diferencias entre tipos de trasplante según el estado del paciente en el momento de la intervención se establecen en los primeros 6 meses después del procedimiento, con un recorrido paralelo de las curvas posteriormente.
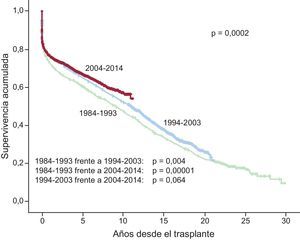
Después de la primera década (1984-1993) se evidencia una significativa mejora en la supervivencia a medio y largo plazo, mediada fundamentalmente por la menor mortalidad en etapas postrasplante precoces (figura 19). Para la última década (2004-2013) se observa una tendencia no significativa (p=0,064) a la mejora de la supervivencia a partir del tercer-cuarto año postrasplante respecto a la década inmediatamente anterior (1994-2003) (figura 19).
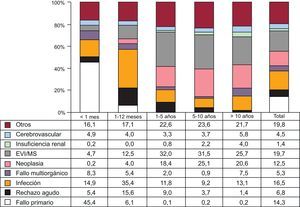
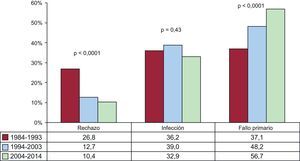
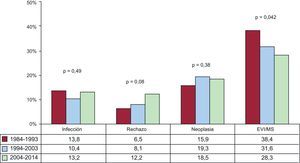
Causas de fallecimientoEn la población total, la más frecuente causa de muerte es la enfermedad vascular del injerto/muerte súbita (19,7%), seguida de las infecciones (16,5%), el fallo primario del injerto 14,3%) y las neoplasias (12,5%) (figura 20). Las causas de fallecimiento cambian según el tiempo postrasplante que se considere (figura 20). En el primer mes postrasplante, casi el 50% de los fallecimientos se producen por fallo primario del injerto. Después del primer mes y hasta cumplir el primer año, el rechazo agudo (15,6%) y sobre todo las infecciones (35,4%) son la principal causa de muerte. Después del primer año, la causa mayoritaria son las distintas manifestaciones de la enfermedad vascular del injerto (29,5%) y los tumores (21,3%). Con el paso del tiempo, las principales causas de muerte en el primer año han cambiado significativamente, con incremento de los fallecimientos por fallo primario del injerto y disminución de las ocurridas por rechazo agudo (figura 21). Sin embargo, en las muertes ocurridas entre el primer y el quinto año después del trasplante, solo se ha observado una disminución significativa de las ocurridas por enfermedad vascular del injerto/muerte súbita y una tendencia al aumento de las muertes por rechazo agudo (figura 22).
La actividad del trasplante cardiaco en España durante 2014 se ha mantenido estable respecto a los últimos años, después de la disminución apreciada desde principios del presente siglo. Asimismo, se confirma la tendencia en las características del procedimiento que viene observándose desde el lustro previo, con un perfil clínico de los receptores complejo, elevada proporción de trasplantes urgentes, un alto porcentaje de donantes subóptimos y tiempos de isquemia relativamente largos. Pese a este entorno en general desfavorable, los equipos españoles han mantenido los resultados en mortalidad e incluso empieza a observarse una tendencia a la mejora en el seguimiento a medio plazo.
Aproximadamente 1 de cada 5 trasplantes en España se realiza a un receptor con algún dispositivo de asistencia circulatoria, repartidos equitativamente entre ECMO y dispositivos de asistencia circulatoria (pulsátil o, principalmente, continua). El uso creciente de la asistencia circulatoria previa al trasplante es una tendencia universal, tal como muestran los datos del registro de la International Society for Heart and Lung Transplantation26, y en España ha comenzado a ser una práctica frecuente a partir de 2009. El presente análisis revela que la estabilización de los pacientes más graves con dispositivos de asistencia ventricular consigue unos excelentes resultados precoces y a medio plazo, muy próximos a los que se obtienen en trasplantes electivos. Sin embargo, en esta serie el pronóstico de los receptores asistidos con ECMO resulta significativamente más desfavorable, hallazgo similar al de los análisis realizados en otras poblaciones27,28. Todos estos hallazgos parecen indicar que el uso de ECMO probablemente sea más apropiado como puente a la decisión que como puente al trasplante en sí mismo, en cuyo caso se debe escalar a un dispositivo de más larga duración.
Cambios significativos son también evidentes en las características de los donantes. Particularmente, el aumento de la edad del donante y la proporción de los donantes considerados subóptimos (edad > 45 años) han presentado un incremento progresivo desde los primeros años de actividad. En 2014 se ha llegado al pico de edad del donante, con una media de 44 años y un 54% de donantes subóptimos. Esto refleja el esfuerzo de los grupos españoles por ofrecer una alternativa terapéutica de gran impacto clínico en una era de relativa escasez de donantes y empeoramiento de su condición. No obstante, hay que tener muy en cuenta el impacto pronóstico de esta variable a la hora de analizar los resultados de los programas, especialmente a medio y largo plazo.
El análisis de las curvas de supervivencia muestra que, a pesar del contexto clínico más complejo actual, la mortalidad precoz sigue en niveles similares a los de periodos anteriores y es superponible a la reportada en el registro internacional en periodos similares26. Es destacable asimismo que los pacientes trasplantados en el último decenio presentan a partir del tercer-cuarto año una casi significativa mejor supervivencia que los pacientes trasplantados en la década inmediatamente anterior. Un análisis de las causas de muerte puede aportar algunas claves para estos hallazgos. Durante el primer año ha aumentado significativamente la proporción de muertes por fallo primario del injerto, lo cual no resulta sorprendente atendiendo a las peores condiciones de los receptores en el momento del trasplante (uso todavía amplio de ECMO como soporte circulatorio en lugar de dispositivos de asistencia ventricular29,30, peores condiciones hemodinámicas31, alargamiento de los tiempos de isquemia y uso de donantes subóptimos). Este incremento se compensa, no obstante, con un control más adecuado de los rechazos agudos graves, que han pasado como causa de muerte de un 27% en la primera década de la serie a un 10% en la última, sin un aumento de las infecciones mortales (debido a la mejora del diagnóstico, la profilaxis y el tratamiento de estas). En las muertes acaecidas entre el primer y el quinto año, se constata una disminución significativa de las debidas a enfermedad vascular del injerto y muerte súbita (una manifestación frecuente de la enfermedad vascular en este periodo postrasplante). Sin duda, los grupos españoles practican una estrategia diagnóstica más agresiva de esta grave y limitante complicación después del trasplante, y sobre todo la implementación de tratamientos de reconocido efecto en esta enfermedad, como el uso universal de estatinas desde el mismo momento del trasplante y una inmunosupresión individualizada. En cuanto a esta, hay que destacar el uso predominante de tacrolimus como inhibidor de la calcineurina, que posee una acción diferencial respecto a la ciclosporina sobre la microvasculopatía y el remodelado de coronarias epicárdicas del injerto32 y sobre el perfil de riesgo cardiovascular33. Lo mismo puede aplicarse al uso del micofenolato respecto a la azatioprina34. En este aspecto, particularmente relevante resulta el amplio uso de los inhibidores de mTOR (principalmente everolimus)35, que llega al 28% de los pacientes durante el seguimiento.
CONCLUSIONESLa actividad del trasplante cardiaco en España se ha mantenido estable en los últimos años, con alrededor de 250 procedimientos por año. A pesar del empeoramiento y la complejidad del contexto clínico actual (uso de donantes subóptimos, asistencia circulatoria mecánica), los grupos españoles han conseguido mantener los resultados en mortalidad y se apunta a una progresiva mejora del pronóstico a medio plazo.
FINANCIACIÓNEl Registro Español de Trasplante Cardiaco está parcialmente financiado por una beca no condicionada de Novartis.
CONFLICTO DE INTERESESF. González-Vílchez recibe remuneración por participar en el comité de control y análisis estadístico de Roche y Astellas y por ponencias, presentaciones educativas y gastos de viaje de Roche, Astellas y Novartis. A. Villa es beneficiario de una beca de St. Jude Medical y ha recibido remuneración por ponencias y presentaciones educativas de St. Jude Medical. J. Segovia ha recibido remuneración por ponencias y presentaciones educativas por Novartis y Roche.
Agradecemos el soporte estadístico dado por ODDS, S.L.
| Clínica Universitaria Puerta de Hierro, Majadahonda, Madrid | Manuel Gómez-Bueno, Francisco Hernández Pérez, Luis Alonso-Pulpón, Alberto Forteza Gil, Santiago Serrano-Fiz, Raúl Burgos Lázaro, Carlos García Montero y Evaristo Castedo Mejuto |
| Hospital Universitario y Politécnico La Fe, Valencia | Ignacio Sánchez-Lázaro, Luis Martínez-Dolz, Mónica Cebrián Pinar y Soledad Martínez Penades |
| Hospital Universitario de A Coruña, A Coruña | María J. Paniagua-Martín, Eduardo Barge-Caballero, José J. Cuenca-Castillo, Francisco Estévez-Cid y Gonzalo Barge-Caballero |
| Hospital Universitario Reina Sofía, Córdoba | Amador López-Granados y Juan Carlos Castillo-Diéguez |
| Hospital Universitario Marqués de Valdecilla, Santander | Manuel Cobo, Miguel Llano-Cardenal, José A. Vázquez de Prada y Francisco Nistal Herrera |
| Hospital Gregorio Marañón (adultos), Madrid | Manuel Martínez Sellés, Juan Fernández-Yáñez, Iago Sousa y Pablo Díez |
| Hospital Universitario 12 de Octubre, Madrid | Miguel Ángel Gómez Sánchez y Laura Morán Fernández |
| Hospital de la Santa Creu i Sant Pau, Barcelona | Viçens Brossa, Sònia Mirabet y Laura López |
| Hospital Universitario Virgen del Rocío, Sevilla | Diego Rángel Sousa y José Manuel Sobrino |
| Hospital Universitario de Bellvitge, L’Hospitalet de Llobregat, Barcelona | Nicolás Manito, Josep Roca-Elías y Joel Salazar-Mendiguchía |
| Clínica Universitaria de Navarra, Pamplona | Cristian Delgado Domínguez e Ignacio Bibiloni Lage |
| Hospital Clínic Universitari, Barcelona | M. Ángeles Castel, Marta Farrero y Ana García-Álvarez |
| Hospital Universitario Central de Asturias, Oviedo | José Luis Lambert, Beatriz Díez de Molina y María José Bernardo Rodríguez |
| Hospital Universitario Gregorio Marañón (infantil), Madrid | Manuela Camino y Constancio Medrano |
| Hospital Universitario Virgen de la Arrixaca, El Palmar, Murcia | Domingo Pascual-Figal, Iris Garrido-Bravo y Francisco Pastor Pérez |
| Hospital Universitario Miguel Servet, Zaragoza | Teresa Blasco-Peiró, Marisa Sanz-Julvé y Ana Pórtoles Ocampo |
| Hospital Clínico Universitario, Valladolid | Luis de la Fuente Galán, Javier López Díaz y Ana María Correa Fernández |
| Hospital Universitario La Paz, Madrid | Luis Guereta, Luz Polo y Carlos Labrandero |
| Hospital Universitario Vall d’Hebron, Barcelona | Dimpna C. Albert Brotons, Ferrán Gran Ipiña y Raúl Abella |