Palabras clave
Introducción
La falta de precisión de los signos y síntomas en el diagnóstico de insuficiencia cardiaca ha conducido a la búsqueda de nuevos biomarcadores. En los últimos años, el péptido natriurético tipo B (BNP) se ha consolidado como un marcador de función cardiaca, con valor diagnóstico y pronóstico demostrado en pacientes con insuficiencia cardiaca crónica (ICC)1-4. La disnea ocasiona en estos pacientes una limitación funcional y suele ser el síntoma principal. Los mecanismos de la disnea de esfuerzo en la ICC no son bien conocidos e implican factores cardiacos, pulmonares y periféricos5. El deterioro de la función pulmonar es progresivo en la evolución de la enfermedad y se asocia a un peor pronóstico6-9. Sin embargo, hasta ahora no disponemos de ningún marcador periférico que, como el BNP, nos ayude a determinar la función pulmonar.
La proteína surfactante pulmonar tipo B (PS-B) se encuentra en el epitelio de la membrana alveolocapilar pulmonar y es necesaria para mantener su función10. La concentración alveolar de PS-B se mantiene constante y su flujo desde el alveolo a la sangre capilar es consecuencia de un gradiente positivo con rápido aclaramiento capilar10,11. Si la barrera alveolocapilar sufre daño, la PS-B pasa desde el espacio aéreo a la circulación como consecuencia del incremento de permeabilidad11-13. Este flujo incrementado puede permitirnos su detección en sangre periférica y medirlo podría ser un método sensible y no invasivo de determinación de la función pulmonar en pacientes con insuficiencia cardiaca. Así, la PS-B se ha detectado en la circulación periférica de pacientes con edema agudo de pulmón, como consecuencia del brusco incremento de presión en el capilar pulmonar y el daño en la unidad alveolocapilar14-16. En pacientes con ICC, el incremento sostenido de presión capilar se asocia a cambios estructurales17-19, y hasta ahora sólo un estudio ha señalado que la cuantificación de PS-B puede correlacionarse con la clase funcional y el pronóstico en estos pacientes20.
La hipótesis de este estudio fue que la PS-B podría ser un marcador pulmonar que ayude a monitorizar el empeoramiento funcional en pacientes con ICC. Los objetivos de este estudio son: determinar si la PS-B es detectable en pacientes con ICC, comparados con un grupo control de voluntarios sanos, y estudiar si su presencia se correlaciona con los parámetros funcionales en una prueba de ejercicio cardiopulmonar.
Métodos
Población de estudio
Se estudió a 43 pacientes consecutivos y ambulatorios, procedentes de una consulta especializada de insuficiencia cardiaca con diagnóstico establecido de ICC y que cumplieron los siguientes criterios de selección: a) disnea de esfuerzo como su síntoma limitante (NYHA II-III); b) estar recibiendo un tratamiento médico optimizado (que incluyera un bloqueador beta [BB] y un inhibidor de la enzima de conversión de angiotensina [IECA] o un antagonista del receptor de la angiotensina II [ARA-II]); c) en una situación clínica estable, sin ingresos hospitalarios en los últimos 6 meses, y d) sin diagnóstico de enfermedad pulmonar primaria y/o una espirometría anormal, definida como un volumen espiratorio forzado el primer segundo (FEV1) < 80% del predicho o un cociente FEV1/capacidad vital forzada < 70%. Dichos criterios fueron establecidos para la obtención de una muestra homogénea, sin sesgos derivados de condiciones que pudieran afectar a los valores de PS-B.
Todos los procedimientos del estudio se realizaron en la misma mañana: a) los pacientes se encontraban en ayunas desde la media noche anterior y, tras un periodo de reposo de 30 min, se obtuvieron muestras sanguíneas de una vena antecubital; b) se realizó un estudio ecocardiográfico (Sonos 5500, Philips, Andover, Massachusetts); c) se realizó una prueba de esfuerzo cardiopulmonar limitada por síntomas, y d) al final de la prueba de esfuerzo, dentro del primer minuto desde el final del ejercicio, se extrajo una segunda muestra sanguínea. Se obtuvo un grupo control (n = 26) de voluntarios sanos asintomáticos, seleccionados por frecuencias de edad y sexo, sin antecedentes de enfermedad conocida ni factores de riesgo cardiovascular, con ecocardiografía y espirometría normales. En las mismas condiciones de reposo y ayunas que en el grupo con ICC, se extrajo una muestra sanguínea de la población control. Este estudio fue aprobado por el comité ético local y todos los participantes dieron su consentimiento informado por escrito.
Determinación de PS-B
La presencia y la cantidad de PS-B en suero sanguíneo se analizaron mediante Western blot. Para cada muestra, se incubaron 100 µg de proteína total durante 5 min a 95 °C en tampón de muestra Laemmli, y se separaron mediante electroforesis en condiciones reductoras en gel de poliacrilamida al 12%. A continuación, el gel se transfirió a una membrana de PVDF (Immobilon-PSQ Membranes, Millipore, Bedford, Massachusetts). Como anticuerpos primario y secundario, se emplearon un anticuerpo policlonal de conejo anti-PSB (Santa Cruz Biotechnology, Inc., Santa Cruz, California) diluido 1:750 y un anticuerpo de cabra anticonejo conjugado con peroxidasa de rábano (Santa Cruz Bio-technology) diluido 1:5.000, respectivamente. Para el revelado empleamos el kit de quimioluminiscencia ECL Plus (Amersham Pharmacia Biotech, Little Chalfont, Reino Unido) siguiendo las instrucciones del fabricante. El análisis cuantitativo se realizó con el programa Gel-Pro Analyzer 3.1 (Sigma, St. Louis, Missouri). Los valores de PSB se expresan como unidades de densidad óptica. Se obtuvo una única banda específica de peso molecular aparente de 17 kDa, que se corresponde con la forma dimérica y activa de PSB liberada de la barrera broncoalveolar21. La concentración de proteína total en suero se determinó mediante el método del ácido bicinconínico. La homogeneidad de la carga total de proteína en las distintas calles del gel se determinó por corte del cuarto superior de la membrana antes del bloqueo y su tinción con amido-black al 0,1% disuelto en un 45% de metanol y ácido acético al 10%. Para comprobar la especificidad de las bandas inmunorreactivas, se utilizó extracto de surfactante pulmonar a partir de lavado broncoalveolar procedente de pacientes con tumor primario de pulmón. Para cada muestra la determinación se repitió por triplicado. La concentración de BNP plasmático se midió por duplicado con una prueba específica de radioinmunoanálisis en fase sólida tipo sandwich (ShionoRia BNP kit, CIS Bio International, Gif sur Yvette, Francia), como ya se ha descrito22.
Prueba de esfuerzo cardiopulmonar
Todos los pacientes realizaron una prueba de esfuerzo cardiopulmonar limitada por disnea, siguiendo el protocolo modificado de Bruce en cinta sin fin. Las variables de intercambio gaseoso y ventilación se obtuvieron mediante un neumotacógrafo y analizador (CPX System, Medical Graphics Corp., St. Paul, Minnesota, Estados Unidos) con medida de ventilación por minuto (VE), consumo de oxígeno (VO2) y producción de dióxido de carbono (VCO2) cada 10 s mediante un espectrómetro de masas (Amis 2000, Innovision; MedGraphics Cardio O2 System, Odense, Denmark). Se animó a los pacientes a realizar ejercicio hasta la extenuación y todos los pacientes alcanzaron el umbral anaeróbico y un cociente respiratorio > 1,05. Se usó monitorización continua con electrocardiograma de 12 derivaciones. La presión sanguínea se midió cada minuto con esfigmomanómetro de manguito. Todos los pacientes detuvieron el ejercicio por disnea, ninguno experimentó dolor torácico ni alteraciones isquémicas del segmento ST. Se estableció el VO2máx como el mayor valor en la fase final del ejercicio y se expresó como ml/kg/min y como porcentaje del normal predicho (%VO2máx o capacidad funcional). El VO2máx predicho se calculó según sexo, edad y peso23. La pendiente de la relación entre ventilación por minuto y producción de dióxido de carbono (VE/VCO2) se estableció como el cociente de la respuesta ventilatoria al ejercicio o ineficiencia ventilatoria24.
Análisis estadístico
Mediante el test de Kolmogorov-Smirnov, se comprobó la normalidad de la distribución en las variables cuantitativas. Los valores de PS-B y BNP mostraron una desviación de la normalidad, por lo que sus valores se expresaron como mediana [intervalo intercuartílico]. El resto de las variables se expresaron como media ± desviación estándar (DE) para las variables cuantitativas y n (%) para las cualitativas. Para la comparación de variables categóricas se usó el test de la χ2 y el test exacto de Fisher. La concentración de PS-B en el grupo con insuficiencia cardiaca y en el grupo control se compararon mediante la prueba de la U de Mann-Whitney para muestras independientes. Los valores de PS-B en reposo y al máximo esfuerzo se compararon mediante el test de la Wilcoxon para muestras apareadas. La asociación entre cifras de PS-B y el diagnóstico de insuficiencia cardiaca se estudió mediante el análisis de curva característica operador-receptor. Para el estudio de las correlaciones se usó la transformación logarítmica de los valores de PS-B (PSBlog) y BNP (BNPlog) y el análisis de regresión lineal simple. La asociación entre valores de PS-B y los parámetros de ejercicio se evaluó mediante el análisis de regresión lineal múltiple ajustado por edad, sexo, FEVI, BNP y las variables con p < 0,1 en el análisis univariable, mostrando los valores de β y su intervalo de confianza (IC) del 95%. Se consideró significativo un valor de p < 0,05. El análisis estadístico se realizó mediante el paquete de softwareestadístico para ciencias sociales SPSS v. 15.0 for Windows (SPSS Inc., Chicago, Illinois, Estados Unidos).
Resultados
PS-B e insuficiencia cardiaca
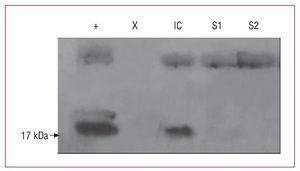
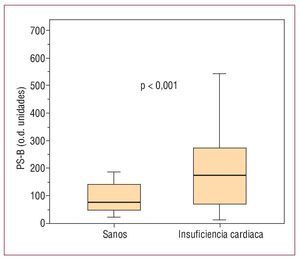
Se estudió a 43 pacientes con ICC, cuyas características clínicas se muestran en la tabla 1. El grupo control comprendió a 26 voluntarios sanos (edad, 51,4 ± 9,6 años; el 77% varones). La presencia de PS-B (fig. 1) fue detectada en la circulación periférica de 35 (82%) pacientes con insuficiencia cardiaca frente a 6 (23%) voluntarios sanos (p < 0,001). En aquéllos con PS-B detectable, la concentración fue mayor en los pacientes con insuficiencia cardiaca: mediana [intervalo intercuartílico] (intervalo), 174 [70-283] (13-1.486) que en voluntarios sanos, 77 [41-152] (23-187) (p < 0,001) (fig. 2). El análisis de curva característica operador-receptor mostró un área bajo la curva de 0,83 (IC del 95%, 0,72-0,91) y la detección de PSB mostró sensibilidad del 81%, especificidad del 77%, valor predictivo positivo del 86% y valor predictivo negativo del 72% para la presencia de insuficiencia cardiaca. En los pacientes con insuficiencia cardiaca, la presencia de PS-B circulante (frente a su ausencia) se asoció con una menor FEVI (31,4% ± 9,6% frente a 41,8% ± 15%; p = 0,01). Los valores de PS-B no se correlacionaron con ninguna otra de las características clínicas mostradas en la tabla 1 (p > 0,5 para todos los análisis).
Fig. 1. Detección de PS-B usando Western blot: control de lavado broncoalveolar de pacientes con tumor primario de pulmón (+); pacientes con insuficiencia cardiaca (IC); voluntarios sanos (S1, S2), y calle vacía (X).
Fig. 2. Cuantificación de la concentración de PS-B circulante en pacientes con insuficiencia cardiaca y en voluntarios sanos.
PS-B y capacidad funcional
El valor de PS-Blog al máximo esfuerzo mostró una correlación casi perfecta con el valor de PS-Blog en reposo (r = 0,980; p < 0,001), pero sin diferencias significativas entre los valores de ambos tiempos (p = 0,164). El cociente de PS-B ejercicio/reposo fue 0,99 ± 0,23 [0,85-1,06] (0,44-1,65). En el análisis de regresión lineal múltiple (tabla 2), un mayor valor de BNPlog fue el principal determinante de una menor capacidad funcional (menor %VO2máx), mientras que la edad y el valor de PS-Blog en reposo se asociaron positivamente con una mayor ineficiencia ventilatoria (mayor pendiente VE/VCO2). No hubo asociación entre PS-Blog y la duración de ejercicio o el máximo producto de presión arterial × frecuencia cardiaca, y la respuesta del PS-B al ejercicio (cociente ejercicio/reposo) no mostró ninguna asociación con el VO2máx y la pendiente VE/VCO2 (p > 0,3 para todos los análisis).
Discusión
Los hallazgos de este estudio tienen implicaciones sobre el conocimiento de la fisiopatología del deterioro funcional en pacientes con ICC. Nuestro trabajo muestra que la PS-B es medible y se la encuentra en la circulación periférica de pacientes con insuficiencia cardiaca, en mayores porcentajes y concentraciones que en una población sana; asimismo, sus valores en reposo se correlacionan con la ineficiencia ventilatoria durante el ejercicio (pendiente VE/VCO2). Además, la descripción por primera vez de su medida por análisis Western blot en suero humano añade relevancia a este estudio.
Estudios previos han mostrado que la PS-B está presente en la circulación periférica de controles sanos y en mayor concentración en diversas enfermedades pulmonares, como un índice del estado pulmonar10,25,26. En situaciones de daño pulmonar agudo, como en el edema agudo de pulmón o en el distrés respiratorio del adulto, la PS-B se ha encontrado incrementada en sangre periférica como consecuencia del daño en la unidad alveolocapilar14,27.
Nuestro estudio muestra que la PS-B está presente en la circulación periférica de pacientes con ICC estable, a concentraciones significativamente mayores que en individuos sanos. Con anterioridad, sólo un estudio de De Pasquale et al20 ha mostrado la presencia de PS-B en 53 pacientes con insuficiencia cardiaca a concentraciones significativemente mayores que en 17 controles sanos. El uso en nuestro estudio de la técnica de transferencia de Western para la detección de PS-B en suero humano, la cual difiere de la técnica de análisis por inmunoabsorbencia ligado a enzimas usada por De Pasquale et al, hace de nuestro trabajo un estudio confirmatorio importante, por cuanto el análisis Western blot es una técnica más específica para detectar y comparar la concentración de proteína. Por otro lado, ambos estudios muestran una amplia gama de concentraciones, lo que indica una elevada variabilidad interindividual, si bien la buena correlación de concentraciones entre reposo y ejercicio señala una menor variabilidad intraindividual.
En pacientes con insuficiencia cardiaca, el ejercicio se asocia con un incremento de presiones en el capilar pulmonar, así como edema pulmonar, que podrían determinar un incremento del PS-B circulante28. Sin embargo, en nuestro estudio no encontramos un incremento significativo en PS-B durante el ejercicio. De Pasquale et al tampoco encontraron un incremento de PS-B en la población total de 20 pacientes sin insuficiencia cardiaca, que realizaron un test de esfuerzo para el diagnóstico de enfermedad coronaria, pero sí en 10 pacientes con inducción de isquemia y anomalías de la contractilidad durante el ejercicio29. En nuestro estudio, la detección de PS-B se asoció con una menor FEVI en reposo, pero la ausencia de monitorización ecocardiográfica o hemodinámica durante el esfuerzo no nos permite determinar si la inducción de disfunción ventricular sistólica durante el esfuerzo pudo identificar a un subgrupo de pacientes con incremento de PS-B. Por otro lado, las concentraciones de PS-B se midieron inmediatamente tras el esfuerzo, y no se dispone de datos acerca de si mediciones seriadas podrían haber aportado diferencias significativas.
La PS-B, como una medida del estado de la unidad alveolocapilar, podría explicar el deterioro funcional debido a disnea de esfuerzo. En nuestro estudio, la PS-B no fue predictora del VO2máx, frente al BNP, del que se ha demostrado que es un predictor significativo20,30. El VO2máx refleja el incremento del gasto cardiaco con el ejercicio, lo que explicaría su mayor asociación con el BNP, al ser éste un biomarcador de función cardiaca. Previamente, en 53 pacientes con insuficiencia cardiaca, De Pasquale et al20 encontraron una correlación entre valores de PS-B, clase funcional NYHA y distancia caminada en el test de los 6 min. A diferencia de ese estudio, nosotros no encontramos una correlación con parámetros más objetivos como el VO2máx y el %VO2máx. La inclusión en nuestro estudio de pacientes estables con un menor deterioro funcional, como demuestran el rango bajo del BNP basal y los valores relativamente elevados del VO2máx, pudo haber condicionado los resultados obtenidos. Sin embargo, encontramos una asociación modesta pero significativa con la ineficiencia ventilatoria, reflejada en una mayor pendiente del cociente VE/VCO2. En pacientes con insuficiencia cardiaca, hay una pérdida progresiva de la capacidad de difusión de gases a través de la membrana alveolocapilar, lo que, junto con el incremento en la congestión durante el ejercicio, implica una mayor necesidad de ventilación (VE) y una mayor pendiente VE/VCO2 o ineficiencia ventilatoria7,31. Guazzi et al32 mostraron que el estado de la membrana alveolocapilar es el parámetro pulmonar que mejor se correlaciona con la pendiente VE/VCO2 durante el ejercicio. Este hallazgo está en concordancia con nuestro estudio, en el que la PS-B se asoció a una mayor pendiente VE/VCO2.
Por lo tanto, nuestro estudio indica que la PS-B, como marcador de daño alveolocapilar, es medible en circulación periférica de pacientes con insuficiencia cardiaca y se asocia a un deterioro de la función pulmonar en términos de ineficiencia ventilatoria durante el ejercicio. En consecuencia, su concentración podría usarse como marcador pulmonar en la insuficiencia cardiaca y podría tener un valor pronóstico en estos pacientes. Son necesarios nuevos estudios con mayores poblaciones para definir mejor su papel en pacientes con insuficiencia cardiaca.
ABREVIATURAS
BNP: péptido natriurético tipo B.
ICC: insuficiencia cardiaca crónica.
PS-B: proteína surfactante pulmonar tipo B.
RIC: rango intercuartílico.
Full English text available from: www.revespcardiol.org
Véase editorial en págs. 117-9
Este trabajo fue financiado parcialmente por una beca 2006 de la Sociedad Española de Cardiología, Sección de Insuficiencia Cardiaca, Trasplante Cardiaco y otras alternativas terapéuticas, España.
Correspondencia: Dr. D.A. Pascual Figal.
Servicio de Cardiología. Hospital Universitario Virgen de la Arrixaca. Ctra. Madrid-Cartagena, s/n. 30120 Murcia. España.
Correo electrónico: dapascual@servicam.com
Recibido el 28 de abril de 2008.
Aceptado para su publicación el 17 de octubre de 2008.