Hay solo unos pocos casos anecdóticos de endocarditis infecciosa (EI) tratada con implante percutáneo de válvula aórtica (TAVI)1,2. A pesar de que la disfunción valvular puede tratarse con TAVI, la infección local persistente requiere desbridar el tejido afectado y descarta el TAVI, puesto que la reinfección se asocia con peor pronóstico2. Además, la EI se ha considerado un criterio de exclusión en la mayoría de los estudios de referencia y el TAVI se ha desestimado empíricamente en este contexto. Por el contrario, es bien conocido que el tratamiento antibiótico en la EI es muy eficaz en algunas etiologías concretas y que, a menudo, el único motivo para la cirugía cardiaca es la disfunción valvular grave sintomática y residual3. Según esto, el TAVI representa una alternativa novedosa para el subgrupo de pacientes con alto riesgo quirúrgico, siempre que se pueda determinar la presencia de marcadores específicos de infección curada.
El objetivo de este estudio es identificar los principales predictores de infección local activa en el momento de la intervención que pudieran descartar el uso de TAVI en la EI. De un registro que incluía 732 episodios de EI izquierda diagnosticados consecutivamente en 2 centros terciarios entre 1996 y 2015, 432 pacientes pasaron por cirugía cardiaca y 224 presentaban afección de la válvula aórtica nativa o una prótesis aórtica biológica. Solo se incluyó a los pacientes con cultivo del material resecado durante la cirugía (n = 182). Se excluyó a los pacientes con cultivo valvular discordante (n = 14), dado que no se podía descartar la contaminación de los cultivos.
Se definió infección local activa en el momento de la intervención como la aparición de complicaciones perianulares o cultivos positivos concordantes (se detecta el mismo microorganismo en el hemocultivo y en el cultivo del tejido cardiaco resecado durante la intervención quirúrgica). Los tejidos biológicos se cultivaron en caldo de tioglicolato e infusión cerebro-corazón y en 4 tipos de medio agar (agar Columbia de sangre de carnero, agar chocolate enriquecido con Isovitalex, agar MacConkey y agar Schaedler).
Para identificar los factores con valor predictivo de infección local activa en el momento de la intervención, se elaboró un modelo predictivo de regresión logística con el método de probabilidad máxima y una selección escalonada retrógrada, que incluía las variables de interés clínico que demostraron significación estadística en el análisis univariable. Se muestra únicamente el último paso del análisis. La bondad del ajuste para cada modelo se determinó mediante la prueba de Hosmer-Lemeshow y el área bajo la curva (ABC) de receiver operating characteristics (ROC).
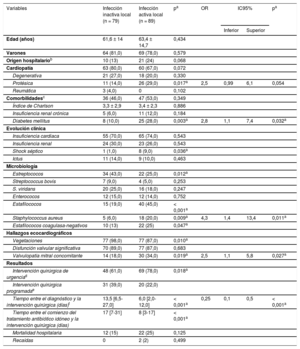
En la tabla se resumen los predictores de infección local activa en el momento de la intervención en los modelos univariable y multivariable. Los principales predictores independientes de infección local activa fueron la diabetes mellitus (odds ratio [OR] = 2,8; intervalo de confianza del 95% [IC 95%], 1,1-7,4), Staphylococcus aureus (OR = 4,3; IC95%, 1,4-13,4) y la afección concomitante de la válvula mitral (OR = 2,5; IC95%, 1,1-5,8). Por el contrario, un intervalo de 10 días transcurridos entre el diagnóstico y la intervención (valor de corte estimado) fue un factor predictor de infección curada (OR = 0,25; IC95%, 0,1-0,5). El modelo presentaba un ABC ROC de 0,776 (IC95%, 0,705-0,847) y según la prueba de Hosmer-Lemeshow p = 0,848. De hecho, después de 10 días de tratamiento antibiótico apropiado y en ausencia de diabetes mellitus, S. aureus y daño concomitante de la válvula mitral o la prótesis aórtica, solo 1 (3,5%) de 29 pacientes tenía un cultivo positivo en el momento de la intervención.
Modelos univariable y multivariable de los predictores de infección local activa en el momento de la cirugía cardiaca para pacientes con endocarditis infecciosa aórtica
| Variables | Infección inactiva local (n = 79) | Infección activa local (n = 89) | pa | OR | IC95% | pa | |
|---|---|---|---|---|---|---|---|
| Inferior | Superior | ||||||
| Edad (años) | 61,6 ± 14 | 63,4 ± 14,7 | 0,434 | ||||
| Varones | 64 (81,0) | 69 (78,0) | 0,579 | ||||
| Origen hospitalariob | 10 (13) | 21 (24) | 0,068 | ||||
| Cardiopatía | 63 (80,0) | 60 (67,0) | 0,072 | ||||
| Degenerativa | 21 (27,0) | 18 (20,0) | 0,330 | ||||
| Protésica | 11 (14,0) | 26 (29,0) | 0,017a | 2,5 | 0,99 | 6,1 | 0,054 |
| Reumática | 3 (4,0) | 0 | 0,102 | ||||
| Comorbilidadesc | 36 (46,0) | 47 (53,0) | 0,349 | ||||
| Índice de Charlson | 3,3 ± 2,9 | 3,4 ± 2,3 | 0,886 | ||||
| Insuficiencia renal crónica | 5 (6,0) | 11 (12,0) | 0,184 | ||||
| Diabetes mellitus | 8 (10,0) | 25 (28,0) | 0,003a | 2,8 | 1,1 | 7,4 | 0,032a |
| Evolución clínica | |||||||
| Insuficiencia cardiaca | 55 (70,0) | 65 (74,0) | 0,543 | ||||
| Insuficiencia renal | 24 (30,0) | 23 (26,0) | 0,543 | ||||
| Shock séptico | 1 (1,0) | 8 (9,0) | 0,036a | ||||
| Ictus | 11 (14,0) | 9 (10,0) | 0,463 | ||||
| Microbiología | |||||||
| Estreptococos | 34 (43,0) | 22 (25,0) | 0,012a | ||||
| Streptococcus bovis | 7 (9,0) | 4 (5,0) | 0,253 | ||||
| S. viridans | 20 (25,0) | 16 (18,0) | 0,247 | ||||
| Enterococos | 12 (15,0) | 12 (14,0) | 0,752 | ||||
| Estafilococos | 15 (19,0) | 40 (45,0) | < 0,001a | ||||
| Staphylococcus aureus | 5 (6,0) | 18 (20,0) | 0,009a | 4,3 | 1,4 | 13,4 | 0,011a |
| Estafilococos coagulasa-negativos | 10 (13) | 22 (25) | 0,047a | ||||
| Hallazgos ecocardiográficos | |||||||
| Vegetaciones | 77 (98,0) | 77 (87,0) | 0,010a | ||||
| Disfunción valvular significativa | 70 (89,0) | 77 (87,0) | 0,683 | ||||
| Valvulopatía mitral concomitante | 14 (18,0) | 30 (34,0) | 0,019a | 2,5 | 1,1 | 5,8 | 0,027a |
| Resultados | |||||||
| Intervención quirúrgica de urgenciad | 48 (61,0) | 69 (78,0) | 0,018a | ||||
| Intervención quirúrgica programadae | 31 (39,0) | 20 (22,0) | |||||
| Tiempo entre el diagnóstico y la intervención quirúrgica (días)f | 13,5 [6,5-27,0] | 6,0 [2,0-12,0] | < 0,001a | 0,25 | 0,1 | 0,5 | < 0,001a |
| Tiempo entre el comienzo del tratamiento antibiótico idóneo y la intervención quirúrgica (días) | 17 [7-31] | 8 [3-17] | < 0,001a | ||||
| Mortalidad hospitalaria | 12 (15) | 22 (25) | 0,125 | ||||
| Recaídas | 0 | 2 (2) | 0,499 | ||||
IC95%: intervalo de confianza del 95%; OR: odds ratio.
Los valores expresan media ± desviación estándar, mediana [intervalo intercuartílico] o n (%).
Origen nosocomial: signos y síntomas de endocarditis infecciosa que comienzan a las 48 h del ingreso hospitalario o durante los primeros 3 días tras al alta o hasta 30 días después de la intervención quirúrgica.
Comorbilidades: se define como la presencia de diabetes mellitus, insuficiencia renal crónica, inmunosupresión, enfermedad pulmonar crónica, cáncer, colagenopatía que requiere tratamiento esteroideo, VIH o consumo de drogas por vía intravenosa.
Intervención quirúrgica de urgencia: intervención realizada durante la fase activa de la endocarditis infecciosa, antes de finalizar el tratamiento antibiótico.
La recomendación de evitar el TAVI en el contexto de una EI aórtica sin complicaciones se basa en supuestos infundados, aunque ampliamente aceptados. Este estudio evalúa por primera vez el riesgo real de este posible tratamiento en una amplia población de pacientes sometidos a cirugía cardiaca con cultivo del tejido resecado, lo que demuestra que en la mayoría de los pacientes se puede predecir la ausencia de infección local tras el inicio del tratamiento antibiótico. Este hallazgo generador de hipótesis podría sustentar el uso de TAVI en pacientes con EI e infección curada pero con lesión valvular residual y alto riesgo quirúrgico. Por otro lado, las complicaciones perianulares, la necesidad de una reparación quirúrgica extensa, el choque séptico y la infección de prótesis biológica parecen asociados con infección persistente, lo que apunta a que el TAVI debería evitarse en estos escenarios hasta disponer de evidencia empírica solvente4,5.
En conclusión, los hallazgos de este estudio indican que, en malos candidatos a cirugía cardiaca, y conforme al criterio de valoración de un equipo multidisciplinario experto en EI, se puede considerar el TAVI como opción terapéutica para casos muy particulares de EI con bajo riesgo de infección local en el momento de programar la intervención.