El tratamiento de los pacientes con insuficiencia cardiaca con fracción de eyección reducida (IC-FEr) con una combinación de 4 clases de fármacos se recomienda en las principales guías de práctica clínica internacionales. Sin embargo, no especifican cómo deben introducirse y ajustarse estos tratamientos. En consecuencia, muchos pacientes con IC-FEr no pasan a un régimen de tratamiento optimizado. El objetivo de esta revisión es proponer un algoritmo pragmático para optimizar el tratamiento, diseñado para que sea lo más fácil posible de aplicar en la práctica diaria. El primer objetivo es garantizar que las 4 clases de medicación recomendadas se inicien cuanto antes para establecer una terapia eficaz, incluso a dosis bajas. Esto se considera preferible a iniciar menos medicamentos a una dosis máxima. El segundo objetivo es garantizar que los intervalos entre la introducción de los medicamentos y entre los distintos pasos de titulación sean lo más breves posible, por la seguridad del paciente. Se hacen propuestas específicas para los pacientes de edad avanzada (> 75 años) frágiles, y para aquellos con trastornos del ritmo cardiaco. La aplicación de este algoritmo debería permitir alcanzar un protocolo de tratamiento óptimo en un plazo de 2 meses para la mayoría de los pacientes. Este debe ser nuestro objetivo en el tratamiento de la IC-FEr.
Palabras clave
La insuficiencia cardiaca (IC) es una causa importante de hospitalización, morbilidad y mortalidad, sobre todo de pacientes de edad avanzada, con una prevalencia mundial estimada de alrededor del 2%1. No obstante, un abordaje apropiado permite prevenir eficazmente el agravamiento de la enfermedad y las descompensaciones agudas y salvar vidas2, si bien la optimización rara vez se alcanza en la práctica clínica real. Recientemente se han publicado nuevas guías de práctica clínica internacionales3,4 que recomiendan el uso de una combinación de 4 clases de medicación como plataforma de tratamiento para la IC con fracción de eyección reducida (IC-FEr) (recomendación de clase I). Estos grupos farmacológicos son determinados bloqueadores beta (BB), los inhibidores de la neprilisina y el receptor de la angiotensina (INRA) o los inhibidores de la enzima de conversión de la angiotensina (IECA), los antagonistas del receptor de mineralocorticoides (ARM) y los inhibidores del cotransportador de sodio-glucosa 2 (iSGTL2). Sin embargo, el enfoque óptimo para introducir este tratamiento médico según las guías de práctica clínica (TMSG) en un paciente concreto continúa siendo motivo de debate5–12.
Los principales factores que limitan la introducción y el ajuste de las dosis de las medicaciones para la IC son el empeoramiento de la función renal13, la presión arterial baja14 y la frecuencia cardiaca baja15. El inicio concomitante de múltiples fármacos que comportan un riesgo de estos eventos adversos puede ser una dificultad que es preciso tener en cuenta al elegir la estrategia terapéutica. De igual modo, la optimización rápida del tratamiento, de ser posible en un plazo de 2 meses, también es una dificultad.
En el presente artículo se propone un enfoque pragmático diseñado para que los médicos clínicos puedan aplicarlo fácilmente en su práctica clínica habitual. Se ha intentado tener en cuenta lo indicado en las guías recientes, el concepto de aplicación temprana y sus dificultades y la necesidad de ajustar el tratamiento individualizado a las necesidades de cada paciente. Esta declaración de posicionamiento se elaboró a través de una colaboración entre expertos del Grupo de Trabajo sobre Insuficiencia Cardiaca de la Sociedad Francesa de Cardiología, con la finalidad de promover la optimización del tratamiento y facilitar la aplicación práctica de la guía sobre IC de la Sociedad Europea de Cardiología4.
FACTORES QUE CONSIDERAR AL DISEÑAR UN ALGORITMO PARA OPTIMIZAR LA MEDICACIÓN EN LA INSUFICIENCIA CARDIACA CON FRACCIÓN DE EYECCIÓN REDUCIDAConsideraciones farmacológicasLas diversas clases de TMSG se dirigen a diferentes mecanismos fisiopatológicos: los INRA/IECA y los ARM inhiben el sistema renina-angiotensina-aldosterona16 y los INRA bloquean también de manera específica la degradación de los péptidos natriuréticos y otras hormonas vasoactivas17. Los BB actúan principalmente en el sistema nervioso autónomo, pero también inhiben la síntesis de la renina18. Por último, los iSGLT2 se desarrollaron inicialmente para impedir la reabsorción de glucosa y sodio por los riñones, pero sus efectos favorables en la IC probablemente se deban a mecanismos extrarrenales que están pendientes de una evaluación más detallada19. Desde una perspectiva farmacológica, parece razonable abordar el mayor número posible de mecanismos fisiopatológicos en paralelo, en vez de perseguir la inhibición máxima de una única vía.
Consideraciones relativas a la eficaciaHistóricamente, las diversas clases de TMSG se introdujeron en secuencia tras la demostración de su eficacia mediante ensayos clínicos aleatorizados bien diseñados a lo largo de un periodo de más de 30 años. Por esta razón, en general cada nueva clase se ha evaluado mediante la comparación con un placebo y utilizada en conjunto con los medicamentos ya disponibles. En general, no se han llevado a cabo estudios de comparación directa, excepto en el caso de los INRA en comparación con los IECA20.
Para abordar la limitación de datos procedentes de comparaciones directas, recientemente se ha evaluado la eficacia comparativa de diferentes tratamientos para la IC en un metanálisis de 75 ensayos clínicos aleatorizados21. No es de extrañar que la opción más eficaz para reducir la mortalidad por cualquier causa en comparación con el placebo haya sido el empleo concomitante de un INRA, un BB, un ARM y un iSGTL221. Es importante señalar que no hay ningún indicio de interacciones entre las distintas clases de medicación para la IC y que los datos disponibles indican claramente que cada una de las clases tiene una repercusión importante en los resultados clínicos con independencia de los demás fármacos utilizados para tratar al paciente8,22.
Lo mismo que ocurre con la magnitud del efecto absoluto del tratamiento con las diversas clases de medicación sucede también con la secuencia en la que se introducen. Por ejemplo, en un reciente estudio en el que se utilizaron los datos de 6 ensayos clínicos fundamentales para elaborar modelos de diferentes secuencias de tratamiento10, se observaron algunas diferencias de los resultados de mortalidad entre las distintas secuencias. Sin embargo, el factor más importante para reducir la mortalidad fue la rapidez del ajuste al alza del tratamiento10.
Para optimizar el pronóstico, se recomienda una introducción temprana del tratamiento tras el diagnóstico o una agudización. Los resultados de análisis post hoc de ensayos recientes han puesto de manifiesto de manera uniforme una reducción rápida del riesgo después del inicio del tratamiento. Por ejemplo, en un ensayo clínico aleatorizado grande en el que se comparó el tratamiento con sacubitrilo-valsartán frente a enalapril20 y también en ensayos recientes de iSGLT223,24, los reingresos hospitalarios se redujeron significativamente en el plazo de 1 mes tras el inicio del tratamiento. Recientemente, en el ensayo STRONG-HF25 se aleatorizó a 900 pacientes hospitalizados a tratamiento según la asistencia habitual o con una asistencia de alta intensidad. En este segundo grupo se utilizó un ajuste rápido de aumento del tratamiento con 4 fármacos para alcanzar las dosis óptimas en un plazo de 2 semanas tras el alta. Este enfoque resultó viable y seguro, y el ensayo mostró que un ajuste de aumento rápido del TMSG reduce significativamente el riesgo de mortalidad por cualquier causa o de hospitalización por IC a los 180 días25. Las hospitalizaciones agudas proporcionan una ventana de oportunidad para iniciar y optimizar los tratamientos de la IC, y esta ventana se pierde si los pacientes son dados de alta sin tratamiento.
Consideraciones relativas a la seguridadLos principales eventos adversos que limitan la optimización del TMSG son la presión arterial baja, la frecuencia cardiaca baja, el deterioro de la función renal y los trastornos electrolíticos, principalmente la hiperpotasemia con los ARM26. A este respecto, parece que los iSGLT2 tienen el mejor perfil de seguridad, ya que su efecto en la presión arterial es mínimo y en general no causan hipotensión ortostática en los pacientes sin hiperglucemia (la cual puede rectificarse con facilidad intensificando otros tratamientos para la diabetes)27. Sin embargo, los iSGLT2 pueden aumentar el riesgo de cetoacidosis28, sobre todo si el paciente pasa a estar hemodinámicamente inestable y entra en shock. En estos casos, el tratamiento con iSGLT2 deberá posponerse o interrumpirse27. Estos fármacos pueden aumentar también el riesgo de infecciones urinarias en los pacientes portadores de una sonda urinaria28.
La presión arterial baja es un problema que se da principalmente con los BB, los IECA y los INRA. El deterioro de la función renal, debido a efectos hemodinámicos reversibles, se observa con los ARM, los IECA y los INRA13,29. Aunque el tratamiento con iSGLT2 puede conducir a un pequeño aumento inicial de la creatinina sérica, estos fármacos proporcionan una protección renal significativa a medio plazo13. Es de destacar que se dispone de poca información sobre el riesgo de la medicación en los pacientes con una IC muy grave (fracción de eyección <25%), para quienes puede ser necesario un tratamiento más conservador. Las dificultades derivadas de la presión arterial baja y el deterioro de la función renal pueden atenuarse con los algoritmos de tratamiento propuestos recientemente14,29.
Otro factor que influye en la rapidez de optimización del TMSG es la persistencia de la congestión, que se asocia a un mal pronóstico después del alta30. Aparte de los BB, que puede ser necesario introducir más tarde o ajustar de manera más lenta, la congestión persistente no debiera impedir la optimización del TMSG antes del alta. De hecho, se ha observado que los IECA, los INRA y los iSGLT2 facilitan la descongestión31-33. Sin embargo, la cuestión del tratamiento de la congestión es compleja y requerirá un examen más prolongado en otras publicaciones.
ComorbilidadesLas comorbilidades son frecuentes en la IC, en especial por lo que respecta a la diabetes, las enfermedades respiratorias crónicas y la enfermedad renal crónica1. Muchas de las medicaciones utilizadas para el tratamiento de la IC también son eficaces en estos otros trastornos o enfermedades, como la hipertensión o la enfermedad coronaria de larga evolución. En los pacientes con diabetes, el uso de iSGLT2 en la IC puede aportar una mejora del control glucémico y la función cardiaca. Además, más recientemente se ha puesto de manifiesto que esta clase de fármacos reduce la progresión de la enfermedad y la mortalidad de los pacientes con enfermedad renal crónica34. Por otra parte, con los INRA se ha observado también una mejora del control de la diabetes35 y la función renal de los pacientes con IC.
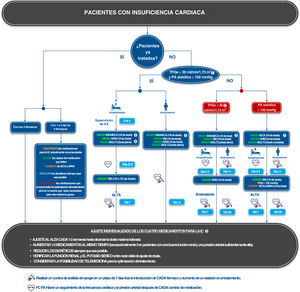
ALGORITMO PROPUESTO PARA LA OPTIMIZACIÓN DE LA MEDICACIÓN PARA LA INSUFICIENCIA CARDIACASobre la base de la evidencia disponible, se propone un algoritmo para el inicio o la optimización de los tratamientos para la IC (figura 1). El objetivo es proporcionar un abordaje sencillo para las formas de presentación clínica heterogéneas de los pacientes que se centre en los factores clave que pueden influir en la tolerabilidad de los fármacos (figura 2). El algoritmo propuesto puede aplicarse a la mayoría de los pacientes. Sin embargo, se debe reconocer que hay otros grupos de pacientes con formas de presentación clínica más complejas. En esos casos, nuestro algoritmo puede adaptarse para un abordaje más sofisticado basado en las comorbilidades36. Debe señalarse que este artículo se centra en el enfoque práctico para optimizar el TMSG, y no se examinan otros aspectos importantes del tratamiento de la IC como los tratamientos de segunda línea, tratamientos no farmacológicos y el control de las comorbilidades.
Algoritmo de tratamiento propuesto para los pacientes con insuficiencia cardiaca. 1. En los pacientes con TFGe entre 30 y 40ml/min/1,73 m2, debe hacerse un seguimiento más estricto de la función renal y los electrólitos séricos. 2. En este grupo debe prestarse especial atención al seguimiento regular del potasio sérico. 3. Se prefieren los INRA a los IECA, ya que ello permite una optimización del tratamiento más rápida; sin embargo, los IECA pueden ser una alternativa, en especial si los INRA están contraindicados; un cuarto de dosis del INRA sacubitrilo-valsartán corresponde a 24/26mg 2 veces al día y media dosis corresponde a 49/51mg 2 veces al día. 4. Para los pacientes con taquicardia ventricular o extrasístoles ventriculares, debe preferirse un BB a un IECA como primer paso; es preciso tener precaución con los pacientes con una PA muy baja o inestabilidad clínica. 5. El ajuste de la dosis no debe considerarse definitivo, y es preciso volver a evaluar la medicación en cada visita de seguimiento, en función del estado de salud general del paciente; es preciso intentar el tratamiento médico según las guías incluso en los pacientes cuya fracción de eyección ha mejorado después del tratamiento. ARM: antagonistas del receptor de mineralocorticoides; BB: bloqueadores beta; EA: eventos adversos; FC: frecuencia cardiaca; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; INRA: inhibidor de la neprilisina y el receptor de la angiotensina; iSGLT2: inhibidores del cotransportador de sodio-glucosa 2; PA: presión arterial; TFGe: tasa de filtrado glomerular estimada; TV: taquicardia ventricular.
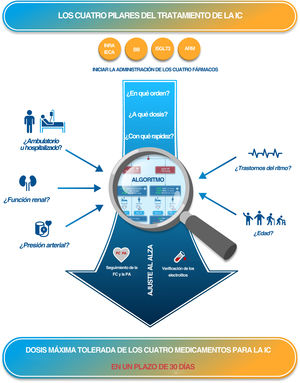
Figura central. Propuesta de algoritmo para la introducción y la optimización de las 4 medicaciones del tratamiento médico según las guías, basada en los factores que influyen en la tolerabilidad de los fármacos y en aportar recomendaciones para el seguimiento y el ajuste para alcanzar una posología óptima en un plazo de 30 días. ARM: antagonistas del receptor de mineralocorticoides; BB: bloqueadores beta; FC: frecuencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; INRA: inhibidor de la neprilisina el receptor de la angiotensina; iSGLT2: inhibidor del cotransportador de sodio-glucosa 2; PA: presión arterial.
Los principios que subyacen a este algoritmo (figura 2) son:
- a)
Asegurar que la administración de las 4 clases de TMSG recomendadas se inicie lo antes posible para establecer un tratamiento eficaz aunque sea a una dosis baja. Esto se considera preferible a iniciar un menor número de medicaciones a una dosis máxima, y en un metanálisis en red21 se ha observado que es la estrategia más eficaz.
- b)
Asegurar que los intervalos entre los inicios de las diferentes medicaciones y entre los diferentes pasos de ajuste de la dosis sean lo más breves posible, en consonancia con el objetivo de garantizar la seguridad del paciente. Nuevamente, en el ensayo STRONG-HF25 se ha observado que un ajuste rápido aporta ventajas en cuanto a la mortalidad.
- c)
Asegurarse de que el tiempo transcurrido entre el inicio del primer tratamiento y el momento en que se alcanza la dosis pretendida de los 4 componentes del TMSG4 no supere los 30 días y que el paciente esté estabilizado con la administración de una medicación óptima en el plazo de 2 meses.
El algoritmo propuesto es de carácter general y se ha elaborado para su uso en todos los pacientes con IC, excepto 2 poblaciones específicas que pueden requerir estrategias de tratamiento diferentes. Las necesidades de estos pacientes se abordan por separado a continuación. Se trata de los siguientes:
- a)
Pacientes de edad > 75 años que presentan fragilidad (definida por una puntuación de la Triage Risk Screening Tool [TRST] ≥ 2)37,38.
- b)
Pacientes con determinados trastornos del ritmo cardiaco.
El algoritmo propone vías de tratamiento específicas en función del número de clases de fármacos para la IC que se emplean actualmente, de si el paciente está hospitalizado o no y de la presencia de una presión arterial baja (presión arterial sistólica <100mmHg) o un deterioro de la función renal (tasa de filtrado glomerular estimada [TFGe] <30ml/min/1,73 m2).
Tratamiento de los pacientes mayores de 75 añosLa prevalencia de la IC aumenta rápidamente con la edad, hasta afectar a un 15-20% de las personas de edad ≥ 80 años39. En estos pacientes es más probable la aparición de eventos adversos con la medicación, es probable que estén ya polimedicados y tienen factores pronósticos desfavorables, como insuficiencia renal, trastornos cognitivos, riesgo de caídas y desnutrición. Estos factores deben tenerse en cuenta a la hora de decidir cómo optimizar el tratamiento de estos pacientes. Además, la fragilidad es muy frecuente en las personas mayores con IC (45%)40, lo cual aumenta el riesgo de mortalidad y hospitalizaciones41.
En todos los pacientes mayores de 75 años se debe evaluar la fragilidad mediante escalas de fragilidad validadas. Nosotros recomendamos el empleo del instrumento TRST38, que es una prueba muy sencilla y rápida que incluye múltiples dimensiones de la fragilidad. Hace poco un grupo de consenso de cardiología-geriatría ha propuesto el uso de la TRST como instrumento de cribado de la fragilidad en el ámbito de la cardiología37. Debe considerarse que los pacientes con una puntuación de la TRST ≥ 2 presentan fragilidad y se debe tratarlos de manera más conservadora. Sin embargo, también pueden usarse otras escalas de la fragilidad, como la FRAIL42, la Clinical Frailty Score43 o los criterios de Fried44, aunque estas escalas abarcan menos dimensiones de la fragilidad que la TRST.
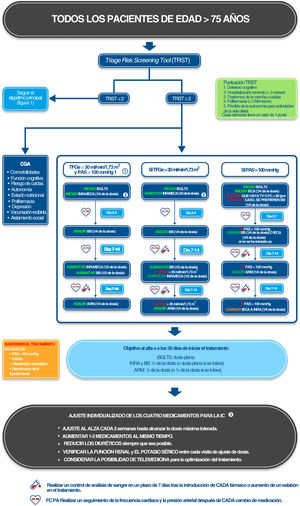
En los pacientes frágiles, la escalada del tratamiento debe ser más gradual que la propuesta en el algoritmo general de tratamiento de la IC. Las dosis iniciales de todas las clases de fármacos deben ser un cuarto de la dosis plena, con la excepción de los iSLGT2, que pueden administrarse a dosis plenas. El intervalo entre cada cambio de la medicación debe prolongarse hasta 1 o 2 semanas, y el aumento de la dosis debe ser incremental en pasos de un cuarto de la dosis. La dosis final de todas las medicaciones estará con más frecuencia por debajo de las dosis pretendidas que se suelen especificar en las guías de tratamiento para todos los fármacos, excepto los iSGLT2. No obstante, siempre que sea posible, debe intentarse el incremento de la dosis hasta la máxima tolerada. En la figura 3 se presenta un algoritmo que ilustra las secuencias propuestas para la escalada del tratamiento de los pacientes frágiles mayores de 75 años en función de sus valores basales de presión arterial y función renal.
Algoritmo de tratamiento propuesto para los pacientes mayores de 75 años con insuficiencia cardiaca. 1. En los pacientes con una TFGe entre 30 y 40ml/min/1,73 m2, se debe hacer un seguimiento más estricto de la función renal y los electrólitos séricos. 2. Se prefieren los INRA a los IECA, ya que ello permite una optimización del tratamiento más rápida; sin embargo, los IECA pueden ser una alternativa, en especial si los INRA están contraindicados; un cuarto de dosis del INRA sacubitrilo-valsartán corresponde a 24/26mg 2 veces al día y media dosis, a 49/51mg 2 veces al día. 3. El ajuste de la dosis no debe considerarse definitivo, y es preciso volver a evaluar la medicación en cada visita de seguimiento, en función del estado de salud general del paciente; es preciso intentar el tratamiento médico según las guías incluso en los pacientes cuya fracción de eyección ha mejorado después del tratamiento. ARM: antagonistas del receptor de mineralocorticoides; BB: bloqueadores beta; CGA: evaluación geriátrica exhaustiva; FC: frecuencia cardiaca; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; INRA: inhibidores de la neprilisina y el receptor de la angiotensina; iSGLT2: inhibidores del cotransportador de sodio-glucosa 2; PAS: presión arterial sistólica; TFGe: tasa de filtrado glomerular estimada; TRST: Triage Risk Screening Tool; TV: taquicardia ventricular.
Además, la presencia de fragilidad debe llevar a la puesta en marcha del control de las comorbilidades y los síndromes geriátricos a través de una evaluación geriátrica completa37,45. Esta evaluación multidimensional debe tener en cuenta las comorbilidades, la función cognitiva, la autonomía, los trastornos de la marcha, el riesgo de caídas, el estado nutricional, la depresión, la polifarmacia, las vacunaciones (en especial las de la gripe, el neumococo y la COVID-19) y el aislamiento social37,45. Se ha observado que este abordaje multidisciplinario reduce la mortalidad de los pacientes de edad avanzada con IC45. Es preciso abordar con prontitud toda posible necesidad médica detectada durante esta evaluación en paralelo con el tratamiento de la IC. Siempre que ello sea apropiado, se deberá tratar las comorbilidades específicas, se ofrecerá ayuda domiciliaria (enfermería y asistencia social) y estimulación cognitiva, y se proporcionará una actividad física adaptada, así como fisioterapia o psicoterapia según las necesidades. Deben verificarse las medicaciones y las vacunas administradas, y se proporcionarán suplementos de vitamina D, suplementos alimenticios orales y tratamiento antidepresivo si está justificado. Por último, debe evaluarse el entorno del paciente.
Tratamiento de los pacientes con trastornos del ritmo cardiacoLas alteraciones del ritmo cardiaco, como las arritmias supraventriculares y ventriculares, la bradicardia y los trastornos de la conducción (principalmente el bloqueo de rama izquierda del haz de His) son frecuentes en los pacientes con IC, y contribuyen a producir el aumento de mortalidad y morbilidad en estos pacientes4. Por estas razones, es importante asegurar que se realice un estudio diagnóstico específico para los trastornos del ritmo y que se aplique el tratamiento apropiado a todos los pacientes a los que se diagnostica una IC. Los trastornos del ritmo asociados pueden tener repercusiones en la estrategia de ajuste del tratamiento, ya que, para los pacientes con taquicardia ventricular o extrasístoles ventriculares, los BB deben introducirse como primer paso del tratamiento, con preferencia a los IECA o los INRA, dados sus efectos favorables en el control de la frecuencia cardiaca.
Además, según la guía de práctica clínica de la ESC4, la decisión de implantar un desfibrilador automático implantable debe tomarse después de haber optimizado la medicación en todos los pacientes con una IC sintomática (clase II-III de la New York Heart Association [NYHA]) y fracción de eyección del ventrículo izquierdo (FEVI) ≤ 35% con miocardiopatía isquémica (recomendación de clase I A) o miocardiopatía no isquémica (clase IIa A). Es aconsejable un inicio rápido de la medicación para la IC para asegurar una aplicación oportuna del desfibrilador automático implantable en los pacientes cuya FEVI se mantiene en valores ≤ 35%. Para los pacientes con IC, QRS ancho y trastornos de la conducción, debe considerarse la posible conveniencia de una terapia de resincronización cardiaca, y el nivel de las recomendaciones depende de la anchura del QRS y el tipo de trastornos de la conducción (presencia o ausencia de bloqueo de rama izquierda del haz de His)4.
La fibrilación auricular (FA) es una comorbilidad frecuente en los pacientes con IC y su prevalencia aumenta con la gravedad de la IC46. Alrededor de la mitad de los pacientes con IC ya tienen una FA preexistente en el momento del diagnóstico de la IC o la sufren más adelante47. La comorbilidad de FA puede agravar la IC subyacente48, por ejemplo a causa de la aparición de una miocardiopatía mediada por la taquicardia, que causa un deterioro de la contractilidad ventricular46. A los pacientes con FA se les debe proponer una cardioversión y el empleo de medicamentos antiarrítmicos (limitados a la amiodarona en los pacientes con FEVI reducida) o la ablación percutánea. Se ha observado que esta última es más eficaz para reducir el riesgo de agravamiento de la IC49.
ORGANIZACIÓN DE LA ASISTENCIA SANITARIAUna vez iniciada la administración de las 4 clases de TMSG, será necesario optimizar las dosis en un entorno ambulatorio, así como un seguimiento regular, con ajustes en caso necesario para evitar las exacerbaciones que pueden resultar mortales y que por lo general requieren una nueva hospitalización.
Después del alta hospitalaria tras un episodio de agravamiento de la IC, los pacientes pasan a estar en un periodo vulnerable, durante el cual se recomienda el empleo de programas de transición para evitar reingresos tempranos por IC50. En la actualidad está en marcha un ensayo clínico aleatorizado para documentar la efectividad de estos programas51.
Sin embargo, la mayoría de los pacientes con IC no son objeto de un seguimiento inmediato, cuando todavía tienen un riesgo elevado52. La fase de optimización de la dosis es crucial y se recomienda proporcionar unas instrucciones detalladas sobre su aplicación en el informe de alta entregado a los pacientes que regresan a su domicilio tras la hospitalización52. Sin un seguimiento específico, es posible que la optimización del tratamiento no se aplique correctamente, con lo que habrá un efecto en el pronóstico a largo plazo más nocivo que el que se da cuando los tratamientos se han introducido en la situación inicial. Lamentablemente, a muchos de los pacientes dados de alta del hospital no se les administra nunca una pauta de tratamiento optimizada debido a la inercia del sistema11,52–56. Establecer un seguimiento estructurado después del alta es crucial, de ser posible a través de un programa específico para la enfermedad57,58. El personal de enfermería de IC con capacitación y dedicación específicas suele ser la piedra angular de la optimización rápida del tratamiento, ya que puede ajustar las dosis de los fármacos para la IC, proporcionar formación sanitaria sobre el tratamiento, asegurar un contacto personalizado con el paciente e identificar todo posible signo temprano de deterioro. En un reciente ensayo clínico aleatorizado en el que se evaluó el papel del personal de enfermería en el ajuste al alza de la medicación para la IC, el personal de enfermería de IC alcanzó unas dosis de BB y IECA en un periodo de 4 meses más altas que las obtenidas por los cardiólogos de IC, principalmente debido a su mayor capacidad de ver al paciente con mucha más frecuencia59. Además, se ha observado que el tratamiento multidisciplinario con la participación de una enfermera dedicada específicamente a la IC mejora la adherencia a las guías de práctica clínica60 y también los resultados clínicos61.
Los programas de telemedicina pueden ser de especial utilidad para garantizar que se realizan las modificaciones oportunas del tratamiento u otras intervenciones en el caso de que se produzca un deterioro del estado del paciente62-64. Sin embargo, es posible que la telemedicina no sea apropiada para todos los pacientes, en especial los que presentan deterioro cognitivo o mala adherencia.
Después de un episodio de descompensación aguda, la rehabilitación cardiaca mediante entrenamiento de ejercicio, combinada con apoyo psicosocial y asesoramiento dietético, es útil para reducir el riesgo de una nueva hospitalización65. En la actualidad, es insuficiente la derivación de los pacientes a centros de rehabilitación cardiaca desde la asistencia ambulatoria66.
En la atención primaria, los retrasos en la derivación a los especialistas en IC, el escaso tiempo de visita y la falta de comunicación entre los profesionales de la salud pueden conducir a una aplicación insuficiente del tratamiento óptimo y a un seguimiento inadecuado67. Para evitar un enfoque compartimentado de la asistencia ambulatoria a los pacientes con IC, es esencial un tratamiento multidisciplinario en el que participen una enfermera específica de IC y los cardiólogos tanto hospitalarios como de la atención ambulatoria. Para conseguirlo, es crucial la formación de los profesionales de la asistencia sanitaria, y el aporte de un conocimiento médico experto online podría ser un medio potente para facilitar que los centros de excelencia en el tratamiento de la IC lleguen a los profesionales de la salud del entorno ambulatorio.
Es importante resaltar que existen diferencias claras en la organización de la asistencia de los pacientes con IC entre regiones y países dicersos, y que es necesario tenerlas en cuenta al considerar las posibles formas de optimizar las vías de tratamiento. Sin embargo, también es responsabilidad de los encargados de las decisiones a escala nacional garantizar que se pueda ofrecer la mejor calidad de la asistencia a todos los pacientes y que se reduzcan al mínimo las desigualdades en su prestación.
CONCLUSIONESEn este artículo de posicionamiento se propone un algoritmo pragmático para la aplicación y la optimización del TMSG para la IC-FEr. Creemos que la introducción secuencial y el ajuste de las dosis de estos 4 pilares del tratamiento de la IC en un plazo de 2 meses tras una agudización de una IC preexistente o un diagnóstico reciente pueden alcanzarse de manera ordinaria con la mayoría de los pacientes con IC. Este debe ser el objetivo de nuestro tratamiento y hay que hacer todo lo posible por alcanzarlo. El algoritmo propuesto deberá ayudar a los médicos hospitalarios y de la asistencia ambulatoria a alcanzar este objetivo en la práctica cotidiana.
FINANCIACIÓNNinguna.
CONTRIBUCIÓN DE LOS AUTORESN. G irerd y F. Roubille coordinaron el manuscrito. N. Girerd, C. Leclercq, O. Hanon y F. Roubille redactaron la versión inicial de partes del manuscrito. N. Girerd, C. Leclercq, O. Hanon, A. Bayés-Genís, J.L. Januzzi, T. Damy, B. Lequeux, C. Meune, P. Sabouret y F. Roubille aportaron una revisión crítica y modificaciones de la versión inicial.
CONFLICTO DE INTERESESF. Roubille declara haber recibido subvenciones y pagos personales de Air Liquide, Abbott, AstraZeneca, Bayer, Boehringer, Novartis, Pfizer, Servier y Vifor; B. Lequeux declara haber recibido pagos personales de Bayer, Boehringer, Microport, Novartis, Pfizer y Vifor; C. Leclercq declara haber recibido pagos personales de Novartis, Medtronic, Biotronik, Microport y Abbott; C. Meune declara haber recibido subvenciones y pagos personales de AstraZeneca, Novartis, Vifor y Roche Diagnostics; T. Damy declara haber recibido subvenciones y pagos personales de Novartis, Vifor, Resmed, Pfizer, Alnylam, Ionsis, Akcea, GSK y Prothena; O. Hanon declara haber recibido pagos personales de AstraZeneca, Bayer, BMS, Boehringer Ingelheim, Leo Pharma, Medtronic, Novartis, Pfizer, Sanofi, Servier y Vifor; P. Sabouret declara haber recibido pagos personales de AstraZeneca, Bayer, BMS, Boehringer Ingelheim, Daiichi Sankyo, Eli Lilly, Medtronic, MSD, Novartis, Servier, Sanofi y Vifor Pharma, y tiene otras relaciones de interés con Minerva Cardiology Angiology, Archives of Medical Science y Frontiers in Cardiovascular Medicine; N. Girerd ha recibido pagos personales de AstraZeneca, Bayer, Boehringer, Lilly, Novartis, Pfizer y Vifor; A. Bayés-Genís declara haber recibido pagos personales de Abbott, Novartis, Vifor, Roche Diagnostics, Critical Diagnostics y AstraZeneca y subvenciones, pagos personales y apoyo no económico de Boehringer Ingelheim; J. Januzzi es consejero del American College of Cardiology; forma parte del consejo de Imbria Pharmaceuticals; ha recibido subvenciones de Applied Therapeutics, Innolife, Novartis Pharmaceuticals y Abbott Diagnostics; ha recibido ingresos por consultoría de Abbott, Janssen, Novartis y Roche Diagnostics, y ha participado en comités de variables de valoración-consejos de vigilancia de seguridad de Abbott, AbbVie, Amgen, Bayer, CVRx, Janssen, MyoKardia y Takeda.
Damos las gracias a Adam Doble PhD (SARL Foxymed, Francia) por su ayuda en la preparación del manuscrito y agradecemos el apoyo técnico de Novartis para las ilustraciones.
El manuscrito cuenta también con el aval del Grupo de Trabajo sobre Insuficiencia Cardiaca de la Sociedad Francesa de Cardiología.