Las guías actuales de práctica clínica recomiendan la doble terapia antiagregante con aspirina y clopidogrel en los pacientes con síndrome coronario agudo. La eficacia del clopidogrel se ve limitada por la lenta y variable transformación del profármaco en metabolito activo, una modesta y variable inhibición plaquetaria, el incremento del riesgo de sangrado y el mayor riesgo de trombosis de stent e infarto agudo de miocardio en los pacientes con pobre respuesta. Tres nuevos inhibidores del receptor P2Y12 han mostrado una inhibición plaquetaria mayor y más rápida que la del clopidogrel.
El prasugrel, una nueva tienopiridina, muestra beneficio clínico neto sobre el clopidogrel en pacientes con síndrome coronario agudo sometidos a intervencionismo coronario. El ticagrelor, inhibidor oral directo, produce una disminución en la mortalidad y el infarto de miocardio sin incremento del sangrado en un amplio espectro de pacientes con síndrome coronario agudo. Por el contrario, el cangrelor, potente inhibidor intravenoso, no ha mostrado el beneficio esperado.
La incorporación de prasugrel y ticagrelor a la práctica clínica implica un cambio importante en el manejo de estos pacientes.
Palabras clave
La identificación del síndrome coronario agudo (SCA) como un proceso aterotrombótico ha dado un papel predominante a las plaquetas en la enfermedad cardiovascular. La eficacia de la antiagregación plaquetaria en la prevención y el tratamiento de las enfermedades cardiovasculares es un hecho establecido y comprobado en numerosos estudios1. Las guías de práctica clínica recomiendan la doble terapia antiagregante con aspirina y clopidogrel durante 12 meses como tratamiento estándar para la prevención de complicaciones trombóticas en los pacientes con SCA2,3. Sin embargo, la eficacia del clopidogrel se ve limitada por la lenta y variable transformación del profármaco en metabolito activo, una modesta y variable inhibición plaquetaria, la irreversibilidad de acción, el incremento del riesgo de sangrado y el mayor riesgo de trombosis del stent e infarto agudo de miocardio (IAM), quedando un riesgo trombótico residual en los pacientes con respuesta pobre.
En los últimos años se ha investigado ampliamente en la identificación de nuevas dianas terapéuticas plaquetarias y en el desarrollo de nuevos fármacos antiagregantes más potentes, eficaces y seguros. Dicha investigación se encuentra en distintas fases de desarrollo y algunos fármacos como prasugrel y ticagrelor han demostrado ya en estudios de fase 3 ser más potentes, produciendo una más rápida y mayor inhibición plaquetar que el clopidogrel.
La incorporación de estos nuevos antiagregantes a la práctica clínica cambiará necesariamente de forma importante el manejo terapéutico actual de los pacientes con SCA. Su disponibilidad implica, además, una actualización en las guías de práctica clínica con nuevas recomendaciones de tratamiento de estos pacientes.
El presente trabajo tiene como objetivo estudiar las evidencias actualmente disponibles sobre los nuevos antiagregantes, valorar las ventajas clínicas que se desprenden de los mencionados fármacos y aventurar el lugar y las indicaciones que ocuparán en la terapia antiplaquetaria actual del SCA.
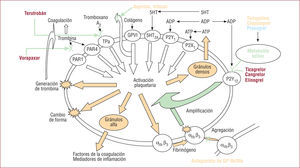
NUEVAS DIANAS TERAPÉUTICAS Y FÁRMACOS ANTIAGREGANTESActualmente la investigación sobre identificación de nuevas dianas terapéuticas plaquetarias y sus correspondientes fármacos antiagregantes se encuentra en distintas fases de desarrollo. En la figura 1 podemos identificar los receptores implicados en la adhesión, activación y agregación plaquetaria. Asimismo podemos visualizar los puntos de inhibición de los tres grupos de antiagregantes clásicos, la identificación de nuevas dianas terapéuticas y fármacos antiplaquetarios correspondientes4.
Receptores plaquetarios y sus inhibidores. Nuevas dianas terapéuticas y fármacos antiplaquetarios. αllb β3: glucoproteína (GB) Ilb/IIIa; 5HT2A: receptor del 5HT (hidoxitriptófano); ADP: adenosindifosfato; ATP: adenosintrifosfato; GPVI: proteína GVI activada por colágeno; P2X1: receptor de ATP; P2Y12, P2Y1: receptores de ADP; PAR1, PAR4: receptores de la trombina. Reproducida con permiso de Storey4.
Básicamente son tres los puntos de investigación y grupos de fármacos (tabla 1):
- 1.
lnhibidores de los receptores de tromboxano/ prostaciclina. Estos fármacos bloquean la agregación plaquetaria que se produce en respuesta no sólo al tromboxano A2 (TXA2), sino a los prostanoides, por lo que el efecto antiagregante esperado es mayor que el de la aspirina. Del grupo de fármacos inicial, sólo queda en desarrollo e investigación un fármaco oral, el terutrobán (S18886), pero no existe en la actualidad ningún estudio en fase 3 en SCA con este fármaco.
- 2.
Inhibidores del PAR1. La trombina es el más potente activador de las plaquetas. El PAR1 es el principal receptor plaquetario para la trombina en humanos. En este grupo tenemos en desarrollo fundamentalmente un fármaco oral, el vorapaxar (SCH 530348), que se une selectivamente a PAR1. Conocemos los resultados del estudio de fase 2 TRA-PCI, muy prometedores5. Efectivamente, en este estudio el SCH 530348 alcanzó el objetivo primario y se demostró que no aumenta las hemorragias mayores o menores cuando se añade a aspirina y clopidogrel en pacientes con intervencionismo coronario percutáneo (ICP). Además, se confirmó una tendencia no estadísticamente significativa a la disminución de los eventos cardiovasculares cuando se empleaba la dosis mayor del fármaco testado. Disponemos actualmente de dos estudios en marcha de fase 3 con este fármaco, el TRA-CER y TRA 2P-TIMI 506,7. El primero tiene como objetivo incluir a 10.000 pacientes con SCA sin elevación del ST (SCASEST) y comparar la triple terapia antiagregante, aspirina, clopidogrel y vorapaxar con la doble terapia estándar más placebo. El objetivo primario combinado es muerte cardiovascular, IAM, rehospitalización por SCA, revascularización coronaria urgente o ictus. En el segundo, cuyo periodo de inclusión ha terminado, se ha reclutado a 26.000 pacientes con IAM, ictus o enfermedad vascular periférica previos y se comparan los dos mismos regímenes terapéuticos que en el primer estudio con el objetivo primario de muerte cardiovascular, IAM, revascularización urgente o ictus.
- 3.
Inhibidores del receptor de ADP P2Y12. Este receptor es el mayor de este tipo en la superficie de la plaqueta. El clopidogrel lo inhibe en cuantía variable en los distintos pacientes y muchos de ellos son incluso resistentes o responden escasamente. De ahí la intensa investigación para desarrollar nuevos antiagregantes de este grupo. En la actualidad tenemos tres nuevos inhibidores del P2Y12 bien desarrollados: prasugrel, ya disponible, ticagrelor y cangrelor, y un cuarto, elinogrel, del que se han comunicado en el último Congreso Europeo de Cardiología de 2010 los resultados prometedores del estudio en fase 2 INNOVATE PCI8. Hay resultados positivos de ensayos en fase 3 con prasugrel y ticagrelor que demuestran mayor eficacia de ambos con respecto a clopidogrel en pacientes con SCA. Por el contrario, se han suspendido los estudios CHAMPION-PCI y CHAMPION-PLATFORM9,10 con cangrelor al no conseguir demostrar la mayor eficacia esperada al añadir este fármaco al clopidogrel en los pacientes con SCA sometidos a ICP. No obstante, no se ha abandonado la investigación con este fármaco y se ha diseñado recientemente el estudio BRIDGE11 con intención de demostrar el beneficio de cangrelor en la sustitución de clopidogrel en pacientes que van a someterse a cirugía de bypass aortocoronario (CABG). Por otra parte, se ha desarrollado una línea de investigación con cilostazol, un inhibidor oral de la fosfodiesterasa III plaquetaria, que produce, además del efecto antiagregante, una clara inhibición de la proliferación de la neoíntima vascular. Estos efectos confieren al cilostazol un especial interés como tratamiento adyuvante de la doble terapia antiagregante en los pacientes con implantación de un stent recubierto. Una revisión sistemática de los ensayos clínicos de cilostazol en pacientes sometidos a ICP demuestra que este fármaco es efectivo y seguro en reducir el riesgo de reestenosis y la necesidad de repetir revascularización. Sin embargo, esta evidencia está muy limitada por el tamaño de los estudios y se precisan ensayos importantes en fase 3 para establecer definitivamente sus indicaciones12. En este sentido, el estudio CILON-T, presentado recientemente en el ACC de marzo, no ha demostrado beneficio de la triple terapia antiagregante, aspirina, clopidogrel y cilostazol tras implantación de stent farmacoactivo en disminuir el objetivo clínico primario pese a mejorar la reactividad plaquetaria tras el tratamiento13. Por último, se están desarrollando a nivel experimental básico, y todavía sin resultados preliminares de estudios en fase 1 o 2, otros posibles candidatos terapéuticos, como dadores de óxido nítrico, antagonistas específicos de la adhesión plaquetaria y bloqueadores de receptores del GAS 614.
Nuevas dianas terapéuticas plaquetarias y fármacos antiagregantes en distintas fases de desarrollo en SCA. Estudios en fase 3
| Receptor | Inhibidor | Estudios en fase 3 |
| TXA/PG | Terutrobán (S18886) | Ningún estudio en marcha |
| PAR1 | Vorapaxar (SCH 530348) | TRA-CER y TRA 2P-TIMI 50 en marcha |
| P2Y12 | Prasugrel | TRITON-TIMI 38 finalizado, TRILOGY en marcha |
| Ticagrelor | PLATO, finalizado | |
| Cangrelor | CHAMPION PCI y PLATFORM, suspendidos; BRIDGE activo | |
| Elinogrel | Se va a iniciar estudio en fase 3 tras INNOVATE PCI |
ADP: adenosindifosfato; P2Y12: principal receptor de ADP en la plaqueta; PAR1: principal receptor plaquetario para la trombina en humanos; SCA: síndrome coronario agudo; TXA/PC: receptor de tromboxano/prostaciclina.
Analizaremos a continuación detalladamente las evidencias disponibles sobre los nuevos antiagregantes, prasugrel, cangrelor y ticagrelor.
NUEVOS INHIBIDORES DEL RECEPTOR DE ADP P2Y12PrasugrelFarmacocinéticaEl prasugrel es una nueva tionopiridina y, como el clopidogrel, un profármaco, pero, a diferencia de este, muestra una rápida y casi completa absorción tras la ingestión oral de su dosis de carga. Se metaboliza a continuación a su forma activa, la cual se une irreversiblemente al receptor de ADP P2Y12 de las plaquetas durante toda la vida de estas. La consecuencia es la inhibición de la activación plaquetaria y la posterior disminución de la agregación de las plaquetas.
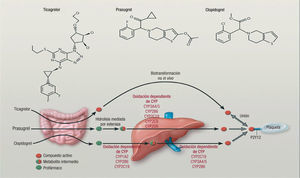
El metabolito activo se origina por hidrolisis mediada por la carboxilesterasa intestinal y la ulterior oxidación por la enzima citocromo P-450 intestinal y hepática. En la figura 2 puede verse que el prasugrel se metaboliza de forma más efectiva que el clopidogrel, lo cual le confiere mayor efecto antiagregante y menor variabilidad en la respuesta plaquetaria, al ser mayor la cantidad de metabolito activo que llega a las plaquetas15. Polimorfismos genéticos que afectan a la enzima citocromo P-450 pueden explicar algunas de las diferencias entre el metabolismo del clopidogrel y el del prasugrel.
Biotransformación y modo de actuación de clopidogrel, prasugrel y ticagrelor. El ticagrelor, una ciclopentiltriazolopiridina, se absorbe rápidamente en el intestino. El fármaco absorbido no requiere transformación para estar activo. Se une de forma directa y reversible al receptor de ADP P2Y12. Las tienopiridinas clopidogrel y prasugrel son profármacos. Sus metabolitos activos se unen de forma irreversible al P2Y12 durante toda la vida de la plaqueta. El clopidogrel, tras su absorción intestinal, requiere dos pasos oxidativos mediados por sendas enzimas citocromo P-450 (CYP) para generar el metabolito activo. Tras la absorción intestinal, el prasugrel es rápidamente hidrolizado por una esterasa a un metabolito intermedio. Por último, requiere un paso oxidativo más, mediante un CYP para generar el metabolito activo. La mayor parte de la activación mediada por CYP tiene lugar en el hígado. Se observan también en la figura otras relevantes isoenzimas CYP que intervienen en la activación de clopidogrel y prasugrel. Esta actividad puede afectarse por polimorfismos genéticos. Reproducida con permiso de Schömig15.13.608 SCA & IC
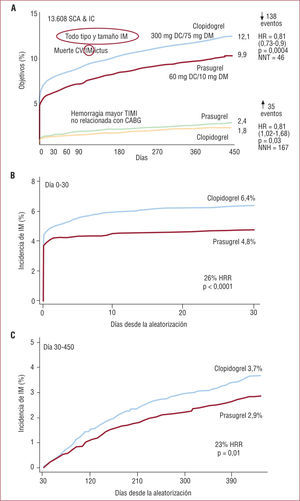
El estudio en fase 2 JUMBO-TIMI 26 de búsqueda de dosis adecuada de prasugrel demostró similar incidencia de sangrados, con tendencia a una mejor eficacia del prasugrel frente al clopidogrel. Este estudio constituyó el antecedente del estudio en fase 3 TRITON-TIMI 38. En él se incluyó a 13.608 pacientes con SCA de moderado-alto riesgo, con ICP programado y se los aleatorizó a recibir prasugrel, 60mg de dosis de carga, seguida de 10mg diarios como dosis de mantenimiento, o clopidogrel, 300mg de dosis de carga seguida de una dosis de mantenimeinto de 75mg al día, durante 6 a 15 meses. El objetivo primario de eficacia era el combinado de muerte cardiovascular, IAM no fatal o ictus. El objetivo primario de seguridad era el sangrado mayor.
El prasugrel mostró un beneficio clínico neto sobre el clopidogrel16 (fig. 3). Así, el objetivo primario de eficacia ocurrió en el 9,9% de los pacientes con prasugrel frente al 12,1% de los pacientes que recibieron clopidogrel (riesgo relativo [RR]=0,81; intervalo de confianza [IC] del 95%, 0,73-0,9; p<0,001), reducción en RR del 19%, con un número de pacientes que es necesario tratar (NNT)=46. La hemorragia mayor ocurrió en el 2,4% de los pacientes con prasugrel frente al 1,8% de los pacientes con clopidogrel (RR=1,32; IC del 95%, 1,03-1,68; p<0,03), NNT=167. El prasugrel disminuyó significativamente el riesgo de IAM nuevo o recurrente (el 7,4 frente al 9,7%; p<0,001), espontáneo o relacionado con el ICP, de tamaño grande o pequeño, incluyendo los producidos durante el periodo de mantenimiento17 y la trombosis del stent (el 1,1 frente al 2,4%; p<0,001) comparado con clopidogrel. Este beneficio se mantuvo durante todo el periodo de seguimiento. Sin embargo, se comprobó un incremento del sangrado mayor, incluido el sangrado fatal (el 0,4 frente al 0,1%; p<0,002). La mortalidad total y el ictus no difirieron significativamente entre los dos grupos de tratamiento.
El beneficio del prasugrel fue particularmente llamativo en los pacientes diabéticos, como se comenta en otro artículo, y en la cohorte de 3.534 pacientes con SCA con elevación del segmento ST (SCACEST)18. En estos, el objetivo primario disminuyó significativamente en los que recibieron prasugrel frente a clopidogrel (el 6,5 y el 9,5%; p<0,002, con una reducción del RR del 30%). En ambos casos el beneficio no se acompañó de aumento del sangrado mayor.
Cuestiones prácticas pendientes19- 1.
Aunque el estudio TRITON-TIMI 38 demostró una reducción del riesgo de IAM y trombosis del stent, se ha comprobado por otra parte un aumento del sangrado mayor, incluido un pequeño pero estadísticamente significativo incremento de la hemorragia fatal (3 episodios cada 1.000 pacientes tratados). Tres subgrupos mostraron especial predisposición al sangrado: los ancianos, los pacientes con bajo peso y los que habían tenido previamente un ictus o un accidente isquémico transitorio (AIT). En estos se identificó un incremento significativo de hemorragia intracraneal con prasugrel. Por lo tanto, se debería evitar el empleo de prasugrel en estos pacientes. Considerando la población de ancianos (≥ 75 años) y pacientes de bajo peso (< 60kg), los datos de farmacocinética indican que en estos pacientes la reducción de la dosis de prasugrel de 10 a 5mg de mantenimiento limitará el riesgo de sangrado. Debemos esperar los resultados de ensayos en fase 3, en marcha, para confirmar esta hipótesis. Además, en los ancianos se recomienda no utilizar el prasugrel, salvo que sean diabéticos o con IAM previo, en cuyo caso se empleará la mitad de la dosis.
- 2.
Un pequeño número de pacientes en el estudio TRITON-TIMI 38 fue sometido a CABG. En este grupo, la frecuencia de sangrado mayor fue 4 veces superior con prasugrel que con clopidogrel (el 13,4 frente al 3,2%). Así, la prevención de los cirujanos cardiacos para el uso de este fármaco previo a CABG es incluso mayor que con clopidogrel. Por este motivo, la estrategia de administrar sistemáticamente prasugrel en el servicio de urgencias a los pacientes con SCA sin conocer previamente la anatomía coronaria debería evitarse en los pacientes con SCASEST, al menos hasta conocer los resultados del ensayo TRILOGY, aún en marcha. Por otra parte, el aumento de sangrado observado en los pacientes con CABG indica parecido riesgo en los pacientes sometidos a cirugía no cardiaca que reciben prasugrel en los 7 días previos. Conviene realizar registros que definan claramente el riesgo de sangrado en las poblaciones que no están claramente definidas en el estudio.
- 3.
En el estudio TRITON-TIMI 38 se comprobó una reducción del 52% en la frecuencia de trombosis temprana o tardía del stent, ya sea farmacoactivo o normal. Pero debemos tener en cuenta que prasugrel no ha sido testado en intervencionismo coronario electivo.
- 4.
El estudio TRITON-TIMI 38ha demostrado beneficio de la terapia dual antiagregante más allá de los 12 meses hasta ahora establecidos, y lo amplía hasta los 15 meses. Pero sigue sin aclararse si la doble terapia antiagregante debe mantenerse indefinidamente en el SCA. Actualmente se consideran cuestiones de riesgo de sangrado y de coste para no hacerlo. Quizá nuevos antiagregantes con menor riesgo de sangrado y la aparición del clopidogrel genérico cambien esta actitud.
- 5.
Al contrario de lo referido en otros estudios con clopidogrel, un análisis retrospectivo del estudio TRITON-TIMI 38 no mostró relación entre el empleo de inhibidores de la bomba de protones (IBP) y aumento de eventos cardiovasculares.
Sin duda el prasugrel representa un avance en la terapia antiplaquetaria del SCA y un análisis riguroso del estudio TRITON-TIMI 38 avala su empleo en:
- 1.
Pacientes con SCA con alta probabilidad de ICP, sobre todo si son diabéticos, con mayor riesgo isquémico que de sangrado: SCACEST y SCASEST después de coronariografía, teniendo en cuenta que: a) en pacientes con bajo peso (< 60kg) se empleará la mitad de la dosis de mantenimiento; b) en pacientes ancianos (≥ 75 años) sólo se utilizará si tienen alto riesgo isquémico, por ejemplo si son diabéticos o ya tuvieron un IAM; c) contraindicado en pacientes con antecedentes de ictus o AIT.
- 2.
Por el momento no está recomendado el empleo de prasugrel como terapia antiagregante inicial en SCA, sobre todo sin elevación del ST.
El cangrelor es un inhibidor potente, directo y reversible del receptor plaquetario P2Y12. Es el primer fármaco de este tipo de administración intravenosa. El compuesto es un análogo de ATP, con un comienzo de acción inmediato tras su administración intravenosa en bolo, dado que tiene una vida media de 5–9min. La función plaquetaria vuelve a la normalidad en apenas 60min tras parar su administración.
Evidencias científicasLas tienopiridinas orales necesitan al menos 1h para alcanzar una inhibición plaquetaria efectiva, y una vez alcanzada, es irreversible. El comienzo de acción tardía de estos fármacos constituye una desventaja de su empleo durante la realización de ICP y la irreversibilidad de acción, por otro lado, es una desventaja en pacientes que requieren CABG, sobre todo de forma urgente. Por este motivo, en algunos centros la administración de una tienopiridina a pacientes con SCA se difiere hasta comprobar tras la coronariografía la necesidad de ICP.
En estudios preliminares en pacientes con SCA, el cangrelor demostró una inhibición plaquetaria profunda (> 95%) estable y bien tolerada durante 72h de perfusión intravenosa. Estos estudios hicieron suponer que el cangrelor podría ser un fármaco ideal para el tratamiento de estos pacientes. Con estos antecedentes, se diseñaron y se iniciaron dos estudios en fase 3, CHAMPION-PCI y CHAMPIONPLATFORM, en pacientes con SCA9,10.
En ambos se incluyó a pacientes con SCA en los que se había elegido una estrategia diferida de iniciación del tratamiento antiagregante con tienopiridina. Se compararon dos estrategias, perfusión de cangrelor seguida de toma de 600mg de clopidogrel al terminar y sólo toma de 600mg de clopidogrel. En los dos estudios se aleatorizó a los pacientes tras la realización de coronariografía siempre que esta indicara la necesidad de ICP. La única diferencia entre ambos era el tiempo de administración de los fármacos de estudio. En el CHAMPION-PCI, tanto el cangrelor como el clopidogrel se iniciaban 30min antes de ICP.
En el estudio PLATFORM, por el contrario, el cangrelor se iniciaba al comienzo del ICP y el clopidogrel se daba al finalizar el procedimiento de revascularización. El objetivo primario era el combinado de muerte por cualquier causa, IAM o revascularización por isquemia. El objetivo primario de seguridad era el sangrado mayor.
Ambos estudios pararon la inclusión de pacientes prematuramente (el 99% de los pacientes incluidos en CHAMPION-PCI y el 84% en el PLATFORM), dado que en un análisis intermedio no se demostró la hipótesis propuesta. El cangrelor no tuvo en ninguno de los dos estudios un efecto significativo en la disminución de la incidencia del objetivo primario, y aunque no se acompañó de un incremento de hemorragias mayores, sí lo hubo de sangrados menores. Podemos concluir, pues, que ambos estudios tuvieron un resultado negativo con respecto al cangrelor.
No obstante, el análisis detallado suscita una pregunta: ¿se administró el cangrelor de una forma óptima para poder demostrar las ventajas que este fármaco presenta? La respuesta probablemente sea no. En futuros estudios, debe mejorarse considerablemente el diseño: la dosis de clopidogrel 300–600mg debe darse antes del diagnóstico angiográfico, como recomiendan las guías; el análisis primario debe ser por intención de tratar (en los estudios CHAMPION se mezclaron tres tipos de análisis primario); el objetivo primario combinado debe incluir, además de los objetivos de complicaciones isquémicas, también las de sangrado (el sangrado periprocedimiento tiene el mismo pronóstico que el IAM posprocedimiento); la evaluación del objetivo primario es mejor a los 30 días y no a las 48h como en los estudios CHAMPION (pueden ocurrir sangrado y trombosis del stent mucho tiempo después de las 48h; la mayoría de los estudios realizan la evaluación a los 30 días, y esto los hace comparables); identificar claramente los criterios y las definiciones de sangrado mayor (en los estudios CHAMPION se utilizaron tres diferentes clasificaciones).
Por último, conviene dejar claro que la razón por la que se tomó la decisión de parar los estudios sin aparente relación con criterios de seguridad no es ni mucho menos clara, y no está justificado deducir detalles de los objetivos secundarios que favorecen al fármaco de estudio.
Cuestiones prácticas pendientes- 1.
Pese a que el cangrelor no ha mostrado beneficio sobre el clopidogrel en los estudios referidos, tampoco se ha mostrado inferior a él y presenta además algunas ventajas prácticas. Por ejemplo, un agente intravenoso puede ser de utilidad en pacientes con dificultad para tomar fármacos orales (pacientes intubados o que presentan un estado nauseoso). Sin embargo, está en desarrollo el elinogrel, que también puede emplearse vía intravenosa.
- 2.
Por otra parte, el cangrelor tiene la ventaja de ser reversible, lo que puede ser beneficioso en caso de que el paciente no sea susceptible de ICP, sino de CABG. En este sentido, está en marcha el estudio BRIDGE, actualmente en fase de reclutamiento, cuyo objetivo es precisamente demostrar la ventaja del cangrelor comoterapia antiplaquetaria«puente»entre la suspensión de una tienopiridina y la práctica de la cirugía.
- 3.
En la actualidad, la práctica clínica habitual es dar el clopidogrel antes del diagnóstico angiográfico. Debería realizarse un estudio con un mejor diseño de la estrategia de comparación teniendo en cuenta esta premisa. Así, lo correcto sería comparar el clopidogrel dado antes de la angiografía con el cangrelor comenzando la infusión tras la coronariografía. Con este diseño, el cangrelor eliminaría el exceso de riesgo de sangrado asociado con el clopidogrel en un 30-40% en los que el ICP no es posible y se precisa CABG con urgencia. Además, se proporciona una inhibición plaquetaria potente y rápida a los pacientes en los que sí se puede realizar ICP.
- 4.
Probablemente una duración de la infusión de cangrelor superior a las 2h de ambos estudios con una gradual reducción en la dosis proporciona una protección más prolongada y una transición más suave a un agente oral.
Por todo ello, podemos concluir que, dadas las valiosas cualidades del cangrelor, se necesitan estudios mejor diseñados que ayuden a identificar en qué situaciones está claramente indicado este fármaco y una aproximación más apropiada a su uso.
Por el momento es prematuro aventurar cuáles serían sus indicaciones, máxime cuando existen dos nuevos antiagregantes, el ticagrelor y el elinogrel, que pueden hacer innecesario su desarrollo.
TicagrelorFarmacocinéticaEl ticagrelor es un nuevo inhibidor del receptor de ADP plaquetario P2Y12. No es una tienopiridina ni un análogo del ATP, sino que pertenece al grupo químico de compuestos conocidos como ciclopentiltriazolopiridinas.
Su mecanismo de acción es único, es el primer inhibidor oral reversible del P2Y12. El nivel de inhibición refleja la concentración plasmática del compuesto. El ticagrelor no es un profármaco, inhibe el receptor P2Y12 de forma directa y dependiente de la dosis. El comienzo de la acción es muy rápido, menos de 60min, y su efecto desaparece pronto tras la retirada del fármaco. Tiene una vida media de 12h.
El ticagrelor produce una inhibición plaquetaria más rápida y mayor que el clopidogrel y con menor variabilidad. No hay prácticamente«no respondedores»a dosis elevadas. El ticagrelor tiene, sin embargo, un inconveniente práctico en la dosificación, puesto que debe administrase en dos dosis diarias.
Evidencias científicasPrimero el estudio DISPERSE y después el estudio en fase 2 de búsqueda de dosis DISPERSE-2 demostraron que el ticagrelor (AZD6140) produce inhibición de la agregación plaquetaria más precoz y mayor que el clopidogrel en pacientes con SCA. Además, el ticagrelor incrementa la agregación plaquetaria en los pacientes previamente tratados con clopidogrel. El estudio no encontró diferencias en la incidencia de sangrado entre ticagrelor y clopidogrel.
Con estos antecedentes se diseñó el estudio de fase 3 PLATO20 para determinar si el nuevo antiagregante ticagrelor es superior al clopidogrel en la prevención de complicaciones cardiovasculares en un amplio espectro de pacientes con SCA. Se incluyó a 18.624 pacientes con SCACEST e intención de ICP primario (38%) y con SCASEST e ICP o tratamiento médico (62%), y en las primeras 24h del episodio agudo se los aleatorizó a doble ciego a recibir una dosis de carga de ticagrelor de 180mg seguida de una dosis de mantenimiento de 90mg/12h o una dosis de carga de 300 o 600mg de clopidogrel seguida de una dosis de mantenimiento de 75mg/día durante 6–12 meses. El seguimiento se completó en el 99,97%, con sólo 5 pacientes perdidos. El objetivo primario de eficacia era el combinado de muerte cardiovascular, IAM e ictus a los 12 meses y el primario de seguridad, la incidencia total de hemorragia mayor utilizando una nueva clasificación propia del estudio y la ya conocida TIMI.
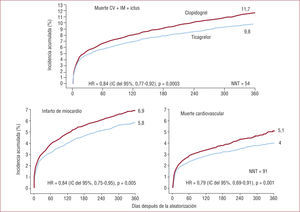
El objetivo primario de eficacia ocurrió de forma significativamente menor en el grupo de ticagrelor que en el de clopidogrel (el 9,8 y el 11,7%; RR=0,84; IC del 95%, 0,77-0,92; p<0,001), con una reducción del riesgo relativo del 16%. Ello implica que tratando a 54 pacientes consecutivos durante 12 meses con ticagrelor en lugar de con clopidogrel se previene un episodio de muerte cardiovascular, IAM o ictus. Las diferencias entre las dos terapias se produjeron en los primeros 30 días de tratamiento y se mantuvieron todo el periodo de seguimiento20.
El ticagrelor disminuyó también de forma significativa los objetivos de eficacia secundarios predefinidos como la muerte cardiovascular (el 4 frente al 5,1%; RR=0,79; IC del 95%, 0,69-0,91; p=0,001) o el infarto de miocardio (el 5,8 frente al 6,9%; RR=0,84; IC del 95%, 0,75-0,95; p=0,005) (fig. 4). Sin embargo, no hubo diferencias significativas en la incidencia de ictus entre los dos grupos de tratamiento. La incidencia de trombosis definitiva del stent fue menor con ticagrelor que con clopidogrel (1,3 frente a 1,9; RR=0,67; IC del 95%, 0,5-0,91; p<0,009). Asimismo, la mortalidad por cualquier causa disminuyó significativamente con ticagrelor (el 4,5 frente al 5,9%; p<0,001), lo que implica una disminución absoluta de la mortalidad total del 1,4% y una reducción del RR del 22%.
Estudio PLATO. Objetivos de eficacia primarios y secundarios. Reproducida con permiso de Wallentin et al20.
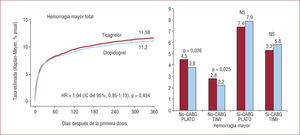
No hubo diferencias significativas en la incidencia de hemorragias mayores, tanto utilizando la definición del PLATO como la más ampliamente utilizada clasificación TIMI (fig. 5). Sin embargo, en el grupo de ticagrelor hubo mayor incidencia de hemorragias no relacionadas con la CABG (el 4,5 frente al 3,8%; p=0,03), incluidas las hemorragias fatales intracraneales (el 0,1 frente al 0,01%; p=0,02).
Objetivo primario de seguridad del estudio PLATO. No-CABG/Sí-CABG PLATO: hemorragia mayor no/sí relacionada con la cirugía de bypass coronario según definición del estudio PLATO; No-CABG/Sí-CABG TIMI: hemorragia mayor no/sí relacionada con la cirugía de bypass coronario según definición del estudio TIMI. Reproducida con permiso de Wallentin et al20.
El hallazgo más significativo del estudio es la reducción de la mortalidad total con ticagrelor, hecho que no habíamos visto con un nuevo antiagregante desde hace 20 años. Además, los beneficios del ticagrelor sobre el clopidogrel son persistentes. Por cada 1.000 pacientes ingresados por SCA, el empleo de ticagrelor en lugar de clopidogrel durante 1 año lleva a que se produzcan 14 muertes menos, 11 IAM menos y 8 trombosis del stent menos, sin un incremento en el sangrado mayor.
Los resultados del subanálisis de la cohorte de 8.430 pacientes con SCACEST e intención de ICP primario demuestran también la ventaja del ticagrelor sobre el clopidogrel. Así, el objetivo primario de eficacia disminuyó significativamente un 15% con ticagrelor (el 9,3 frente al 11%; RR=0,85; p<0,02) sin incremento en sangrado mayor, resultando un NNT de 59. La incidencia de trombosis definitiva del stent fue significativamente menor con ticagrelor que con clopidogrel (el 1,6 y el 2,5%; p<0,01) y la mortalidad total disminuyó un 18% (p=0,04).
Lo mismo ocurre con los 13.408 pacientes del estudio PLATO en los que se planificó estategia invasiva tanto en SCACEST como en SCASEST, como se trata en otro artículo de la monografía21.
En la reunión del ACC de marzo de 2010, se ha presentado un análisis retrospectivo de la cohorte de pacientes en el PLATO que se sometieron a CABG. Los resultados son confusos, dado que demuestran que el ticagrelor en comparación con el clopidogrel se asocia a un 50% de menos muertes (el 4,6 y el 9,2%; RR=0,49; p<0,002), cardiovasculares y totales posquirúrgicas, sin diferencias de sangrado, IAM o ictus entre los dos grupos de tratamiento.
Por último, el estudio RESPOND, diseñado para valorar el efecto de ticagrelor en las plaquetas de los pacientes no respondedores a clopidogrel y estudiar la función plaquetaria durante el cambio de clopidogrel a ticagrelor y viceversa en pacientes con enfermedad coronaria estable, ha demostrado que la inhibición laquetaria medida por agregómetro producida por el clopidogrel tanto en respondedores como en no respondedores aumenta significativamente con el cambio del fármaco a ticagrelor22. Este estudio hace que la cuestión de la terapia de inhibidores del ADP, guiada por la medida analítica de la función plaquetaria y la preocupación por la llamada«resistencia»al clopidogrel, resulte irrelevante.
Cuestiones prácticas pendientes- 1.
El mecanismo de acción único del ticagrelor, al ser un fármaco directo y reversible, le confiere ventajas clínicas evidentes de mayor eficacia y seguridad que los fármacos irreversibles clopidogrel y prasugrel. Sin embargo, su obligada dosificación en dos tomas diarias es su principal inconveniente. Surge la preocupación sobre un correcto cumplimiento en la toma de este fármaco que contrarreste las ventajas referidas.
- 2.
El ticagrelor, pese a producir mayor inhibición plaquetaria que el clopidogrel y el prasugrel, no se acompaña del esperado incremento de sangrado, y se debe a la reversibilidad de su acción. Este hecho le confiere especial ventaja en la CABG. Sin embargo, el ticagrelor se asocia a una mayor incidencia de sangrados mayores no relacionados con CABG; además, en el estudio PLATO no se incluyó a los pacientes con sangrado activo, historia de hemorragia previa o grave anemia. Por todo ello, conviene tener registros en el mundo real de pacientes con SCA tratados con este fármaco para conocer mejor las consecuencias de su empleo.
- 3.
El PLATO indicó una tendencia a mayor frecuencia de ictus hemorrágico con ticagrelor. Otro punto que vigilar con registros de pacientes reales.
- 4.
El ticagrelor se asoció a otros efectos adversos no vistos con clopidogrel o prasugrel, como elevación de ácido úrico y creatinina, incremento de la frecuencia de disnea (13,8 frente a 7,8; p<0,001) y bradiarritmias como pausas>3s (5,8 frente a 3,6; p<0,01). Sin embargo, ninguno de ellos fue grave y muy pocos pacientes tuvieron que abandonar el fármaco por estos motivos. La disnea desaparecía en 1 semana y las bradiarritmias, siempre asintomáticas, no se presentaron más allá de 1 mes de evolución. Conviene seguir estos efectos en la población real de SCA, muchos de ellos broncópatas o asmáticos, con registros adecuados.
- 5.
Ni en el estudio CURE ni en el TRITON-TIMI 38 se objetivó una disminución en la mortalidad total asociada a la mayor inhibición plaquetaria. En el estudio PLATO, el ticagrelor se asoció a una disminución del RR de muerte por cualquier causa del 22%. Este hallazgo puede ser casual, pero también puede explicarse por varios motivos: la disminución del riesgo de muerte por isquemia sin aumento del riesgo de muerte por sangrado, la aleatorización precoz en este estudio, dada la alta frecuencia de complicaciones trombóticas en esta fase y, finalmente —más especulativa pero más interesante—, considerar que el ticagrelor no es sólo un antiplaquetario, sino además un antagonista de la adenosina. Al ser muy similar su estructura, se asocia a una disminución de la recaptura de la adenosina por las células rojas. Esto explicaría también los efectos adversos des critos, como la disnea y la bradicardia. Pero estas hipótesis deben demostrarse en futuros estudios.
- 6.
Un análisis reciente de la población americana del PLATO muestra diferencias en los resultados con respecto a los pacientes reclutados en otros lugares, sin que exista actualmente explicación aparente para esta diferencia geográfica. Debe tenerse en cuenta que dicho análisis no estaba diseñado a priori en el estudio.
El ticagrelor se perfila como el fármaco de elección inicial, junto con la aspirina, en todos los pacientes que ingresan con SCA y en particular:
- 1.
Los pacientes de los que se conoce la anatomía coronaria y precisan de cirugía cardiaca. Si estos pacientes están recibiendo clopidogrel o prasugrel, parece indicado sustituirlos por ticagrelor 5–7 días antes de la CABG.
- 2.
Por otra parte, parece prudente evitar el ti- cagrelor en los pacientes con elevado riesgo de sangrado o con antecedentes de ictus o AIT, broncopatía crónica grave, insuficiencia renal grave o bradiarrit- mias graves sin la protección de un marcapasos.
La autora declara no tener ningún conflicto de intereses.