La trombina, como núcleo central de los procesos aterotrombóticos, es la diana terapéutica del síndrome coronario agudo (SCA). La heparina fue el primer fármaco anticoagulante asociado a la aspirina. Su uso se remonta a más de 20 años. No obstante, las limitaciones de la heparina y el mayor conocimiento fisiopatológico del SCA han llevado al desarrollo de nuevos anticoagulantes, unos orientados a una inhibición más eficiente de la trombina (inhibidores directos de la trombina), otros a inhibir su formación (inhibidores indirectos y directos del factor X activado). Los anticoagulantes deben asociarse a antiagregantes plaquetarios en el SCA, y ello comporta riesgo hemorrágico. El objetivo de esta revisión es reflexionar sobre el tratamiento anticoagulante actual del SCA y su proyección de futuro.
Palabras clave
La trombina es el núcleo central de los procesos aterotrombóticos que son la base fisiopatológica del síndrome coronario agudo (SCA)1. Según el concepto moderno de la cascada de coagulación propuesto por Ferguson2, el mecanismo de acción de los fármacos anticoagulantes y, por lo tanto, sus potenciales beneficios clínicos quedan claramente explicitados. No obstante, en la práctica clínica la situación es mucho más compleja por el amplio abanico de situaciones clínicas, mecanismos fisiopatológicos y tratamientos asociados en pacientes con SCA con elevación persistente del segmento ST (SCACEST) o sin elevación persistente del segmento ST (SCASEST). Con el tiempo se han ido incorporando fármacos antitrombóticos (antiagregantes plaquetarios y anticoagulantes), en ocasiones sustituyendo los clásicos por fármacos más potentes, en otras combinándolos, lo que ha llevado a un incremento del riesgo hemorrágico. La incidencia de hemorragias se asocia directamente con un incremento de mortalidad3, que ha hecho que nos replanteemos nuevamente nuestra práctica clínica4. Por lo tanto, nos hallamos ante un tema amplio, complejo, cambiante y de gran trascendencia.
El objetivo de esta revisión no es dar pautas de tratamiento anticoagulante, que se hallan disponibles en las guías de práctica clínica, sino reflexionar sobre el tratamiento anticoagulante actual del SCA. Para ello, en primer lugar expondremos someramente el mecanismo de acción de los diferentes fármacos anticoagulantes utilizados en el SCA. En segundo lugar, haremos un análisis crítico de los ensayos clínicos con fondaparinux y bivalirudina, para después dar unas pinceladas sobre algunos ensayos clínicos en curso y finalizar con unas reflexiones personales sobre la situación actual del tratamiento antitrombótico en el SCA.
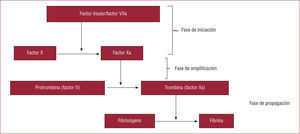
CASCADA DE LA COAGULACIÓN: CONCEPTO MODERNO Y FÁRMACOS ANTICOAGULANTESEn 1998, Ferguson propuso un nuevo concepto de la cascada de la coagulación2 que divide el proceso en tres fases (fig. 1). La primera fase es la de iniciación: la formación del complejo factor tisularfactor VII activado (FT-FVIIa) favorece la activación del factor X, y es este factor X activado (FXa) lo que promueve el paso de protrombina (factor II) a trombina (factor II activado). Pequeñas cantidades de trombina potencian de forma muy importante el proceso de coagulación. Por ello, a esta segunda fase se la conoce como fase de amplificación. A partir de aquí se produce una consolidación del proceso trombótico con el paso de fibrinógeno a fibrina inducido por la presencia de trombina; esta es la fase de propagación. Por lo tanto, el esquema terapéutico lógico es administrar fármacos que actúen en las fases más precoces del proceso trombótico, teniendo siempre la trombina como objetivo primordial tanto para impedir su formación como para inhibir su acción. Así pues, clasificaremos a los fármacos anticoagulantes indicados en el SCA en:
Cascada de la coagulación: concepto moderno. Propuesto por Ferguson2, se compone de tres fases: iniciación, amplificación y propagación. a: activado. Modificado de Ferguson et al2.
1. Inhibidores de la trombina
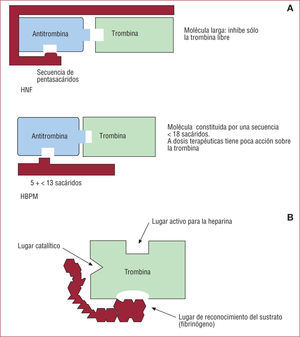
1.1. Inhibidor indirecto de la trombina: heparina sódica no fraccionada (HNF). Es una molécula larga que potencia la capacidad de la antitrombina III (ATIII) para unirse a la trombina y al FXa e inhibir su acción de forma irreversible (fig. 2A). Se administra por vía intravenosa (i.v.) y tiene un nivel anticoagulante impredecible, por lo que requiere monitorización estricta. Su eliminación se realiza básicamente por vía hepática y en menor proporción a través del sistema reticuloendotelial y renal. La protamina es su antídoto. Por las características de la molécula, la HNF sólo es capaz de inhibir la trombina libre, dejando que la trombina ligada a la fibrina continúe su efecto de amplificación del proceso trombótico.
A: heparina, inhibición indirecta de la trombina. El mecanismo de acción es potenciar la unión de la antitrombina III a la trombina. B: bivalirudina, inhibición directa de la trombina; no precisa cofactor y su unión directa a la trombina es reversible; por ser una molécula corta, es capaz de inhibir tanto la trombina libre como la ligada al coágulo. HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada.
1.2. Inhibidor directo de la trombina: bivalirudina. Molécula análoga de la hirudina, constituida por 20 aminoácidos, es el único inhibidor directo de la trombina bivalente. La unión a la trombina es reversible (fig. 2B). Se administra por vía i.v. y su vida media es de 25min. Aproximadamente un 20% se excreta por vía renal, con un aclaramiento dependiente de la dosis y el sexo5. Al ser una molécula corta, tiene capacidad para inhibir tanto la trombina libre como la ligada a la fibrina y, por lo tanto, evita eficientemente la fase de amplificación de la coagulación y la de propagación. No se dispone de antídoto, pero su vida media es corta.
Otros inhibidores orales directos de la trombina, como el dabigatrán, se han estudiado en otros escenarios clínicos5.
2. Inhibidores del factor Xa. Estos fármacos, al inhibir el FXa, actúan en la fase de iniciación de la coagulación; por lo tanto, reducen la formación de trombina. Según su mecanismo de acción, se dividen en:
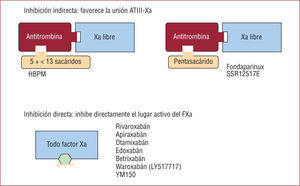
2.1. Inhibidores indirectos. Precisan ATIII como cofactor para inhibir de forma irreversible al FXa. Una vez activada la ATIII, el fármaco se libera del cofactor y tiene capacidad para poder actuar de nuevo. No obstante, como el fármaco actúa potenciando la ATIII, sólo inhibe el FXa libre5.
2.1.1. Heparina de bajo peso molecular (HBPM). Molécula compuesta por una cadena de menos de 18 sacáridos, su efecto primordial es anti-Xa (fig. 3), pero en menor proporción también antitrombina (fig. 2A). La vía de administración es subcutánea y tiene efecto predecible, por lo que no requiere monitorización. Se elimina por vía renal, aspecto que tener en cuenta en pacientes con insuficiencia renal. La protamina sólo inhibe muy parcialmente su efecto anticoagulante, ya que sólo actúa sobre la acción de la HBPM en la trombina5.
Mecanismos de inhibición del factor Xa. Los fármacos que producen inhibición indirecta precisan de cofactor (ATIII) para inhibir el FXa libre y tienen efecto irreversible. Los fármacos con inhibición directa actúan directamente sobre el lugar activo y tienen capacidad para inhibir todo el FXa. Efecto reversible. a: activado; ATIII: antitrombina III.
2.1.2. Fondaparinux. Análogo sintético de la secuencia de 5 sacáridos, hallados en la HNF y las HBPM, que actúa a nivel del lugar activo de la ATIII; por lo tanto, es un inhibidor indirecto pero selectivo del FXa libre (fig. 3). Se administra por vía subcutánea, su vida media es de 17h, lo que permite una sola administración al día, y la eliminación es renal, por lo que requiere ajustar la dosis en situación de insuficiencia renal grave5. No tiene antídoto.
2.2. Inhibidores directos del factor Xa. Son fármacos que administrados por vía i.v. u oral se unen 1:1 e inhiben de forma directa y reversible todo el FXa, tanto libre como unido al complejo protrombinasa. La vida media varía en función de la vía de administración, pero es de 6–12h cuando se administra por vía oral. Se elimina por vía renal y fecal5. En la figura 3 se muestra su mecanismo de acción y se listan los fármacos que actualmente están en diferentes fases de estudio en varios escenarios clínicos. No tienen antídoto.
ENSAYOS CLÍNICOS RECIENTES CON TERAPIA ANTICOAGULANTEEl incremento de la mortalidad secundaria a sangrado ha condicionado la planificación de los ensayos clínicos con antitrombóticos en los últimos años. Se prioriza la seguridad, no inducir y, de ser posible, reducir las hemorragias. Los ensayos clínicos se hacen más complejos de diseño. Aparece la variable combinada de beneficio neto (seguridad+eficacia) como variable de resultado primaria. A pesar de ello, no hay una homogeneización en la definición de hemorragia y las diferentes escalas de riesgo son útiles pero no superponibles6. Igualmente, las variables de resultado combinadas mezclan variables de muy diferente peso y, si se asocian a beneficio neto, el resultado final puede ser de difícil valoración para su extrapolación a la práctica clínica. En esta situación compleja, se desarrollan los ensayos clínicos con fondaparinux y bivalirudina en el SCA, de los que a continuación exponemos los resultados.
FondaparinuxEs un inhibidor indirecto y selectivo del FXa que se ha estudiado en dos ensayos clínicos, OASIS 57 en el SCASEST y OASIS 68 en el SCACEST, a dosis fija de 2,5mg cada 24h administrada por vía subcutánea, sin ajustar por la función renal, ya que valores de creatinina>3mg/dl eran criterio de exclusión. Según la ficha técnica, el fondaparinux está contraindicado cuando el aclaramiento de creatinina es<20ml/min. Asimismo, las dosis en otros contextos clínicos son: a) prevención de la enfermedad tromboembólica, 2,5mg/24h y reducción de la dosis a 1,5mg/24h cuando el aclaramiento de creatinina está entre 20 y 50ml/min, y b) tratamiento de la trombosis venosa profunda y la tromboembolia pulmonar: dosis en función del peso, 5, 7,5 o 10mg/24h según el peso sea<50, 50–100 o>100kg, respectivamente. Por lo tanto, las dosis utilizadas en el SCA son las mismas que las utilizadas para la prevención de enfermedad tromboembólica y quedan lejos de las utilizadas como dosis anticoagulantes.
El estudio OASIS 57 incluyó a 20.078 pacientes ingresados por SCASEST. Inicialmente estaban previstos 16.000, pero se tuvo que ampliar la muestra y cambiar los criterios de inclusión cuando se analizó a los primeros 4.000 pacientes, debido a la baja incidencia de acontecimientos clínicos. Se aleatorizó a los pacientes a recibir fondaparinux 2,5mg/24h o enoxaparina 1mg/kg/h. La variable de resultado primaria de eficacia, determinada como no inferioridad, fue un combinado de muerte, infarto o isquemia refractaria y la variable de resultado primaria de seguridad, determinada como superioridad en prevenir hemorragias mayores; ambas variables determinadas a 9 días. El beneficio neto se estableció como la asociación de las variables de resultado primarias de eficacia y seguridad. Asimismo, únicamente se preespecificaron variables de resultado secundarias a 9, 30 días y final del seguimiento (entre 30 y 180 días) para cada una de las variables de resultado de eficacia individualmente o combinadas. La variable de resultado primaria de eficacia fue en el grupo de fondaparinux del 5,8% y en el de enoxaparina, el 5,7% —hazard ratio (HR)=1,01 (intervalo de confianza [IC] del 95%, 0,91,13)—; por lo tanto, el fondaparinux cumplió el criterio de no inferioridad. La variable de resultado de seguridad mostró la superioridad del fondaparinux sobre la enoxaparina al reducir la incidencia de hemorragias mayores (el 2,2 y el 4,1%, respectivamente; HR=0,52; IC del 95%, 0,44-0,61), como no podría ser de otra manera, ya que no estamos equiparando dosis equipotentes de fármacos: enoxaparina a dosis anticoagulantes plenas y fondaparinux a dosis administradas en profilaxis. Las variables de resultado secundarias predefinidas mostraron superioridad del fondaparinux en la reducción de la mortalidad a 30 días (fondaparinux, 2,9%; enoxaparina, 3,5%; HR=0,83; IC del 95%, 0,71-0,97) que no se observó durante la hospitalización (fondaparinux, 1,8%; enoxaparina, 1,9%; HR=0,95; IC del 95%, 0,77-1,17) y perdió la significación estadística al final del seguimiento (fondaparinux, 5,8%; enoxaparina, 6,5%; HR=0,89; IC del 95%, 0,8-1). Esta reducción de la mortalidad podría asociarse a la menor incidencia de hemorragias y de complicaciones derivadas de ellas en el grupo de fondaparinux. Destaca la reducción de las hemorragias mayores en el seguimiento, alejadas de su relación con la administración de los fármacos y, por lo tanto, de difícil interpretación, así como la reducción de la incidencia de accidente cerebrovascular (ACV) sólo a 180 días. No obstante, el análisis de estas variables no se había predefinido en los tiempos reportados o simplemente no se había predefinido en ningún tiempo, ni solas ni asociadas, por lo que, desde el punto de vista metodológico, se debería ser cauteloso en otorgarles valor.
Es interesante el análisis que realizan Fox et al9 de la relación entre el filtrado glomerular y la incidencia de acontecimientos clínicos adversos, definidos como hemorragia y muerte, en un análisis post-hoc del OASIS 5. Una vez más, la función renal se muestra como un potente marcador en la incidencia de hemorragia y muerte. El fondaparinux a las dosis administradas se muestra superior a las dosis administradas de enoxaparina para cualquier nivel de insuficiencia renal.
El estudio OASIS 68 analizó la administración de fondaparinux en 12.092 pacientes con SCACEST. Hubo que incrementar el tamaño muestral de 10.000 a 12.000 pacientes por poca incidencia de eventos clínicos. Asimismo, durante la fase de inclusión de pacientes se realizaron dos cambios en el diseño y la metodología del estudio. En primer lugar, cuando se llevaba incluidos a unos 4.300 pacientes, se redujo el intervalo de inclusión de 24 a 12h desde el inicio de los síntomas. En segundo lugar, cuando se había incluido a 8.000 pacientes se decidió intercambiar el tiempo de medida de la variable de resultado primaria, combinada de muerte o reinfarto, de 9 a 30 días, pasando la de 30 días a variable de resultado primaria y 9 días a secundaria conjuntamente con la medida al final del estudio (entre 3 y 6 meses). Destaca que no se definió como variable de resultado primaria ni secundaria la incidencia de hemorragia.
Se trata de un estudio de diseño complejo, ya que compara el fondaparinux con pacientes aleatorizados a placebo, en los pacientes sin indicación de heparina a criterio del médico tratante (estrato I) o a HNF (estrato II) y en las conclusiones incluyeron ambos estratos para la comparación con fondaparinux. Por otra parte, no se realizó ninguna terapia de reperfusión en el 23,7% de los pacientes, se administraron trombolíticos en un 45%, de los que en el 73% fue estreptoquinasa, que no requiere terapia anticoagulante asociada, e intervencionismo coronario percutáneo primario (ICP-P) en el 31,1%. La variable de resultado primaria a 30 días del combinado de muerte o reinfarto fue favorable al fondaparinux; el 9,7% en el grupo de fondaparinux y el 11,2% en el grupo de HNF/placebo (HR=0,86; IC del 95%, 0,77-0,99; p=0,008), pero las diferencias se debieron a los pacientes en el estrato I, es decir, cuando se comparó fondaparinux (11,2%) con placebo (14%) (HR=0,79; IC del 95%, 0,68-0,92), mientras que no hubo diferencias cuando se comparó fondaparinux (8,3%) con HNF (8,7%) (HR=0,96; IC del 95%, 0,81-1,13), y este patrón se repitió en todos los periodos analizados. A los 9 días no hubo diferencias en sangrado según escala TIMI modificada entre fondaparinux (1%) y placebo (1,6%) (HR=0,63; IC del 95%, 0,4-1,02), pero tampoco entre fondaparinux (1,1%) y HNF (1,1%) (HR=0,95; IC del 95%, 0,59-1,51).
Requieren especial atención los pacientes reperfundidos mediante ICP-P. En este subgrupo, la variable combinada primaria de muerte y reinfarto a los 30 días se produce en el 6% del grupo de fondaparinux y el 4,9% del grupo HNF/placebo (HR=1,24; IC del 95%, 0,95-1,63). A pesar de que el grupo de fondaparinux recibió en un 20,8% HNF durante el procedimiento, se detectó trombosis de catéter en el 22% de los pacientes asignados a este grupo y ninguno en el grupo de HNF y mayor índice de complicaciones coronarias.
Por último, cabe destacar que el diagnóstico de IAM no se confirmó en más pacientes del grupo de fondaparinux (2,4%) que del grupo de HNF/placebo (1,8%; p=0,04).
BivalirudinaLa andadura de la bivalirudina en el SCA es larga y se inició en 199310,11 con el nombre de Hirulog. Un ensayo clínico a gran escala en 17.073 pacientes con SCACEST, que comparó la administración de bivalirudina o HNF durante 48h como terapia coadyuvante a estreptoquinasa, no muestra diferencias en la mortalidad a 30 días entre la bivalirudina (10,5%) y HNF (10,9%) y sí un incremento estadísticamente significativo en el riesgo de hemorragia para la bivalirudina, pero sin requerir mayor número de transfusiones12. Los ensayos clínicos recientes realizados con bivalirudina se han centrado exclusivamente en el ICP y aquí analizaremos los aspectos metodológicos y médicos de los ensayos.
ACUITY13 es un ensayo clínico realizado en 13.819 pacientes con SCASEST de moderado-alto riesgo y estrategia intervencionista precoz. Se aleatorizó a los pacientes de forma ciega a tres ramas de tratamiento: HNF o enoxaparina combinada con un inhibidor de la glucoproteína (GP) IIb/IIIa (anti-GPIIb/IIIa), bivalirudina combinada con un anti- GPIIb/IIIa o bivalirudina sola. Después de la aleatorización, el ensayo clínico era abierto. Las variables de resultado primarias son tres, a 30 días, una compuesta de eventos isquémicos (muerte, infarto de miocardio o revascularización no planeada por isquemia), la segunda es hemorragia mayor y la tercera, el beneficio clínico neto que combina las dos previas. Se plantean los análisis estadísticos para demostrar la no inferioridad entre los diferentes grupos. El beneficio neto observado en el grupo de HNF/enoxaparina+anti-GPIIb/IIIa (11,7%) y el grupo de bivalirudina+anti-GPIIb/ IIIa (11,8%) es superponible y cumple el criterio de no inferioridad. El grupo de bivalirudina sola presenta mejor beneficio neto (10,1%) que los otros dos grupos (riesgo relativo [RR]=0,86; IC del 95%, 0,77-0,97; p<0,001). No se observan diferencias en la incidencia de eventos isquémicos en los tres grupos: HNF/enoxaparina+anti-GPIIb/IIIa (7,3%), bivalirudina+anti-GPIIb/IIIa (7,7%) y bivalirudina sola (7,8%). Mientras que las hemorragias se reducen en el grupo de bivalirudina sola (3%), HNF/enoxaparina+anti-GPIIb/IIIa (5,7%) y bivalirudina+anti-GPIIb/IIIa (5,3%). Por lo tanto, el beneficio neto se produce a expensas de la reducción de hemorragias y por ello las hemos de analizar con detalle. Las diferencias se hallan en la hemorragias retroperitoneales, el 0,5, el 0,6 y el 0,2% (p=0,002) en HNF/enoxaparina+anti-GPIIb/ IIIa, bivalirudina+anti-GPIIb/IIIa y bivalirudina sola, respectivamente; en un hematoma>5cm en el lugar de la punción HNF/enoxaparina+antiGPIIb/IIIa (2,2%), bivalirudina+anti-GPIIb/IIIa (2,2%) y bivalirudina sola (0,7%) (p<0,001). Esta mayor incidencia de hemorragia se traduce en un sangrado mayor de acuerdo con la escala TIMI del 1,9, el 1,7 y el 0,9% (p<0,0001) en HNF/enoxaparina+anti-GPIIb/IIIa, bivalirudina+anti-GPIIb/ IIIa y bivalirudina sola, respectivamente, y necesidad de transfusión sanguínea en HNF/enoxaparina+anti-GPIIb/IIIa (2,7%), bivalirudina+antiGPIIb/IIIa (2,6%) y bivalirudina sola (1,6%). Dos cuestiones surgen de estos datos: ¿cómo puede variar la incidencia de hemorragia el acceso radial? y ¿cómo puede modificar la asignación de las hemorragias el hecho de ser un estudio abierto?
El seguimiento al año de estos pacientes muestra que no hay diferencias estadísticamente significativas entre los tres grupos de tratamiento en la variable de resultado compuesta de eventos isquémicos HNF/enoxaparina+anti-GPIIb/IIIa (15,4%), bivalirudina+anti-GPIIb/IIIa (16%) y bivalirudina sola (16,2%) ni en la mortalidad (el 3,9, el 3,9 y el 3,8% en HNF/enoxaparina+anti-GPIIb/ IIIa, bivalirudina+anti-GPIIb/IIIa y bivalirudina sola, respectivamente)14.
El ensayo clínico HORIZONS-AMI15 se realizó en pacientes con SCACEST de menos de 12h de evolución e ICP-P como terapia de reperfusión. Se aleatorizó a los pacientes 1:1 a HNF+anti-GPIIb/ IIIa o bivalirudina. Se analizan dos variables de resultado primarias a 30 días, un combinado de hemorragia y evento cardiovascular adverso que incluye muerte, reinfarto, revascularización no planeada por isquemia y ACV (beneficio clínico neto) y una segunda variable de resultado, que es el sangrado mayor. Cabe destacar que en ningún apartado (metodología, análisis estadístico) se predefine el análisis independiente de los diferentes componentes de la variable de resultado combinada. Este ensayo clínico, que tiene una larga lista de criterios de exclusión, está constituido por 3.602 pacientes aleatorizados a las dos ramas de tratamiento, pero con administración del fármaco abierta. El beneficio clínico neto se observa en el 9,2% del grupo de bivalirudina y en el 12,1% del de HNF+anti-GPIIb/IIIa (HR=0,76; IC del 95%, 0,63-0,92) y el sangrado mayor también es favorable a los que recibieron bivalirudina sola, el 4,9 y el 8,3% con HNF+anti-GPIIb/IIIa (HR=0,6; IC del 95%, 0,46-0,77). La trombosis del stent a 30 días no muestra diferencias entre ambos grupos (bivalirudina, 2,5%; HNF+anti-GPIIb/IIIa, 1,9%), pero la variable de resultado predefinida de trombosis de stent en las primeras 24h es desfavorable para el grupo de bivalirudina, que presenta mayor incidencia (bivalirudina, 1,3%; HNF+anti-GPIIb/IIIa, 0,3%; p<0,001).
No se observan diferencias entre los grupos de tratamiento para el evento cardiovascular adverso (el 5,4 y el 5,5% con bivalirudina y HNF+anti- GPIIb/IIIa respectivamente) ni para la muerte no cardiaca, que incluye la muerte relacionada con el sangrado (bivalirudina, 0,3%; HNF+anti-GPIIb/ IIIa, 0,2%). No obstante, la muerte cardiaca se halla reducida en el grupo de bivalirudina (el 1,8 frente al 2,9% en el de HNF+anti-GPIIb/IIIa) (HR=0,62; IC del 95%, 0,4-0,95; p=0,003). Pero como ya se ha comentado previamente, no se había predefinido el análisis de estas variables de resultado de forma independiente y resulta difícil una explicación fisiopatológica de estos hallazgos, ya que la muerte no cardiaca, que no muestra diferencias, incluye la relacionada con el sangrado, que es la que reduce la bivalirudina, y en cambio la muerte cardiaca que se podría ver afectada por la mayor incidencia de trombosis del stent observada en el grupo de bivalirudina es la que se halla reducida en este grupo.
Como los mismos autores refieren, este ensayo clínico tiene limitaciones; las más destacables son: administración abierta de los fármacos, administración de heparina previa a la aleatorización (grupo de bivalirudina, 66%; grupo de HNF, 76%), sólo 615 pacientes (34%) recibieron bivalirudina como monoterapia y la dosis de carga de clopidogrel de 600mg no se administró a todos los pacientes (bivalirudina, 62,6%; HNF+anti-GPIIb/IIIa, 60,7%).
A pesar de que en el diseño inicial del ensayo clínico no se definió como variable de resultado el seguimiento al año, los autores han publicado recientemente los resultados16, que muestran no sólo el mantenimiento del beneficio obtenido por la bivalirudina a los 30 días, sino que se incrementa entre el primer mes y el año. Así pues, el beneficio clínico neto es del 15,6% en el grupo asignado a bivalirudina y del 18,3% en el de HNF+anti-GPIIb/IIIa (HR=0,83; IC del 95%, 0,78-0,97; p=0,022). Se incrementa el sangrado mayor después del primer mes, pero resulta menor en los pacientes que recibieron bivalirudina sola (el 5,8 frente al 9,2% de aquellos con HNF+anti-GPIIb/IIIa) (HR=0,1; IC del 95%, 0,48-0,78; p<0,0001), pero no se traduce en un incremento de la mortalidad de causa no cardiaca (bivalirudina, 1,3%; HNF+anti-GPIIb/ IIIa, 1,1%). Persiste la ausencia de diferencias para el evento cardiovascular adverso (bivalirudina, 11,9%; HNF+anti-GPIIb/IIIa, 11,9%), pero la muerte cardiaca continúa mostrando diferencias entre ambos grupos: bivalirudina, 2,1%; HNF+anti-GPIIb/IIIa, 3,8% (HR=0,57; IC del 95%, 0,38-0,84; p=0,005). Es difícil comprender estos resultados y, si se confirmaran en próximos estudios, deberemos estudiar nuevos mecanismos fisiopatológicos de la enfermedad.
ENSAYOS CLÍNICOS EN CURSOMúltiples fármacos anticoagulantes se están estudiando en el SCA. La tabla 1 muestra los ensayos clínicos en curso que están en fase III o que van a responder a preguntas planteadas en ensayos previos. Son tres ensayos clínicos con fármacos inhibidores directos del factor Xa (rivaroxabán, apixabán y otamixabán) y otros tres con bivalirudina (inhibidor directo de la trombina). Con este fármaco, ISAR-REACT 4 va a responder a la cuestión que planteó el ACUITY, en el que sólo el 9% de los pacientes recibieron abciximab, fármaco considerado como el mejor anti-GPIIb/IIIa en el ICP. Y el ensayo clínico EUROMAX plantea la administración precoz de los fármacos en la ambulancia e intentará confirmar los resultados de la mortalidad observados en HORIZONS-AMI predefiniendo como variable de resultado secundaria la mortalidad en diferentes tiempos.
Ensayos clínicos en curso
| Ensayo clínico | Diana terapéutica | Vía | Fármaco activo | Control | Contexto clínico | Variable de resultado primaria |
| ATLAS-ACS2 | Factor Xa | Oral | Rivaroxabán | Placebo | Tras SCA | Eficacia |
| APRAISE-2 | Factor Xa | Oral | Apixabán | Placebo | Tras SCA | Eficacia |
| SEPIA-ACS2 | Factor Xa | Oral | Otamixabán | HNF+eptifibatida | SCA | Beneficio neto 7 días |
| BRAVE-4 | Trombina | i.v. | Bivalirudina, prasugrel | HNF+clopidogrel | SCACEST+ICP-P | Beneficio neto 30 días |
| ISAR-REACT4 | Trombina | i.v. | Bivalirudina | HNF+abciximab | SCASEST+ICP precoz | Beneficio neto 30 días |
| EUROMAX | Trombina | i.v. | Bivalirudina | HNF | SCACEST+ICP-P | Beneficio neto 30 días |
Beneficio neto: reducción de eventos cardiovasculares+incidencia de hemorragias; HNF: heparina no fraccionada; i.v.: intravenosa; ICP: intervencionismo coronario percutáneo; ICP-P: intervencionismo coronario percutáneo primario; SCA: síndrome coronario agudo; SCACEST: síndrome coronario agudo con elevación del ST; SCASEST: síndrome coronario agudo sin elevación del ST.
Una mirada en perspectiva al tratamiento antitrombótico en el SCA aporta información que puede ser extremadamente útil. El primer antitrom bótico utilizado fue la aspirina (1985), seguida de la HNF, en comparación con aspirina (1988) y ambos fármacos combinados (1990). A partir de entonces, la aspirina constituye la piedra angular del tratamiento y la HNF continúa vigente en ICP. En la década de los noventa se introdujeron los inhibidores directos de la trombina (hirudina y bivalirudina), HBPM y anti-GPIIb/IIIa, y finalmente, en 2001, el clopidogrel, siempre combinados con aspirina. Entonces, las guías de práctica clínica para el SCA otorgan nivel de recomendación de clase I de forma independiente a cada uno de estos fármacos. Esta recomendación se extrapola a la práctica clínica y se inicia la administración simultánea de diferentes fármacos antitrombóticos. El precio que se paga es un incremento de las hemorragias. Cuando el binomio hemorragia-mortalidad queda en evidencia, hay un replanteamiento de los ensayos clínicos para reducir dosis, utilizar fármacos más específicos e indicaciones más concretas, y en las últimas guías clínicas de revascularización coronaria se dan recomendaciones para reducir el riesgo de sangrado (no intercambiar fármacos anticoagulantes, excepto con fondaparinux, suspender la anticoagulación después del ICP, ajustar en relación con la función renal, etc.)17. Pero se continúan introduciendo nuevos antitrombóticos que en ocasiones sustituyen a los previos de la misma familia, pero en otras se van a asociar a todo el arsenal terapéutico.
No obstante, tímidamente aparece una nueva línea de pensamiento que cuestiona los niveles altos de anticoagulación en presencia de doble terapia antiagregante18 y si la hipótesis de la trombina, que tan buenos resultados da en el ámbito experimental, tiene el mismo comportamiento en clínica19. Hasta ahora hemos ido sumando antitrombóticos y quizá sea momento de empezar a plantearse si, en presencia de una antiagregación potente, debemos disminuir el nivel de anticoagulación o incluso si debemos anticoagular, exceptuando durante el ICP.
Mientras esta nueva vía no tome protagonismo, no debemos olvidar que en los últimos 25 años hemos ido incorporando al arsenal terapéutico antiagregantes y anticoagulantes cada vez más potentes y más específicos, que tienen potencial hemorrágico. La relación riesgo/beneficio que ofrecemos a nuestros pacientes debe ser cuidadosamente establecida en cada individuo. Para ello, debemos estratificar el riesgo cardiovascular y el riesgo hemorrágico para determinar el tipo y la duración del tratamiento anticoagulante asociado a los antiagregantes plaquetarios tanto en la fase hospitalaria como en el seguimiento de un SCA. No se trata de sumar indiscriminadamente, sino de utilizar estrictamente lo necesario.
CONFLICTO DE INTERESESLa autora declara no tener ningún conflicto de intereses.