Full English text available from: www.revespcardiol.org/en
INTRODUCCIÓNEl implante percutáneo de válvulas ha sido un empeño de años y un sueño de los cardiólogos intervencionistas. En 2007-2008 tuvimos el privilegio de disponer en nuestro país1,2 de 2 de los modelos más implantados hasta la fecha: la prótesis valvular aórtica de Cribier-Edwards1 y la prótesis autoexpansible CoreValve2. Estos modelos proporcionaron buenos resultados iniciales en pacientes con estenosis aórtica grave de alto riesgo quirúrgico. Sin embargo, pronto se puso de manifiesto en estos diseños una serie de limitaciones que restringían su aplicabilidad a todos los pacientes con estenosis aórtica grave. Además, el procedimiento no estaba libre de complicaciones o de resultados subóptimos3,4. Tras una experiencia inicial, los operadores han reclamado algunas mejoras técnicas5:
- 1.
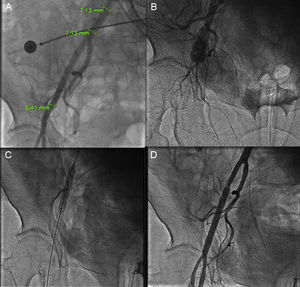
Reducción del perfil del dispositivo para poder introducirlo por un introductor < 18 Fr. Para implantar la mayoría de los modelos por vía femoral, se requiere un vaso de al menos 6 mm (la medida del introductor de 18 Fr). Las complicaciones femorales no son infrecuentes6,7 (figura 1) y están relacionadas con el tamaño del orificio producido en la arteria para el acceso valvular. Por otro lado, pacientes con femorales pequeñas o con enfermedad grave del territorio iliaco femoral no son candidatos a implante valvular transfemoral.
Figura 1.A: rotura femoral tras fallo del dispositivo de cierre Prostar, en una arteria femoral < 6 mm; la complicación se produjo tras implantar con éxito una válvula percutánea a través de un introductor de 18 Fr. B: angiografía que demuestra la rotura del vaso. C: implante de 2 stents recubiertos. D: resultado final.
(0.23MB). - 2.
Aumento en la gama de tamaños de las prótesis disponibles inicialmente, de forma que se acomoden a todo tipo de anillos valvulares: 17-29 mm. Este requerimiento se ha ido produciendo en estos años. Los fabricantes han ido introduciendo nuevos modelos que prácticamente se adaptan a todos los tamaños de anillos aórticos. Solo algunas de las más recientes en el mercado tienen algunas faltas que probablemente se subsanarán en un futuro próximo.
- 3.
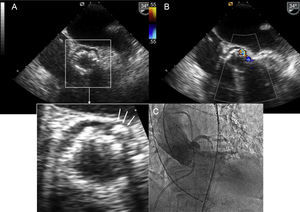
Mejora de la fijación al anillo valvular con reducción de las regurgitaciones periprotésicas. La regurgitación periprotésica es uno de los mayores determinantes del curso clínico posterior al implante8. Las calcificaciones irregulares en el anillo aórtico pueden impedir la buena aposición entre la estructura de la válvula y el tejido periprotésico, lo que genera una regurgitación de mayor o menor grado a pesar de la correcta posición de la válvula (figura 2). Así, se precisa una mejora en los diseños de la primera generación de válvulas percutáneas que reduzca la incidencia de fugas perivalvulares.
Figura 2.A: protuberancia cálcica (flechas) que impide la coaptación de una prótesis CoreValve al tejido periprotésico. B y C: insuficiencia aórtica periprotésica (pese a la correcta posición) evidenciada por Doppler color (B) y angiografía (C). Esta figura se muestra a todo color solo en la versión electrónica del artículo.
(0.18MB). - 4.
El dispositivo debería ser fácilmente reposicionable y retraíble en su totalidad en caso necesario. La válvula debe implantarse correctamente a nivel del anillo aórtico. Los implantes altos pueden generar embolia en la aorta y los implantes bajos, insuficiencia aórtica grave. Que se pueda seleccionar el sitio adecuado del implante y resituar la válvula hasta una posición óptima resulta crucial para obtener buenos resultados inmediatos del procedimiento. Esto puede resultar difícil en aortas muy horizontales o distorsionadas.
- 5.
Disponibilidad de accesorios específicos: introductores, guías y dispositivos de cierre femoral. Como la implantación percutánea de válvulas es una técnica nueva, su ejecución precisa material dedicado. En estos años han aparecido introductores hidrofílicos de diámetro suficiente que mejoran la introducción del dispositivo en la arteria femoral. Recientemente, también están disponibles guías dedicadas para la introducción de la válvula en ventrículo con una preformación específica en la punta que reduce el riesgo de perforación en el ventrículo izquierdo9.
- 6.
Durabilidad a largo plazo con integridad del sistema a los 10-15 años. Todavía se precisan algunos años más para demostrar que la durabilidad de las válvulas percutáneas es equivalente a la de las válvulas quirúrgicas.
Tres artículos de Revista Española de Cardiología analizan la experiencia inicial con 3 nuevos diseños de válvula aortica percutánea: SAPIEN 3 (Edwards Lifesciencies; Irvine, California, Estados Unidos)10, Lotus (Boston Scientific; Natick, Massachusetts, Estados Unidos)11 y DirectFlow (DirectFlow Medical; Santa Rosa, California, Estados Unidos)12. Estos modelos presentan algunas de las mejoras técnicas anteriormente requeridas.
Sapien 3Es una modificación importante de los modelos previos de la compañía ya conocidos. Dispone de unos sistemas de liberación de 14 Fr (para válvulas de 23 y 26 mm) y 16 Fr (para la de 29 mm), gracias a la simplificación de la estructura de la malla de cromo-cobalto, la reducción del grosor de los struts y la mejora en el sistema de crimpado de la válvula. Se trata de la máxima reducción del sistema de liberación hasta la fecha y podría ser el sistema de elección para pacientes con femorales de diámetro reducido (figura 1).
Además, incorpora faldones interno y externo de polietileno tereftalato ideado para minimizar las fugas perivalvulares residuales, lo cual es una ventaja en pacientes con anillos calcificados de forma asimétrica (figura 2). De hecho, ninguno de los pacientes reportados en el artículo sufrió insuficiencia aórtica10. El sistema de liberación permite una doble articulación que mejora el control en el posicionamiento de la válvula con una marca radioopaca central en el balón, que facilita el alineamiento con el plano valvular. Esta propiedad también sería una ventaja en pacientes con aortas distorsionadas.
LotusSe trata de una válvula de pericardio bovino incorporada en una endoprótesis de nitinol que viene ya precargada. Precisa un introductor de 18 Fr. Con respecto a los posibles requisitos técnicos anteriormente mencionados, tiene la característica de ser reposicionable y recuperable antes del implante definitivo. También, este modelo presenta ventajas en pacientes con aortas muy distorsionadas donde resulta difícil un correcto posicionamiento de la prótesis. Otra modificación técnica de interés es el sistema de sellado consistente en una membrana de uretano que se adapta a la superficie de anillos calcificados irregularmente (figura 2). Esto minimiza el riesgo de insuficiencia aórtica paravalvular, de modo que en la serie estudiada ningún paciente sufrió insuficiencia aortica periprotésica11.
DirectFlowLa prótesis difiere de las anteriores en que no tiene elementos metálicos y su estructura es un sistema de vasos comunicantes que al llenarse de líquido configura 2 anillos unidos por un armazón de poliéster; el anillo inferior estabiliza la prótesis y el superior soporta las 3 cúspides de pericardio bovino. El sistema de liberación está constituido por 3 cables que se anclan al anillo inferior y permiten el llenado de los anillos y el posicionamiento y la liberación de la válvula. También su introducción requiere una vaina de 18 Fr. Presenta 3 ventajas sobre los sistemas clásicos: es recapturable, es reposicionable y la adaptación al tejido periprotésico es excelente mediante el inflado de los anillos. Debido a esta propiedad, el riesgo de insuficiencia periprotésica es bajo. Tampoco se refieren insuficiencias aórticas significativas en la serie estudiada12. Tiene el inconveniente de su menor fuerza radial y que deja un gradiente transprotésico algo mayor, como el del paciente comentado en el mismo artículo12.
PERSPECTIVAS FUTURASLas futuras indicaciones de los implantes percutáneos dependerán de las mejoras que sigan produciéndose en estos años sobre los modelos actuales. Muchas de ellas ya las hemos mencionado en el apartado anterior, y es de esperar que sigan produciéndose al mismo ritmo. Otro de los determinantes fundamentales del futuro de las válvulas percutáneas será los resultados de los estudios aleatorizados en comparación con la cirugía de reemplazo. En un estudio reciente, realizado en pacientes con estenosis aórtica grave de alto riesgo quirúrgico, los pacientes tratados con implante de válvula CoreValve tuvieron mayor supervivencia al año que los pacientes con sustitución valvular quirúrgica13. En cualquier caso, se precisan más estudios en pacientes de menor riesgo quirúrgico y también es preciso conocer la durabilidad de la prótesis a largo plazo para ampliar las indicaciones actuales. Por el momento, queda limitada a este tipo de pacientes en quienes la cirugía tiene alta mortalidad. Sin embargo, el número de implantes ha aumentado exponencialmente desde su introducción en la práctica clínica: de 10.000 implantes mundiales a comienzos de 2010 a más de 60.000 implantes en 2013 (datos suministrados por la compañía para la válvula CoreValve). Es de suponer que este crecimiento se mantendrá en las mismas proporciones durante los próximos años. Las mejoras técnicas incorporadas a los nuevos dispositivos, como demuestran los artículos publicados en Revista Española de Cardiología10-12, colaboraran sin duda a la expansión de la técnica. Si esta historia sigue un paralelismo con la revascularización percutánea en pacientes con enfermedad coronaria, podríamos suponer que la proporción de pacientes operados frente a intervenidos percutáneamente podría invertirse en los próximos años, tal como ocurrió con la revascularización coronaria. Sea cual fuere el futuro de las prótesis percutáneas en los próximos años, se precisa una estrecha colaboración entre todos los especialistas que tratamos a pacientes con esta enfermedad.
CONFLICTO DE INTERESESNinguno.