Analizar los efectos, en la fibrilación ventricular y en la capacidad de capturar al miocardio mediante estimulación a frecuencias rápidas, de una lesión lineal producida con radiofrecuencia.
MétodosEn 22 corazones de conejo aislados y perfundidos, se utilizaron electrodos múltiples epicárdicos para registrar la fibrilación ventricular. Se analizaron los mapas de activación al aplicar trenes de estímulos a tres frecuencias distintas, cercanas a las de la arritmia, en tres situaciones: a) basalmente; b) tras producir con radiofrecuencia una lesión en la pared libre del ventrículo izquierdo (longitud, 10±1mm), y c) tras ampliar su extensión (longitud, 23±2mm).
ResultadosTras la lesión, se observó una disminución de la regularidad de las señales registradas y variaciones significativas en la dirección de los frentes de activación. Con la lesión ampliada, se incrementaron ligeramente los episodios con al menos tres capturas consecutivas al estimular con ciclos un 10% más largos que los de la arritmia (basal, 0,6±0,7; lesión inicial, 1±1, diferencias no significativas; lesión ampliada, 3±2,8; p<0,001), mientras que se redujeron los obtenidos al estimular con ciclos un 10% más cortos que los de la arritmia.
ConclusionesLa lesión efectuada con radiofrecuencia aumenta la heterogeneidad de la activación miocárdica durante la fibrilación ventricular y modifica la llegada de los frentes de activación a las zonas adyacentes. La estimulación durante la fibrilación ventricular a frecuencias rápidas provoca capturas ocasionales durante al menos tres estímulos consecutivos. La lesión ampliada incrementa ligeramente la capacidad de captura al utilizar ciclos ligeramente más largos que los de la fibrilación ventricular.
Palabras clave
Aunque todavía hay controversia sobre los mecanismos básicos de la fibrilación ventricular (FV), en las últimas décadas se ha incrementado la información disponible1, 2, 3, 4, 5, 6, 7. Paralelamente al estudio de los mecanismos que inician o sustentan la arritmia, se han ido desarrollando trabajos que permiten conocer mejor cómo influyen diversos factores en su aparición y su perpetuación8, 9, 10, 11, 12, 13, 14. Entre ellos se encuentran los estímulos y choques eléctricos o la ablación con radiofrecuencia (RF), esta para controlar los factores que la inician15, 16, 17, 18, ya que es muy escasa la información disponible sobre sus efectos modificadores del sustrato19, 20, 21.
Se ha comenzado a analizar los efectos de la estimulación a frecuencias cercanas a las de la arritmia22, 23, 24, 25, ya que en la fibrilación auricular se demostró la capacidad de modificar los patrones de activación con estos procedimientos26, 27. Mediante la estimulación durante los procesos fibrilatorios se ha intentado conseguir la captura de una parte extensa del miocardio con el objeto de interrumpirlos o de facilitar su control con otras actuaciones23, 24, 25, 28. Sin embargo, la capacidad de alterar los patrones de activación se circunscribe a áreas de poca extensión. Desconocemos si la modificación de la llegada de frentes de activación a la zona de aplicación de los impulsos eléctricos modifica también la capacidad de captura miocárdica y con ello las posibilidades de interferir la perpetuación de la arritmia. La realización de lesiones con RF es uno de los procedimientos que permiten modificar el sustrato y los patrones de activación durante la FV, aunque no se han estudiado sus efectos en la capacidad de capturar al miocardio mediante sobrestimulación.
Para analizar estos aspectos en el presente trabajo se ha empleado un modelo experimental con corazones aislados y perfundidos de conejo según la técnica de Langendorff. Se han utilizado procedimientos cartográficos de alta resolución para registrar la FV durante la estimulación eléctrica a frecuencias rápidas, tanto en condiciones basales como tras la realización de lesiones lineales con RF. El trabajo se ha planteado con los siguientes objetivos: a) analizar las modificaciones de la activación ventricular durante la FV originadas tras la creación con RF de una lesión lineal en la pared libre del ventrículo izquierdo (VI) y tras extender su longitud, y b) estudiar la capacidad de capturar el miocardio durante la FV mediante estimulación eléctrica a frecuencias rápidas, tanto en condiciones basales como tras efectuar la lesión en una zona cercana a la de aplicación de los estímulos.
MétodosPreparación experimentalSe siguieron las recomendaciones internacionales sobre investigación con animales de laboratorio de la Sociedad Americana de Fisiología. Se utilizaron conejos de raza Nueva Zelanda (n=22). Tras anestesiarlos con ketamina (25mg/kg, i.m.) y heparinizarlos, se extrajo el corazón, se lo sumergió en Tyrode frío y, en un intervalo inferior a 3 min, se lo conectó a través de la aorta a un sistema de Langendorff perfundiendo solución de Tyrode oxigenado, a una presión de 60 mmHg y una temperatura de 37±0,5°C. Los registros cartográficos se obtuvieron con dos multielectrodos (121 y 115 electrodos unipolares de acero inoxidable; diámetro, 0,125 mm; distancia entre electrodos, 1 mm), situados sobre la pared libre del VI. Se utilizó un sistema de cartografía (MAPTECH, Waalre, Países Bajos) con una frecuencia de muestreo en cada canal de 1 kHz. Se empleó como electrodo indiferente una placa de Ag/AgCl de 4×6 mm situada sobre la aorta. La estimulación ventricular se realizó con electrodos bipolares (diámetro, 0,2 mm; distancia entre electrodos, 1 mm) situados en el centro de cada multielectrodo. Para obtener la captura ventricular durante la FV, se aplicaron estímulos bifásicos de 2 ms e intensidad 6 veces el umbral diastólico.
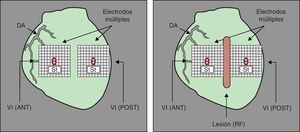
Protocolo experimentalUna vez transcurridos 30 min, se indujo la FV mediante estimulación a frecuencias crecientes y se mantuvo la perfusión coronaria durante la arritmia. A los 5 min se aplicaron trenes de estímulos de 15 s de duración a tres ciclos distintos (un 10% más corto, igual o un 10% más largo que el ciclo medio durante la FV), dejando pausas de 15 s entre ellos. La duración de esta fase fue de 15 min. En la mitad de los experimentos, la estimulación se efectuó en la pared anterior del VI y en la otra mitad, en la pared posterolateral. Una vez aplicados los trenes de estímulos (10 con cada ciclo), se efectuó con RF una lesión lineal situada verticalmente en la zona media de la pared anterolateral del VI (Figura 1). Para ello se realizaron aplicaciones sucesivas de RF (10 W durante 20 s) utilizando un electrodo de aguja que se insertaba perpendicular al epicardio, asegurándose de que la porción insertada fuera de longitud ligeramente mayor que el grosor medio de la pared20, 29. La longitud de la lesión en esta fase fue de 10±1mm, con una anchura máxima de 3,9±0,2mm. Tras 10 min de estabilización, se repitió el protocolo, y una vez finalizado, se aumentó la extensión de la lesión (longitud media, 23±2mm; anchura máxima, 4,1±0,3 mm) (Figura 2, Figura 3) repitiendo el protocolo de estimulación a los 10 min. El tiempo transcurrido desde la inducción de la FV hasta la finalización del protocolo fue de 70 min y la duración total de cada experimento desde la extracción del corazón fue siempre < 2h.
Figura 1. Esquema con la ubicación de los multielectrodos epicárdicos sobre la pared anterior y posterolateral del ventrículo izquierdo, así como la situación de la lesión. DA: arteria coronaria descendente anterior; RF: radiofrecuencia; St: electrodo de estimulación; VI (ANT): pared anterior del ventrículo izquierdo; VI (POST): pared posterior del ventrículo izquierdo.
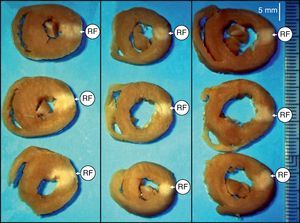
Figura 2. Secciones transversales de los corazones correspondientes a tres experimentos en las que macroscópicamente se observa la transmuralidad de la lesión efectuada con radiofrecuencia. RF: radiofrecuencia.
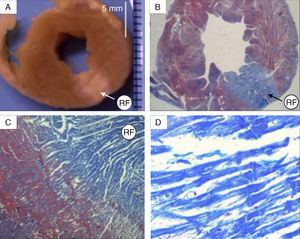
Figura 3. A: sección transversal de uno de los corazones en la que se visualiza la lesión transmural efectuada con radiofrecuencia. B-D: preparaciones histológicas a distintos aumentos (B, ×2; C, ×10; D, ×20) en las que la tinción tricrómica ayuda a distinguir la zona lesionada del miocardio adyacente no lesionado. En la imagen de mayor aumento se aprecia la presencia de bandas de contractura en los miocitos lesionados. RF: radiofrecuencia.
Parámetros analizadosActivación miocárdica durante la fibrilación ventricularEn cada electrodo se identificaron los tiempos de activación local mediante la determinación de la máxima pendiente negativa de los electrogramas unipolares, y cuando mostraban dos o más deflexiones, se asignó a aquella con la pendiente más pronunciada. Se obtuvieron los histogramas de los ciclos de activación correspondientes a cada una de las dos zonas de estudio y se determinaron la mediana, los percentiles 5 y 95 y las diferencias entre ambos.
A partir del análisis de las variaciones en la morfología de los electrogramas consecutivos, se determinó un índice de regularidad (IR) que cuantifica (entre 0 y 1) la semejanza de los electrogramas en cada canal considerado30, 31. Para señales repetitivas en las que la morfología de las ondas de activación es muy similar, el valor del índice es alto, mientras que disminuye cuando dicha morfología es variable. Para obtener el IR, se efectuó un filtrado pasa-banda para eliminar las oscilaciones basales y el ruido (filtro FIR de orden 40, banda pasante 5-40Hz, ventana de Kaiser), y tras la identificación de las activaciones locales, se calculó el baricentro de las señales, definido como el punto que divide el área del módulo de la señal en dos partes iguales. Una vez normalizadas las señales para evitar variaciones en amplitud, se analizó la similitud entre las ondas de activación sucesivas detectadas en cada canal durante segmentos de 4 s.
Asimismo se construyeron los mapas de activación de las dos zonas exploradas a intervalos de 100 ms durante ventanas de tiempo de 2 s en cada fase, antes de aplicar los protocolos de estimulación (basalmente, tras la lesión inicial y tras su ampliación). Tras la construcción de las isocronas, se cuantificaron los frentes de activación que llegaban a las dos zonas procedentes de cada uno de los lados del electrodo. Cuando el frente llegaba simultáneamente por dos de los lados, se asignó la entrada al de mayor número de electrodos activados.
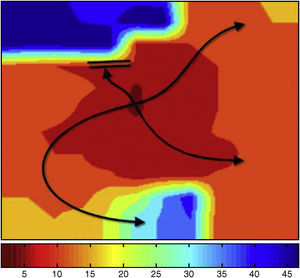
Captura miocárdica durante la fibrilación ventricularSe utilizó un procedimiento secuencial procesando las señales para caracterizar: a) la posible sincronización entre los estímulos y la señales registradas en los electrodos cercanos al de estimulación; b) la existencia de patrones de activación centrífugos desde el electrodo de estimulación (Figura 4), y c) la coincidencia del momento de activación en dicha zona con el de emisión de los estímulos. Una vez señalados los posibles episodios de captura, se procedió a la edición manual de los mapas seleccionados con el objeto de confirmar la existencia de captura.
Figura 4. Mapa de activación durante la fibrilación ventricular, en el que se observa un patrón de activación centrífugo desde la zona central donde se aplican los estímulos. La codificación en color indica los tiempos de activación local y las isocronas.
Análisis estadísticoLas comparaciones entre los valores medios de las variables cuantitativas (diferencias intraindividuales, medidas repetidas) se efectuaron mediante la utilización del modelo general lineal. Se consideraron estadísticamente significativos valores de p<0,05.
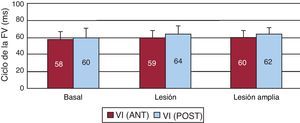
ResultadosModificación de la activación miocárdica durante la fibrilación ventricular producida por la lesiónLa Figura 5 muestra los promedios de la mediana de los ciclos de la FV en las dos zonas del VI estudiadas. No se observan variaciones significativas tras la lesión y tras su ampliación.
Figura 5. Media±desviación estándar de la mediana de los intervalos entre las activaciones sucesivas durante la fibrilación ventricular obtenidos en las dos zonas de estudio basalmente, tras efectuar la lesión y tras su ampliación. FV: fibrilación ventricular; VI (ANT): pared anterior del ventrículo izquierdo; VI (POST): pared posterolateral del ventrículo izquierdo. Valores en milisegundos.
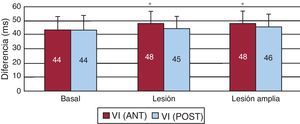
En la Figura 6 se representan los promedios de las diferencias entre los percentiles 95 y 5 de los ciclos en las dos zonas de estudio en las tres fases experimentales. Tras la lesión se observa un ligero incremento estadísticamente significativo en la zona anterior del VI.
Figura 6. Media±desviación estándar de las diferencias entre los percentiles 95 y 5 de los histogramas correspondientes a los intervalos entre las activaciones sucesivas durante la fibrilación ventricular, obtenidos en las dos zonas de estudio en las tres fases experimentales. VI (ANT).: pared anterior del ventrículo izquierdo; VI (POST): pared posterolateral del ventrículo izquierdo. Valores en milisegundos. *p < 0,05 respecto a los valores basales.
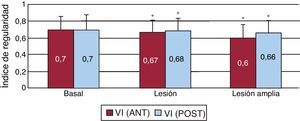
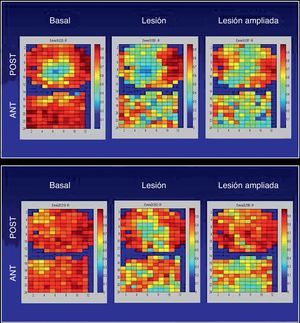
La Figura 7 muestra los promedios del IR obtenido en las dos zonas en cada fase. Tanto en la zona anterior como en la posterolateral, es significativamente menor tras la lesión y tras su ampliación. En la Figura 8 se representan los mapas del IR obtenidos en las dos zonas en dos de los experimentos efectuados. Se observa la disminución del IR en gran parte de los electrodos tras la lesión y tras su ampliación.
Figura 7. Media±desviación estándar del índice de regularidad obtenido en las dos zonas de estudio en cada una de las fases experimentales. VI (ANT): pared anterior del ventrículo izquierdo; VI (POST): pared posterolateral del ventrículo izquierdo. *p<0,05 respecto a los valores basales.
Figura 8. Representación, codificada en color, de los índices de regularidad obtenidos en cada uno de los electrodos de los dos multielectrodos situados en las paredes anterior y posterolateral del ventrículo izquierdo basalmente, tras efectuar la lesión y tras su ampliación. ANT: anterior; POST: posterolateral.
Una vez construidos los mapas de activación durante la FV basalmente, tras la lesión y tras su ampliación (n=2.640), se calcularon los promedios de los frentes de activación que llegaban a las dos zonas de estudio desde cada uno de los lados de los multielectrodos. La Tabla 1 muestra los promedios obtenidos. Tras la lesión y su ampliación, en la pared anterior disminuyeron significativamente los procedentes de la parte derecha y de la parte inferior y aumentaron los de la parte izquierda, opuesta a la lesión, y los de la superior. En la pared posterolateral aumentaron los de la derecha y disminuyeron los procedentes de la izquierda, situada junto a la lesión. Al extender la lesión, disminuyeron significativamente los que llegaban desde la parte superior.
Tabla 1. Media±desviación estándar del número de frentes de activación que llegan a las zonas abarcadas por los electrodos múltiples situados en la pared anterior y posterolateral del ventrículo izquierdo desde cada uno de los lados que forman dichos multielectrodos en las tres fases experimentales
| Basal | Lesión | Lesión ampliada | |
| Pared anterior | |||
| Superior | 4,8±1,9 | 5,5±2,1 a | 5,2±2,2 a |
| Derecho | 3,2±1,6 | 2,9±1,7 a | 2,2±1,4 a,b |
| Inferior | 3,4±2,1 | 3,1±2,1 a | 2,4±1,9 a,b |
| Izquierdo | 4,5±2,1 | 5,6±2,9 a | 7,1±3,2 a,b |
| Pared posterolateral | |||
| Superior | 4,2±2 | 4,2±2,1 | 3,8±2,2 a,b |
| Derecho | 3,6±1,8 | 4,4±2,1 a | 5,1±2,3 a,b |
| Inferior | 5,5±2,3 | 5,5±2,4 | 5,6±2,7 |
| Izquierdo | 3,8±1,8 | 3,3±2 a | 2,6±1,7 a,b |
a p<0,05 respecto a los valores basales.
b p<0,05 respecto a la lesión inicial.
Se cuantificaron también los mapas con patrones de afloramiento y con reentrada completa. Antes de efectuar la lesión, las proporciones de ambos tipos de mapas fueron, respectivamente, del 33 y el 8%. Tras efectuar la lesión, fueron del 31 y el 7%, y tras ampliar la lesión, del 27 y el 8%. Las diferencias entre las tres fases no son estadísticamente significativas. En los mapas con evidencia de reentrada completa, el promedio del número de giros o rotaciones fue 1,2±0,2 antes de la lesión, 1,1±0,2 tras la lesión y 1,1±0,1 tras ampliarla (diferencias no significativas).
Captura miocárdica durante la fibrilación ventricularPara evaluar el algoritmo utilizado en la identificación de capturas, en ocho de los registros obtenidos en experimentos diferentes se efectuó un análisis manual de los mapas de activación correspondientes a 2.180 estímulos emitidos, y se identificaron 22 capturas. Al aplicar el procesado automático, se detectaron activaciones que cumplían los criterios de posibles capturas en 581 ocasiones, y 21 de las 22 capturas identificadas manualmente se encontraban en este grupo. Así, el algoritmo tuvo una sensibilidad del 95%, con una especificidad del 79%. El valor predictivo negativo fue alto (99%) y su aplicación redujo considerablemente el número de mapas que hubo que analizar manualmente, con una baja probabilidad de excluir estímulos con captura.
La Tabla 2 muestra el número de capturas observadas en cada fase. Basalmente, las diferencias para cada ciclo no fueron significativas y lo mismo sucedió tras efectuar la lesión. Tras ampliar la lesión, el número de capturas con ciclos un 10% más largos que el de la FV fue significativamente mayor que el de las obtenidas con ciclos un 10% más cortos y las obtenidas basalmente. No obstante, el número de capturas fue similar al obtenido basalmente, con ciclos un 10% más cortos que el de la arritmia. La Tabla 3 muestra los promedios de los episodios correspondientes a cada experimento en que se pudo constatar al menos tres capturas consecutivas. Se observa que el número de episodios es reducido y que no hay diferencias entre los tres ciclos basalmente y tras la lesión inicial. Tras la ampliación de la lesión, el promedio aumentó ligeramente y fue significativamente mayor para ciclos un 10% más largo que el de la FV. Con ciclos un 10% más cortos que el de la FV, el número de episodios con captura se redujo tras efectuar la lesión y tras su ampliación. Ninguno de los episodios de captura dio lugar a la interrupción de la FV.
Tabla 2. Media±desviación estándar del número de estímulos con captura durante la fibrilación ventricular obtenidos en cada caso durante la estimulación con ciclos un 10% más cortos, iguales o un 10% más largos que el ciclo medio de la fibrilación en las tres fases de estudio
| Basal | Lesión | Lesión ampliada | |
| Ciclo 10% más corto | 89±54 | 68±51 | 49±34 |
| Ciclo igual | 84±58 | 70±42 | 79±50 |
| Ciclo 10% más largo | 56±35 | 42±22 | 85±41 * |
* p<0,05 respecto a los valores basales y al ciclo un 10% más corto.
Tabla 3. Media±desviación estándar del número de episodios con tres o más capturas consecutivas durante la fibrilación ventricular, obtenidos en cada caso durante la estimulación con ciclos un 10% más cortos, iguales o un 10% más largos que el ciclo medio de la fibrilación en las tres fases de estudio
| Basal | Lesión | Lesión ampliada | |
| Ciclo 10% más corto | 1,8±1,9 | 0,1±0,1 a | 0,1±0,1 a |
| Ciclo igual | 1,1±0,6 | 0,8±0,4 | 0,8±0,9 |
| Ciclo 10% más largo | 0,6±0,7 | 1±1 | 3±2,8 a,b |
a p<0,05 respecto a los valores basales.
b p<0,05 respecto al ciclo un 10% más corto.
Tras las lesiones, el número total de frentes de activación detectados en las zonas cartografiadas no varió significativamente, aunque hubo una disminución significativa de los procedentes de la zona homolateral a la lesión. En una muestra aleatoria de 50 capturas correspondientes a cada una de las tres fases del protocolo, se analizaron las características del mapa de activación previo a la captura. En estos mapas, el número de frentes de activación homolaterales a la zona en que se situó la lesión disminuyó significativamente tras la lesión y tras su ampliación (basal, 9%; lesión, 2%; lesión ampliada, 0; p<0,01).
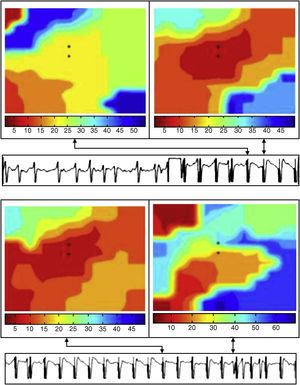
La Figura 9 muestra los mapas correspondientes a uno de los episodios de captura obtenidos tras la lesión inicial durante la estimulación desde la pared anterior del VI. En la parte superior izquierda, se muestra el mapa previo a la captura en que la activación de la zona donde se encuentra el electrodo precede a la emisión del estímulo. A la derecha se observa la captura que origina un patrón de activación centrífugo desde la zona de aplicación del estímulo. En la parte inferior izquierda, se observa otro de los mapas en que también hay captura, y a la derecha se observa la pérdida de la captura por la activación de la zona central por un frente que alcanza esta zona antes de la emisión del estímulo.
Figura 9. Mapas de activación correspondientes a uno de los episodios de captura obtenidos tras efectuar la lesión. En el registro obtenido con uno de los electrodos, se indica el momento correspondiente a cada uno de los mapas. La codificación en color indica los tiempos de activación local y las isocronas. El electrodo de estimulación se sitúa en la zona central del multielectrodo, ubicado en la pared anterior del ventrículo izquierdo.
DiscusiónLos principales resultados obtenidos son: a) la realización de la lesión en la pared libre del VI aumenta la heterogeneidad de la activación miocárdica durante la FV y modifica la llegada de los frentes a las zonas adyacentes; b) la estimulación durante la FV con trenes de estímulos a frecuencias rápidas provoca capturas ocasionales durante al menos tres estímulos consecutivos, y c) la lesión ampliada incrementa ligeramente las capturas consecutivas al utilizar ciclos ligeramente más largos que los de la arritmia.
Modificación de la activación miocárdica durante la fibrilación ventricular producida por la lesiónLa ablación transcatéter con RF es una técnica muy utilizada para el tratamiento de diversos tipos de arritmias y se han estudiado ampliamente sus efectos sobre el sustrato y la transmisión de los impulsos en la fibrilación auricular32. Los efectos de la ablación han sido menos estudiados en relación con la FV15, 16, 17, 18, 19, 20, 21. En pacientes con FV primarias idiopáticas o asociadas a síndromes con QT largo o síndrome de Brugada, las aplicaciones selectivas de RF en el sistema de Purkinje o en el tracto de salida ventricular derecho y en los lugares de inicio de extrasístoles se han mostrado eficaces en la prevención de episodios arrítmicos18.
En modelos experimentales con corazones aislados de conejo, la ablación del músculo papilar anterior terminó la FV durante la perfusión de propranolol y redujo su inducibilidad21. Al efectuar lesiones que abarcaban la zona posterior del septo y de las paredes ventriculares, la zona anterior del septo y de las paredes o la zona medioseptal, se modificó o se interrumpió la activación en zonas extensas del miocardio excluyéndolas del proceso de activación durante la FV, y se observó que no eran esenciales para la perpetuación de la FV20.
En el presente estudio, con un modelo experimental similar, la lesión se ha situado entre los músculos papilares y sin alcanzar el surco auriculoventricular, hechos que probablemente han determinado la ausencia de cambios en el ciclo medio de la arritmia, aunque se ha modificado la llegada de los frentes de activación a las zonas exploradas, con una reducción de las entradas desde la zona de la lesión, principalmente a expensas de aumentos en las zonas opuestas a ella. La transmuralidad de las lesiones se ha comprobado macroscópicamente en todos los casos visualizando su extensión desde el epicardio hasta el endocardio. La verificación histológica se ha efectuado en un tercio de los casos y no se puede descartar que en los restantes hayan persistido en las lesiones zonas limitadas de miocardio no dañado. En relación con la estabilidad de las preparaciones, en el trabajo no se ha desarrollado un grupo control, aunque en estudios previos en que se utilizó una preparación experimental similar3, 20 se observó que las propiedades electrofisiológicas del miocardio ventricular se mantenían estables durante periodos de hasta 2 h, en lo referente tanto a la refractariedad como a la velocidad de conducción, y que en los registros de la FV obtenidos durante largos periodos, si se mantenía la perfusión coronaria, tanto los ciclos entre activaciones sucesivas como la frecuencia dominante eran estables, excepto inmediatamente después de la inducción de la arritmia.
Captura miocárdica durante la fibrilación ventricular. Efectos de la lesiónKenknight et al33 observaron en un modelo porcino capturas regionales del miocardio durante la FV al emitir trenes de estímulos con ciclos comprendidos entre el 80 y el 115% del ciclo medio durante la arritmia. Estos resultados confirmaban la existencia de una ventana de excitabilidad durante la FV, tal como se había demostrado previamente durante la fibrilación auricular en un modelo canino26, 27. Nanthakumar et al24 efectuaron estimulación rápida desde una o dos líneas de electrodos ventriculares epicárdicos, y objetivaron la existencia de captura miocárdica durante la arritmia, al igual que Pak et al23, que sincronizaron los frentes de activación con la finalidad de facilitar la terminación de la FV. Posteriormente, Ravi et al34 utilizaron técnicas de estimulación sincronizada para crear líneas de bloqueo durante la FV en corazones aislados y perfundidos de conejo. Johnson et al22 aplicaron la estimulación durante la FV para comparar la eficacia de algoritmos de estimulación adaptativos o fijos, y no observaron diferencias significativas. En el presente trabajo se han utilizado protocolos de estimulación fijos con tres ciclos de estimulación diferentes, uno similar al de la arritmia, otro ligeramente más largo y otro más corto. La identificación de las capturas durante la FV es un proceso laborioso, dado el elevado número de estímulos emitidos. Para facilitar esta labor, se ha utilizado un procedimiento secuencial y semiautomático que ha permitido excluir estímulos sin captura con una baja probabilidad de error. Se ha observado que basalmente la capacidad de captura ha sido limitada, tal como lo indica el número de episodios en los que existen al menos tres consecutivas. La observación aislada de mapas que cumplen los criterios de captura no excluye la posibilidad de que haya coincidido la emisión del estímulo con una activación espontánea iniciada en el centro del área explorada por afloramiento de un frente procedente de zonas subendocárdicas. Esta coincidencia es más improbable cuando se observan capturas repetidas, y por este motivo estas reflejan con mayor exactitud la capacidad de capturar al miocardio durante la arritmia.
La realización de la lesión lineal ha introducido modificaciones en los patrones de activación, especialmente en la llegada de los frentes desde la zona de la lesión, cuyo número se ha reducido tras su realización y tras su ampliación a expensas de cambios simultáneos en la llegada desde otras zonas. La capacidad de obtener capturas tras efectuar las lesiones ha seguido siendo escasa y no se ha evitado la perpetuación de la arritmia. No obstante, la lesión ampliada ha modificado la capacidad de obtener capturas sucesivas con un ligero incremento al estimular con ciclos un 10% más largos que los de la arritmia. La presencia de la lesión y la disminución de la llegada de frentes desde la zona en la que se encuentra pueden haber reducido las interferencias de los frentes que, al alcanzar la zona de estimulación antes de la emisión del siguiente estímulo, impiden la perpetuación de la captura miocárdica. Este es uno de los mecanismos implicados en la pérdida de la captura miocárdica durante los procesos fibrilatorios al estimular con ciclos ligeramente más largos que los de la arritmia26, 27.
Por otra parte, una vez ampliada la lesión, al estimular con ciclos más cortos que los de la arritmia ha habido una tendencia a que disminuya el número de capturas, aunque las diferencias no han alcanzado significación estadística. Una posible explicación es que, tras la realización de la lesión, se haya prolongado el límite inferior de la ventana excitable, con lo que disminuye la posibilidad de captura. Esta modificación podría deberse a la mayor irregularidad de la activación y a la propia acción de los estímulos, que a su vez acortaría el límite superior de la ventana excitable al generar activaciones reentrantes que interfieren con las capturas originadas por los estímulos sucesivos. Al estimular con ciclos más largos que los de la arritmia, el límite superior de la ventana excitable quedaría determinado en mayor medida por la llegada espontánea de los frentes de activación, entre ellos los que alcanzan esa zona más tardíamente, con lo que aumentaría la probabilidad de que los estímulos coincidieran con la ventana excitable.
Repercusiones clínicasLa estimulación eléctrica es útil para interrumpir las taquicardias ventriculares y, de hecho, los desfibriladores implantables incluyen esta modalidad de estimulación para iniciar el control de esas arritmias. La captura regional del miocardio durante la FV ha sido menos estudiada y se está empezando a definir sus efectos y los factores que la favorecen o que la limitan. El presente trabajo se sitúa en este terreno y permite definir algunas de las limitaciones de los procedimientos de captura mediante estimulación a frecuencias rápidas. Los resultados obtenidos pueden ser de utilidad para orientar la investigación futura sobre la captura miocárdica durante la FV mediante procedimientos de estimulación programada.
Limitaciones del estudioLas características del modelo utilizado hacen posible analizar la FV y los efectos de las lesiones sin la interferencia del deterioro metabólico que acompaña al desencadenamiento de la FV, aunque restringe el análisis de los resultados a situaciones similares a los momentos iniciales de la arritmia cuando esta ocurre en un contexto clínico.
ConclusionesLa lesión efectuada con RF aumenta la heterogeneidad de la activación miocárdica durante la FV y modifica la llegada de los frentes de activación a las zonas adyacentes. La estimulación durante la FV a frecuencias rápidas provoca capturas ocasionales durante al menos tres estímulos consecutivos. La lesión ampliada incrementa ligeramente la capacidad de captura al utilizar ciclos ligeramente más largos que los de la FV.
FinanciaciónTrabajo financiado mediante las ayudas a la investigación del Instituto de Salud Carlos III FIS PI06/0758-PS09/02417 y RETIC REDINSCOR RD06/0003/0010, de la Generalitat Valenciana PROMETEO 2010/093 y de la Sociedad Española de Cardiología.
Conflicto de interesesNinguno.
Recibido 29 Abril 2011
Aceptado 8 Septiembre 2011
Autor para correspondencia: Servicio de Cardiología, Hospital Clínico Universitario de Valencia, Avda. Blasco Ibáñez 17, 46010 Valencia, España. Francisco.J.Chorro@uv.es