Cuando la fibrinolisis fracasa en pacientes con infarto de miocardio con elevación del ST, está indicadad la realización de una intervención coronaria percutánea (ICP) de rescate. Sin embargo, hay pocas evidencias sobre la cantidad del miocardio en riesgo que realmente puede rescatarse tras una ICP de rescate.
MétodosSe realizó resonancia magnética cardiaca en un plazo de 6 días a 50 pacientes consecutivos. La necrosis miocárdica se definió mediante la extensión de la captación tardía de contraste; el miocardio en riesgo, mediante la extensión del edema, y la cantidad de miocardio rescatado, mediante la diferencia entre el miocardio en riesgo y la necrosis miocárdica. Finalmente, el índice de miocardio rescatado (IMR) se obtuvo a partir de la fracción área en riesgo tamaño de infarto/área en riesgo.
ResultadosLa media de tiempo transcurrido entre el inicio del dolor y la administración del fármaco fibrinolítico fue de 176 ± 113min; el tiempo de lisis-ICP de rescate fue de 209±122min; el tiempo de inicio del dolor-ICP fue de 390±152min. El área en riesgo fue del 37±13% y el tamaño del infarto, del 34,5±13%. El miocardio rescatado fue un 3±4% y el IMR, 9±8. El miocardio rescatado y el IMR fueron similares en los pacientes con una arteria permeable a la llegada al laboratorio de cateterismo (Thrombolysis in Myocardial Infarction [TIMI] 3) y en los que tenían un flujo TIMI ≤ 2 (el 3,3±3,6% y 8,2±6,9 [p=0,8] en los casos de TIMI 0-2 frente al 3±3,7% y 10,8±10,9 [p=0,31] en los de TIMI 3). No se observaron diferencias significativas entre los pacientes a los que se efectuó la ICP de rescate en un plazo corto y aquellos a los se intervino tras un intervalo mayor.
ConclusionesLa cantidad de miocardio rescatado tras una ICP de rescate cuantificada mediante resonancia magnética cardiaca es muy pequeña. El largo tiempo entre el inicio del dolor y la apertura de la arteria relacionada con el infarto es la causa más probable de este efecto mínimo de la ICP de rescate.
Palabras clave
El mejor tratamiento en los pacientes con infarto de miocardio con elevación del ST (IAMCEST) consigue una reperfusión rápida, adecuada y persistente de la arteria relacionada con el infarto. Aunque se ha demostrado que la intervención coronaria percutánea (ICP) primaria es superior a la fibrinolisis1, 2, esta sigue siendo la opción más frecuentemente utilizada en alrededor del 50% de los pacientes, principalmente debido a las dificultades logísticas que comporta la realización de la ICP primaria. En un 30-50% de los casos, la fibrinolisis no logra restablecer un flujo efectivo en el vaso (flujo Thrombolysis in Myocardial Infarction [TIMI] 3)3; estos pacientes presentan una tasa de mortalidad, tanto inicial como tardía, más alta que los pacientes en los que se alcanza un flujo adecuado4. En estos casos, a menudo se utiliza la angioplastia de rescate para restablecer un flujo TIMI 3. No obstante, se discuten sus efectos beneficiosos, en cuanto a reducción de la tasa de mortalidad, tras los resultados de los ensayos clínicos publicados hasta el momento, como el MERLIN (Middlesbrough early revascularization to limit infarction)5 y el REACT (Rescue angioplasty after failed thrombolytic therapy for acute myocardial infarction)6, y el nivel de la recomendación actualmente en las guías europeas y norteamericanas es IIa7, 8.
Diversos ensayos clínicos recientemente publicados han utilizado diferentes técnicas de imagen para evaluar adecuadamente la cantidad de miocardio en riesgo que se puede rescatar en un infarto agudo de miocardio (IAM) tras la reperfusión9, 10. Sin embargo, continúa sin estar claro qué cantidad de miocardio potencialmente en riesgo puede rescatarse realmente al realizar una angioplastia de rescate.
La resonancia magnética cardiaca (RMC) ha pasado a ser la técnica ideal para el estudio integral de los pacientes con miocardiopatía isquémica, puesto que nos permite no sólo evaluar la función miocárdica, sino también determinar la extensión del IAM en el mismo estudio11.
Según nuestra hipótesis, la cantidad de miocardio rescatado tras el fallo de la fibrinolisis y el uso de una angioplastia de rescate en pacientes con IAMCEST (caracterizado mediante RMC) es más bien bajo, fundamentalmente debido al retraso en los diferentes tiempos de ejecución.
El objetivo principal de este estudio es cuantificar el miocardio rescatado tras la angioplastia de rescate realizada en pacientes con IAM utilizando RMC. El objetivo secundario es evaluar la relación entre la variación en los tiempos transcurridos hasta la angioplastia y la cantidad de miocardio rescatado.
MÉTODOSPoblación en estudioEste ensayo prospectivo se llevó a cabo en un único centro de nivel terciario entre junio de 2008 y febrero de 2009. Incluimos en el estudio a 63 pacientes consecutivos a los que se practicó una ICP de rescate en nuestro laboratorio de cateterismo. Estos pacientes habían sido remitidos a ICP de rescate tras el fracaso terapéutico de la fibrinolisis en siete hospitales de nivel «secundario» en los que no se disponía de laboratorios de cateterismo ni de un equipo de cardiólogos intervencionistas de guardia, por lo que el método de elección para el tratamiento del IAMCEST fue la fibrinolisis. El IAMCEST se definió por la presencia de dolor torácico anginoso de una duración > 30 min, no aliviado con nitratos sublinguales y asociado a una elevación típica del segmento ST en el electrocardiograma (ECG) de 12 derivaciones (≥ 2 mm en dos o más derivaciones torácicas contiguas y ≥ 1 mm en dos o más derivaciones contiguas de las extremidades). Todos los pacientes recibieron una dosis ajustada según el peso de un fármaco con acción específica sobre la fibrina (tenecteplasa); ácido acetilsalicílico, 300mg por vía oral; una dosis de carga oral de clopidogrel, 300mg, y enoxaparina en bolo intravenoso seguido de una primera dosis subcutánea 15 min después. La falta de respuesta al tratamiento fibrinolítico se definió mediante un segundo ECG de 12 derivaciones obtenido 90 min después de iniciado el tratamiento fibrinolítico, en el que se evidenciaba falta de resolución de la elevación del segmento ST en un 50% respecto al ECG previo al tratamiento (medido 80 mg después del punto J) en la derivación con máxima elevación. Se contactó con el cardiólogo intervencionista de guardia y se trasladó al paciente a nuestro centro para que pudiera realizarse la ICP de rescate.
Criterios de exclusiónSe excluyó finalmente a los pacientes con inestabilidad clínica tras la ICP de rescate (arritmia grave o insuficiencia cardiaca) y a los que presentaban contraindicaciones conocidas para la RMC (claustrofobia, marcapasos o dispositivos desfibriladores implantables). Se excluyó también a los pacientes con un infarto previo (con independencia de su localización, en el mismo lugar o en otra zona) con objeto de evitar la confusión al calcular la cantidad de miocardio rescatado.
El protocolo del estudio fue aprobado por el comité ético local, y todos los pacientes dieron su consentimiento informado por escrito una vez se les hubo explicado el objetivo de esta investigación.
Angioplastia de rescateA criterio del operador, se administró a los pacientes el inhibidor de la glucoproteína IIb/IIIa abciximab en forma de bolo intravenoso de 0,25mg/kg e infusión de 0,125mg/kg/min (máximo 10mg/min durante 12 h) en el laboratorio de cateterismo. La elección de la vía de acceso radial o femoral, el diámetro del catéter (5-7 Fr), el tipo de stent (stent metálico convencional o stent liberador de fármaco), así como la trombectomía, corrió a cargo del operador.
Registramos las características clínicas y demográficas de los pacientes, así como las características angiográficas al ingreso, y analizamos también el tiempo transcurrido desde los primeros síntomas hasta el inicio del tratamiento fibrinolítico, el tiempo entre la trombolisis ineficaz y la llegada del paciente al laboratorio de cateterismo y, finalmente, el tiempo total transcurrido entre el inicio de los síntomas y el hinchado del balón. Las proyecciones angiográficas utilizadas fueron las que permitían una evaluación óptima del flujo TIMI en la arteria relacionada con el infarto (grado 0=ausencia de flujo anterógrado más allá del punto de oclusión; grado 1=el medio de contraste supera la zona de obstrucción pero no logra opacificar la totalidad del lecho distal a ella; grado 2=el medio de contraste supera la obstrucción y opacifica el lecho coronario distal a la obstrucción pero lo hace más lentamente que el flujo normal; grado 3=flujo normal)3. El análisis angiográfico incluyó el flujo pre-ICP y post-ICP en el vaso culpable, así como la presencia de un trombo visible. Se examinó también el grado de afección vascular (arterias con al menos una lesión > 50%), así como la fracción de eyección del ventrículo izquierdo. La ausencia de restablecimiento de flujo angiográfico se definió por la falta de restablecimiento de un flujo adecuado (flujo TIMI 3) tras la ICP, sin signos angiográficos de obstrucción vascular mecánica.
Estos datos fueron revisados off-line por un mismo investigador experto al que se ocultó tanto la información clínica como el resultado. Se realizó un ECG 30 min después de la intervención. El mismo cardiólogo analizó de manera enmascarada todos los ECG; se definió la resolución del ST como la disminución de su elevación en más de un 50% respecto al ECG inicial.
Resonancia magnética cardiacaLa RMC se realizó en un plazo máximo de 6 (2-6) días para garantizar que los resultados de la RMC se debían a cambios agudos.
Obtención de las imágenesSe utilizó un escáner de 1,5 T (Intera CV; Philips Medical Systems, Best, Países Bajos). Durante toda la exploración, se mantuvo una monitorización continua del ECG junto con oximetría de pulso. Los pacientes se colocaron en decúbito prono. Todas las imágenes se obtuvieron mediante sincronización con el ECG y mientras el paciente aguantaba la respiración. La función del ventrículo izquierdo (VI) se evaluó con una técnica de precesión libre en estado de equilibrio estable estándar (tiempo de repetición, 3,3 ms; tiempo de eco, 1,7 ms; ángulo de giro (flip), 60°; matriz, 192×256; longitud de tren de eco, 23; grosor de corte, 8 mm; 20 fases). Posteriormente, se utilizó una secuencia de espín-eco rápida de inversión-recuperación triple, con ponderación T2 (T2 STIR) (tiempo de repetición, 2.000 ms; tiempo de eco, 100 ms; matriz, 256×512; grosor de corte, 8 mm; longitud de tren de eco, 33) que cubría todo el ventrículo, con objeto de determinar el área en riesgo. Por último, se obtuvo una imagen de captación de contraste tardía (LE) 5 min después de la administración de 0,1 mmol/kg de gadobutrol (Gadovist; Bayer Schering Pharma, Berlín, Alemania) utilizando una secuencia de gradiente-eco turbo de inversión-recuperación tridimensional (tiempo de repetición, 4,1 ms; tiempo de eco, 1,23 ms; ángulo de giro (flip), 15°; matriz 256×256) que cubría de nuevo todo el miocardio. El tiempo de inversión se determinó para anular el miocardio normal de forma individual.
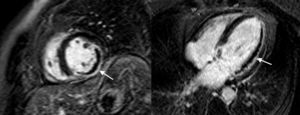
Análisis de las imágenesEl análisis de las imágenes corrió a cargo de un radiólogo experto en RMC, que lo llevó a cabo en una estación de trabajo independiente proporcionada por el fabricante (View-Forum versión 6.3; Philips Medical Systems). El borde endocárdico se determinó en la telesístole y la telediástole para todas las imágenes de eje corto, con objeto de analizar los volúmenes ventriculares (expresados en mililitros). Se evaluó también la presencia o ausencia de obstrucción microvascular (OMV), que se definió como la falta de llegada de contraste al núcleo del área de infarto en las imágenes de LE (Figura 1). La OMV se codificó de manera dicotómica (OMV positiva frente a OMV negativa): la OMV se consideró positiva cuando se observó en al menos un segmento. Se dibujó una región de interés dentro de un segmento miocárdico normal tras trazar manualmente los contornos epicárdico y endocárdico tanto en las imágenes T2 STIR como en las imágenes LE. Identificamos una región miocárdica como «afectada» cuando había más de la media +2 desviaciones estándar (DE) del miocardio establecido normal en las imágenes con ponderación T2 y +5 DE en las imágenes LE. A menudo se observó una hiperintensidad subendocárdica en los segmentos más apicales, y se excluyó trazando manualmente el contorno endocárdico.
Figura 1. Proyecciones de eje corto y de cuatro cámaras con contraste de gadolinio tardío en un paciente con un infarto transmural extenso en las paredes laterales e inferior del ventrículo izquierdo, con una importante zona concomitante de obstrucción microvascular (flechas).
La necrosis miocárdica se definió mediante la extensión de la LE anormal; el miocardio en riesgo, mediante la extensión del edema, y la cantidad de miocardio rescatado, mediante la diferencia entre el miocardio en riesgo y la necrosis miocárdica. Tanto el tamaño del infarto como el área en riesgo se expresaron en forma de porcentaje de la masa del VI total. Las áreas de OMV se incluyeron manualmente tanto en el miocardio en riesgo como en el miocardio con infarto. El índice de miocardio rescatado (IMR) se obtuvo con la siguiente fracción: área en riesgo menos tamaño del infarto/área en riesgo.
La coincidencia en el observador fue 0,96 (κ=0,88; intervalo de confianza [IC] del 95%, 0,67-1) para el área de necrosis y 0,93 (κ=0,84; IC del 95%, 0,59-1) para el área en riesgo al analizar a los primeros 20 pacientes.
Análisis estadísticoSe evaluó la distribución normal de las variables continuas con la prueba de Kolmogorov-Smirnov. Las variables continuas de distribución normal se presentan en forma de media±DE y las de distribución no paramétrica, en forma de mediana [intervalo intercuartílico]. Las variables discretas se presentan en forma de frecuencias (porcentajes) y se comparan luego con la prueba de la χ2 o la prueba de Fisher (según sea apropiado). Se utilizó la prueba de la t de Student para las variables continuas.
Todas las pruebas estadísticas fueron bilaterales y se consideró estadísticamente significativo un valor de p<0,05. Utilizamos el programa informático SPSS versión 15.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos) para realizar todos los análisis.
RESULTADOSTan sólo 50 de los 63 pacientes consecutivos seleccionados fueron incluidos finalmente en el estudio, ya que se excluyó a 13 por no cumplir todos los criterios: claustrofobia (2), inestabilidad clínica o muerte tras la ICP de rescate (3), marcapasos o dispositivos desfibriladores implantables (1), IAM previo (5), imposibilidad de dilatar el vaso culpable (1) y pérdida del seguimiento (1). Las características basales de los 50 pacientes que finalmente constituyeron la población en estudio se indican en la Tabla 1; el 68% de ellos se encontraba en la clase 1 de Killip-Kimball al ingreso.
Tabla 1. Características basales de la población en estudio y datos de la intervención coronaria percutánea de rescate
| Pacientes | 50 |
| Media de edad (años) | 58,5±11,4 |
| Varones | 39 (78%) |
| Factores de riesgo cardiovascular | |
| Diabetes mellitus | 15 (30%) |
| Hipercolesterolemia | 25 (50%) |
| Tabaquismo | 29 (58%) |
| Hipertensión | 23 (46%) |
| Localización del IAMCEST | |
| Anterolateral | 29 (58%) |
| Posteroinferior | 21 (42%) |
| Grado del flujo TIMI antes de la ICP | |
| < 3 | 34 (68%) |
| 3 | 16 (32%) |
| Grado de flujo TIMI después de la ICP | |
| < 3 | 4 (8%) |
| 3 | 46 (92%) |
| Vaso culpable | |
| Descendente anterior izquierda | 27 (54%) |
| Arteria circunfleja | 5 (10%) |
| Arteria coronaria derecha | 18 (36%) |
| Enfermedad de múltiples vasos | 27 (54%) |
| FEVI en la angiografía (%) | 51,7±12,1 |
| Aspiración del trombo | 18 (36%) |
| Inhibidor de la glucoproteína IIb/IIIa | 12 (24%) |
| ICP con stent | 49 (94%) |
| Número de stents implantados | 1,2±0,7 |
| Uso de stents liberadores de fármacos | 20 (40%) |
| Ausencia de restablecimiento del flujo durante la ICP | 5 (10%) |
| Mejoría de la elevación del segmento ST tras la ICP | 50% |
FEVI: fracción de eyección ventricular izquierda; IAMCEST: infarto de miocardio con elevación del ST; ICP: intervención coronaria percutánea; TIMI: Thrombolysis in Myocardial Infarction.
Los datos se presentan en forma de n (%), salvo otra indicación.
Los principales resultados angiográficos se enumeran en la Tabla 1. El 68% de los pacientes presentaban un flujo TIMI 0-2, y en el 62% de los casos había un trombo coexistente. En un total de 18 pacientes (36%) se realizó una trombectomía percutánea. Se implantaron stents a 47 pacientes (94%); se utilizaron stents liberadores de fármacos en el 40% de los casos de ICP de rescate. Se alcanzó un flujo TIMI 3 en el 92% de los pacientes y una mejora del segmento ST en el 50%. No se produjeron eventos clínicos que indicaran una trombosis aguda o subaguda del stent durante el periodo transcurrido entre el estudio angiográfico y el estudio de RMC.
Tiempo hasta el tratamientoEn la Tabla 2 se resumen los tiempos transcurridos hasta el tratamiento. La media de tiempo transcurrido entre el inicio del dolor y la administración del fármaco fibrinolítico (tiempo dolor-aguja) fue de 176±113 min y la media de tiempo entre la lisis y la ICP de rescate fue de 209±122 min. La media de tiempo transcurrido entre el inicio del dolor y la ICP fue de 390±152 (mediana, 355 [275-480]) min. Se realizó una RMC en todos los pacientes en un plazo de 6 días tras el evento agudo, con una media de 4,7±1,3 días.
Tabla 2. Tiempos hasta el tratamiento
| Tiempo de dolor a lisis (min) | 176,4±113,3 (60-475) |
| Tiempo de lisis a ICP de rescate (min) | 208,6±121,6 (80-675) |
| Tiempo de dolor a ICP de rescate (min) | 389,6±152,2 (181-820) |
| Días hasta la RMC | 4,7±1,3 (2-6) |
ICP: intervención coronaria percutánea; RMC: resonancia magnética cardiaca.
Todas las exploraciones de RMC se consideraron diagnósticas. La secuencia con ponderación T2 permitió la detección del edema en todos los pacientes tras el IAM (de cara anterior o lateral en el 56% y de cara inferior o posterior en el 44%). Las imágenes con contraste tardío de gadolinio permitieron detectar la necrosis asociada al IAMCEST en todos los casos. Todos los pacientes presentaron una LE en la misma localización del edema, y ambos hechos son compatibles con el territorio del vaso coronario culpable. En la Figura 2 se muestra un ejemplo de los resultados en un paciente con un infarto de miocardio de cara inferior. En la Tabla 3 se resumen los resultados más significativos en relación con la RMC.
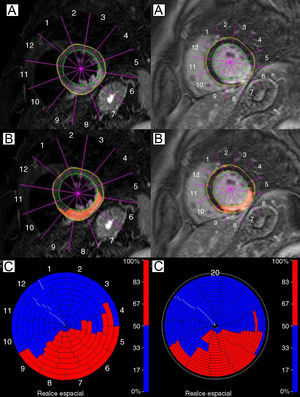
Figura 2. Hallazgos en la resonancia magnética cardiaca de un paciente con un infarto de miocardio de cara inferior. Izquierda: imagen con ponderación T2. Hay una intensidad de señal elevada que afecta a las paredes inferior, inferoseptal e inferolateral del ventrículo izquierdo (A y B); en C, representación en color de segmentos miocárdicos edematosos del ventrículo izquierdo (en rojo). Derecha: imagen de captación de contraste tardía en la que se observa una lesión miocárdica irreversible (A y B) con extensión y distribución muy similares a las del miocardio edematoso; en C, representación en color de segmentos miocárdicos no viables del ventrículo izquierdo (en rojo).
Tabla 3. Resultados de la resonancia magnética cardiovascular
| Total | TIMI ≤ 2 antes de ICP | TIMI 3 antes de ICP | p | |
| Pacientes, n | 50 | 34 | 16 | |
| Localización | 1 | |||
| Anterior o lateral, % (n/N) | 56 (28/50) | 19 | 9 | |
| Inferior o posterior, % (n/N) | 44 (22/50) | 15 | 7 | |
| Volumen telesistólico (ml) | 72,1±32,6 | 77,9±35,8 | 59,2±19,4 | 0,06 |
| Volumen telediastólico (ml) | 146,1±36,3 | 151,1±38,6 | 135,1±28,8 | 0,16 |
| FEVI (%) | 52,4±10,3 | 50,6±11,1 | 56,4±6,9 | 0,06 |
| Obstrucción microvascular tardía (% de VI) | 39,6 | 48,5 | 20 | 0,11 |
| Área en riesgo (% de VI) | 37,1±13,2 | 40±12,9 | 30,7±11,8 | 0,02 |
| Tamaño del infarto (% de VI) | 34,3±12,5 | 36,9±12,3 | 28,5±11,3 | 0,03 |
| Miocardio rescatado (% de VI) | 3,2±3,6 | 3,3±3,6 | 3±3,7 | 0,8 |
| Índice de miocardio rescatado (%) | 9±8,3 | 8,2±6,9 | 10,8±10,9 | 0,31 |
| Tiempo de dolor a lisis (min) | 176,4±113,3 | 173,5±100,8 | 182,2±138,3 | 0,81 |
| Tiempo de lisis a ICP de rescate (min) | 208,6±121,6 | 217,6±145,3 | 190,4±46,9 | 0,47 |
| Tiempo de dolor a ICP de rescate (min) | 389,6±152,2 | 395,2±167,4 | 379,9±121,7 | 0,73 |
| Tiempo hasta la RMC (días) | 4,7±1,3 | 4,5±1,5 | 5±1 | 0,25 |
FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; RMC: resonancia magnética cardiaca; TIMI: Thrombolysis in Myocardial Infarction; VI: ventrículo izquierdo.
Los datos expresan media±desviación estándar, salvo otra indicación.
La media de área de edema de la masa miocárdica total en las imágenes con ponderación T2 fue del 37±13% (área en riesgo) y la media de área de captación de contraste en las imágenes de LE fue del 34,5±13% (tamaño del infarto). Esto corresponde a una diferencia absoluta de un 3±4% (miocardio rescatado). En términos relativos, se salvó realmente tan sólo un 9±8% (IMR) del miocardio total en riesgo (área edematosa).
En el 40% de los casos, se detectó una OMV, generalmente situada en el subendocardio y que mostraba un grado variable de transmuralidad. Cuando había una OMV, el 58% de los casos tenía de 1 a 3 segmentos afectados, el 26% tenía entre 4 y 6, y el 16% tenía 7 u 8.
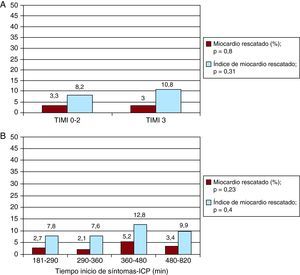
Relación entre el flujo Thrombolysis in Myocardial Infarction previo a la intervención coronaria percutánea de rescate y el miocardio rescatadoAnalizamos las diferencias entre los pacientes con y sin flujo TIMI 3 a la llegada al laboratorio de cateterismo (Tabla 3). Tanto el área en riesgo como el tamaño final del infarto fueron significativamente mayores en el grupo que presentaba una oclusión arterial y/o un flujo lento (TIMI 0-2) en comparación con el grupo que tenía un flujo normal (TIMI 3) (40±12,9 frente a 30,7±11,8 [p=0,02] y 36,9±12,3 frente a 28,5±11,3 [p=0,03] respectivamente). Sin embargo, el miocardio rescatado y el IMR fueron muy similares en ambos grupos (3,3±3,6 y 8,2±6,9 [p=0,8] en el grupo de TIMI 0-2 frente a 3±3,7 y 10,8±10,9 [p=0,31] en el grupo de TIMI 3). En la Figura 3A se presenta toda esta información.
Figura 3. A: cantidad de miocardio rescatado e índice de miocardio rescatado según el flujo Thrombolysis in Myocardial Infarction antes de la intervención coronaria percutánea. B: cantidad de miocardio rescatado e índice de miocardio rescatado según el tiempo transcurrido entre el inicio de los síntomas y la reperfusión (cuartiles). ICP: intervención coronaria percutánea; TIMI: Thrombolysis in Myocardial Infarction.
Relación entre el tiempo transcurrido hasta el tratamiento y el miocardio rescatadoEl tiempo transcurrido hasta el tratamiento se dividió en cuartiles para analizar su influencia en la cantidad de miocardio rescatado y el IMR. No se observaron diferencias significativas entre los pacientes tratados con ICP de rescate en un plazo más corto y los tratados tras un tiempo mayor. En la Figura 3B se muestra la cantidad de miocardio rescatado y el IMR en función del tiempo transcurrido entre los primeros síntomas y la reperfusión. No hubo diferencias estadísticas significativas entre esos cuatro grupos.
Se observó ausencia de relación entre la resolución del ST y la cantidad de miocardio rescatado (p=0,36) o el IMR (p=0,24). Tampoco hubo asociación alguna entre la presencia de un flujo TIMI 3 después de la ICP y la cantidad de miocardio rescatado (p=0,45) o el IMR (p=0,43).
DISCUSIÓNEn este estudio se ha analizado mediante la RMC el miocardio rescatado tras realizar una angioplastia de rescate. Sus resultados indican que los efectos beneficiosos, en cuanto a miocardio rescatado, son muy bajos. La principal razón es el largo tiempo transcurrido hasta que se desobstruye la arteria y se consigue un flujo efectivo.
La ICP de rescate suele utilizarse para restablecer un flujo TIMI 3 cuando el tratamiento fibrinolítico no ha sido eficaz. Esta estrategia no ha mostrado beneficios en cuanto a reducción de la mortalidad, y el nivel de recomendación en las guías actuales es IIa7, 8. Sin embargo, no se ha cuantificado nunca la cantidad de miocardio que se «rescata» realmente. La RMC es la única técnica no invasiva que permite detectar el área de miocardio afectada por el infarto (tanto el área necrótica con una lesión irreversible como el área del edema asociado). Este estudio brinda la oportunidad de evaluar estos índices en un nuevo escenario como el de la ICP de rescate, lo cual nos permite, a su vez, examinar la diferencia entre ambas áreas y, en última instancia, el «miocardio rescatado».
En estos pacientes, el edema es un hallazgo transitorio que aparece en las fases iniciales tras un IAM, tal y como se ha demostrado en estudios realizados en animales12 y en humanos13 con la extensión del tiempo de relajación transversal (o T2) que causa un aumento del contraste de señal entre el miocardio edematoso y el miocardio normal en secuencias con ponderación T214. La media de miocardio rescatado en nuestra serie es de un 3±4%, una cifra muy baja si se compara con el 14-18% de miocardio rescatado con una ICP primaria9, 15, 16 para infartos de un tamaño similar (el área en riesgo en nuestra serie fue del 37%, en comparación con el 35,2% en el estudio de Eitel16). Lo mismo puede decirse del IMR: 8,8±8 en nuestros pacientes con la ICP de rescate, en comparación con 48,3 en los estudios en los que se ha utilizado RMC en la ICP primaria16.
Los resultados descritos podrían explicar el limitado beneficio clínico que ha aportado la ICP de rescate en diferentes ensayos clínicos5, 6 (e incluso en un metaanálisis17) y la falta de reducción de la mortalidad. Así por ejemplo, el metaanálisis de Wijeysundera17 no reveló reducción alguna de la mortalidad con la ICP de rescate en comparación con el tratamiento médico (del 10,4 al 7,3%; riesgo relativo [RR]=0,69; IC del 95%, 0,36-1,05; p=0,09), aunque sí se observó menor frecuencia de reinfarto, con una reducción del 10,7 al 6,1% (RR=0,58; IC del 95%, 0,35-0,97; p=0,04), que está claramente relacionada con la desobstrucción del vaso diana.
Esta escasa cantidad de miocardio rescatado está claramente relacionada con el tiempo transcurrido hasta la permeabilización de la arteria. Este tiempo es bastante homogéneo y elevado en nuestro grupo de estudio (la media es de 390±152 min y el intervalo intercuartílico, 275-480 min), lo cual se debe relacionar con la falta de beneficio. Lógicamente, este largo tiempo se correlaciona con los diversos plazos intrínsecos de la ICP de rescate: tiempo desde la aparición de los síntomas hasta el primer contacto médico; tiempo desde el primer contacto médico hasta el inicio de la fibrinolisis; los 90 min necesarios tras el inicio del tratamiento fibrinolítico para observar una resolución<50% del segmento ST; el tiempo necesario para el traslado del paciente al laboratorio de cateterismo y el tiempo transcurrido entre la llegada al laboratorio y el hinchado del balón. En la angioplastia primaria se ha alcanzado de hecho una reducción de estos tiempos con diferentes programas y estrategias de actuación en todo el mundo18, basándose siempre en formación de equipos de cardiólogos intervencionistas de guardia, coordinados a través de sistemas de traslado dinámicos y ágiles. Lamentablemente, a diferencia de lo que ocurre en la ICP primaria18, los tiempos que transcurren hasta la aplicación de la ICP de rescate sólo pueden reducirse ligeramente. Los retrasos producidos en nuestro entorno (en la práctica clínica real) son muy similares a los observados en los ensayos clínicos, en los que han oscilado entre 258 y 414 min17.
La estrategia farmacológica invasiva (fibrinolisis seguida de angioplastia sistemática) ha aportado recientemente algunos datos muy prometedores en cuanto al tamaño del infarto y la OMV19. De hecho, podría ser una opción apropiada para los pacientes sin complicaciones graves, especialmente en zonas alejadas de los hospitales de nivel terciario.
Vale la pena señalar que nuestros resultados han sido uniformes. En primer lugar, los pacientes que acuden pronto (cuartiles 1 y 2) no obtienen más beneficio que los que acuden más tardíamente. El hecho de que el tiempo transcurrido desde la aparición de los síntomas hasta la reperfusión en el primer cuartil oscilara entre 181 y 290 min explica que la cantidad de miocardio rescatado fuera escasa (2,7%) en el mejor de los casos. Estos tiempos están lejos de los utilizados por algunos autores como hipótesis para determinar reducción de la mortalidad y aumento del miocardio rescatado20. En segundo lugar, el hecho de presentar una arteria permeable (TIMI 3) al llegar no parece tener un efecto más positivo (IMR=10,8 frente a IMR=8,2 en los casos con TIMI 0-2; p=0,31). Esto podría deberse a que la apertura de la arteria se haya producido demasiado tarde y también a la posible lesión causada por la reperfusión secundaria a la embolización distal; esta embolización podría explicar, en parte, por qué solamente el 50% de los pacientes presentaron una mejoría clara del segmento ST.
El fracaso de la fibrinolisis en un porcentaje elevado de pacientes (30-50%) y el limitado beneficio de la angioplastia de rescate deben ser otros pilares para el desarrollo y la consolidación de la angioplastia primaria como técnica de elección para la reperfusión en los pacientes con IAMCEST. Así pues, deberá hacerse todo lo posible para fomentar activamente programas como el Stent 4 Life21 patrocinado por la Sociedad Europea de Cardiología, cuyo principal objetivo es «implementar un programa de acción destinado a aumentar el acceso de los pacientes a la ICP primaria cuando esté indicado». Esto ayudará a evitar un escenario en el que casi la mitad de los pacientes reperfundidos con fibrinolisis apenas obtienen un beneficio en cuanto a miocardio rescatado.
LimitacionesAunque completamos el protocolo de este estudio prospectivo, la investigación se llevó a cabo en un solo centro y el número de pacientes fue bajo (n=50). En consecuencia, no pueden extraerse conclusiones clínicas, que obviamente no fueron el objetivo del estudio. El retraso en la realización de la RMC podría favorecer la resorción del edema y, por lo tanto, reducir la diferencia entre el área en riesgo y el tamaño del infarto. No obstante, el marco temporal para la realización de la RMC en nuestro estudio fue de 6 días, lo cual nos lleva a suponer que esta situación no debiera haberse producido todavía. Otra limitación que es preciso mencionar es la exclusión de los pacientes hemodinámicamente inestables, que no toleraban la RMC en los días siguientes al IAM. Esto explica por qué el 68% de nuestros pacientes tenían un IAMCEST Killip-Kimball 1. Así pues, no se examinó realmente el miocardio rescatado en el IAM con peor tolerancia hemodinámica y mayor mortalidad tanto a corto como a largo plazo, aunque la cantidad de miocardio rescatado en esos pacientes podría ser probablemente inferior a la de los pacientes que sí fueron examinados en este estudio. Como consideración final, hay que subrayar que no conocemos el porcentaje de pacientes a los que se trató con fibrinolisis y posteriormente se remitió a ICP de rescate. Tan sólo disponemos de información precisa de tres de los siete hospitales, que remitieron a un 32% de los pacientes tras la fibrinolisis.
CONCLUSIONESLa cantidad de miocardio rescatado tras la ICP de rescate, cuantificado mediante RMC, es muy pequeña. El largo tiempo transcurrido entre el inicio del dolor y la permeabilización de la arteria relacionada con el infarto (en promedio, 6,5 h) es muy probablemente la razón del efecto mínimo producido por la ICP de rescate. Estos retrasos (que, además, son muy difíciles de reducir) hacen que la falta de beneficio de la ICP de rescate apreciada en la RMC sea uniforme en el conjunto de este grupo de pacientes. La promoción de los programas de ICP primaria incrementaría los beneficios que ha obtenido un alto porcentaje de los pacientes asignados a la estrategia farmacológica de reperfusión.
CONFLICTO DE INTERESESNinguno.
Agradecimientos
Damos las gracias a todos los cardiólogos e intensivistas de la provincia de Alicante por su colaboración en la realización de este estudio.
Recibido 22 Enero 2011
Aceptado 28 Abril 2011
Autor para correspondencia: Departamento de Cardiología, Hospital General Universitario de Alicante, Pintor Baeza 12, 03010 Alicante, España. ruiz_jmi@gva.es