Diferentes estudios han mostrado mejoría funcional en pacientes con miocardiopatía dilatada no isquémica tratada con terapia celular. Sin embargo, los factores que influyen en la respuesta no son bien conocidos. El presente estudio investiga los cambios funcionales y los factores que influyen en la mejora de la fracción de eyección a los 6 meses en 27 pacientes con miocardiopatía dilatada tratados con terapia celular intracoronaria.
MétodosLos pacientes recibieron una infusión intracoronaria de células mononucleares autólogas de la médula ósea (media de células infundidas, 10,2±2,9 × 108). En todos se efectuó análisis funcional y citometría de flujo de las células infundidas.
ResultadosLa ganancia en fracción de eyección observada a los 6 meses osciló entre el −9 y el 34% (media, 9%). Estos cambios formaron dos grupos de pacientes: 21 (78%) que mostraron una mejora significativa (ganancia media, 14±7%), frente a 6 (22%) que no mostraron respuesta (ganancia media, −5±3%). Los respondedores eran más jóvenes (50±12 frente a 62±9 años; p<0,04). Se encontró una correlación inversa (r=−0,41; p<0,003) entre la ganancia en la fracción de eyección y los valores basales de lipoproteínas de alta densidad. La capacidad migratoria de las células infundidas a las 24h estaba significativamente reducida en el grupo de respondedores (factor de crecimiento del endotelio vascular, 5,4±1,7 × 108 frente a 8,1±2,3 × 108; p<0,009; factor 1 derivado de células estromales, 5,8±1,7 × 108 frente a 8,4±2,9 × 108; p<0,002).
ConclusionesLos pacientes más jóvenes con miocardiopatía dilatada y concentración plasmática de lipoproteínas de alta densidad más baja parecen tener mayor beneficio funcional tras la terapia celular. La mejoría funcional también parece aumentada en los pacientes con menor capacidad migratoria de las células infundidas.
Palabras clave
La infusión intracoronaria de células mononucleares derivadas de médula ósea autóloga (CMNMO) se ha utilizado para la recuperación funcional en pacientes con cardiopatía isquémica aguda1–3 o crónica4,5. Sin embargo, hay menos información sobre los efectos de las CMNMO en pacientes con miocardiopatía dilatada (MD) no isquémica. Diferentes estudios han mostrado una mejoría clínica y un leve efecto beneficioso en la función ventricular izquierda de pacientes con MD idiopática tratados con terapia celular6–12. Pero el grado de mejoría funcional varía de un paciente a otro y no se conoce bien los factores que influyen en esa respuesta. En este ensayo se investigan los factores que influyen en la ganancia de la fracción de eyección del ventrículo izquierdo (FEVI) a los 6 meses, en 27 pacientes con MD incluidos en un ensayo de la terapia celular intracoronaria.
MÉTODOSProtocolo del estudioSe propuso la participación en el ensayo a pacientes con MD idiopática. El protocolo del estudio (TCMR0007/06) fue aprobado por todos los comités institucionales, regionales y nacionales. El ensayo se presentó como ensayo clínico de fase II no controlado (EudraCT: 2007-003088-36) y se registró en www.clinical-trials.gov (NCT00629096). El objetivo principal fue evaluar la seguridad y la eficacia de la infusión intracoronaria de CMNMO en pacientes con MD idiopática que fueron objeto de seguimiento durante 1 año. Se diseñó un análisis biológico para relacionar la composición y la función de la médula ósea con los posibles cambios en la evolución clínica y funcional. Los criterios de inclusión fueron los siguientes: a) pacientes con diagnóstico clínico y angiográfico de MD idiopática, FEVI < 50% y signos y síntomas de insuficiencia cardiaca a pesar del tratamiento médico óptimo individualizado, y b) ritmo sinusal estable. Los criterios de exclusión fueron: a) MD de origen conocido (tóxica, isquémica, secundaria a quimioterapia o por depósito); b) un antecedente reciente de miocarditis; c) pacientes con criterios de asincronía que podrían obtener beneficio del tratamiento de resincronización; d) pacientes en lista de espera de trasplante cardiaco; e) pacientes de más de 80 años o que sufrieran otros trastornos sistémicos o hemáticos; f) mujeres embarazadas o con probabilidad de quedar embarazadas, y g) pacientes incluidos en cualquier otro tipo de ensayo clínico.
Después de que dieran su consentimiento informado por escrito, se estudió a todos los pacientes clínica y funcionalmente en cuatro etapas: basal (antes del tratamiento) y 3, 6 y 12 meses después de la infusión celular. Se llevaron a cabo evaluaciones ecocardiográficas seriadas antes del tratamiento, a los 3 meses y al año. Se realizó un estudio angiográfico antes del tratamiento y en la evaluación de los 6 meses. Se analizaron los cambios de la función ventricular izquierda considerados objetivo principal. La ganancia neta en la FEVI (angiográfica) fue el objetivo funcional principal. Como objetivos secundarios, se evaluó el curso clínico, la reserva de flujo coronario y los seguimientos ecocardiográficos, junto con las propiedades biológicas de las células infundidas.
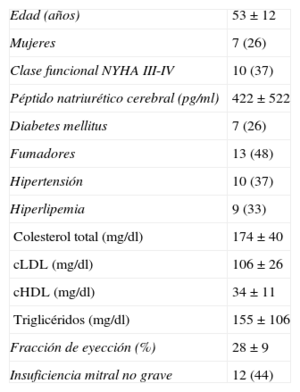
PacienteLa inclusión de pacientes en el ensayo se llevó a cabo entre marzo de 2008 y diciembre de 2010. No se incluyó en el ensayo a ningún paciente después de un periodo corto de evolución de la enfermedad tras el diagnóstico. Todos los pacientes tenían una evolución clínica crónica estable antes de la inclusión en el ensayo. La edad a la que se aplicó el tratamiento osciló entre 31 y 74 (media, 53±12) años; 20 pacientes eran varones y 7, mujeres. Habían necesitado un desfribrilador automático para la prevención de arritmias mortales 3 pacientes. En la tabla 1 se muestran los principales datos clínicos basales. En el momento de la inclusión en el ensayo, todos los pacientes se encontraban estables y recibían tratamiento médico individualizado según su estado clínico y su clase funcional de la New York Heart Association (NYHA); todos recibían tratamiento con inhibidores de la enzima de conversión de la angiotensina o antagonistas de los receptores de la angiotensina II, diuréticos de asa, bloqueadores beta y espironolactona o eplerenona. Tenían diabetes mellitus tratada médicamente 7 pacientes (26%); 8 (30%) estaban en tratamiento con acenocumarol y 19 (70%), con ácido acetilsalicílico; 12 pacientes (44%) estaban tratados con digoxina y 9 pacientes (33%) con hiperlipemia recibían estatinas. El tratamiento médico se mantuvo estable durante todo el ensayo para la mayoría de los pacientes (n=20). A 1 paciente, con dos episodios de agravamiento de la insuficiencia cardiaca, se le aumentó el tratamiento médico. A 6 pacientes se les redujo el número de fármacos cuando la mejora de la clase funcional en el seguimiento lo hizo posible. El tratamiento farmacológico se mantuvo mayoritariamente inalterado durante todo el ensayo y se redujo incluso ligeramente en unos pocos pacientes.
Datos clínicos basales principales
| Edad (años) | 53±12 |
| Mujeres | 7 (26) |
| Clase funcional NYHA III-IV | 10 (37) |
| Péptido natriurético cerebral (pg/ml) | 422±522 |
| Diabetes mellitus | 7 (26) |
| Fumadores | 13 (48) |
| Hipertensión | 10 (37) |
| Hiperlipemia | 9 (33) |
| Colesterol total (mg/dl) | 174±40 |
| cLDL (mg/dl) | 106±26 |
| cHDL (mg/dl) | 34±11 |
| Triglicéridos (mg/dl) | 155±106 |
| Fracción de eyección (%) | 28±9 |
| Insuficiencia mitral no grave | 12 (44) |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; NYHA: New York Heart Association.
Los datos se expresan en forma de n (%) o media±desviación estándar.
La evaluación clínica se basó en la clase funcional de la NYHA y se estableció claramente en cada etapa del ensayo. Además, se determinó la capacidad de ejercicio, evaluada mediante la captación de oxígeno máxima en ml/kg/min, antes del tratamiento y 3 meses y 1 año después. Las pruebas de esfuerzo se realizaron con un sistema Marquette Case 8000 (GE Healthcare; Burr Ridge, Illinois, Estados Unidos) utilizando un protocolo Naughton según lo establecido en las guías13. Se determinó el intercambio de gases respiratorios durante un esfuerzo máximo mediante una estación de ergoespirometría (Oxycon Pro/Delta, Viasys Healthcare; Hochberg, Alemania). Las determinaciones de la captación de oxígeno máxima se obtuvieron y se expresaron tanto en valores absolutos como en porcentaje respecto a los valores teóricos esperados según la edad y la superficie corporal. Se registró también el tiempo de ejercicio, que además se consideró un parámetro funcional.
Evaluaciones ecocardiográficasEn las tres etapas (basal, 3 meses y 1 año), se llevó a cabo una evaluación ecocardiográfica completa (Philips iE33, Philips Ultrasound, Philips Healthcare; Massachusetts, Estados Unidos) con obtención de imagen de segundo armónico. La determinación de los volúmenes y la FEVI se basó en la regla de Simpson biplanar. En todos los casos se inyectaron contrastes ecográficos por vía intravenosa para optimizar la definición de los límites del endocardio. En los casos en que había insuficiencia mitral, se evaluó mediante Doppler continuo y color y se clasificó su gravedad en una escala de I a IV grados. Para definir cada grado, la insuficiencia mitral se evaluó integralmente mediante el acuerdo de dos ecocardiografistas expertos, siguiendo las recomendaciones de la American Society of Echocardiography14.
Evaluaciones hemodinámicas y angiográficasAntes del tratamiento y 6 meses después de la infusión de las células, se realizó un cateterismo cardiaco para obtener la presión telediastólica ventricular izquierda y sistémica, evaluar la función del ventrículo izquierdo y analizar la reserva de flujo coronario en cada arteria coronaria. Las evaluaciones de la función del ventrículo izquierdo se basaron en el análisis de al menos una angiografía ventricular izquierda en una proyección oblicua anterior derecha de 30°. Durante cada ventriculografía, se intentó obtener un latido sinusal y un latido postextrasistólico para el análisis, con vistas a determinar la reserva contráctil del ventrículo.
Se dibujaron las siluetas telediastólica y telesistólica con el sistema CASS, mediante el consenso de dos angiografistas expertos. Se determinaron los volúmenes y la FEVI y se analizó el movimiento regional de la pared. Se utilizó el método de Sheehan15 para el estudio de la asinergia, dividiendo las siluetas superpuestas en 100 radios de acortamiento de la pared, de la telediástole a la telesístole. El segmento de contracción anormal se definió como el porcentaje de radios que mostraban acinesia o discinesia. Se evaluó la competencia de la válvula mitral y, cuando había insuficiencia mitral, se valoró en una escala de I a IV grados.
La medición de las velocidades y de la reserva de flujo coronario en cada arteria coronaria se realizó también en ambas fases con el sistema FloMap® (Cardiometrics; Mountain View, California, Estados Unidos). Se colocó una guía Doppler intracoronaria de 0,014’ en los segmentos proximales de las tres arterias coronarias y se registró la velocidad de flujo de manera continua. Se obtuvo el valor medio de la velocidad máxima en la situación basal y tras la inyección intracoronaria de un bolo de 60μg de adenosina en la arteria coronaria izquierda y 40μg de adenosina en la arteria coronaria derecha. La reserva de flujo coronario se calculó mediante el cociente entre la velocidad de flujo máxima durante el efecto máximo de la inyección de adenosina y la velocidad del flujo basal.
Obtención, preparación e infusión intracoronaria de las célulasSe obtuvo un volumen de médula ósea (100–150ml) con anestesia local. Las CMNMO se aislaron mediante centrifugación en gradiente de densidad sobre una solución de Ficoll-Hypaque en un dispositivo Sepax estéril. Después de tres lavados, se filtraron las CMNMO y se resuspendieron en 10ml de cloruro sódico al 0,9% con un suplemento de heparina al 0,1%. La preparación de la suspensión de células no duró más de 4h y se transportó al laboratorio para la infusión de las células en sincronía con el cateterismo cardiaco diagnóstico adecuadamente completado. Dependiendo de la anatomía coronaria observada, se tomó la decisión de dividir la suspensión celular según la arteria dominante. Se infundió un total de 10,2±2,9×108 CMNMO en las arterias coronarias, de la siguiente forma: el 50% de la suspensión de células se infundió en la arteria descendente anterior izquierda y el 50%, en la arteria coronaria derecha de 4 pacientes (15%); el 50% de la suspensión de células se infundió en la arteria descendente anterior izquierda y el 50%, en la arteria circunfleja dominante de 6 pacientes (22%); se infundió el 50% de la suspensión de células en la arteria descendente anterior izquierda, el 25% en la arteria coronaria derecha y el 25% en la arteria circunfleja de 16 pacientes (59%), y se distribuyó a partes iguales (el 33% cada una) la suspensión de células en las tres arterias coronarias de 1 paciente (4%) que tenía una arteria descendente anterior izquierda pequeña. La infusión selectiva en cada arteria se hizo con un microcatéter, que posteriormente se colocó en un segmento proximal de cada arteria coronaria. Cada infusión intracoronaria duró entre 2 y 4min, sin condiciones de estancamiento del flujo. Después de la infusión, se trasladó a los pacientes a planta para una monitorización continua durante 24h y la realización de determinaciones seriadas de enzimas.
Evaluación biológicaSe obtuvieron partes alícuotas del producto final de CMNMO para recuento celular automático, citometría de flujo, análisis funcional de unidades formadoras de colonias de células endoteliales y determinación de su capacidad migratoria. Las células se marcaron con anticuerpos monoclonales ligados a isotiocianato de fluoresceína o aloficocianina dirigidos contra el CD34 humano (BD Pharmingen™; San Diego, California, Estados Unidos) y anticuerpos monoclonales ligados a isotiocianato de fluoresceína o ficoeritrina dirigidos contra las siguientes proteínas de superficie celular humanas: CD38+, CXCR4, CD31, CD146, factor de crecimiento endotelial vascular R2 (VEGFR2) (BD Pharmingen™), CD90 (R&D Systems; Minneapolis, Minnesota, Estados Unidos), HLA-DR y CD117 (BD Biosciences; San Jose, California, Estados Unidos) o un anticuerpo monoclonal acoplado a aloficocianina, anti-CD133 humano (Miltenyi Biotec; Bergisch Gladbach, Reino Unido). Las muestras de células se obtuvieron en un citómetro de flujo FACSCanto™ de Beckton & Dickinson (BD Biosciences) con láser dual y se analizaron con el programa informático BD CellQuest Pro™ (BD Biosciences). Se analizaron al menos 2.000 eventos para cada marcador.
El análisis funcional de la capacidad migratoria de las células infundidas se realizó en un dispositivo de membrana con tereftalato de polietileno de 6,5mm de diámetro y poros de 8μm (BD Falcon™ Cell Culture Insert System; Franklin Lakes, New Jersey, Estados Unidos) de la siguiente forma: a) se colocó el dispositivo de membrana en un disco de cultivo de una placa de 24 pocillos (BD Falcon™); b) la cámara inferior del dispositivo de membrana se llenó con RPMI-1640 (BioWhittaker® Lonza; Verviers, Bélgica) más factor de crecimiento derivado de células de estroma 1α (SDF-1α; 100 ng/ml; R&D Systems) o RPMI-1640 más factor de crecimiento endotelial vascular (VEGF 165; 100 ng/ml; R&D Systems) o RPMI solo. La cámara superior del dispositivo de membrana se cargó con 5 × 104 células mononucleares resuspendidas en medio sin suero RPMI-1640. Las placas se incubaron a 37°C con una humedad del 95% y un 5% de CO2 durante 24h, y a continuación se observaron en un microscopio de inversión con campos de sistema de recuento automático que permitían el cálculo del porcentaje de células migradas.
Análisis estadísticoLos datos se expresan en forma de media±desviación estándar. Las diferencias entre los porcentajes se evaluaron con una prueba de la χ2 o una prueba exacta de Fisher, según fuera apropiado. Se utilizaron pruebas no paramétricas (prueba de Wilcoxon para datos apareados y la prueba de la U de Mann-Whitney para datos independientes) para comparar los valores de medias. Las diferencias entre las tres etapas en cuanto a los parámetros no invasivos de un mismo paciente se analizaron con una prueba no paramétrica para k muestras relacionadas (prueba de Friedman). La correlación lineal entre las variables cuantitativas se analizó con la prueba de Pearson. Los valores de p<0,05 se consideraron estadísticamente significativos.
RESULTADOSCaracterísticas de la suspensión de célulasEl número de células infundidas fue el siguiente: CMNMO (×108), 10,2±2,9; CD34+ (×106), 40,4±23,6; CD34+/CD117+ (×106), 20,6±15,4; CD133+ (×106), 22,8±15,3; CD34+/CD38- (×106), 9,9±11,8; CD34+/CXCR4+ (×106), 1,9±2,8, y CD90+ (×106), 1,3±1,3. El número total de hematíes presentes como contaminantes en la suspensión fue de 0,49±0,23 (×108), con un hematocrito del 0,42%±0,2%. Por lo que respecta a las principales características funcionales, la migración para VEGF (×108) fue de 5,8±2 células, la migración para SDF-1 (×108) fue de 6,3±2,1 células, y la frecuencia de células endoteliales de unidades formadoras de colonias (×106) fue de 8,2±13,9 células.
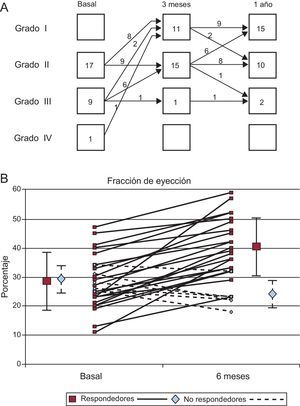
Resultados clínicosEn la tabla 1 se muestran los principales datos clínicos basales. No se produjo ninguna complicación importante en relación con la transferencia de células intracoronaria ni con ningún otro procedimiento durante el protocolo del estudio. Durante la infusión de la suspensión de células en la arteria coronaria derecha, se observó una leve bradicardia e hipotensión en 5 pacientes; la administración de líquidos intravenosos y una reducción de la rapidez de infusión permitieron completar la intervención sin complicaciones. No se registraron arritmias ni daño miocárdico durante las 24h siguientes (la media del valor máximo de troponina I fue de 0,03±0,04 ng/ml). Durante un seguimiento estricto realizado durante 1 año, solamente 1 paciente requirió rehospitalización en dos ocasiones a causa de un agravamiento de la insuficiencia cardiaca. Los otros 26 pacientes continuaron evolucionando a una clase funcional mejor. En la figura 1A se muestra la evolución de la clase funcional de la NYHA en nuestros pacientes. Tan sólo 2 de los 10 pacientes continuaban en NYHA III después de 1 año. Esto coincidió con una reducción significativa de la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) circulante durante todo el ensayo: basal, 403±417 pg/ml; a los 3 meses, 129±169 pg/ml, y al año, 122±190 pg/ml (p<0,05).
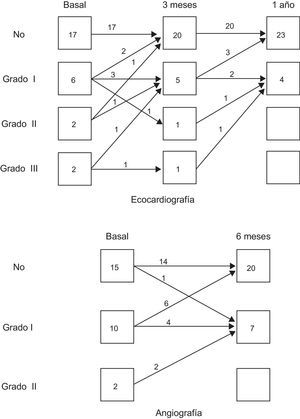
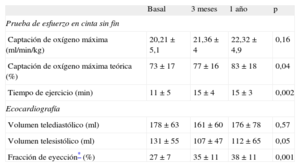
Resultados funcionales en pruebas no invasivasEn la tabla 2 se muestra la evolución observada en los parámetros no invasivos. La capacidad de ejercicio mejoró en la mayor parte de los pacientes. La captación de oxígeno máxima teórica y el tiempo de ejercicio mejoraron en las determinaciones secuenciales. También hubo mejoras significativas de los volúmenes y la FEVI determinados ecocardiográficamente. Además, se observó una reducción frecuente del grado de insuficiencia mitral, en los casos que la sufrían, en el examen realizado mediante eco-Doppler. En la figura 2A se muestran los cambios observados en el grado de insuficiencia mitral entre exámenes ecocardiográficos durante todo el estudio.
Evolución de los parámetros de valoración no invasivos
| Basal | 3 meses | 1 año | p | |
| Prueba de esfuerzo en cinta sin fin | ||||
| Captación de oxígeno máxima (ml/min/kg) | 20,21 ± 5,1 | 21,36 ± 4 | 22,32 ± 4,9 | 0,16 |
| Captación de oxígeno máxima teórica (%) | 73 ± 17 | 77 ± 16 | 83 ± 18 | 0,04 |
| Tiempo de ejercicio (min) | 11 ± 5 | 15 ± 4 | 15 ± 3 | 0,002 |
| Ecocardiografía | ||||
| Volumen telediastólico (ml) | 178 ± 63 | 161 ± 60 | 176 ± 78 | 0,57 |
| Volumen telesistólico (ml) | 131 ± 55 | 107 ± 47 | 112 ± 65 | 0,05 |
| Fracción de eyección* (%) | 27 ± 7 | 35 ± 11 | 38 ± 11 | 0,001 |
Los datos se expresan en forma de media ± desviación estándar.
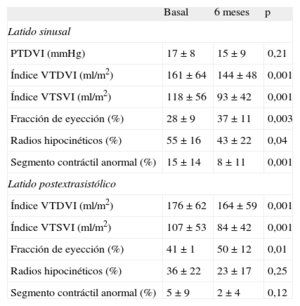
En la tabla 3 se muestra la evolución observada en los principales parámetros hemodinámicos y angiográficos. No se observaron cambios en la velocidad de flujo máxima por Doppler ni en la reserva de flujo coronario de las tres arterias coronarias en el seguimiento realizado a los 6 meses. La media de la reserva de flujo coronario fue normal en las tres arterias en la determinación basal (arteria coronaria derecha, 2,5±0,8; arteria descendente anterior izquierda, 2,6±0,8, y arteria circunfleja, 2,3±0,6). A los 6 meses de tratamiento, la reserva de flujo coronario de las tres coronarias se mantenía inalterada (2,8±0,8, 2,5±0,4 y 2,7±1 respectivamente). Respecto a la función ventricular izquierda, hubo reducciones significativas de los volúmenes ventriculares izquierdos y una ganancia en FEVI que coincidieron con una reducción del acortamiento regional anormal de la pared (reducción media de los radios hipocinéticos, 12,9±20%) y una reducción de los segmentos acinéticos en los casos en que el examen basal los había mostrado (media de reducción del segmento de contracción anormal, 7,1±9,4%). La reserva contráctil del ventrículo, evaluada mediante la potenciación postextrasistólica, mejoró de manera proporcional 6 meses después de la terapia celular. Antes del tratamiento, 12 pacientes presentaban cierto grado de insuficiencia mitral angiográfica; 6 meses después de la terapia celular, 8 de los pacientes presentaban una reducción del grado de insuficiencia mitral angiográfica y 1 paciente, aumento de 1 grado (fig. 2).
Cambios funcionales del ventrículo izquierdo (hemodinámicos y angiográficos)
| Basal | 6 meses | p | |
| Latido sinusal | |||
| PTDVI (mmHg) | 17 ± 8 | 15 ± 9 | 0,21 |
| Índice VTDVI (ml/m2) | 161 ± 64 | 144 ± 48 | 0,001 |
| Índice VTSVI (ml/m2) | 118 ± 56 | 93 ± 42 | 0,001 |
| Fracción de eyección (%) | 28 ± 9 | 37 ± 11 | 0,003 |
| Radios hipocinéticos (%) | 55 ± 16 | 43 ± 22 | 0,04 |
| Segmento contráctil anormal (%) | 15 ± 14 | 8 ± 11 | 0,001 |
| Latido postextrasistólico | |||
| Índice VTDVI (ml/m2) | 176 ± 62 | 164 ± 59 | 0,001 |
| Índice VTSVI (ml/m2) | 107 ± 53 | 84 ± 42 | 0,001 |
| Fracción de eyección (%) | 41 ± 1 | 50 ± 12 | 0,01 |
| Radios hipocinéticos (%) | 36 ± 22 | 23 ± 17 | 0,25 |
| Segmento contráctil anormal (%) | 5 ± 9 | 2 ± 4 | 0,12 |
PTDVI: presión telediastólica ventricular izquierda; VTDVI: volumen telediastólico ventricular izquierdo; VTSVI: volumen telesistólico ventricular izquierdo.
Los datos se expresan en forma de media ± desviación estándar.
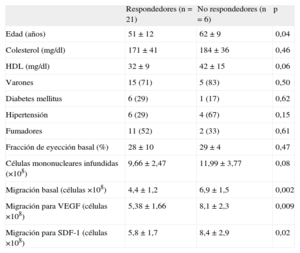
La ganancia en la FEVI fue significativamente mayor en los pacientes con cifras más bajas (< 25%) en situación basal (16±8% frente a 6±9%; p<0,01). En la figura 1B se muestran los cambios individuales de la FEVI. Se estableció una clara distinción entre dos grupos de pacientes: 21 (78%) con una mejoría significativa en la evaluación realizada a los 6 meses (media de ganancia, 14±7%) frente a 6 pacientes sin respuesta o incluso con empeoramiento (media de ganancia, −5±3%) en la evaluación realizada a los 6 meses. Aunque el segundo grupo era pequeño, analizamos los posibles factores asociados a la capacidad de respuesta. En la tabla 4 se presenta el análisis univariable. Los pacientes respondedores eran de menor edad. Tiene interés señalar que la capacidad migratoria en 24h de la suspensión de células fue significativamente inferior en estos pacientes respondedores.
Factores que influyen en la capacidad de respuesta (análisis univariable)
| Respondedores (n=21) | No respondedores (n=6) | p | |
| Edad (años) | 51 ± 12 | 62 ± 9 | 0,04 |
| Colesterol (mg/dl) | 171 ± 41 | 184 ± 36 | 0,46 |
| HDL (mg/dl) | 32 ± 9 | 42 ± 15 | 0,06 |
| Varones | 15 (71) | 5 (83) | 0,50 |
| Diabetes mellitus | 6 (29) | 1 (17) | 0,62 |
| Hipertensión | 6 (29) | 4 (67) | 0,15 |
| Fumadores | 11 (52) | 2 (33) | 0,61 |
| Fracción de eyección basal (%) | 28 ± 10 | 29 ± 4 | 0,47 |
| Células mononucleares infundidas (×108) | 9,66 ± 2,47 | 11,99 ± 3,77 | 0,08 |
| Migración basal (células ×108) | 4,4 ± 1,2 | 6,9 ± 1,5 | 0,002 |
| Migración para VEGF (células ×108) | 5,38 ± 1,66 | 8,1 ± 2,3 | 0,009 |
| Migración para SDF-1 (células ×108) | 5,8 ± 1,7 | 8,4 ± 2,9 | 0,02 |
HDL: lipoproteínas de alta densidad; SDF-1: factor 1 derivado de células de estroma; VEGF: factor de crecimiento endotelial vascular.
Los datos se expresan en forma de n (%) o media ± desviación estándar.
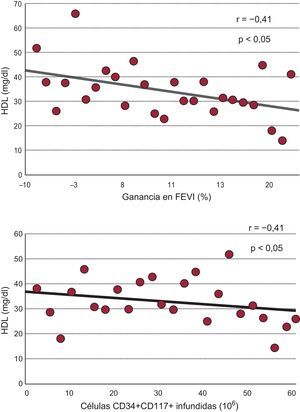
Además, la ganancia de FEVI mostró una correlación inversa con el valor basal de lipoproteínas de alta densidad (HDL) (r=−0,41; p=0,03), lo que indica una ganancia en FEVI superior en presencia de menores concentraciones de HDL. De hecho, las cifras de HDL eran significativamente menores en los pacientes con mayor ganancia (> 10%) en la FEVI (30±8 frente a 40±10mg/dl; p<0,01). El valor basal de HDL mostraba también correlación inversa con el número de células CD34+ CD117+ infundidas (r=−0,41; p<0,05) (fig. 3).
DISCUSIÓNDiferentes estudios experimentales llevados a cabo en modelos de MD en conejos y ratas han puesto de manifiesto que se obtiene beneficio funcional tras la terapia celular16–20. Usando aspirados de médula ósea de ratas isogénicas16, mioblastos de músculo esquelético autólogo en cultivo17 o células mesenquimatosas en cultivo18–20, la suspensión de células se inyectó directamente en el miocardio. Basándose en estos resultados experimentales, diferentes estudios clínicos6–12 han analizado la seguridad y la eficacia de diferentes tipos de terapia celular en pacientes con MD no isquémica. En 2006, Seth et al6 fueron los primeros en describir mejoría de la clase funcional de la NYHA, disminución del volumen telesistólico ventricular izquierdo y un aumento del 5,4% en la FEVI en 24 pacientes con MD tratados con infusión intracoronaria de CMNMO autólogas. En un análisis de seguimiento posterior del mismo ensayo10, se observó que los beneficios funcionales se mantenían sin que hubiera ningún efecto secundario a largo plazo. Además, tras emplear una infusión intracoronaria de CMNMO autólogas, Fisher-Rasokat et al9 observaron una mejoría de la función general y regional a los 3 meses, una tendencia en la reserva de flujo coronario y una disminución significativa de la concentración sérica de NT-proBNP 1 año después del tratamiento en 33 pacientes. En otros estudios8,12, tanto las CMNMO como las células madre de sangre periférica obtenidas mediante aféresis, cultivadas o no, se inyectaron en la pared libre del ventrículo izquierdo. Estos estudios mostraron mejoras de la clase funcional o de la prueba de los 6min de marcha, así como un leve aumento de la FEVI. A pesar de que se usaran inyecciones localizadas, la función ventricular izquierda pareció mejorar de manera general11.
En nuestro ensayo de 27 pacientes con MD idiopática tratados con infusión intracoronaria de CMNMO, no se observaron efectos adversos y hubo una mejora clínica de la clase funcional de la NYHA y las concentraciones de NT-proBNP. Aunque cabría argumentar que esta mejoría pueda deberse en parte al tratamiento farmacológico, es importante señalar que todos nuestros pacientes se encontraban en una situación estable antes de la inclusión en el ensayo y que el tratamiento médico se mantuvo inalterado en la mayoría de ellos durante todo el periodo de ensayo. Además, se observó una disminución a los 6 meses en el volumen angiográfico del ventrículo izquierdo y una ganancia neta media del 9% en la FEVI. Sin embargo, las ganancias en la FEVI después de la terapia celular difieren de un paciente a otro. Se observaron dos grupos de pacientes: respondedores y no respondedores. Los respondedores tenían una edad significativamente menor. Se sabe que la edad puede influir en la funcionalidad de la médula ósea. El contenido de grasa de la médula ósea aumenta con la edad; el envejecimiento reduce también la población colateral de células madre y las unidades formadoras de colonias de granulocitos-macrófagos en la médula ósea, así como las células CD34+, KDR+ y CD133 circulantes, y las concentraciones de SDF–1 e IGF-1 en sangre21.
Es interesante señalar que la capacidad migratoria en 24h de la suspensión de células para el VEGF y el SDF-1 fue significativamente menor en los pacientes respondedores. Las células de médula ósea que pueden migrar siguiendo un gradiente de VEGF en 24h son casi todas progenitoras maduras, mientras que las células madre realmente inmaduras necesitan varios días para la migración. Así pues, parece que la ganancia en la FEVI se potencia también por la menor capacidad migratoria de la suspensión de células, con un porcentaje más elevado de células infundidas inmaduras. Fisher-Rasokat et al9 han observado también una correlación inversa significativa entre el grado de recuperación de la hipocinesia del ventrículo izquierdo y la funcionalidad de las células infundidas medida por su capacidad de formación de colonias. Estos resultados podrían implicar un efecto superior de la suspensión de células cuando hay mayor proporción de células indiferenciadas sin capacidad migratoria o formaciones de colonias hemopoyéticas. Se realizaron observaciones similares en pacientes con infarto de miocardio crónico tratados con infusión intracoronaria de CMNMO5.
Además, hubo una correlación inversa entre la ganancia en FEVI y concentraciones séricas basales de HDL, lo que indica mayor ganancia en presencia de valores de HDL más bajos. Por otra parte, los valores basales de HDL mostraron también una correlación inversa con el número de progenitores inmaduros: células CD 34+ y células CD 117+ infundidas. El papel de las HDL circulantes parece estar incrementándose constantemente. In vitro, el crecimiento celular y la formación de colonias se inhiben en el suero con un suplemento de HDL22. In vivo, es bien sabido que las HDL fomentan la salida de colesterol de las células espumosas y que tienen propiedades antiinflamatorias y antiaterogénicas23,24. Las HDL contribuyen a producir las acciones antioxidantes, vasodilatadoras y antitrombóticas, y modulan la activación plaquetaria25. Las HDL desempeñan un papel incluso en el sistema inmunitario26. Además, la concentración plasmática de HDL está relacionada con el número de células progenitoras endoteliales circulantes27. Tso et al28 señalaron que las HDL participarían en el fomento de la reparación endotelial a través de células progenitoras. De hecho, los valores bajos de HDL son un predictor independiente de la disfunción endotelial29. En la médula ósea, se sabe que las HDL inhiben la proliferación de las células madre hemopoyéticas30. Y a la inversa, las bajas concentraciones de HDL pueden desempeñar un papel en el fomento de la proliferación en los pacientes con procesos neoplásicos22,31. La relación inesperada que se observó entre la ganancia en FEVI y los valores basales de HDL podría indicar que las bajas concentraciones plasmáticas de HDL constituirían un entorno favorable para la proliferación celular en el miocardio después del estímulo de la infusión de CMNMO. Sin embargo, se tendrá que confirmarlo en ulteriores estudios con series de pacientes más amplias. Nuestros resultados también indican una relación entre el estado de funcionalidad de la médula ósea y las cifras de HDL circulantes.
Limitaciones del estudioEl número de pacientes de un ensayo realizado en un solo centro es limitado, y nuestro estudio no es un ensayo aleatorizado. El principal objetivo es determinar la seguridad y la eficacia, y en ambas se obtuvieron resultados favorables. El número de pacientes considerados no respondedores es bajo, pero sus respuestas a la terapia celular son claramente diferentes, lo que podría ser una cuestión de interés para futuros estudios.
CONCLUSIONESEste ensayo introduce el concepto de la capacidad de respuesta a la terapia celular en pacientes con MD. Se observó una mejoría clínica y funcional en pacientes con MD tras una terapia celular intracoronaria. Sin embargo, la capacidad de respuesta parece ser superior en los pacientes de menos edad y en los que tienen concentraciones plasmáticas de HDL más bajas. Además, la mejoría funcional observada parece verse potenciada por una menor capacidad migratoria de las células infundidas.
FINANCIACIÓNEste ensayo clínico se financió por una subvención (TCMR 007/06) de la Fundación Progreso y Salud, Junta de Andalucía, España.
CONFLICTO DE INTERESESNinguno.