Una profundidad más alta del implante percutáneo de una válvula aórtica autoexpandible minimiza el daño en el sistema de conducción y puede reducir las tasas de marcapasos permanente a 30 días. El objetivo es determinar la seguridad y la eficacia de modificar la técnica de implante clásica para el reemplazo percutáneo de la válvula aórtica a una técnica de proyección de superposición de cúspides (PSC) para lograr una profundidad más alta del implante y reducir la necesidad de marcapasos permanente.
MétodosDesde marzo de 2017 se incluyó a 226 pacientes consecutivos: 113 tratados con técnica de implante PSC frente a 113 casos consecutivos previos con implante clásico. La profundidad del implante se evaluó mediante 3 métodos en todos los pacientes (cúspide no coronaria a válvula cardiaca percutánea (VCP); media de cúspide no coronaria y cúspide coronaria izquierda a VCP y el borde más profundo de cúspide coronaria izquierda y cúspide no coronaria a VCP).
ResultadosEl grupo de PSC presentó una profundidad del implante menor que el del grupo de implante clásico (4,8±2,2 frente a 5,7±3,1 mm; p=0,011; 5,8±3,1 frente a 6,5±2,4 mm; p=0,095; 7,1±2,8 frente a 7,4±3,2 mm; p=0,392). A los 30 días de seguimiento, 40 pacientes (17,7%) requirieron el implante de marcapasos permanente, menos en el grupo de PSC (el 12,4 frente al 23%; p=0,036). La técnica de implante PSC protegió contra el evento principal (OR=0,45; IC95%, 0,21-0,97; p=0,043), con parecidos éxito del procedimiento y complicaciones.
ConclusionesLa técnica de implante PSC es una simple modificación en el protocolo que proporciona una profundidad del implante más alta de la prótesis valvular autoexpandible con menores alteraciones de la conducción y tasas de marcapasos permanente.
Palabras clave
Durante los últimos años, el implante percutáneo de válvula aórtica (TAVI) se ha convertido en el tratamiento estándar de la estenosis aórtica (EA) grave en pacientes con alto riesgo e inoperables y sus indicaciones se han extendido a pacientes con riesgo medio y bajo mayores de 65 años1–3. Diversas variables han contribuido a reducir las complicaciones de la intervención y aumentar las tasas de éxito: experiencia del operador/centro, avances tecnológicos en el diseño de válvulas y los sistemas de liberación, así como los análisis habituales antes de la intervención con tomografía computarizada multicorte (TCMC) para obtener un tamaño preciso de las válvulas y un acceso vascular óptimo. Actualmente, el TAVI es una intervención estándar en todo el mundo con un continuo aumento anual del número de implantes1–3.
A pesar de todos estos avances, la aparición de alteraciones de la conducción, como el bloqueo auriculoventricular de alto grado (BAVAG) y el bloqueo cardiaco completo que requiere un nuevo implante de marcapasos permanente (IMPP), continúa siendo una preocupación importante4. Incluso con la última generación de válvulas cardiacas percutáneas (VCP), la tasa de IMPP no se ha reducido con el tiempo, con una mayor incidencia con VCP autoexpandibles (17,4%) en comparación con VCP expandible con balón (6,5%)1. Varios factores se han relacionado con el IMPP después del TAVI, como las alteraciones de la conducción al inicio del estudio, la predilatación de la válvula aórtica, el uso de VCP autoexpandibles y la profundidad del implante (PI)4,5.
Aunque la PI es uno de los más importantes factores intraprocedimiento modificables, continúa abierto el debate sobre cómo puede asegurarse una PI óptima (PIO) y obtenerse una medida precisa de la profundidad final de la VCP6. Se ha propuesto una técnica de implante con proyección de superposición de cúspides (PSC) para el implante de VCP autoexpandibles porque proporciona la visualización de la PI real durante el implante de la válvula. Además, la PSC ofrece ventajas potenciales, como eliminar el paralaje, obtener una mejor visualización de la cúspide no coronaria, lograr una verdadera vista coplanar y mayor implante de la VCP7,8, y en otros estudios de VCP expandible con balón no aumentó el riesgo de embolización de la válvula9.
Esta técnica de implante se ha extendido ampliamente en la práctica clínica; sin embargo, se dispone de poca información sobre su impacto en la aparición de alteraciones de la conducción8,9, sobre todo en el caso de la VCP aórtica autoexpandible, con mayor tasa de implante de marcapasos.
Nuestro estudio tiene por objetivo determinar la seguridad y la eficacia de esta nueva estrategia (técnica de implante con PSC) para lograr una mayor PI y su impacto en la incidencia de nuevos IMPP a los 30 días.
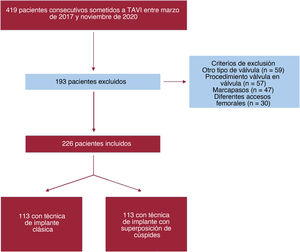
MÉTODOSPoblación de estudio y diseñoEste es un estudio piloto unicéntrico, observacional y prospectivo. Desde el 28 de marzo de 2017 hasta el 12 de noviembre de 2020, nuestro equipo cardiológico remitió a 419 pacientes consecutivos con EA sintomática grave para TAVI y los incluyó en el presente estudio. Después de la exclusión, se incluyó a 226 pacientes en el análisis. Los detalles de los pacientes excluidos se presentan en el diagrama de flujo (figura 1). Desde 2007, en nuestro centro se practicaron TAVI a 807 pacientes. Un equipo cardiológico multidisciplinario evaluó cuidadosamente a todos los pacientes derivados para recambio de la válvula aórtica. Llevaron a cabo el seguimiento de los pacientes derivados para TAVI cardiólogos intervencionistas experimentados en una clínica ambulatoria de TAVI de acuerdo con las guías de práctica clínica y protocolos sistemáticos10,11. Todos los pacientes dieron su consentimiento informado y el estudio fue aprobado por el comité de ética local.
Teniendo en cuenta informes anteriores que indicaban una mejora de la PIO modificando la proyección del implante7,8, a partir del 1 de febrero de 2019, la técnica clásica de implante coplanar de 3 cúspides (TIC) de VCP autoexpandible se modificó en nuestro centro para convertirla en una técnica de implante con PSC para optimizar la PI. Nuestro estudio aprovechó esta modificación de la práctica habitual y, para el análisis y la investigación clínica, comparó 2 grupos de pacientes consecutivos: grupo A de 113 pacientes consecutivos (del 28 de marzo de 2017 al 1 de febrero de 2019) con TIC y grupo B de 113 pacientes consecutivos (del 2 de febrero de 2019 al 12 de noviembre de 2020) con la técnica de implante con PSC. El diagrama de flujo de nuestro estudio ofrece una visión general de la distribución de los pacientes (figura 1).
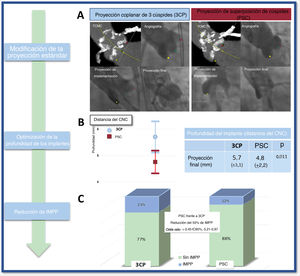
Procedimiento de TAVIEl mismo equipo evaluador del TAVI, con una experiencia de más de 900 estudios, realizó de manera prospectiva y según un protocolo sistemático la TCMC de alta resolución con contraste sincronizada con electrocardiograma (ECG). La adquisición de imágenes se hizo siguiendo las recomendaciones estandarizadas12. Para finalizar todas las mediciones específicas previas a la intervención, los datos de la TCMC se transfirieron a un terminal informático especializado para su evaluación (3Mensio Structural Heart, Pie Medical Imaging BV, Países Bajos) y se tomaron las mediciones, como la evaluación integral de las dimensiones anatómicas y las proyecciones de trabajo relevantes. La técnica de implante con PSC modifica el TIC superponiendo la cúspide coronaria derecha y la cúspide coronaria izquierda (CCI). La vista de superposición de cúspides, como predijo la TCMC, se usó para la implementación del dispositivo durante toda la intervención. El tamaño de la válvula se basó en mediciones de la TCMC derivadas del perímetro con sobredimensionamiento en casos límite. El equipo de implante estuvo formado por 2 cardiólogos intervencionistas. El primer operador fue el mismo para todos los pacientes, un gran experto con más de 1.400 TAVI. Todas las intervenciones se llevaron a cabo en el laboratorio de cateterismo cardiaco con un abordaje mínimamente invasivo en sedación consciente. La técnica de implante de PSC fue similar a la de TIC en todo el protocolo de TAVI, excepto en la proyección del implante. Se utilizó una guía preformada Safari (Boston Scientific, Estados Unidos) para colocar la VCP mediante estimulación temporal del marcapasos en el anillo aórtico cuando la altura de la prótesis era óptima según el cirujano principal, la VCP se soltó parcialmente y se realizó una evaluación angiográfica. Si la hemodinámica de la válvula se consideraba óptima, se implantaba la prótesis. En pacientes seleccionados, si existía un elevado riesgo de oclusión coronaria (ostium coronario <10mm del anillo aórtico y altura del seno de Valsalva <15mm para los tamaños de 23, 26 y 29 de la VCP y <16mm para el tamaño 34 de la VCP), se colocaba un catéter guía que encajaba el ostium coronario con una guía intracoronaria en caso de obstrucción aguda. Se hizo predilatación cuando las válvulas estaban muy calcificadas y con una EA importante con fracción de eyección del ventrículo izquierdo (FEVI) reducida. La TCMC identificó el PSC en la evaluación previa a la intervención y posteriormente lo confirmó la angiografía durante el procedimiento de TAVI (figura 2A).
PSC para reducir la tasa de implantes de un nuevo marcapasos tras el TAVI. A: imágenes de angiografía y tomografía computarizada multicorte que ilustran las técnicas de implante clásica y con proyección de superposición de cúspides. B: media ± desviación estándar (IC95%) de la profundidad del implante medida desde la cúspide no coronaria hasta la prótesis. C: tasa de marcapasos según la técnica clásica de implante frente a la técnica con proyección de superposición de cúspides. 3CP: proyección coplanar de 3 cúspides; CNC: cúspide no coronaria; IC95%: intervalo de confianza del 95%; IMPP: implante de marcapasos permanente; PSC: técnica con proyección de superposición de cúspides; TAVI: implante percutáneo de válvula aórtica; TCMC: tomografía computarizada multicorte.
Los objetivos primarios fueron la PI y el nuevo implante de marcapasos a los 30 días. Los secundarios fueron la aparición de BAVAG y las definiciones de seguridad del Valve Academic Research Consortium 2 (VARC-2).
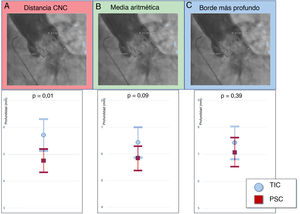
Evaluación de la profundidad del implanteDos cirujanos con experiencia midieron retrospectivamente la PI por angiografía con el software SyngoDynamics (Siemens Healthcare, Estados Unidos). Dado que no existen definiciones estandarizadas en los criterios actuales del VARC-2 sobre cómo evaluar la PI10, se decidió usar 3 de los métodos utilizados con más frecuencia en la evaluación de la profundidad de las VCP (figura 2A): a) distancia de la cúspide no coronaria (CNC): distancia desde la parte más profunda de la CNC hasta el extremo distal del borde intraventricular de la VCP; b) media aritmética de la CNC y la CCI: se midieron las distancias desde el extremo distal de la parte intraventricular de la VCP hasta la CNC y la CCI respectivamente, y se comunicó la media, y c) borde más profundo: se midieron las distancias desde el extremo distal de la parte intraventricular de la VCP hasta la CNC y la CCI respectivamente, y solo se tuvo en cuenta la más profunda de las 2 mediciones.
La PI se midió mediante angiografía en la proyección final en un plano perpendicular a la VCP con 20ml de medio de contraste Optiray (ioversol) de baja osmolalidad a un flujo de 20ml/s. La fiabilidad interobservadores se evaluó con las mediciones de 2 médicos de la PI desde la CNC y la CCI respectivamente hasta la VCP en 100 pacientes aleatorios (figura 3A).
Profundidad del implante. A: medida desde la CNC hasta el extremo distal de la parte intraventricular de la prótesis (2,3mm). B: se miden las distancias de la CCI y la CNC hasta el extremo distal de la parte intraventricular de la válvula y se comunica la media aritmética: (2,3 + 8,2) / 2=5,25mm. C: se comunica el borde más profundo desde la CCI y la CNC hasta el extremo distal de la prótesis (2,3 < 8,2 = 8,2 mm). CCI: cúspide coronaria izquierda; CNC: cúspide no coronaria; PSC: proyección de superposición de cúspides; TIC: técnica de implante clásica.
El seguimiento de la evolución clínica y hemodinámica se evaluó de forma prospectiva según los criterios del VARC-213. Después del TAVI, se mantuvo una supervisión por ECG continua de todos los pacientes al menos durante 48 h. Antes del alta y en el seguimiento de 30 días, se registraron ECG de 12 derivaciones de cada paciente. El BAVAG se definió como la aparición de BAV de segundo o tercer grado en el ECG posterior a la intervención. Se realizó IMPP si el paciente presentaba BAVAG o era necesario un marcapasos temporal permanente según las recomendaciones de las guías de práctica clínica vigentes14–16. Después del alta, se realizó un seguimiento programado de cada paciente en la clínica ambulatoria específica de TAVI, definido previamente con un nuevo ECG. No hubo pérdidas en el seguimiento.
Variables de estudioLas variables de estudio se incluyeron en una base de datos diseñada específicamente. Las variables relacionadas con el seguimiento clínico se documentaron según los criterios del VARC-213.
Análisis estadísticosEl análisis de la normalidad de las variables continuas se realizó con la prueba de Kolmogorov-Smirnov. Las variables continuas con distribución normal se expresan como media±desviación estándar y se compararon mediante la prueba de la t de Student. Las variables continuas con distribución no normal se expresan como mediana [intervalo intercuartílico] y se compararon con la suma de rangos de Wilcoxon. Las variables cualitativas se expresan como número (porcentaje) y se comparan mediante la prueba de la χ2.
Se utilizó un análisis de regresión logística para probar la asociación entre los factores de riesgo potenciales y el IMPP a los 30 días. Las variables con p <0,1 en el análisis univariante se introdujeron en un modelo multivariante. Las relaciones se expresan como odds ratio (OR) con su intervalo de confianza del 95% (IC95%). Para comparar la mortalidad, se construyeron curvas de Kaplan-Meier y se hizo la prueba de orden logarítmico. Se consideró que las diferencias eran estadísticamente significativas si la hipótesis nula podía rechazarse con el IC95%. Para los análisis estadísticos se empleó el paquete de software estadístico STATA 14 (STATA Corp LP, Estados Unidos).
Se utilizó el coeficiente de correlación de Pearson para evaluar la fiabilidad interobservadores de las mediciones de profundidad desde la CCI y la CNC hasta la válvula en 100 casos elegidos al azar y se interpretaron de la siguiente manera: >0,8, concordancia excelente; 0,6-0,8, concordancia de regular a buena; 0,4-0,6, concordancia moderada, y <0,4, sin concordancia.
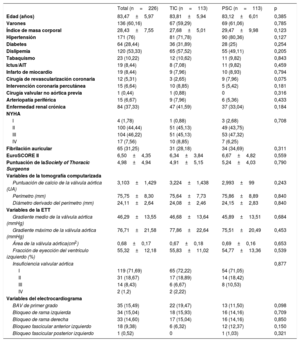
RESULTADOSCaracterísticas basalesDesde febrero de 2019, se trató a 113 pacientes mediante la técnica de implante con PSC y se los comparó con los 113 pacientes consecutivos anteriores, tratados con TIC (figura 1). La media de edad fue 83,5±6 años, 136 pacientes (60,2%) eran varones y entre los grupos hubo una distribución uniforme de los factores de riesgo cardiovascular y los antecedentes médicos relevantes. Los pacientes tenían un riesgo quirúrgico intermedio, con un EuroSCORE II medio de 6,5 ± 4,4 y una puntuación de la Society of Thoracic Surgeons de 5 ± 4,9 (tabla 1).
Características basales
| Total (n=226) | TIC (n=113) | PSC (n=113) | p | |
|---|---|---|---|---|
| Edad (años) | 83,47±5,97 | 83,81±5,94 | 83,12±6,01 | 0,385 |
| Varones | 136 (60,16) | 67 (59,29) | 69 (61,06) | 0,785 |
| Índice de masa corporal | 28,43±7,55 | 27,68±5,01 | 29,47±9,98 | 0,123 |
| Hipertensión | 171 (76) | 81 (71,78) | 90 (80,36) | 0,127 |
| Diabetes | 64 (28,44) | 36 (31,89) | 28 (25) | 0,254 |
| Dislipemia | 120 (53,33) | 65 (57,52) | 55 (49,11) | 0,205 |
| Tabaquismo | 23 (10,22) | 12 (10,62) | 11 (9,82) | 0,843 |
| Ictus/AIT | 19 (8,44) | 8 (7,08) | 11 (9,82) | 0,459 |
| Infarto de miocardio | 19 (8,44) | 9 (7,96) | 10 (8,93) | 0,794 |
| Cirugía de revascularización coronaria | 12 (5,31) | 3 (2,65) | 9 (7,96) | 0,075 |
| Intervención coronaria percutánea | 15 (6,64) | 10 (8,85) | 5 (5,42) | 0,181 |
| Cirugía valvular no aórtica previa | 1 (0,44) | 1 (0,88) | 0 | 0,316 |
| Arteriopatía periférica | 15 (6,67) | 9 (7,96) | 6 (5,36) | 0,433 |
| Enfermedad renal crónica | 84 (37,33) | 47 (41,59) | 37 (33,04) | 0,184 |
| NYHA | ||||
| I | 4 (1,78) | 1 (0,88) | 3 (2,68) | 0,708 |
| II | 100 (44,44) | 51 (45,13) | 49 (43,75) | |
| III | 104 (46,22) | 51 (45,13) | 53 (47,32) | |
| IV | 17 (7,56) | 10 (8,85) | 7 (6,25) | |
| Fibrilación auricular | 65 (31,25) | 31 (28,18) | 34 (34,69) | 0,311 |
| EuroSCORE II | 6,50±4,35 | 6,34±3,84 | 6,67±4,82 | 0,559 |
| Puntuación de laSociety of Thoracic Surgeons | 4,98±4,94 | 4,91±5,15 | 5,24±4,03 | 0,790 |
| Variables de la tomografía computarizada | ||||
| Puntuación de calcio de la válvula aórtica (UA) | 3,103±1,429 | 3,224±1,438 | 2,993±99 | 0,243 |
| Perímetro (mm) | 75,75±8,30 | 75,64±7,73 | 75,86±8,89 | 0,840 |
| Diámetro derivado del perímetro (mm) | 24,11±2,64 | 24,08±2,46 | 24,15±2,83 | 0,840 |
| Variables de la ETT | ||||
| Gradiente medio de la válvula aórtica (mmHg) | 46,29±13,55 | 46,68±13,64 | 45,89±13,51 | 0,684 |
| Gradiente máximo de la válvula aórtica (mmHg) | 76,71±21,58 | 77,86±22,64 | 75,51±20,49 | 0,453 |
| Área de la válvula aórtica(cm2) | 0,68±0,17 | 0,67±0,18 | 0,69±0,16 | 0,653 |
| Fracción de eyección del ventrículo izquierdo (%) | 55,32±12,18 | 55,83±11,02 | 54,77±13,36 | 0,539 |
| Insuficiencia valvular aórtica | 0,877 | |||
| I | 119 (71,69) | 65 (72,22) | 54 (71,05) | |
| II | 31 (18,67) | 17 (18,89) | 14 (18,42) | |
| III | 14 (8,43) | 6 (6,67) | 8 (10,53) | |
| IV | 2 (1,2) | 2 (2,22) | ||
| Variables del electrocardiograma | ||||
| BAV de primer grado | 35 (15,49) | 22 (19,47) | 13 (11,50) | 0,098 |
| Bloqueo de rama izquierda | 34 (15,04) | 18 (15,93) | 16 (14,16) | 0,709 |
| Bloqueo de rama derecha | 33 (14,60) | 17 (15,04) | 16 (14,16) | 0,850 |
| Bloqueo fascicular anterior izquierdo | 18 (9,38) | 6 (6,32) | 12 (12,37) | 0,150 |
| Bloqueo fascicular posterior izquierdo | 1 (0,52) | 0 | 1 (1,03) | 0,321 |
AIT: ataque isquémico transitorio; BAV: bloqueo auriculoventricular; ETT: ecocardiografía transtorácica; NYHA: clase funcional de la New York Heart Association; PSC: técnica con proyección de superposición de cúspides; TIC: técnica de implante clásica; UA: unidades Agatston.
Los valores expresan media±desviación estándar o n (%).
En el análisis del ECG, 121 pacientes (53,3%) presentaron alteraciones de la conducción previas, las más frecuentes de ellas el bloqueo auriculoventricular de primer grado en 35 pacientes (15,5%), el bloqueo de rama izquierda en 34 (15%) y el bloqueo de rama derecha en 33 (14,7%). En cuanto a los hallazgos ecocardiográficos, el gradiente medio fue 46,3 ± 13,6mmHg y el gradiente máximo, 76,7 ± 21,6mmHg. La TCMC mostró un perímetro medio de 75,8 ± 8,3mm y una puntuación de calcio de 3.102 ± 1.428 UA. No hubo diferencias significativas entre los grupos (tabla 1).
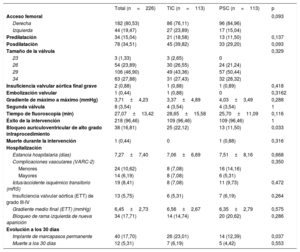
Datos de la intervención, la hospitalización y la evolución a los 30 díasEl éxito de la intervención se logró en el 96,5% de los pacientes. El acceso vascular más frecuente fue la arteria femoral derecha en 182 pacientes (80,5%). Se empleó Evolut R pro 29 en 106 pacientes (46,9%), fue necesario predilatar en 34 (15%) y posdilatar en 78 (34,5%). Solo 8 pacientes (3,5%) necesitaron una segunda válvula a causa de insuficiencia aórtica grave evaluada por angiografía; hubo 1 caso (0,4%) de embolización de la VCP en el grupo con TIC y la media de tiempo de fluoroscopia fue 27,1 ± 13,4min. El BAVAG apareció en 38 intervenciones (16,8%), con 25 casos (22,1%) en el grupo de TIC y 13 (11,5%) en el de PSC (p=0,0328). No hubo casos de oclusión coronaria aguda ni síndromes coronarios agudos durante los primeros 30 días. Se detectó bloqueo de la rama izquierda de nueva aparición durante el procedimiento en 34 pacientes (17,7%). Solo 1 paciente (0,4%) del grupo de PSC falleció durante la intervención por taponamiento cardiaco secundario a un desgarro ventricular (tabla 2).
Datos de la intervención y resultados a 30 días
| Total (n=226) | TIC (n=113) | PSC (n=113) | p | |
|---|---|---|---|---|
| Acceso femoral | 0,093 | |||
| Derecha | 182 (80,53) | 86 (76,11) | 96 (84,96) | |
| Izquierda | 44 (19,47) | 27 (23,89) | 17 (15,04) | |
| Predilatación | 34 (15,04) | 21 (18,58) | 13 (11,50) | 0,137 |
| Posdilatación | 78 (34,51) | 45 (39,82) | 33 (29,20) | 0,093 |
| Tamaño de la válvula | 0,329 | |||
| 23 | 3 (1,33) | 3 (2,65) | 0 | |
| 26 | 54 (23,89) | 30 (26,55) | 24 (21,24) | |
| 29 | 106 (46,90) | 49 (43,36) | 57 (50,44) | |
| 34 | 63 (27,88) | 31 (27,43) | 32 (28,32) | |
| Insuficiencia valvular aórtica final grave | 2 (0,88) | 1 (0,88) | 1 (0,89) | 0,418 |
| Embolización valvular | 1 (0,44) | 1 (0,88) | 0 | 0,3162 |
| Gradiente de máximo a máximo (mmHg) | 3,71±4,23 | 3,37±4,89 | 4,03±3,49 | 0,288 |
| Segunda válvula | 8 (3,54) | 4 (3,54) | 4 (3,54) | 1 |
| Tiempo de fluoroscopia (min) | 27,07±13,42 | 28,65±15,58 | 25,70±11,09 | 0,116 |
| Éxito de la intervención | 218 (96,46) | 109 (96,46) | 109 (96,46) | 1 |
| Bloqueo auriculoventricular de alto grado intraprocedimiento | 38 (16,81) | 25 (22,12) | 13 (11,50) | 0,033 |
| Muerte durante la intervención | 1 (0,44) | 0 | 1 (0,88) | 0,316 |
| Hospitalización | ||||
| Estancia hospitalaria (días) | 7,27±7,40 | 7,06±6,69 | 7,51±8,16 | 0,668 |
| Complicaciones vasculares (VARC-2) | 0,350 | |||
| Menores | 24 (10,62) | 8 (7,08) | 16 (14,16) | |
| Mayores | 14 (6,19) | 8 (7,08) | 6 (5,31) | |
| Ictus/accidente isquémico transitorio (mRS) | 19 (8,41) | 8 (7,08) | 11 (9,73) | 0,472 |
| Insuficiencia valvular aórtica (ETT) de grado III-IV | 13 (5,75) | 6 (5,31) | 7 (6,19) | 0,264 |
| Gradiente medio final (ETT) (mmHg) | 6,45±2,73 | 6,56±2,67 | 6,35±2,79 | 0,575 |
| Bloqueo de rama izquierda de nueva aparición | 34 (17,71) | 14 (14,74) | 20 (20,62) | 0,286 |
| Evolución a los 30 días | ||||
| Implante de marcapasos permanente | 40 (17,70) | 26 (23,01) | 14 (12,39) | 0,037 |
| Muerte a los 30 días | 12 (5,31) | 7 (6,19) | 5 (4,42) | 0,553 |
ETT: ecocardiografía transtorácica; mRS: escala de clasificación modificada para discapacidad neurológica; PSC: técnica con proyección de superposición de cúspides; TIC: técnica de implante clásica; VARC-2: Valve Academic Research Consortium-2.
Los valores expresan media±desviación estándar o n (%).
La evaluación de la PI mostró que los pacientes del grupo de PSC tenían un implante más profundo que los del grupo de TIC. Sin embargo, esta diferencia solo fue estadísticamente significativa cuando se medía desde la CNC hasta el extremo distal de la VCP con una profundidad media de 4,8 ± 2,2 frente a 5,7 ± 3,1mm (p=0,011) de los casos de PSC frente a los de TIC (tabla 3, figura 2B). Hubo tendencia a un implante más profundo al utilizar la media aritmética desde la CNC y la CCI (5,8 ± 2,4 frente a 6,5 ± 2,9mm; p=0,095) para los casos de PSC frente a los de TIC y sin diferencias al utilizar el borde más profundo (7,1 ± 2,8 frente a 7,42 ± 3,2mm; p=0,392) (figura 3B). Los coeficientes de correlación intraclase desde la CNC y la CCI hasta la VCP fueron 0,915 y 0,867 respectivamente.
Evaluación de la profundidad del implante
| Profundidad medida desde la CNC | Media aritmética desde la CNC y la CCI | Borde más profundo | |
|---|---|---|---|
| Técnica de implante clásica (mm) | 5,71±3,07 | 6,45±2,94 | 7,42±3,16 |
| Proyección de superposición de cúspides (mm) | 4,77±2,22 | 5,84±2,35 | 7,07±2,79 |
| p | 0,011 | 0,095 | 0,392 |
CCI: cúspide coronaria izquierda; CNC: cúspide no coronaria.
Profundidad de la cúspide coronaria: profundidad desde la CNC hasta la prótesis; media aritmética desde la CNC y la CCI hasta la prótesis; borde más profundo: la mayor distancia desde la CNC o la CCI hasta la prótesis.
Los valores se expresan como media±desviación estándar.
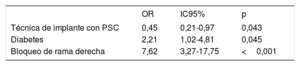
En los primeros 30 días requirieron un nuevo IMPP 40 pacientes (17,7%), 14 (12,4%) del grupo con PSC y 26 (23%) del grupo con TIC (p=0,365). En los análisis univariante y multivariante, la técnica de implante de PSC protegió de modo sistemático del evento principal (OR = 0,45; IC95%, 0,21-0,97; p=0,043) (tabla 4, figura 2C).
Análisis multivariante para predecir el implante de marcapasos a los 30 días
| OR | IC95% | p | |
|---|---|---|---|
| Técnica de implante con PSC | 0,45 | 0,21-0,97 | 0,043 |
| Diabetes | 2,21 | 1,02-4,81 | 0,045 |
| Bloqueo de rama derecha | 7,62 | 3,27-17,75 | <0,001 |
IC95%: intervalo de confianza del 95%; OR: odds ratio; PSC: proyección de superposición de cúspides.
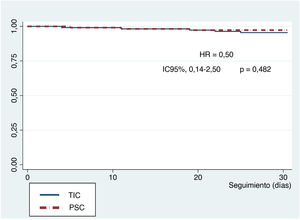
En los resultados a 30 días, hubo 12 muertes (tabla 1 del material adicional); 1 de ellas durante la intervención y el resto durante la estancia hospitalaria (5,3%), así como 20 ictus/accidentes isquémicos transitorios (11,5%), 16 de ellos (9,2%) sin discapacidad importante según la escala de clasificación modificada y 4 (2,3%) con discapacidad moderada o superior. Solo 3 pacientes (1,6%) tenían una fuga paravalvular > grado III. Según las definiciones del VARC-2, hubo 14 complicaciones mayores del acceso vascular (6,2%) y 24 menores (10,6%), sin diferencias entre los grupos (tabla 2). Las curvas de supervivencia de Kaplan-Meier a los 30 días no mostraron diferencias significativas entre los grupos (figura 4). No hubo pérdidas durante el seguimiento.
DISCUSIÓNLa técnica de implante con PSC en el TAVI se ha adoptado ampliamente en todo el mundo; sin embargo, hasta donde se sabe, este es el primer estudio que aborda de manera sistemática la seguridad y la eficacia de esta técnica en el implante de prótesis valvular aórtica autoexpandible (AE) en comparación con TIC. Los principales hallazgos de nuestro estudio son los siguientes: a) esta estrategia se ha demostrado segura; b) logró una mayor PI y, lo más importante, c) redujo la aparición de trastornos de la conducción auriculoventricular y, en consecuencia, la tasa de IMPP. Nuestros resultados tienen claras implicaciones clínicas. Por primera vez se demuestra que este cambio en el procedimiento del implante reduce considerablemente una de las complicaciones más frecuentes y temidas del TAVI autoexpandible, la tasa de implante de marcapasos.
De suma importancia en el diseño de este estudio, se aprovecharon 2 cohortes consecutivas tratadas por el mismo equipo, con los mismos protocolos y la misma VCP. Por lo tanto, se obtiene una muestra homogénea que supera uno de los principales factores de confusión de los ensayos sobre TAVI, a saber, la influencia de diferentes equipos y curvas de aprendizaje.
Nuestros resultados respaldan el hecho de que esta técnica de implante con PSC en TAVI AE es fácil y segura, con tasas de éxito comparables y un perfil valvular hemodinámico semejante al del implante «clásico» y podría servir para todos los casos con esta VCP AE2,17,18. La única diferencia de la intervención entre las 2 técnicas fue la modificación de la proyección de trabajo. No hubo diferencias en cuanto al material utilizado o los pasos seguidos para liberar la válvula. Hubo bajas tasas de complicaciones, como embolización de la VCP, insuficiencia aórtica residual, oclusión coronaria y conversión a cirugía a corazón abierto. Además, no hubo diferencias entre los 2 grupos en la mortalidad a 30 días (figura 4).
Teniendo en cuenta la estandarización de las mediciones por TCMC para la planificación, no debería ser difícil implementar las medidas de la PSC en la evaluación preoperatoria. En nuestra experiencia, no añadió complejidad al protocolo de TAVI estandarizado, como muestra la ausencia de diferencias en los tiempos de fluoroscopia entre los 2 grupos.
Es bien sabido que las alteraciones de la conducción basales, como el bloqueo de rama derecha preexistente, el bloqueo auriculoventricular de primer grado y el hemibloqueo anterior izquierdo, son los predictores independientes más relevantes e inalterables asociados con el IMPP después del TAVI. Otros predictores robustos, como la predilatación, el tipo de VCP y la PI, son factores modificables y su manejo cuidadoso podría reducir el riesgo de IMPP4,19. La VCP autoexpandible se ha asociado con un riesgo de IMPP 2,5 veces mayor20, y en un metanálisis actual con la VCP de última generación, la tasa de IMPP osciló entre el 14,7 y el 26,7% con válvulas AE y entre el 4 y el 24% con las válvulas expandibles con balón10. A pesar de los avances en el diseño y la fabricación de VCP, este asunto continúa siendo un problema médico sin resolver.
La idea principal de nuestro estudio era cómo sería posible reducir las alteraciones de la conducción relacionadas con la VCP AE. La respuesta parece clara: hacer un implante superior para reducir el daño en el sistema de conducción. Sin embargo, un implante superior confiere más riesgo de embolización valvular y fuga paravalvular. Una PIO es fundamental para mejorar los resultados. El implante 5-7 mm por debajo del anillo aórtico aumenta el riesgo de IMPP, mientras que un implante más alto puede reducir el riesgo. En cambio, una PI <3mm podría aumentar el riesgo de insuficiencia paravalvular y oclusión coronaria21. Por consiguiente, el fabricante recomienda un PIO de 3-5mm por debajo del anillo aórtico para obtener mejores resultados.
Esta es la principal ventaja de la técnica de TAVI con PSC porque permite la correcta alineación de los senos mediante la superposición de 2 de ellos para un implante de la válvula más alto y reducir el riesgo de embolización valvular (figura 2A). Frente a otros estudios, nuestra proporción de embolizaciones valvulares fue baja, pues solo hubo 1 caso en el grupo de TIC (0,88%) y ningún caso en el de la técnica con PSC (p=0,316)9. Además, puede ofrecer otros beneficios potenciales durante el implante, como eliminar el paralaje del sistema de implante y centrarlo a lo largo del anillo aórtico. Esta técnica también permite mantener la alineación del plano basal de las cúspides coronarias con una verdadera vista coplanar y optimizar la PI porque proporciona una excelente referencia anatómica y una menor distancia visual de la válvula y la CNC8,22.
Hasta donde se sabe, no existe ninguna definición estandarizada de cómo medir la distancia desde el anillo aórtico hasta el extremo distal de la VCP. Se han comunicado varios enfoques para medir esta distancia, pero falta una referencia o un método estandarizado. Se han utilizado muchas técnicas: la media aritmética de la distancia desde la CNC y la CCI hasta la VCP, la distancia desde la CNC hasta la prótesis y el borde más profundo desde la CNC o la CCI hasta la válvula6.
Además, no existe consenso sobre cuál es la mejor proyección fluoroscópica para lograr la medición precisa de esta distancia. Se ha utilizado la proyección de implante23 y la proyección final, donde las 3 valvas están alineadas y en un mismo plano24.
Uno de los puntos fuertes de nuestro estudio es la medición cuidadosa y constante de la profundidad de la válvula. Dado que no existe consenso sobre la mejor manera de valorar esta distancia, se decidió utilizar todos los métodos de medición comunicados hasta la fecha11–13. Dos cardiólogos intervencionistas con experiencia midieron de manera sistemática todos los casos con las mismas prácticas ya descritas y una elevada tasa de concordancia11–13. La PI fue con los 3 métodos cuantitativamente mayor en los implantes con PSC que en los implantes TIC.
Nuestro estudio coincide con otros anteriores en que muestra una asociación independiente de la PI con trastornos de la conducción e IMPP, pero demuestra una reducción importante (OR = 0,45; IC95%, 0,21-0,97) de sus tasas con la técnica de TAVI con PSC.
Queremos resaltar las consecuencias clínicas beneficiosas de la intervención de TAVI con PSC porque es posible que muchos de los factores potencialmente modificables implicados en la reducción de las alteraciones de la conducción después del TAVI no puedan llevarse a cabo (p. ej., predilatación de una válvula muy calcificada) y la elección de VCP puede estar sujeta a la disponibilidad en el centro quirúrgico. Sin embargo, en la mayoría de los casos podría ser adecuado planificar un implante de la válvula más alto.
LimitacionesLas principales limitaciones de este estudio son el discreto tamaño de la muestra con un diseño unicéntrico y observacional, y el hecho de que la PI se midiera retrospectivamente. El operador principal fue siempre la misma persona, por lo que podría resultar difícil extrapolar los datos a otros cirujanos. Solo se utilizó un análisis de regresión logística multivariante para predecir el evento principal y, teniendo en cuenta la naturaleza del estudio, no se tomaron algunas mediciones de la TCMC, como la anatomía del tabique membranoso. Por último, nuestro estudio se centró únicamente en un tipo de VCP AE, por lo que los resultados y las conclusiones deben interpretarse en este contexto.
CONCLUSIONESNuestro estudio indica que la técnica de implante con PSC es una simple modificación del protocolo de TAVI que proporciona un implante más alto de la VCP AE con menores tasas de alteraciones de la conducción e IMPP.
- -
A pesar de todos los avances técnicos en el TAVI, la aparición de alteraciones de la conducción que requieren el implante de un nuevo marcapasos permanente continúa siendo una preocupación importante.
- -
En este estudio piloto se muestra por primera vez que la adopción de la técnica de implante con PSC para prótesis valvulares aórticas autoexpandibles reduce considerablemente la tasa de implante de marcapasos, una de las complicaciones más frecuentes y temidas del TAVI autoexpandible.
Ninguna.
CONTRIBUCIÓN DE LOS AUTORESConceptualización: I. Pascual, P. Avanzas y C. Morís. Metodología, tratamiento de datos, investigación y análisis formal: I. Pascual, M. Almendárez, L. Arboine, R. del Valle, R. Álvarez y D. Hernández-Vaquero. Redacción (proyecto del borrador original): I. Pascual y M. Almendárez. Revisión, edición y supervisión: P. Avanzas, F. Alfonso y C. Morís. Todos los autores han leído y han aceptado la versión final del original.
CONFLICTO DE INTERESESC. Morís es proctor de Medtronic. Los autores declaran no tener ningún conflicto de intereses.