La fibrosis intersticial miocárdica es un hallazgo constante en las cardiopatías estructurales que desarrollan insuficiencia cardiaca. Aunque la fibrosis facilita la progresión de la insuficiencia cardiaca, aún no se dispone de una estrategia terapéutica que la revierta. Probablemente, ello se deba al error de considerar la fibrosis intersticial miocárdica como una lesión homogénea y no como una lesión heterogénea en la que coexisten diferentes fenotipos. Hay que tener presente también que la heterogeneidad de la fibrosis intersticial miocárdica puede variar entre distintas cardiopatías. Por ello, el diagnóstico y el tratamiento de la fibrosis intersticial miocárdica suponen un verdadero desafío para la transición de un manejo convencional de la insuficiencia cardiaca a un manejo basado en los principios de la medicina de precisión. Como prueba de concepto, en este artículo revisamos cómo el fenotipado de pacientes con insuficiencia cardiaca atribuible a cardiopatía hipertensiva basado en las alteraciones histomoleculares principales de la fibrosis intersticial miocárdica permite identificar subgrupos de pacientes con características fisiopatológicas, clínicas y pronósticas diferentes. Además, discutimos la información disponible sobre el empleo de determinados biomarcadores circulantes y ciertos fármacos útiles para el diagnóstico no invasivo y el tratamiento personalizado, respectivamente, de dichos subgrupos de pacientes.
Palabras clave
Un principio de la medicina de precisión en cardiología es establecer el fenotipo preciso de cualquier trastorno cardiaco dado mediante, entre otros métodos, la identificación de biomarcadores que caracterizan la heterogeneidad fenotípica para ayudar al diagnóstico y el pronóstico y determinar el tratamiento óptimo en necesidades clínicas específicas no satisfechas1. En este doble marco conceptual y metodológico, se ha propuesto que el desarrollo y la implementación de la medicina de precisión basada en biomarcadores para la insuficiencia cardiaca (IC) ofrece la posibilidad de reducir de manera considerable las cargas clínicas y económicas asociadas con este síndrome2. Por consiguiente, existe actualmente un programa de investigación cuyo objetivo es identificar con biomarcadores los fenotipos diana de la IC3,4. En particular, emerge una nueva perspectiva que va más allá de los biomarcadores clásicos de estrés miocárdico/lesión miocárdica, de la activación neurohormonal y la comorbilidad: los biomarcadores que identifican los fenotipos diana del remodelado estructural patológico del miocardio que pueden ser útiles para mejorar los métodos tradicionales de evaluación de los pacientes con IC5, entendiéndose que las características del remodelado miocárdico pueden variar en función de la etiología de la IC.
Por ejemplo, en condiciones de hipertensión crónica causante de cardiopatía hipertensiva, los componentes histológicos del miocardio sufren una serie de lesiones (p. ej., crecimiento de los cardiomiocitos y muerte, inflamación intersticial y fibrosis, reducción del área transversal máxima de las prearteriolas y arteriolas, reducción de la densidad de los capilares y rarefacción de los vasos linfáticos) que se regulan por una compleja interacción de mecanismos6. En particular, la fibrosis intersticial miocárdica (FIM) difusa no solo contribuye a la alteración progresiva de la función cardiaca, lo que propicia la IC, sino que también influye de manera adversa en los resultados clínicos de pacientes con IC debida a cardiopatía hipertensiva7. Cabe destacar la regresión farmacológica de la FIM y la mejora en la función cardiaca en roedores hipertensos de distinta etiología y en humanos hipertensos8, lo cual respalda que la reversión de esta lesión es realmente factible. Así pues, se ha propuesto que el fenotipado de la FIM podría mejorar el pronóstico en pacientes con IC mediante el diagnóstico y el tratamiento personalizado de la FIM específica de la enfermedad cardiaca9.
En este artículo se comentan nuevos datos que respaldan la idea de que la heterogeneidad histomolecular de la FIM produce distintos fenotipos con un impacto clínico variable en los pacientes con IC atribuible a cardiopatía hipertensiva. Además, también se aborda cómo puede caracterizarse la heterogeneidad fenotípica histomolecular de la FIM en estos pacientes utilizando biomarcadores no invasivos, lo que permite un enfoque terapéutico personalizado ante la FIM.
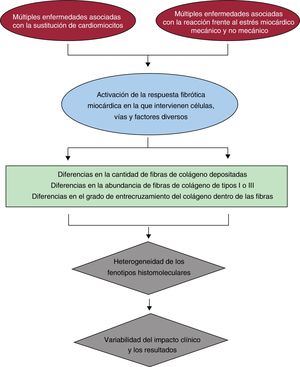
HETEROGENEIDAD HISTOMOLECULAR DE LA FIMEn pocas palabras, la FIM se produce cuando varios factores profibróticos que actúan sobre distintos tipos celulares presentes en el corazón, concretamente los fibroblastos cardiacos, favorecen su transformación a miofibroblastos, cuyo secretoma incluye factores que llevan a un predominio de la síntesis de fibras de colágeno sobre su degradación10. Los factores profibróticos pueden activarse como parte de la respuesta posterior a la pérdida de cardiomiocitos (es decir, fibrosis reparadora) o por estrés mecánico y no mecánico (neurohormonal, inflamatorio o metabólico) en el corazón (es decir, fibrosis reactiva). Un número creciente de pruebas indica que hay que tener en cuenta la cantidad y la calidad de las fibras de colágeno depositadas para comprender mejor de qué modo la heterogeneidad histomolecular de la FIM produce distinto impacto clínico en pacientes con IC causada por cardiopatía hipertensiva (figura 1).
Cuantitativamente, la FIM se caracteriza por un depósito difuso y excesivo de de fibras de colágeno en relación con la masa de cardiomiocitos. Los depósitos de colágeno pueden aparecer como microcicatrices y grandes filamentos dentro del espacio intersticial que rodea cada uno de los cardiomiocitos y fascículos de cardiomiocitos o alrededor de los vasos intramiocárdicos. El depósito de colágeno (DC) excesivo se detecta por un aumento del porcentaje de tejido miocárdico total ocupado por fibras de colágeno en muestras de miocardio teñidas con tinción específica para colágeno y analizadas con sistemas automatizados de análisis de imágenes. Curiosamente, se ha observado una fuerte correlación (r> 0,95) entre el DC y la cantidad de fibras de colágeno de tipo I, pero no con las de tipo III, en el miocardio en pacientes con IC debida a cardiopatía hipertensiva11,12, lo que indica que la FIM resulta de un DC de tipo I excesivo.
Los cambios cualitativos relacionados con la organización molecular de las fibras de colágeno también son importantes con respecto a la influencia de la FIM en la función cardiaca13. Por ejemplo, el grado de enlaces covalentes intramoleculares e intermoleculares entre las moléculas de colágeno que constituyen la fibra de colágeno (es decir, entrecruzamiento del colágeno [ECC])14 puede variar y, por lo tanto, también las propiedades físico-químicas de la fibra pueden cambiar (p. ej., cuanto mayor es el ECC, menor la solubilidad de la fibra y mayores su rigidez y su resistencia a la degradación)15, lo cual influye en las propiedades mecánicas del miocardio16. En el ECC intervienen mecanismos enzimáticos (lisil-oxidasas [LOX-1 y enzimas tipo LOX] y transglutaminasas) y no enzimáticos (productos finales de glicación avanzada)17,18. Curiosamente, se ha observado aumento del ECC, determinado como el cociente entre el colágeno insoluble y el soluble en muestras de miocardio de pacientes con IC debida a cardiopatía hipertensiva que muestran FIM y aumento de la rigidez del ventrículo izquierdo (VI)12,19. Además, se ha hallado aumento de la LOX-1 miocárdica en estos pacientes, con expresión localizada en áreas de fibrosis y asociada con el grado de ECC, la cantidad de colágeno insoluble y de fibras de colágeno de tipo I y la rigidez del VI19,20. Cabe destacar que estas observaciones se hicieron en pacientes hipertensos con IC tanto con fracción de eyección conservada como reducida.
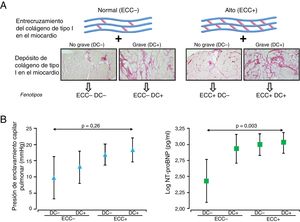
FENOTIPADO DE LA HETEROGENEIDAD HISTOMOLECULAR DE LA FIMLa relevancia clínica de la heterogeneidad histomolecular de la FIM es mayor por los hallazgos de estudios observacionales que demuestran que el aumento del DC en pacientes con IC se relaciona con mortalidad por cualquier causa a largo plazo21, y el aumento en el ECC se relaciona con hospitalización prolongada por IC22. En consecuencia, como enfoque de prueba de concepto, recientemente se investigó si el análisis de la DC y el ECC permite identificar diversos fenotipos de FIM en pacientes con IC atribuible a cardiopatía hipertensiva que presentan características clínicas y resultados diferentes23. Por eso se clasificó a los pacientes en primer lugar, según valores inferiores o superiores a los valores de referencia del ECC, como pacientes con ECC normal (o ECC−) o con ECC elevado (o ECC+) respectivamente. Asimismo, se clasificó a los pacientes, en función de si los valores eran inferiores o superiores a los de referencia del DC, como pacientes con DC no grave (o DC−) o DC grave (o DC+) respectivamente. A continuación, se clasificó a los pacientes en 4 subgrupos: ECC− DC−, ECC− DC+, ECC+ DC− y ECC+ DC+(figura 2A) y se compararon las características histopatológicas y clínicas de los 4 subgrupos. La cantidad de colágeno miocárdico de tipo I, pero no de colágeno de tipo III, aumentó considerablemente y de manera progresiva desde el subgrupo ECC– DC– al grupo ECC+ DC+. La presión de enclavamiento de los capilares pulmonares y la prohormona aminoterminal del péptido natriurético cerebral también aumentaron considerablemente y mostraron diferencias ajustadas significativas entre los subgrupos ECC+ DC+ y ECC− DC− (figura 2B). No se observaron diferencias significativas en la frecuencia de comorbilidad o IC con fracción de eyección conservada o reducida entre los 4 subgrupos. Tras un seguimiento medio de 8,15 años, el primer evento combinado de primera hospitalización por IC después de entrar en el estudio o mortalidad por causas cardiovasculares y el segundo evento o resultado compuesto de primera hospitalización por IC tras entrar en el estudio o mortalidad por cualquier causa aumentaron considerablemente y de manera progresiva en los subgrupos; el bioperfil ECC+ DC+ mostró el riesgo más alto23.
A: clasificación de los pacientes con insuficiencia cardiaca de etiología hipertensiva en cuatro fenotipos histomoleculares distintos de fibrosis intersticial miocárdica, según valores de referencia de depósito de colágeno (DC) y el entrecruzamiento del colágeno (ECC), como pacientes con DC no grave (DC−) o grave (CD+) y con EEC normal (ECC−) o alto (ECC+). B: los símbolos representan medias ajustadas por edad y sexo e intervalos de confianza del 95% de la presión de enclavamiento de los capilares pulmonares (triángulos) y fracción aminoterminal del propéptido natriurético cerebral (NT- proBNP) (log) (cuadrados) en pacientes con insuficiencia cardiaca atribuible a cardiopatía hipertensiva clasificada según los fenotipos histomoleculares de fibrosis intersticial miocárdica mencionados anteriormente. Adaptado con permiso de Ravassa et al.23.
Estos hallazgos muestran que la heterogeneidad histomolecular de la FIM en pacientes con IC de etiología hipertensiva se traduce en diversidad de fenotipos con distintas implicaciones clínicas, tales como un fenotipo de alto riesgo en aproximadamente el 30% de los pacientes en quienes la concurrencia de DC grave y alto ECC se relaciona con disfunción grave del VI y con mayor vulnerabilidad tanto a la hospitalización por IC como a la mortalidad. Si estos fenotipos también pueden observarse en pacientes con IC debida a otras etiologías distintas de la cardiopatía hipertensiva, es algo que requiere más estudios.
IDENTIFICACIÓN BASADA EN BIOMARCADORES DE LOS FENOTIPOS HISTOMOLECULARES DE LA FIMEl uso de biomarcadores que reflejan la concomitancia de DC grave y ECC elevado en un paciente determinado puede ayudar a identificar a los pacientes con IC y alto riesgo de fenotipo histomolecular de FIM y, por lo tanto, susceptibles de recibir tratamiento personalizado para prevenir alteraciones en el colágeno subyacente y mejorar su pronóstico.
Se ha propuesto que la determinación de la fracción de volumen extracelular (FVE) miocárdica mediante cardiorresonancia magnética o tomografía computarizada permite la detección de FIM difusa24. No obstante, esta FVE reflejaría la cantidad de depósitos de fibras de colágeno (DC) pero no su calidad (ECC)25. De hecho, un estudio reciente realizado a partir de las biopsias intraoperatorias del tabique interventricular de 133 pacientes con estenosis aórtica indica que la FVE miocárdica no puede registrar al mismo tiempo ambos aspectos cuantitativo y cualitativo de la fibrosis26. Por lo tanto, se requiere un enfoque complementario basado en biomarcadores para identificar la heterogeneidad histomolecular de la FIM en la IC.
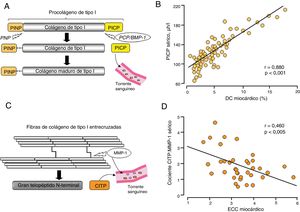
Aunque para la evaluación no invasiva de la FIM27,28 se ha propuesto la evaluación de un número de moléculas circulantes, solo unas cuantas satisfacen los criterios para considerarlas verdaderos biomarcadores de FIM29. En este sentido, según hallazgos de laboratorio, 2 biomarcadores circulantes relacionados con el procesamiento del colágeno extracelular de tipo I pueden ser útiles para evaluar los fenotipos histomoleculares del DC y el ECC en pacientes con IC atribuible a cardiopatía hipertensiva. Se ha demostrado que las concentraciones séricas del propéptido carboxiterminal del procolágeno de tipo I (PICP), formado durante la conversión de procolágeno de tipo I a colágeno maduro de tipo I formador de fibrillas por la enzima procolágeno proteinasa C o la proteína morfogenética ósea 1 (PCP/BMP-1) (figura 3A), se relacionan directamente con el DC en el miocardio en pacientes con IC (figura 3B)11,12,30. Por otro lado, como ya se ha mencionado, el grado de ECC determina la resistencia de la fibras de colágeno de tipo I a la degradación por parte de la metaloproteinasa de matriz 1 (MMP-1), cuyo resultado es la menor escisión del telopéptido carboxiterminal del colágeno de tipo I (CITP) (figura 3C). Recientemente se ha visto que el cociente CITP:MMP-1 séricos se correlaciona inversamente con el ECC miocárdico en pacientes con IC (figura 3D)22. Hay que tener en cuenta que ni el PICP ni el cociente CITP:MMP-1 son biomarcadores cardiacos específicos a pesar de su asociación con el DC y el ECC miocárdicos, respectivamente, y que la IC se caracteriza por la presencia de comorbilidades que también afectan al metabolismo del colágeno (p. ej., enfermedad renal crónica)31.
A: representación esquemática del origen y destino extracelular de los péptidos derivados del colágeno fibrilar propéptido carboxiterminal del procolágeno de tipo I (PICP). B: correlación directa entre la depósito de colágeno (DC) miocárdico y el PICP en pacientes con insuficiencia cardiaca atribuible a cardiopatía hipertensiva. Adaptado con permiso de López et al.30. C: representación esquemática del telopéptido carboxiterminal del colágeno de tipo I (CITP). D: correlación inversa entre el entrecruzamiento de colágeno (ECC) miocárdico y la ratio sérica entre el CITP y la metaloproteinasa de matriz 1 total (CITP:MMP-1) en pacientes con insuficiencia cardiaca atribuible a cardiopatía hipertensiva. Adaptado de López et al.22. PCP/BMP-1: procolágeno C-proteinasa/proteína morfogenética ósea 1; PINP: propéptido aminoterminal del procolágeno de tipo I; PNP: procolágeno N-proteinasa.
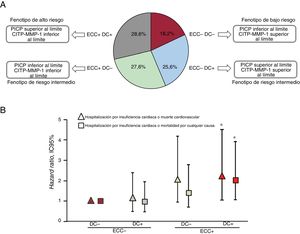
Teniendo en cuenta estas limitaciones, se ha investigado si la combinación de PICP sérico y el cociente CITP:MMP-1 plasma el resultado de la variable clínica de los distintos patrones histomoleculares del DC más el ECC en pacientes con IC atribuible a cardiopatía hipertensiva23. Con anterioridad, en biopsias endomiocárdicas y muestras sanguíneas de pacientes con IC, se identificó el valor límite del PICP para identificar a pacientes con DC grave (DC+), y los valores límite del cociente CITP:MMP-1 para identificar a pacientes con ECC elevado (ECC+) utilizando curvas ROC (figura 4A). Con estos valores, se clasificó a los pacientes con IC en 4 bioperfiles basados en biomarcadores tales como: fenotipo de bajo riesgo (ECC− DC−), fenotipos de riesgo intermedio (ECC− DC+ y ECC+ DC−) y fenotipo de alto riesgo (ECC+ DC+) (figura 4A), y se compararon los resultados clínicos de los 4 bioperfiles. Tras un seguimiento medio de 5,31 años, los resultados compuestos de cardiopatía hipertensiva o muerte cardiovascular y cardiopatía hipertensiva o mortalidad por cualquier causa aumentaron considerablemente en los distintos grupos, con diferencias significativas entre los bioperfiles ECC+ DC+ y ECC− DC− (figura 4B). Además, esta clasificación mejoró el rendimiento pronóstico de importantes factores de riesgo. Utilizando el mismo enfoque basado en la misma combinación de biomarcadores, recientemente se ha observado que el bioperfil ECC+ DC+ se relaciona con una mayor prevalencia de fibrilación auricular (FA), incidencia de FA de nuevo inicio y recurrencia de FA tras ablación de la vena pulmonar que el resto de fenotipos de pacientes con IC atribuible a cardiopatía hipertensiva30. Además, mejoró el valor predictivo de importantes factores de riesgo de FA32.
A: distribución de frecuencias de los fenotipos histomoleculares de fibrosis intersticial miocárdica en pacientes con insuficiencia cardiaca atribuible a cardiopatía hipertensiva clasificados como pacientes con depósito de colágeno no grave (DC−) o grave (DC+) y con entrecruzamiento del colágeno normal (ECC−) o alto (ECC+), determinado por los valores séricos del propéptido carboxiterminal del procolágeno de tipo I (PICP) y del cociente entre el telopéptido carboxiterminal entrecruzado con colágeno de tipo I (CITP) y la metaloproteinasa de matriz 1 (MMP-1) (CITP:MMP-1). B: los símbolos representan las hazard ratio ajustadas y los intervalos de confianza del 95% (IC95%) para la hospitalización por insuficiencia cardiaca o muerte cardiovascular (triángulos) y hospitalización por insuficiencia cardiaca o mortalidad por cualquier causa (cuadrados) en pacientes con insuficiencia cardiaca atribuible a cardiopatía hipertensiva clasificada según los fenotipos bioquímicos mencionados anteriormente de fibrosis intersticial miocárdica. * p <0,05 comparado con los pacientes DC− ECC−. Adaptado con permiso de Ravassa et al.23.
En consecuencia, la combinación del PICP sérico y el cociente CITP:MMP-1 es un buen reflejo del impacto clínico de la variable de los fenotipos histomoleculares de la FIM en pacientes con IC debida a cardiopatía hipertensiva. Además, el bioperfil definido por la combinación de PICP sérico alto y CITP:MMP-1 bajo identifica a los pacientes con el fenotipo de alto riesgo (ECC+ DC+) caracterizado por riesgo aumentado de FA, cardiopatía hipertensiva y mortalidad.
TRATAMIENTO PERSONALIZADO DE LA FIM BASADO EN LOS FENOTIPOS HISTOMOLECULARESDesde un punto de vista mecánico, puede establecerse la hipótesis de que, en pacientes con fenotipo de alto riesgo de FIM (DC+ ECC+), el eje fibrogénico PCP/BMP-1-LOX-1 predomina sobre el eje fibrolítico MMP-1, lo que ofrece por tanto una oportunidad para personalizar los tratamientos antifibróticos en estos pacientes en función de la inhibición del eje PCP/BMP-1-LOX-1. En este sentido, independientemente de que algunos hallazgos clínicos destaquen la posibilidad de incidir en PCP/BMP-1 y LOX-1 con sustancias farmacológicas que actualmente se usan para tratar a los pacientes con IC, la identificación de fármacos nuevos que incidan en estas moléculas se halla actualmente en curso.
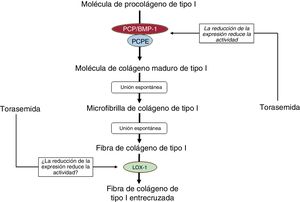
En pacientes con IC debida a cardiopatía hipertensiva, la administración de torasemida junto con el tratamiento estándar de la IC se relacionó con reducción del DC y el ECC miocárdicos junto con menor activación de PCP/BMP-1, expresión reducida de su potenciador-1 (PCPE-1) y expresión disminuida de LOX-119,30,33. Además, el tratamiento con torasemida se acompañaba de la normalización de la rigidez del VI y la mejora de la función en el 80% de los pacientes, sin agrandamiento del VI18. Ninguno de estos efectos se observó en pacientes tratados con furosemida19,30,33.
En consecuencia, más allá de sus acciones en el túbulo renal causantes de una natriuresis y diuresis aumentadas, la torasemida puede ejercer acciones cardiacas antifibróticas que interfieran con el eje fibrogénico PCP/BMP-1-LOX-1 (figura 5). Si los pacientes con IC y fenotipo ECC+ DC+ con alto riesgo de FIM se beneficiarían más de las propiedades antifibróticas de la torasemida, es una hipótesis que aún hay que probar en ensayos adecuadamente diseñados con pacientes estratificados según el bioperfil de PICP y del CITP:MMP-1.
Efectos inhibidores propuestos para la torasemida en los pasos en los que intervienen enzimas del proceso extracelular que lleva a la generación de fibras de colágeno de tipo I. LOX-1: lisil oxidasa 1; PCP/BMP-1: procolágeno C-proteinasa/proteína morfogenética ósea 1; PCPE-1: potenciador del procolágeno C-proteinasa 1.
Los nuevos compuestos antifibróticos basados en la modulación de la formación de colágeno maduro mediada por PCP/BMP-1 y de ECC mediada por LOX-1 se hallan actualmente en desarrollo, pero todavía no se ha investigado su seguridad y su eficacia en células en cultivo y en modelos experimentales in vivo. Es interesante la información según la cual el EXP3179, un metabolito aldehído del losartán y no antagonista del receptor AT1, evita por completo el aumento de LOX-1, de ECC y de DC sin normalizar la presión arterial en ratas con hipertensión y FIM inducidas de forma experimental34. En cambio, la administración del metabolito ácido del losartán y antagonista del receptor AT1, el EXP3174, normalizó la presión sanguínea y atenuó la fibrosis, pero no modificó la LOX-1 ni el ECC34. La posible traducción de estos efectos puede anticiparse teniendo en cuenta que la administración de losartán se relaciona con regresión de la FIM independiente de la presión arterial y reducción de la rigidez del VI en pacientes hipertensos35.
CONCLUSIONES Y DIRECCIONES FUTURASLa FIM es muy heterogénea, ya que existen varias etapas del proceso fibrótico, cada una con distintos componentes fisiopatológicos que producen una expresión histomolecular y un comportamiento clínico diversos. La detección y el tratamiento de la FIM carecen de precisión y en consecuencia se requieren estrategias que permitan la diferenciación de fenotipos de la FIM específicos de la enfermedad, preferiblemente que combinen bioimagen y biomarcadores circulantes. En este marco conceptual, el presente estudio ha revisado un ejemplo de bioperfil basado en biomarcadores de la heterogeneidad histomolecular de la FIM en pacientes con IC atribuible a cardiopatía hipertensiva. Este enfoque permite estratificar el riesgo del paciente y establece el marco idóneo para un tratamiento personalizado, en particular de los pacientes con mayor riesgo. Es urgente que el mundo académico, la industria y los reguladores colaboren para desarrollar una amplia agenda de investigación (que incluya un ensayo aleatorizado) que estudie si este y otros enfoques antifibróticos similares garantizan unos mejores tratamiento y cuidado de los pacientes con IC debida a cardiopatía hipertensiva o de etiologías distintas.
FINANCIACIÓNEste proyecto fue financiado por el Ministerio de Ciencia, Innovación y Universidades, España (Instituto de Salud Carlos III subvenciones CB16/11/00483 y PI18/01469 cofinanciadas por el Fondo Europeo de Desarrollo Regional [FEDER]), el Programa FP7 de la Comisión Europea (proyecto FIBRO-TARGETS 2013-602904 y proyecto HOMAGE 2012-305507) y la Convocatoria Transnacional Conjunta ERA-CVD 2016 LYMIT-DIS (AC16/00020) y LIPCAR-HF (AC16/00016).
CONFLICTO DE INTERESESNinguno.