Debido a la controversia existente al determinar si la terapia de resincronización cardiaca corrige asincronía eléctrica o mecánica, el objetivo del estudio es determinar si hay correlación entre las secuencias eléctricas y mecánicas y si la cicatriz miocárdica tiene un impacto relevante.
MétodosSe estudió a 6 pacientes con función ventricular izquierda normal y 12 pacientes con disfunción del ventrículo izquierdo y bloqueo de rama izquierda tratados con terapia de resincronización cardiaca. Se realizaron ecografías tridimensionales en tiempo real y cartografías electroanatómicas de todos los pacientes, antes y después de dicha terapia, así como una resonancia magnética para evaluar la cicatriz miocárdica. Se posprocesaron las imágenes, se definieron secuencias de activación mecánica y eléctrica y se determinaron diferencias temporales entre el primer y el último segmento del ventrículo izquierdo. Se consideró respuesta a la terapia una reducción del volumen telesistólico del ventrículo izquierdo ≥ 15% a los 12 meses.
ResultadosSe encontró buena correlación entre tiempos eléctricos y mecánicos en pacientes con función ventricular normal (r2 = 0,88; p = 0,005), pero no en aquellos con disfunción (r2 = 0,02; p = no significativa). Después de optimizar el dispositivo, se modificaron y mejoraron los tiempos y las secuencias, excepto los de aquellos con cicatriz miocárdica.
ConclusionesA pesar de la estrecha relación electromecánica en ventrículos normales, no hay una correlación significativa en los pacientes con disfunción ventricular. Aunque la terapia mejora esta correlación, los cambios en la activación eléctrica no pueden producir cambios similares en la mecánica del ventrículo izquierdo, sobre todo en función del sustrato miocárdico subyacente.
Palabras clave
La terapia de resincronización cardiaca (TRC) tiene como objetivo normalizar las anomalías electromecánicas para mejorar el rendimiento del ventrículo izquierdo (VI). Sin embargo, hasta una tercera parte de estos pacientes no responden a la TRC, lo cual subraya los déficits existentes en el conocimiento de la compleja relación existente entre la activación eléctrica y la activación mecánica del VI, sobre todo en los corazones dilatados con disfunción. Algunos estudios han puesto de manifiesto que la duración del QRS es un mal indicador de la asincronía mecánica1,2 y el análisis de la disincronía mecánica, basado en técnicas de imagen tampoco ha aportado resultados uniformes y de aplicación amplia3. Por otro lado, la disincronía mecánica no necesariamente se correlaciona con una disincronía eléctrica según lo definido por la anchura del QRS4,5. Patrones del electrocardiograma (ECG) de superficie similares muestran secuencias de activación eléctrica o mecánica diferentes6,7. Así pues, podría haber una compleja interrelación entre la activación eléctrica y los procesos mecánicos en los pacientes con insuficiencia cardiaca y disfunción del VI. El presente estudio tiene por objetivo determinar si hay o no correlación entre las secuencias eléctrica y mecánica y si la cicatriz miocárdica tiene alguna influencia relevante. Nuestra hipótesis es que la integración de técnicas de imagen mecánicas, estructurales y eléctricas podría proporcionar un mejor conocimiento de la respuesta a la TRC y una posible mejora en la selección de los pacientes candidatos a la TRC.
Para ello, utilizamos mapeo electroanatómico endocárdico invasivo y ecocardiografía transtorácica tridimensional en tiempo real (E3DTR) para caracterizar la relación y la correlación de la activación eléctrica y mecánica del VI en diferentes subgrupos de pacientes e intentamos determinar la influencia de la TRC. Así pues, se debe considerar este análisis un estudio piloto destinado a validar el uso de los métodos de E3DTR para evaluar el tiempo de movimiento mecánico y correlacionarlo con el tiempo eléctrico, y su posible utilidad en la predicción y la mejora del conocimiento sobre la respuesta a la TRC.
MÉTODOSPoblación de pacientesEl presente estudio se realizó en 6 pacientes reclutados de una población tratada con ablación percutánea de una fibrilación auricular paroxística aislada (grupo I), sin cardiopatía estructural, con función sistólica del VI normal y duración del QRS < 120 ms en el ECG de superficie, y 12 pacientes con disfunción sistólica del VI tratados con implante de TRC (grupo II), seleccionados según lo establecido en las guías actualmente aceptadas: insuficiencia cardiaca, fracción de eyección del VI < 35% y QRS ancho (> 120 ms) en el ECG de superficie8. De todos los pacientes de ambos grupos se obtuvo una E3DTR para determinar la secuencia de movimiento mecánico del VI, y se estableció un mapa electroanatómico endocárdico para evaluar la secuencia de activación eléctrica del VI. El protocolo del estudio fue aprobado por el comité de ética del hospital y se aplicó cumpliendo la Declaración de Helsinki de Principios Éticos para la Investigación Médica en Sujetos Humanos. Se obtuvo el consentimiento informado por escrito de todos los participantes.
Terapia de resincronización cardiacaA los pacientes con disfunción del VI (grupo II), se les implantó un dispositivo de TRC. Los electrodos se colocaron en el vértice del ventrículo derecho y, si el paciente estaba en ritmo sinusal, en la orejuela auricular derecha. El electrodo del VI se colocó en la pared lateral o posterolateral del VI a través del seno coronario. Todos los electrodos se implantaron por vía transvenosa.
Todos los dispositivos se optimizaron con el empleo de un método basado en el ECG, según lo descrito con anterioridad9.
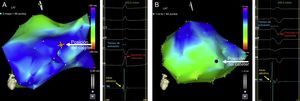
Mapa electroanatómico endocárdico del ventrículo izquierdoLos estudios se llevaron a cabo durante la ablación de la fibrilación auricular (grupo I) o antes y después del implante de TRC (grupo II). Se introdujo un catéter de cartografía con punta de 4 mm (Navistar, Biosense-Webster Inc.) en el VI a través de un abordaje aórtico retrógrado. Durante el ritmo sinusal, se estableció un mapa del VI, y se alcanzó una media de 37 ± 15 puntos en cada mapa. En los pacientes tratados con TRC (grupo II), se obtuvieron mapas con el dispositivo inactivado (Off) y una vez optimizado (Optimizado) el intervalo interventricular (VV). El tiempo de activación en cada punto se determinó mediante el intervalo entre el pico de la onda R de las derivaciones de las extremidades (o las derivaciones de extremidades potenciadas) y el pico del electrograma bipolar, que se asociaba a la punta del catéter con deflexión intrínseca negativa más profunda. En la figura 1 se muestran los mapas electroanatómicos de un paciente del grupo I y otro del grupo II.
Mapa electroanatómico endocárdico ventricular izquierdo (proyección anterolateral) de un paciente con ventrículo izquierdo normal (grupo I) (A) y un paciente con disfunción ventricular izquierda (grupo II) (B). Los trazados del lado derecho de cada panel corresponden a la información eléctrica procedente de derivaciones de extremidades potenciadas de un catéter bipolar endocárdico. Los colores fríos (azul-verde) corresponden a segmentos activados de manera posterior y los colores cálidos (naranja-rojo) corresponden a las primeras zonas en activarse. El tiempo de activación se define como la diferencia de tiempo entre la referencia (aVL, flecha azul) y el inicio eléctrico de la señal endocárdica M1-M2 (flecha amarilla). La posición de la punta del catéter se representa con un punto de mayor tamaño resaltado en el ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Una vez reconstruido por completo el volumen del VI, este se dividió en 16 segmentos (según la segmentación del VI de la American Heart Association) basándose en tres puntos de referencia anatómicos (válvula mitral, válvula aórtica y vértice del VI). El lugar de activación endocárdica del VI se definió como el primer lugar del VI en activarse en el mapa electroanatómico. Para obtener la secuencia de la activación eléctrica, se promediaron los tiempos de activación de todos los puntos en cada uno de los 16 segmentos del VI. A partir de ello, se obtuvieron: a) la secuencia de activación eléctrica de los 16 segmentos del VI, y b) el tiempo de activación total (ΔTe), que se definió como la diferencia de tiempo entre el primer y el último punto activado del VI. Los patrones de propagación eléctrica se representaron en gráficos clásicos de «ojo de buey» (mapa polar) mediante la asignación en el mapa de cada punto adquirido dentro del VI a una elipsoide aplanada (orientada mediante los tres puntos de referencia). Para la visualización de la secuencia de activación eléctrica, se generaron gráficos de «ojo de buey» empezando en el primer punto de activación y hasta el último punto activado, en pasos de 5 ms.
Ecocardiografía transtorácica tridimensional en tiempo realLa E3DTR se llevó a cabo empleando un ecógrafo comercial, equipado con un transductor de matriz X3-1 (IE33, Philips Medical Systems; Andover, Massachusetts, Estados Unidos). Se realizaron exploraciones antes de la intervención de ablación en el grupo I. En el grupo II, la E3DTR se llevó a cabo antes (Off) y 48 h después de la TRC, una vez optimizado el intervalo VV(Optimizado).
Se obtuvieron los volúmenes completos del VI en todos los pacientes desde la ventana apical. La profundidad se redujo al mínimo con objeto de incluir solamente la totalidad del VI. La velocidad media de fotogramas fue 15 ± 3 fps. El análisis off-line se llevó a cabo con un programa informático comercial (Qlab, versión 7.1, Philips). Se creó un mallado de la cavidad del VI, que proporciona datos de tiempo-volumen para la totalidad del ciclo cardiaco. Finalmente, este volumen se dividió según el volumen de los 16 segmentos y se obtuvo el cambio de volumen durante el ciclo cardiaco para cada segmento.
Las curvas de volumen-tiempo de los segmentos del VI proporcionados por la E3DTR permitían la identificación de la secuencia temporal de cada segmento del VI hasta alcanzar el volumen sistólico mínimo10,11. En consecuencia, a partir del análisis de la E3DTR, obtuvimos lo siguiente: a) la secuencia o diseminación de la activación mecánica de los 16 segmentos del VI, y b) la diseminación temporal del movimiento mecánico máximo (ΔTm), que corresponde a la diferencia de tiempo entre el primero y el último segmento del VI que alcanzan el volumen sistólico mínimo.
La secuencia del movimiento mecánico se representó también con gráficos de «ojo de buey». El mapa se obtuvo empleando la segmentación del VI establecida a partir del análisis de la ecocardiografía tridimensional con QLab. Para cada paciente, se generaron 12 pasos de tiempo que representaban la diferencia total entre el tiempo transcurrido hasta alcanzar los volúmenes mínimos del primer y el último segmento.
Resonancia magnéticaSe llevaron a cabo exploraciones de resonancia magnética cardiaca en todos los pacientes mediante un escáner de resonancia magnética Signa de 1,5 T (General Electric; Milwaukee, Wisconsin, Estados Unidos) 72 h antes de implantar el dispositivo de TRC. Se obtuvieron imágenes con realce tardío tras la inyección de un bolo de 0,2 mmol de gadodiamida/kg de peso corporal (Omniscan®, GE Healthcare Buchler; Múnich, Alemania) empleando una secuencia de eco de gradiente de inversión-recuperación y optimizando el tiempo de inversión para anular el miocardio. La captación de contraste tardía se evaluó mediante una puntuación en una escala de 3 puntos, según un método descrito con anterioridad (0, ninguna; 1, no transmural, que se definió como afección < 50% de la anchura del miocardio, y 2, captación transmural, que se definió como afección ≥ 50% de la anchura del miocardio)12. Los datos relativos a presencia, extensión y localización de la cicatriz miocárdica se integraron también en las representaciones en «ojo de buey» de los datos eléctricos y mecánicos.
Seguimiento de los pacientes tras la terapia de resincronizaciónLos pacientes que recibieron TRC fueron objeto de seguimiento en la clínica ambulatoria a los 12 meses del implante del dispositivo. A estos pacientes se les practicó una ecocardiografía transtorácica exhaustiva, tanto en la situación basal como en el seguimiento, utilizando para ello un sistema comercial (Vivid 7, General Electric; Milwaukee, Wisconsin, Estados Unidos). En cada exploración, se calcularon los volúmenes de VI y la fracción de eyección del VI a partir de las proyecciones apicales de cuatro y de dos cámaras, mediante la regla de Simpson13. La respuesta a la TRC se definió por el remodelado inverso volumétrico del VI, que se consideró presente cuando el volumen telesistólico del VI en el seguimiento se había reducido ≥ 15% respecto al valor basal14.
Análisis estadísticoLas variables basales de carácter continuo se expresan mediante media ± desviación estándar o mediana [intervalo intercuartílico], tras verificar la normalidad aplicando la prueba de Shapiro-Wilks, y se analizan con la prueba de la t de Student para datos no apareados o la de la U de Mann-Whitney o la prueba de la t para datos apareados o análisis de Wilcoxon, en función de la normalidad de la distribución de los datos. Las variables discretas se expresaron mediante el número total (porcentaje) y las comparaciones de estas variables entre los grupos se realizaron con la prueba de la χ2 o la prueba de Fisher, según fuera apropiado. Se utilizó un análisis de regresión lineal para analizar la correlación entre ΔTe y ΔTm. La significación estadística se definió como p < 0,05. Todos los datos se analizaron con el programa de estadística SPSS versión 15.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
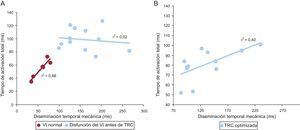
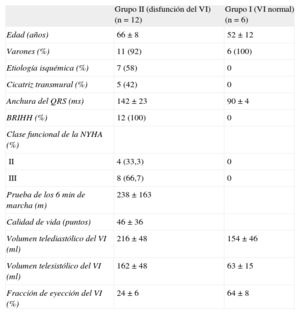
RESULTADOSPacientes con función sistólica del ventrículo izquierdo normalLas características basales clínicas y ecocardiográficas se indican en la tabla 1. Todos los pacientes del grupo I presentaron una duración del QRS < 120 ms en el ECG de superficie y mostraron un patrón similar de distribución de la propagación eléctrica. La activación más temprana tuvo una localización medioseptal en la mayoría de los pacientes, con un primer frente de onda a través de la pared anterior del VI, y los últimos segmentos activados fueron los situados en las paredes basales inferoposteriores del VI. Por lo que respecta al movimiento mecánico, se observó alta sincronía, de tal manera que todos los segmentos del VI alcanzaban el volumen sistólico mínimo casi al mismo tiempo. Los primeros segmentos con contracción fueron los septales y los apicales, mientras que la pared posterior fue la última en sufrir la contracción (figura 2). Se observó alta correlación entre los tiempos eléctricos y los mecánicos (ΔTe, 55 ± 14 ms; ΔTm, 58 ± 18 ms; r2 = 0,88; p = 0,005) (figura 3).
Características basales clínicas y ecocardiográficas de la población estudiada
| Grupo II (disfunción del VI) (n = 12) | Grupo I (VI normal) (n = 6) | |
| Edad (años) | 66 ± 8 | 52 ± 12 |
| Varones (%) | 11 (92) | 6 (100) |
| Etiología isquémica (%) | 7 (58) | 0 |
| Cicatriz transmural (%) | 5 (42) | 0 |
| Anchura del QRS (ms) | 142 ± 23 | 90 ± 4 |
| BRIHH (%) | 12 (100) | 0 |
| Clase funcional de la NYHA (%) | ||
| II | 4 (33,3) | 0 |
| III | 8 (66,7) | 0 |
| Prueba de los 6 min de marcha (m) | 238 ± 163 | |
| Calidad de vida (puntos) | 46 ± 36 | |
| Volumen telediastólico del VI (ml) | 216 ± 48 | 154 ± 46 |
| Volumen telesistólico del VI (ml) | 162 ± 48 | 63 ± 15 |
| Fracción de eyección del VI (%) | 24 ± 6 | 64 ± 8 |
BRIHH: bloqueo de rama izquierda del haz de His; NYHA: New York Heart Association;VI: ventrículo izquierdo.
Secuencias de activación eléctrica (mapas en «ojo de buey» superiores) desde el inicio eléctrico (izquierda) hasta el final (derecha), y de movimiento mecánico máximo (mapas en «ojo de buey» inferiores) desde el primer segmento (izquierda) hasta el último segmento que alcanza el volumen mínimo en un paciente representativo de cada grupo. A: función sistólica del ventrículo izquierdo normal. B: disfunción sistólica del ventrículo izquierdo sin cicatriz transmural y con propagación anterolateral de la línea de bloqueo. C: disfunción sistólica del ventrículo izquierdo con cicatriz transmural y línea de bloqueo posterior. D: el mismo paciente que en B, después de terapia de resincronización cardiaca. TRC: terapia de resincronización cardiaca; VI: ventrículo izquierdo. Pasos: tiempo entre imágenes. Las líneas rojas representan los segmentos del ventrículo izquierdo con cicatriz miocárdica transmural. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Gráficos de regresión lineal entre los intervalos de tiempo de la activación eléctrica (tiempo de activación total) y movimiento mecánico máximo (diseminación temporal mecánica) en pacientes con función sistólica del ventrículo izquierdo normal y con disfunción del ventrículo izquierdo (antes de la terapia de resincronización cardiaca) (A) y pacientes con disfunción del ventrículo izquierdo después de una programación optimizada del intervalo interventricular del dispositivo (B). TRC: terapia de resincronización cardiaca; VI: ventrículo izquierdo.
Las características basales clínicas y ecocardiográficas se indican en la tabla 1. La media de edad era 66 ± 8 años y la media de fracción de eyección del VI, del 24 ± 6%. Los pacientes con disfunción sistólica del VI (grupo II), todos ellos con bloqueo de rama izquierda del haz de His (BRIHH) en el ECG de superficie, presentaron mayor retraso, tanto en las secuencias eléctricas como en las mecánicas, que los pacientes con función sistólica del VI normal (tabla 2). No se observó correlación alguna entre los tiempos eléctricos y los mecánicos en estos pacientes (figura 3). De igual modo, no se observó concordancia entre la secuencia de activación eléctrica y el movimiento mecánico (figura 2). Hubo una amplia variabilidad en cuanto a los primeros y los últimos segmentos del VI que presentaban una contracción mecánica. Por lo que respecta a la activación eléctrica, los patrones fueron más similares, de tal manera que el septo y la pared posterolateral eran el primer y el último segmento del VI que se activaban en la mayor parte de los casos. Sin embargo, en 7 pacientes (58%), pudo observarse una línea clara de bloqueo de la conducción eléctrica (principalmente en la pared lateral) junto con un reinicio de la diseminación de la activación eléctrica más tardío. En el material suplementario se presentan todas las secuencias de activación y mecánicas de cada uno de los pacientes antes y después del tratamiento.
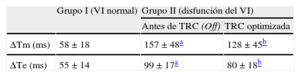
Tiempos de activación eléctrica y de movimiento mecánico
| Grupo I (VI normal) | Grupo II (disfunción del VI) | ||
| Antes de TRC (Off) | TRC optimizada | ||
| ΔTm (ms) | 58 ± 18 | 157 ± 48a | 128 ± 45b |
| ΔTe (ms) | 55 ± 14 | 99 ± 17a | 80 ± 18b |
ΔTe: tiempo de activación eléctrica; ΔTm: tiempo de diseminación mecánica máxima; Off: dispositivo inactivado; TRC: terapia de resincronización cardiaca; VI: ventrículo izquierdo.
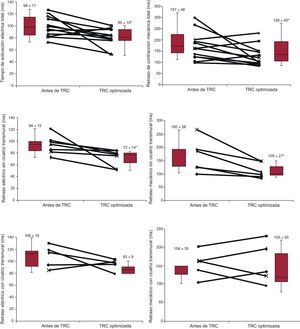
Tras la activación de la TRC, se optimizó la programación del intervalo VV y, como resultado de ello, en 8 pacientes (66,6%) se utilizó una configuración de ritmo de marcapasos biventricular simultáneo (VV = 0 ms) y en 4 pacientes (33,3%), una preactivación del VI (VV = –30ms). Los tiempos y las secuencias de activación tanto eléctricas como mecánicas se modificaron en todos los pacientes tras la TRC, con una reducción de los retrasos temporales y un cambio del inicio mecánico y eléctrico (tabla 2). Después de esta optimización, se observó una leve mejora de la correlación entre los tiempos de activación eléctricos y los mecánicos (r2 = 0,40; p = 0,02) (figura 3B), lo cual indica que se restablece la sincronía, al menos parcialmente. Con la TRC optimizada, el inicio de la propagación eléctrica en pacientes con preactivación del VI (VV = –30ms; n = 4) se observó en la pared lateral del VI, mientras que el tabique era el último segmento en activarse en todos los pacientes. Los pacientes con ritmo de marcapasos biventricular simultáneo optimizado (n = 8) presentaron unos patrones diferentes (figura 2D y figuras 1–8 del material suplementario). Al analizar el patrón de la diseminación del movimiento mecánico máximo su el dispositivo optimizado, se observó también una amplia variación entre los pacientes en cuanto al primer y el último segmento en alcanzar el movimiento máximo (figura 2D). Se presenta una información más detallada al respecto en el material suplementario.
Influencia del carácter transmural de la cicatrizCinco pacientes presentaron cicatrices transmurales y en 2 pacientes hubo cicatrices no transmurales, todas ellas de origen isquémico. No se observó captación de contraste en los demás pacientes con disfunción del VI isquémica ni en los que tenían disfunción del VI no isquémica. No hubo diferencias significativas en los tiempos eléctricos y mecánicos de los pacientes con disfunción del VI (grupo II) en función de que presentaran cicatrices transmurales o no transmurales (tiempo de activación eléctrica, 94 ± 15 y 106 ± 18 ms; tiempo de diseminación del movimiento mecánico, 160 ± 18 y 154 ± 35ms). La localización de la cicatriz transmural fue la pared lateral en 2 pacientes, la pared posterolateral en otros 2 y la pared posterior en 1 paciente. Después de la optimización de la TRC, en el grupo de pacientes con cicatriz transmural, no hubo cambios significativos en los tiempos de activación eléctrica y mecánica (figura 4). Sin embargo, en el grupo de pacientes sin cicatriz transmural, se observaron reducciones significativas tanto de los tiempos eléctricos como de los mecánicos tras la programación VV optimizada. Aunque el inicio de la activación eléctrica estuvo claramente localizado en la pared lateral del VI (85%), se observó una amplia variabilidad en lo relativo al último segmento del VI en mostrar la activación eléctrica (figuras 1–8 del material suplementario).
Tiempos de activación mecánica (derecha) y eléctrica (izquierda) antes y después de la terapia de resincronización cardiaca optimizada. En los paneles superiores se presentan datos del conjunto de todos los pacientes. En los paneles centrales se presentan los cambios en el retraso temporal de los pacientes sin cicatriz transmural (es decir, pacientes con cicatriz no transmural o sin cicatriz). En los paneles inferiores se presentan los cambios en el retraso temporal de los pacientes con cicatriz transmural. TRC: terapia de resincronización cardiaca. Los datos expresan media ± desviación estándar.
* p < 0,05 para la disfunción ventricular izquierda tras la terapia de resincronización cardiaca optimizada frente a la disfunción ventricular izquierda antes de dicha terapia.
En el seguimiento, hubo 8 pacientes con respuesta (66%) y 4 sin respuesta (34%), según los criterios de reducción del volumen telesistólico del VI ≥ 15% en el examen de seguimiento en comparación con el valor basal. Los pacientes con respuesta a la TRC presentaron una media de aumento del 17 ± 4% en la fracción de eyección del VI y una disminución del 44 ± 7% en el volumen telesistólico del VI; mientras que en los no respondedores el aumento de la fracción de eyección del VI y la disminución del volumen telesistólico del VI fueron del 3 ± 3 y el 1,5 ± 3,6% respectivamente. Los pacientes con respuesta presentaron una disminución inmediata de los tiempos tanto de activación eléctrica como de movimiento mecánico con la TRC, mientras que los pacientes sin respuesta mostraron un aumento significativo de los tiempos de movimiento mecánico máximos (ΔTm) a pesar de los cambios no significativos en el tiempo de activación eléctrica (ΔTe) (figura 5). La mayoría de los pacientes con respuesta (87%) no presentaban una cicatriz transmural en la resonancia magnética previa a la TRC, mientras que todos los pacientes sin respuesta tenían cicatriz transmural.
Cambios en los tiempos de movimiento mecánico máximo y activación eléctrica después de la terapia de resincronización cardiaca de los pacientes con respuesta (A) y sin respuesta (B). TRC: terapia de resincronización cardiaca. Los datos expresan media ± desviación estándar.
* p < 0,05 para la disfunción ventricular izquierda tras la terapia de resincronización cardiaca optimizada frente a la disfunción ventricular izquierda antes de dicha terapia.
Los principales resultados de este pequeño estudio observacional pueden resumirse como sigue: a) hubo buena correlación entre los tiempos de propagación de la activación eléctrica y los del movimiento mecánico máximo, con patrones y secuencias similares, en el VI de función normal; b) esta correlación se perdía en los pacientes con disfunción del VI, lo cual indica que la contracción mecánica no se produce solo por la activación eléctrica, sino también por el acoplamiento electromecánico de la contractilidad y las interacciones de los segmentos; c) la TRC restablece en parte esta correlación, aunque lo hace en menor medida en los pacientes con cicatriz miocárdica, y d) los pacientes con cicatriz transmural no mostraron mejoras significativas en los tiempos o los patrones de activación electromecánica inmediatamente después de la TRC, y ello estaba relacionado con la respuesta a largo plazo (es decir, era más probable que se tratara de pacientes sin respuesta).
Activación eléctrica y mecánica en el bloqueo de rama izquierda del haz de HisEn estudios previos de mapas electroanatómicos endocárdicos del VI, se han evidenciado patrones de conducción eléctrica y secuencias de activación diferentes en el VI o en ambos ventrículos de pacientes con miocardiopatía dilatada y BRIHH15-18 y con tiempos de activación del VI similares, como los del presente estudio; además, se ha demostrado que la TRC reduce el tiempo de activación eléctrica19. En el presente estudio, nosotros observamos también unas secuencias eléctricas similares a las descritas en dichos estudios. Además, observamos que algunos pacientes presentaban una línea de bloqueo con un reinicio brusco de la propagación eléctrica; todos estos pacientes respondieron a la TRC. En cambio, algunos pacientes (n = 5) mostraron una propagación más escalonada y una línea de bloqueo más posterior; de estos, 4 tenían una cicatriz transmural localizada en la zona de la pared posterolateral. Auricchio et al17 habían demostrado previamente la presencia de esta línea de bloqueo en la mayor parte de su población de pacientes con BRIHH y describieron que estas líneas de bloqueo se desplazan tras la aplicación de un ritmo de marcapasos ventricular desde las venas coronarias y el ápex del ventrículo derecho. Hemos confirmado estos resultados previos y, además, hemos evidenciado de qué forma se modifica el patrón después de la TRC.
Son pocos los estudios que han analizado la secuencia de la diseminación mecánica usando ecocardiografía. De Boeck et al20 evaluaron los patrones de activación mecánica basándose en el strain bidimensional, reconstruyendo la geometría tridimensional a partir de la ecocardiografía bidimensional y analizando la activación mecánica y la deformación del VI. Esos autores observaron también patrones de activación mecánica en los pacientes con disfunción sistólica del VI y BRIHH diferentes que en los pacientes con ventrículos normales. Por otro lado, la relación entre la activación eléctrica y la contracción mecánica máxima del VI en los pacientes con disfunción sistólica del VI y BRIHH apenas se ha estudiado15,21. Fung et al15 evaluaron la relación entre la activación eléctrica del VI determinada por cartografía sin contacto y la disincronía mecánica por técnicas de imagen por Doppler tisular en pacientes con disfunción sistólica del VI y BRIHH. Esos autores observaron una alta correlación entre el tiempo de activación eléctrica del VI y un índice de sincronía mecánica en los pacientes con una línea de bloqueo de conducción. Sin embargo, en los pacientes con conducción homogénea y sin una línea de bloqueo de conducción, no hubo correlación entre estos tiempos de activación eléctrica y mecánica. Después de 3 meses de seguimiento con TRC, solamente los pacientes con una línea de bloqueo de conducción mostraron mejoras significativas en los parámetros clínicos y la función sistólica del VI.
Influencia del sustratoDespués de la TRC optimizada, los tiempos de diseminación de las activaciones tanto eléctrica como mecánica se redujeron de manera significativa. Se observaron reducciones significativas del retraso temporal tras la TRC tan solo en los pacientes sin cicatriz transmural en el VI, mientras que los tiempos se mantuvieron principalmente sin cambios en los pacientes con cicatriz transmural (figura 4). Además, los pacientes que presentaron reducciones inmediatas de los tiempos eléctricos y mecánicos, la mayoría de ellos (87%) sin cicatriz transmural, mostraron una respuesta positiva a la TRC en el seguimiento llevado a cabo a los 12 meses. Esto concuerda con los resultados obtenidos por Leclercq et al22, que demostraron en un estudio en animales de experimentación que la resincronización mecánica parece ser de la máxima importancia para la mejora funcional, en mayor medida que la resincronización eléctrica, y esto concuerda también con la peor respuesta a la TRC observada en los pacientes con isquemia23,24, lo que está directamente relacionado con la cantidad de miocardio viable y la presencia de cicatriz transmural24.
De hecho, el 80% de los pacientes con cicatriz transmural no respondieron a la TRC y sus tiempos no se modificaron significativamente después de la TRC. La extensión de la cicatriz y la localización precisa del electrodo en relación con la cicatriz influyen también en el efecto de la TRC, ya que implantar el electrodo en un segmento del miocardio con cicatriz puede conducir a activación y estimulación ineficaces. En este sentido, la E3DTR ha mostrado ya su potencial en la evaluación de la colocación óptima de los electrodos y su efecto en la respuesta a la TRC25.
LimitacionesLa principal limitación de este estudio es el pequeño tamaño muestral de la población evaluada; sin embargo, teniendo en cuenta la complejidad de las técnicas utilizadas (cartografía electroanatómica), creemos que es suficiente para generar una hipótesis, a pesar de que las conclusiones pudieran no tener la potencia suficiente para modificar el tratamiento de los pacientes. En consecuencia, es necesario confirmar nuestros resultados en estudios más amplios.
La adquisición insuficiente de la geometría ventricular determinada por el número de puntos registrados en los estudios electroanatómicos puede haber limitado nuestro análisis de la activación del VI. Por lo que respecta a la E3DTR, la baja resolución temporal puede haber limitado la calidad de la imagen y, por ello, el análisis preciso de la secuencia de la activación mecánica; además, la evaluación del movimiento mecánico mediante la E3DTR se basa en los cambios de los volúmenes segmentarios, por lo que el movimiento podría no corresponder a una verdadera contracción del miocardio, sino a un movimiento pasivo producido como consecuencia de la tensión de segmentos adyacentes. Nuevos estudios basados en el strain tridimensional26,27, y no en el desplazamiento o los cambios de volumen, podrían ser útiles para determinar mejor la secuencia de la contracción mecánica, en especial en pacientes con cicatriz miocárdica. A pesar de estas limitaciones, creemos que los cambios de los volúmenes segmentarios aportan un instrumento útil para evaluar las secuencias de movimiento de los segmentos en lo relativo a la eyección ventricular10,28. Además, no se tuvo en cuenta el área de la cicatriz en relación con el tejido miocárdico restante ni la localización del electrodo respecto a la cicatriz.
Por último, la definición de la respuesta a la TRC, que continúa siendo objeto de controversia29, se basó en el remodelado inverso volumétrico del VI y no incluyó otras variables detalladas.
CONCLUSIONESEste estudio demuestra la existencia de una relación muy variable entre las secuencias y los tiempos de acoplamiento electromecánico del VI de los pacientes con disfunción sistólica del VI, a pesar de un patrón similar del ECG de superficie (BRIHH). Además, la posible corrección de esta relación con la TRC depende del sustrato miocárdico. Normalizar la diseminación del movimiento mecánico corrigiendo la secuencia de la activación eléctrica es un requisito para que se produzca la respuesta al TRC; sin embargo, esto varía en función de la presencia de una cicatriz miocárdica. De hecho, se observó una resincronización eléctrica parcial en los pacientes con respuesta e incluso en algunos pacientes sin respuesta a la TRC, mientras que la resincronización mecánica se produjo únicamente en los pacientes con respuesta. Evitar el miocardio con cicatrización y un mejor conocimiento de la secuencia de activación eléctrica de cada paciente individual pueden conducir a una mejor respuesta a la TRC en el futuro. Serán necesarios nuevos estudios prospectivos más amplios que combinen estas técnicas de imagen.
FINANCIACIÓNEl estudio fue financiado en parte por subvenciones del programa CENIT (Consorcios Estratégicos Nacionales en Investigación Técnica) del Centro de Desarrollo Tecnológico Industrial (proyecto cvREMOD [Convergencia de Tecnologías Médicas para la Gestión Integral del Remodelado Cardiovascular]), la Sociedad Española de Cardiología (2010) y el Gobierno de España, REDINSCOR RD06/0003/0008.
CONFLICTO DE INTERESESNinguno.
Estamos en deuda con Gemma Pros y Neus Portella por su ayuda administrativa y con Elaine Lilly por su colaboración editorial.