Palabras clave
INTRODUCCIÓN
Los resultados esperados en el intervencionismo coronario dependen de numerosos factores clínicos, anatómicos y técnicos, en muchas ocasiones solapados e interdependientes unos de otros. La predicción de los resultados de la angioplastia coronaria ha sido establecida desde el año 19861 por la clásica estratificación de riesgo del American College of Cardiology/American Heart Association (ACC/AHA). Esta clasificación, ampliamente usada en la actualidad, presenta varias limitaciones, como la variabilidad interobservador en la cualificación angiográfica de las lesiones, el no tener en cuenta la función ventricular ni determinadas características clínicas del paciente o la forma de presentación de los cuadros clínicos. Por otra parte, el cambio de las técnicas, la mayor experiencia global y la aplicación universal del stent, con la disponibilidad reciente de los stents recubiertos de fármacos, han cambiado sustancialmente el enfoque actual del intervencionismo.
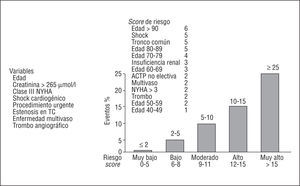
Han surgido varios intentos de precisar con mayor exactitud los riesgos inherentes al intervencionismo coronario. Entre éstos destaca el desarrollado por miembros de la Clínica Mayo2, que establecen un score basado en 5 variables clínicas y 3 variables angiográficas (fig. 1). En comparación con el score de la ACC/AHA, éste tiene una mayor capacidad discriminatoria para establecer el riesgo de complicaciones mayores tras la angioplastia, verdaderos determinantes de la evolución a largo plazo, aunque aquél todavía es ligeramente mejor para predecir el fallo angiográfico inmediato. A continuación veremos la importancia de diversos factores clínicos y anatómicos en los resultados actuales del intervencionismo coronario.
Fig. 1. Predicción de complicaciones postintervencionismo según el score de la Clínica Mayo. Variables clínicas y angiográficas con la puntuación correspondiente sobre el gráfico y los 5 grados de riesgo de complicaciones mayores.
ANGINA ESTABLE
Los pacientes con angina estable generalmente tienen una menor coronariopatía asociada y presentan una función ventricular conservada, por lo que el riesgo de eventos clínicos importantes no es elevado. En estudios clásicos en los que se comparaba el tratamiento médico con la angioplastia con balón3,4 no se observaron diferencias significativas en la mortalidad o el infarto, aunque sí una mejor tolerancia al ejercicio y una menor incidencia de angina en los pacientes dilatados, pero con una mayor tasa de cirugía por reestenosis en los pacientes con angioplastia.
Con el stent, el principal inconveniente de la reestenosis ha disminuido notablemente, lo que ha determinado un cambio en los protocolos de actuación de los pacientes con angina estable. Sin ser excluyente con un correcto tratamiento a base de aspirina, antianginosos, bloqueadores beta, estatinas y controles higiénico-sanitarios, la angioplastia con stent es el tratamiento de elección en la gran mayoría de lesiones si se exceptúan, sobre todo, las lesiones del tronco común izquierdo. Está en marcha un estudio interesante con datos de seguimiento a largo plazo (5 años), el COURAGE5, en el que se compara la angioplastia y el tratamiento médico intensivo con el manejo médico agresivo aislado en pacientes con 1-3 vasos; sus resultados nos ofrecerán una respuesta ante los modos de proceder actuales.
ANGINA INESTABLE
El tratamiento farmacológico de los pacientes con síndrome coronario agudo sin elevación del segmento ST (SCASEST) incluye, además de las terapias antianginosas habituales, la administración en el momento del ingreso de inhibidores de la agregación plaquetaria6-8: aspirina, clopidogrel, inhibidores de la glucoproteína IIb/IIIa y la utilización simultánea de antitrombóticos, como las heparinas fraccionadas de bajo peso molecular9.
Las dos cuestiones que se deben plantear a continuación en el manejo de los pacientes con SCASEST serán, en primer lugar, conocer cuáles son los pacientes que se van a beneficiar de una estrategia intervencionista inicial. De esta manera será preciso disponer de un método de estratificación individual de riesgo, útil y de alto valor predictivo que sea aplicable casi inmediatamente después del ingreso10. La segunda cuestión surge si se adopta una estrategia intervencionista inicial y consiste en determinar cuándo se realiza dicho procedimiento, o el tiempo óptimo de retraso del estudio coronariográfico11.
En los últimos años han ido apareciendo suficientes datos que apoyan la estrategia invasiva inicial, especialmente en los pacientes de riesgo intermedio y alto, frente a la pasivización o enfriamiento de la placa12-14. Todos estos estudios tenían en común que el tratamiento invasivo se efectuaba, por término medio, en las primeras 24-72 h y que desde el diagnóstico se había comenzado un tratamiento intensivo con antitrombóticos y antiplaquetarios. Un estudio reciente, ISAR-COOL, hace todavía más hincapié en el tiempo óptimo para la intervención15. Se aleatorizó a 410 pacientes con angina inestable, con depresión del segmento ST o elevación de la troponina T, para una intervención percutánea precoz dentro de las primeras 6 h (tiempo medio de 2,4 h) o para una estrategia de «enfriamiento» durante 3-5 días antes de la intervención (tiempo medio, 86 h). Todos los pacientes recibieron desde el ingreso aspirina, clopidogrel, tirofiban y heparina intravenosa no fraccionada. El objetivo principal (muerte o infarto a los 30 días) fue significativamente reducido en el grupo de intervencionismo precoz (el 5,9 frente al 11,6%; p = 0,04). Esta diferencia fue debida sobre todo a un mayor número de infartos antes del cateterismo en el grupo de la estrategia de «enfriamiento».
Una alternativa al tratamiento antitrombótico y antiplaquetario intravenoso habitual, concomitante al intervencionismo, está representada por los datos del estudio REPLACE II16, que muestra la seguridad y eficacia de un nuevo antitrombótico, la bivalirudina, frente a la combinación de heparina y abciximab como único tratamiento durante el procedimiento intervencionista. Estudios que tienen como objetivo definir el papel de la bivalirudina en pacientes con angina inestable de alto riesgo con intervención precoz, como el estudio ACUITY17, verán la luz durante el próximo año.
Las recomendaciones actuales de las guías18 en los pacientes con SCASEST de riesgo bajo es la de efectuar una coronariografía guiada por isquemia. En los de riesgo intermedio o elevado (especialmente si hay cambios electrocardiográficos o marcadores enzimáticos elevados) se recomienda aplicar una estrategia intervencionista precoz; la realización de la coronariografía dentro de las primeras 24-48 h parece un plazo adecuado, dada la variabilidad logística inherente a nuestro sistema sanitario19.
INSUFICIENCIA RENAL
La incidencia de nefropatía por contraste en los pacientes a los que se realiza una coronariografía o un procedimiento de revascularización percutánea puede variar según los criterios de definición utilizados20. Si utilizamos un incremento en la cifra de creatinina sérica > 25% de la cifra basal, la incidencia varía desde < 1% en pacientes normales hasta el 50% en grupos de alto riesgo. Por otra parte, la presencia de insuficiencia renal oscurece el pronóstico21 e incluso llega a doblar la cifra de mortalidad de los pacientes con intervencionismo coronario. Aunque la etiología es multifactorial, la intensa vasoconstricción medular inducida por el contraste es la causa más común de nefropatía, y los enfermos con disfunción renal previa presentan el mayor riesgo, especialmente los que tienen nefropatía diabética. Otros factores de riesgo en estos pacientes incluyen la utilización de grandes volúmenes de contraste, la hipovolemia y la presencia de disfunción ventricular izquierda.
El principal mecanismo protector, especialmente en los pacientes de alto riesgo, es la adecuada hidratación de los pacientes22 mediante la administración de suero salino isotónico (100-150 ml/h) durante las 8-12 h previas al procedimiento y manteniéndolo después durante otras 12-24 h. La utilización de contrastes no iónicos isoosmolares (iodixanol)23, en comparación con los de baja osmolaridad (iohexol) y, sobre todo, la cantidad utilizada pueden afectar la severidad del daño renal.
El tratamiento previo con N-acetilcisteína (600 mg cada 12 h el día antes y el día después del procedimiento) parece que disminuye la incidencia de nefropatía en pacientes con insuficiencia renal moderada, especialmente cuando se asocia con una correcta hidratación y la utilización de pequeñas cantidades de contraste24. El beneficio de la N-acetilcisteína se puede obtener también cuando sea necesario efectuar procedimientos urgentes mediante su administración en forma de bolo intravenoso 4 h antes del procedimiento25.
La utilización de fenoldopan, un agonista dopaminérgico, antes del procedimiento no parece que tenga ningún efecto protector en la nefrotoxicidad. En un estudio reciente26 se ha comparado la N-acetilcisteína con el fenoldopan junto con una correcta hidratación y se ha observado un claro beneficio a favor de la N-acetilcisteína (el 4,1 frente al 13,7%; p = 0,019) en la elevación de al menos 0,5 mg/dl de la cifra de creatinina sérica.
Se ha postulado la utilidad de efectuar un hemofiltrado posprocedimiento en pacientes con cifras elevadas (creatinina > 2 mg/dl) sobre la base de un estudio reciente27 que mostraba una reducción significativa (el 52 frente al 9%; p < 0,001) en el incremento de la creatinina en un 25% del valor basal y una reducción de la mortalidad hospitalaria del 14 frente al 2% (p = 0,001).
DIABETES MELLITUS
Más de la mitad de los adultos diabéticos tiene una ateroesclerosis coronaria significativa, con una prevalencia 10 veces mayor que la de la población general, que se sitúa en torno al 2-4%28. Los pacientes diabéticos representan el 15-25% del total de pacientes que reciben un procedimiento intervencionista coronario y los resultados a corto y largo plazo son inferiores a los de los no diabéticos29, fundamentalmente por la presencia de una enfermedad vascular más difusa, con vasos más pequeños, un alto grado de trombogenicidad y un mayor desarrollo de hiperplasia intimal, que se traduce en una mayor tasa de reestenosis postangioplastia.
Tres son las medidas para mejorar los resultados del intervencionismo en los pacientes diabéticos: optimizar el tratamiento farmacológico de los síndromes coronarios, mejorar los dispositivos intervencionistas y mejorar la prevención secundaria.
Los pacientes diabéticos son los que más se han beneficiado del tratamiento coadyuvante durante el intervencionismo coronario con los inhibidores de la glucoproteína IIb/IIIa, especialmente el abciximab y el tirofiban. El efecto beneficioso se produce tanto en situaciones estables como en síndromes coronarios agudos30,31, con una reducción de la mortalidad a los 30 días del 70% y al año del 45%.
El stent metálico ha mejorado los resultados iniciales y a largo plazo y ha disminuido la tasa de reestenosis frente al balón pero los resultados no son superponibles a los de los pacientes no diabéticos, especialmente en los que tienen diabetes tipo 132. Con la aparición de los stents recubiertos con fármacos inhibidores de la hiperplasia intimal se ha dado un paso de gigante para la disminución de la tasa de reestenosis intra-stent. En la actualidad son dos los fármacos disponibles: rapamicina y paclitaxel, y los datos disponibles hasta el momento procedentes de estudios aleatorizados33,34 muestran, en el subgrupo de pacientes diabéticos, una reducción global a los 9 meses de la tasa de reestenosis angiográfica del 80%. A su vez, la necesidad de nueva revascularización oscila, según los estudios, entre el 2-7% y el 20-56% (p < 0,001) entre los tratados con stent recubierto frente a los tratados con stent convencional. En un estudio reciente de Sabaté et al35 realizado en pacientes diabéticos aleatorizados para recibir stent recubierto con rapamicina frente a stent convencional se ha observado una disminución de la tasa de reestenosis del 5 frente al 31% (p < 0,0001) y una disminución de nueva revascularización del 7,5 frente al 31% (p < 0,0001).
Independientemente de los fármacos y dispositivos utilizados, es de gran importancia mantener un buen control de las cifras de glucemia postintervencionismo, así como el reconocimiento de los llamados estados «prediabéticos», en los que una ligera elevación de la cifra de glucosa en ayunas o de la hemoglobina A1c36,37 está asociada con un incremento del riesgo de muerte, reestenosis y necesidad de nuevas revascularizaciones.
ENFERMEDAD MULTIVASO Y FUNCIÓN VENTRICULAR
Los datos clásicos del estudio CASS establecieron que la indicación de revascularización en los pacientes diagnosticados de una coronariopatía multivaso y función normal es mejorar los síntomas y la capacidad funcional; si la función está disminuida, el objetivo incluirá prolongar la supervivencia.
Para determinar cuál es la mejor estrategia de revascularización, si la angioplastia o la cirugía coronaria, se efectuaron múltiples estudios aleatorizados en los que se incluyó a más de 5.000 pacientes38. La mayoría de ellos, sin embargo, fueron efectuados en épocas en las que no se utilizaban los stents y los inhibidores de la glucoproteína IIb/IIIa de forma sistemática por lo que, si bien los resultados a 1-3 años eran similares en términos de muerte y/o infarto, a largo plazo el beneficio se decantaba por la cirugía, especialmente por una menor necesidad de nueva revascularización. Este beneficio era aún más evidente en los pacientes diabéticos.
Sin embargo, se pusieron de manifiesto dos cuestiones importantes: a) los pacientes remitidos para una u otra técnica son diferentes, un hecho problemático para el diseño y la interpretación de los estudios clínicos, y b) la reestenosis, el factor que mejor explica las diferencias de resultados, ha ido disminuyendo desde la utilización sistemática del stent.
Los criterios de inclusión y exclusión fueron muy rígidos y diferentes en estos estudios, de manera que, globalmente, menos del 10% de los pacientes considerados elegibles fue finalmente aleatorizado, lo que sugiere que los resultados pueden no ser aplicables a todos los pacientes con enfermedad multivaso. Una cuestión importante que afecta a los resultados a largo plazo no es tanto el modo de revascularización, sino si ésta es o no completa, ya sea desde un punto de vista anatómico (revascularización de todas las estenosis > 50% en vasos ≥ 2,0 mm) o funcional (revascularización sólo de las lesiones que causen isquemia). Datos del estudio EAST39 sugieren que cuando una revascularización funcional equivalente se obtiene con angioplastia y cirugía, los resultados a largo plazo serán los mismos. Del mismo modo, cuando la función está disminuida, especialmente en los pacientes diabé ;ticos, estará justificada una revascularización anatómicamente completa, mientras que si aquélla es normal, puede ser suficiente con una revascularización funcionalmente completa.
Con la utilización de los potentes fármacos antiplaquetarios y la generalización en el uso del stent ha aumentado la complejidad de las lesiones y de los pacientes con una angioplastia multivaso, sin que haya habido un empeoramiento de los resultados inmediatos en términos de mortalidad y/o infarto hospitalario, más bien todo lo contrario40. En los pacientes con enfermedad multivaso y de alto riesgo para la cirugía, la estrategia intervencionista con stent supone una alternativa eficaz a medio plazo, con unas tasas de complicaciones inmediatas hospitalarias significativamente menores que con la opción quirúrgica, como muestran los datos publicados del estudio AWESOME41. A largo plazo tenemos los datos de varios estudios aleatorizados entre cirugía y angioplastia con stent (ARTS 1 y ERACI II )42,43; todos ellos muestran, a 2-3 años de seguimiento, una supervivencia sin muerte, infarto ni accidente cerebrovascular igual en ambas estrategias, pero con una mayor necesidad de nueva revascularización que, aunque claramente inferior a la de los estudios previos con balón, todavía era mayor en el grupo de tratamiento percutáneo.
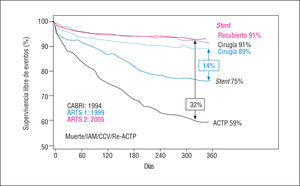
Los buenos resultados obtenidos con la utilización de stents recubiertos con fármacos33,34 pone de nuevo en cuestión la utilidad práctica de los datos conocidos hasta el momento. Tenemos ya datos preliminares del estudio ARTS 244, en el que se comparan los datos conocidos del estudio ARTS 1 con los de un grupo de pacientes con afectación multivaso pero con un peor perfil clínico tratados con stents recubiertos. La cifra de complicaciones al mes en los pacientes del ARTS 2 fue del 2,8%, frente al 4,1 y 8,2% en los grupos quirúrgico e intervencionista, respectivamente, del estudio ARTS 1. A su vez, la tasa de eventos mayores a los 6 meses fue del 5,3% en el ARTS 2 frente al 9,0 y 20% en los grupos quirúrgico y percutáneo del ARTS 1, respectivamente, debido a una disminución significativa de la necesidad de una nueva revascularización por reestenosis. A la espera de conocer los resultados a 1 año, parece que con los stents recubiertos estamos cerca de igualar los resultados quirúrgicos a largo plazo (fig. 2).
Fig. 2. Supervivencia libre de eventos de 2 estudios aleatorizados entre cirugía y angioplastia en pacientes con enfermedad multivaso (CABRI y ARTS 1) y datos previstos del estudio ARTS 2 para el stent recubierto con fármacos. Los resultados a largo plazo con el stent recubierto igualan los mejores resultados quirúrgicos. IAM: infarto agudo de miocardio; CCV: cirugía de revascularización; ACTP: angioplastia coronaria transluminal percutánea.
LOCALIZACIÓN DE LA LESIÓN
Safenas
La angioplastia sobre la safena ha sido siempre un problema no del todo resuelto en la cardiología intervencionista, con una elevada tasa de complicaciones inmediatas y peores resultados a largo plazo. Las complicaciones inmediatas o subagudas se relacionan con la embolia distal y la disminución del flujo anterógrado (fenómeno de no reflow), mientras que a largo plazo el problema es la elevada reestenosis.
La embolización distal de parte de la placa que causa una oclusión aguda en las porciones distales del vaso nativo ocurre en el 2-15% de los casos. Aunque se dispone de algunos datos que sugieren la utilidad de los inhibidores de la glucoproteína IIb/IIIa, en otros estudios observacionales se muestra un limitado beneficio con esta estrategia45. En los últimos años han ido apareciendo diferentes sistemas mecánicos que previenen esta embolización distal, y son varios los estudios publicados46,47 que muestran su eficacia debido fundamentalmente a una menor incidencia de infarto de miocardio (el 8,6 frente al 14,7%) y de fenómeno de no reflow (el 3 frente al 9%). Cuando el cuadro clínico y el aspecto angiográfico hacen sospechar la presencia de material trombótico reciente, además de los sistemas mencionados pueden utilizarse sistemas de extracción de trombo. Aparte de estudios observacionales, hasta el momento sólo disponemos de 2 estudios aleatorizados48,49 que, aunque con resultados dispares en cuanto a beneficio clínico global, sí que parecen disminuir la magnitud de los infartos de miocardio posprocedimiento.
La disminución del flujo anterógrado, también conocido como fenómeno de no reflow, tiene una etiología incierta, pero puede ser debido a microembolizaciones y/o espasmos microvasculares y su frecuencia puede llegar hasta el 12% de los procedimientos. Aunque los sistemas de protección pueden prevenir este fenómeno, su tratamiento es diferente y pueden ser efectivos diversos fármacos administrados por vía intracoronaria, como vasodilatadores del tipo de los nitratos, nitroprusiato o adenosina, y antagonistas del calcio como el verapamilo.
La elevada reestenosis tras la utilización del balón hizo que el implante del stent fuese una indicación clara en el intervencionismo de las safenas50. Pese a todo, los resultados a largo plazo siempre fueron inferiores a los obtenidos en las arterias nativas, con una posibilidad de reestenosis que se extendía más allá de los primeros 7 meses y con un riesgo que continuaba hasta los 18-24 meses, debido a una especial naturaleza progresiva de la enfermedad en zonas en las que inicialmente se había utilizado un stent51. Aunque en la mayoría de estudios aleatorizados disponibles sobre los stents recubiertos de fármacos se excluye a los pacientes con safenas, éstos sí que han sido incluidos en registros recientes52 en los que se recoge la actividad consecutiva, incluido todo tipo de lesiones, de varios equipos de intervencionismo, con excelentes resultados a medio plazo y tasas de nueva revascularización por reestenosis < 5%.
Tronco común
La afección del tronco común izquierdo está presente en el 3-5% de los pacientes que realiza una coronariografía. Aunque se ha considerado siempre como una indicación estándar de la revascularización quirúrgica53, la lesión del tronco es técnicamente factible y, desde la disponibilidad del stent, numerosos grupos han comunicado sus resultados. En principio, éstos dependerán de varios factores: a) las condiciones clínicas en que se efectúa el procedimiento (electivo o emergente); b) la presencia de una protección mediante un injerto venoso o arterial, y c) el estado de la función ventricular.
En una serie actual54 en la que se ha incluido a todo tipo de pacientes se obtienen cifras de mortalidad hospitalaria del 15% (del 3,7% en casos electivos y del 45,5% en casos urgentes). La probabilidad acumulada de supervivencia para el grupo electivo fue del 86% a los 3 años, comparada con el 54% a partir del sexto mes en el grupo urgente. En otro estudio similar55 se mostraba una supervivencia global al año del 88%, que aumentaba al 95% en los troncos protegidos y disminuía al 72% en los no protegidos; la tasa de eventos fue del 25 y del 49%, respectivamente, sobre todo por una nueva revascularización por reestenosis (20%). Una serie con datos a más largo plazo en la que únicamente se han incluido troncos no protegidos en procedimientos electivos56 muestra una tasa de supervivencia a los 3 años del 91%, con cifras de mortalidad de origen cardíaco del 11,9% y una tasa de reestenosis del 31%.
El factor limitante impuesto por la alta tasa de reestenosis del stent podría quedar en parte solucionado por la disponibilidad de los stent recubiertos de fármacos. Aunque la experiencia todavía es escasa, empiezan a aparecer algunas series57-59 con muy buenos resultados inmediatos y cifras de reestenosis, tras 1 año de seguimiento, del 4-8%, con necesidad de nueva revascularización en el 2-4% de los pacientes y con cifras de mortalidad no superiores al 1%.
No obstante, en el momento actual siguen siendo aplicables las guías publicadas sobre intervencionismo coronario60, que establecen el tratamiento quirúrgico del tronco común como una indicación de tipo I; asimismo, la angioplastia es una indicación de tipo IIa en lesiones favorables con tronco protegido o, si no está protegido, cuando el riesgo quirúrgico sea elevado, y una indicación de tipo IIb en troncos no protegidos (fig. 3).
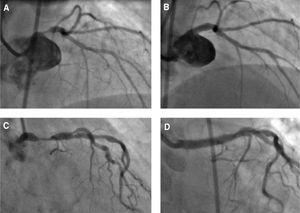
Fig. 3. Dos casos de angioplastia del tronco común izquierdo, electivas y sin protección. A) Lesión ostial sin calcio, en mujer de 57 años, con clínica estable y con alta probabilidad de éxito angiográfico (indicación IIb). B) Resultado tras colocar un stent recubierto. C) Lesión en tercio medio del tronco en una mujer de 85 años con alto riesgo quirúrgico (indicación IIa). D) Resultado final tras implantar un stent recubierto.
Lesiones ostiales
Podemos definir las lesiones ostiales como aquellas localizadas dentro de los 3 mm del ostium de la descendente anterior, la circunfleja o la coronaria derecha. Clásicamente, estas lesiones estaban asociadas con un resultado angiográfico inadecuado tras el balón, por su mayor rigidez y un gran componente elástico. Diferentes dispositivos de aterectomía, por corte o abrasión61, o bien con balón de corte62, fueron eficaces para obtener un mejor resultado angiográfico inmediato pero, por el contrario, presentaban una alta tasa de reestenosis (40-60%).
El stent utilizado como única medida o tras la realización de un procedimiento de aterectomía ha disminuido el riesgo de retracción elástica y disección severa, con lo que se ha obtenido un buen resultado inmediato y menores tasas de reestenosis (20-35%)63. En un reciente trabajo retrospectivo se compara la evolución a 1 año del stent en lesiones ostiales y lesiones proximales no ostiales64. Mientras que los resultados inmediatos fueron similares (el 93 frente al 97%), la supervivencia libre de eventos al año fue más baja en la lesiones ostiales (el 69 frente al 80%; p < 0,002), principalmente debido a una mayor necesidad de nueva angioplastia (el 19 frente al 10%; p < 0,0001). Aunque no hay estudios específicos sobre stents recubiertos en este tipo de lesiones, los datos obtenidos acerca de la actividad consecutiva de un único centro65 en el que se implantan de manera exclusiva stents recubiertos muestran cifras de reestenosis significativamente menores que con los stents convencionales.
Bifurcaciones
Se puede definir una auténtica lesión bifurcada como la que presenta al menos una estenosis del 70% en el vaso principal y también en el ostium de la rama secundaria o lateral. Con esta definición, hasta un 15% de los procedimientos intervencionistas se efectúa en lesiones bifurcadas. Tradicionalmente, la angioplastia con balón estaba asociada con ua tasa de éxito y una relativamente alta incidencia de complicaciones inmediatas66, en muchas ocasiones debido a problemas relacionados con la disección u oclusión de la rama lateral. Las técnicas con doble balón o con sistemas de aterectomía no obtuvieron los resultados esperados, ni inmediatos, con mayor número incluso de complicaciones hospitalarias, ni a largo plazo, con una alta tasa de reestenosis. La utilización del stent logró en principio reducir las complicaciones agudas y disminuir la tasa de reestenosis, principalmente la asociada a la rama principal.
Antes de considerar las diferentes técnicas del abordaje con stent en el tratamiento de las lesiones bifurcadas, la primera cuestión que se plantea es si de entrada se va a tratar únicamente la arteria principal o si desde un principio se considera un tratamiento combinado con stent de ambos vasos. Para ello es necesario establecer la importancia real del vaso lateral, ya sea por su diámetro o, sobre todo, por la extensión del miocardio que dicho vaso irriga.
En los últimos años han sido numerosas las técnicas que han ido surgiendo para implantar el stent del modo más satisfactorio. El grupo francés de Lefevre67 establece 4 opciones principales según el orden y la forma de colocación del stent en la rama principal y la lateral.
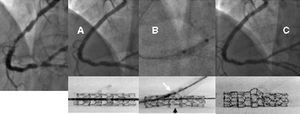
Si la opción elegida es colocar el stent en ambas ramas, utilizaremos la técnica de T stenting o la más actual técnica de crushing. El procedimiento de esta última técnica comienza por posicionar los 2 stents simultáneamente en ambas ramas de la bifurcación. A continuación se expande el stent de la rama lateral haciendo que sobresalga 3-5 mm en la luz de la rama principal. Seguidamente se expande el stent principal, con lo que la porción del stent lateral que sobresalía del ostium se aplasta literalmente contra la pared. Es aconsejable finalizar el procedimiento con un inflado simultáneo de balones en ambas ramas para mejorar la apertura lateral. Con este método aseguramos la completa cobertura metálica del ostium de la rama lateral a expensas de colocar, en una pequeña zona contigua del vaso principal, tres capas metálicas superpuestas (fig. 4).
Fig. 4. Lesión severa en la descendente anterior/diagonal. Técnica de Crushing stenting. A) Lesión inicial. B) Kissing balón tras implantar los 2 stents en las 2 arterias. C) Imagen en vacío de los 2 stents que permite apreciar la perfecta cobertura metálica del ostium de la diagonal. D) Imagen angiográfica final.
Si por el contrario se decide implantar inicialmente un solo stent en el vaso principal, la técnica elegida será la que facilite el paso, a través de las mallas de dicho stent, de un segundo stent hacia la rama lateral, siempre que haya razones clínicas o angiográficas para ello; este concepto se denomina provisional stenting (fig. 5).
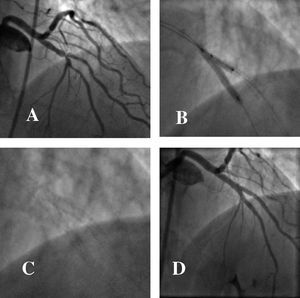
Fig. 5. Lesión severa en la bifurcación distal de la coronaria derecha. A) Implante de un stent recubierto hacia la rama interventricular posterior y lesión severa residual en el origen de tronco posterolateral. B) Posterior angioplastia con balón a través de las mallas del stent, hacia tronco posterolateral. C) Buen resultado angiográfico, que hace innecesaria la colocación de un stent en dicha rama. En la parte inferior se observa el equivalente in vitro de la técnica descrita.
Si bien los resultados inmediatos angiográficos con las técnica de T stenting o de stent provisional son excelentes (92-98%)68,69, con una tasa de complicaciones inmediatas del 2-5%, los resultados tardíos mostraban unas cifras de reestenosis angiográficas todavía elevadas, del 17-53%, sobre todo a expensas de reestenosis de la rama lateral y generalmente en su origen. El motivo de tan mala evolución es, en muchos casos, la imposibilidad de cubrir correctamente su ostium con el stent debido a la gran angulación en el origen de las ramas laterales.
Con la disponibilidad del stent recubierto, numerosos grupos han presentado sus resultados70,71 con la utilización de técnicas diversas con 1 o 2 stents. Las tasas de reestenosis se situaban entre el 3 y el 9% para el vaso principal y entre el 13 y el 25% para la rama lateral. Si se analizaban los casos de crushing (técnica que asegura la mejor cobertura del ostium lateral), la cifra de reestenosis en la rama lateral bajaba hasta un 7%, y también era menor (14%) si se analizaban los casos de provisional stenting. Una alternativa a estas técnicas son los llamados stents bifurcados, todavía no recubiertos de fármacos, de reciente disponibilidad en el mercado y por ello insuficientemente testados, pero que facilitan, si fuese preciso, un mejor acceso a la rama lateral.
Lesiones calcificadas
La calcificación es un componente importante de la placa aterosclerótica. Aparece en grados variables dependiendo de la composición y antigüedad de la placa, y tan importante es su extensión como la distribución en la placa y la pared arterial. La forma óptima de medir estas características es la ecografía intravascular72, pero habitualmente suele evaluarse mediante radioscopia en el momento de la angiografía, aunque su sensibilidad es escasa para detectar cantidades ligeras o moderadas de calcio y sólo moderada para detectar su extensión.
La calcificación no sólo es importante en la lesión a tratar, sino también en la pared arterial del vaso. Una arteria calcificada en toda su longitud puede dificultar la navegación del balón y otros dispositivos, complicando la llegada del stent hasta la lesión. Por otra parte, el calcio en la lesión puede impedir la correcta expansión del balón, pese a la utilización de altas presiones de inflado. Aunque la presencia de calcio, por sí sola, no es un factor que incremente el riesgo de reestenosis, la propia rigidez de la arteria dificulta la obtención de un área intraluminal final adecuada, lo que guarda una relación inversamente proporcional con el desarrollo de reestenosis. Así pues, es importante obtener la mayor área luminal posible. Para ello se implantará el stent mediante la utilización de presiones de inflado elevadas que nos permitan asegurar una correcta expansión y aposición a la pared arterial.
Si con balones adecuados y presiones elevadas no se consigue expandir simétricamente el balón, se utilizará un sistema de aterectomía rotacional o Rotablator, que fragmenta parte del calcio en micropartículas, de manera que se logra vencer la rigidez arterial y se pueden realizar posteriores inflados para, finalmente, implantar el stent. Los datos conocidos73 con esta técnica permiten obtener unos resultados de éxito angiográfico inmediato > 95%, con una tasa de eventos hospitalarios del 3,5%. Cuando el procedimiento se finalizaba con el implante de un stent, la necesidad de nueva revascularización por reestenosis fue del 15%.
Una alternativa sería la utilización de un balón de corte74 que, si bien estaría más indicado en lesiones fibrosas, puede fragmentar, mediante cortes longitudinales, las calcificaciones superficiales de la placa y facilitará una mejor distensibilidad de la lesión, lo que permitirá una correcta dilatación y expansión del stent.
Cabe esperar que los mismos resultados obtenidos con stents recubiertos en lesiones menos complejas se consigan también en lesiones calcificadas; al menos, los datos conocidos de alguna serie75 en la que incluyen todo tipo de lesiones, con un porcentaje elevado de lesiones calcificadas, muestran unos excelentes resultados clínicos a medio y largo plazo.
Oclusiones crónicas
La angioplastia sobre lesiones crónicamente ocluidas representa el 10-15% de la actividad intervencionista habitual. El sustrato patológico de las oclusiones crónicas es principalmente una placa fibrocalcificada, lo que dificulta, o en ocasiones imposibilita, que sea atravesada por los dispositivos especialmente diseñados al efecto. Esta circunstancia determina una baja tasa de éxito, con elevados costes de material, incremento de la dosis de exposición radiológica y, sobre todo, una mayor frecuencia de reestenosis y reoclusiones a medio plazo en comparación con las estenosis no oclusivas.
Una revisión de la bibliografía, con más de 4.400 oclusiones crónicas tratadas, muestra una tasa de éxito angiográfico del 69% (47-81%). Las razones más comunes para un fallo del procedimiento fueron: la imposibilidad de atravesar la lesión con la guía intracoronaria (80%), el fallo del balón para cruzar la oclusión (15%) y la incapacidad de éste para dilatar la estenosis (5%). Para situaciones de fallo persistente con las guías habituales se ha desarrollado un sistema especial consistente en una guía que, mediante reflectometría óptica, es capaz de diferenciar entre la pared del vaso y la luz central, lo que evita el riesgo de perforación. De manera simultánea, el sistema tiene la posibilidad de liberar pulsos de radiofrecuencia que favorecen el paso por el material fibrótico. Los datos de un estudio76 con este dispositivo muestran su eficacia para obtener un éxito angiográfico en más de la mitad de procedimientos previamente fallidos con las guías habituales, aunque hay que resaltar una cifra de perforaciones clínicas no despreciable (2,6%).
Se han publicado muchos estudios sobre las ventajas de la utilización del stent en este contexto. Pese a ello, las tasas de reestenosis angiográfica oscilan entre el 32 y el 55% y es necesaria una nueva revascularización en el 15 y el 25%. Las razones que explican esta mala evolución a largo plazo son variadas. Con frecuencia, estas lesiones están calcificadas, localizadas en zonas ostiales o bifurcadas y, además, suelen ser lesiones largas (> 15 mm), factores que favorecen por sí solos el aumento de la reestenosis.
A la vista de los datos de que se dispone, una de las aplicaciones más claras de los stents recubiertos es su utilización en las oclusiones crónicas. Los datos publicados por el grupo de Rotterdam77 sobre 56 pacientes consecutivos con oclusiones crónicas tratados con stents recubiertos muestran una tasa de reestenosis angiográfica a los 6 meses del 9%. Al año, el porcentaje de pacientes libres de eventos (infarto, muerte o nueva angioplastia) era del 96,4%. Un estudio prospectivo no aleatorizado (estudio SICTO)78 acaba de dar a conocer los resultados preliminares de 25 pacientes tratados con stent recubierto. A los 6 meses, sólo 2 pacientes necesitaron una nueva angioplastia en lesiones no relacionadas con los stents implantados.
Vasos pequeños
Un tercio de las angioplastias se realiza sobre arterias con un diámetro < 3 mm, el cual es un importante parámetro que condiciona la evolución del intervencionismo coronario. Las arterias de pequeño diámetro se asocian, además, con otros factores, como la diabetes o la ateromatosis difusa, que contribuyen aún más a una peor evolución a largo plazo. La utilización del stent ha mejorado los resultados, pero todavía está condicionado por cifras de reestenosis elevadas en comparación con los vasos de mayor diámetro.
La causa principal de la reestenosis intra-stent es el crecimiento neointimal. A igualdad de crecimiento neointimal, la reducción del área intraluminal será lógicamente mayor cuanto más pequeño sea el diámetro del stent utilizado. Éste es el motivo por el que la reestenosis es mayor en los vasos de pequeño diámetro.
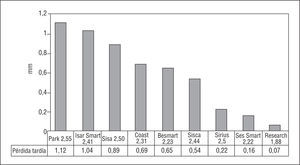
Han sido numerosos los estudios en los que se ha comparado el stent con el balón en vasos pequeños, aunque en algunos se han obtenido resultados contradictorios. En un reciente metaanálisis79 en el que se recogían los datos de 11 estudios aleatorizados se obtiene una tasa global de reestenosis angiográfica con stent frente al balón de 25,8 frente al 34,2% (p = 0,003), respectivamente. No hubo diferencias en la mortalidad y en la incidencia de infarto de miocardio, pero la necesidad de nueva revascularización fue menor en el grupo del stent (el 12,5 frente al 17%; p = 0,004) (fig. 6).
Fig. 6. Cuadro comparativo de estudios realizados en arterias de pequeño diámetro (el diámetro de referencia se indica junto con el acrónimo) respecto a la pérdida tardía (disminución de la ganancia inmediata en el área intraluminal) en el seguimiento angiográfico. Se incluyen 3 estudios: Sirius, Research y Ses-Smart, con stents recubiertos y con una pérdida tardía, claramente menor que con stents convencionales.
Un subanálisis de los principales estudios publicados con stent recubierto33,34 muestra que el beneficio se extiende también a los pacientes con arterias entre 2,3 y 2,8 mm de diámetro, con cifras de reestenosis que varían entre el 16 y el 6%, respectivamente, y con una reducción de riesgo del 57 y del 83%. En el estudio SES SMART80 se aleatorizó para recibir stent recubierto de rapamicina frente a stent convencional a una población de pacientes con arterias < 2,75 mm. La tasa de reestenosis fue del 9,8 frente al 53%, con necesidad de una nueva revascularización en un 7 frente a un 19,3%. Un subanálisis del registro de actividad con stents recubiertos del grupo de Rotterdam, sobre el tratamiento con stents recubiertos de rapamicina en arterias de muy pequeño diámetro81 (1,88 ± 0,34 mm), muestra unos excelentes resultados, con una cifra de reestenosis angiográfica del 10% y con una tasa de necesidad de una nueva angioplastia al año del 5,5%.
Sección patrocinada por el Laboratorio Dr. Esteve
Correspondencia: Dr. J. Zueco Gil.
Unidad de Cardiología Intervencionista. Hospital Universitario Marqués de Valdecilla.
Avda. Valdecilla, s/n. 39008 Santander. Cantabria. España.
Correo electrónico: hemodinamica@humv.es