Grupo de Trabajo sobre la Insuficiencia Cardíaca Aguda de la Sociedad Europea de Cardiología Aprobado por la Sociedad Europea de Medicina Intensiva (ESICM)
Autores/Miembros del Grupo de Trabajo: Markku S. Nieminen, Coordinadora (Finlandia), Michael Böhm (Alemania), Martin R. Cowie (Reino Unido), Helmut Drexler (Alemania), Gerasimos S. Filippatos (Grecia), Guillaume Jondeau (Francia), Yonathan Hasin (Israel), José López-Sendón (España), Alexandre Mebazaab (Francia), Marco Metra (Italia), Andrew Rhodesb (Reino Unido), Karl Swedberg (Suecia)
Comité de la ESC para la elaboración de las Guías de Práctica Clínica (GPC), Silvia G. Priori (Presidente) (Italia), María Ángeles Alonso García (España), Jean-Jacques Blanc (Francia), Andrzej Budaj (Polonia), Martín R. Cowie (Reino Unido), Veronica Dean (Francia), Jaap Deckers (Países Bajos), Enrique Fernández Burgos (España), John Lekakis (Grecia), Bertil Lindahl (Suecia), Gianfranco Mazzotta (Italia), João Morais (Portugal), Ali Oto (Turquía), Otto A. Smiseth (Noruega)
Revisores del documento: María Ángeles Alonso García (Co-coordinadora de revisión del GPC) (España), Kenneth Dickstein (Co-coordinador de revisión del GPC) (Noruega), Anibal Albuquerque (Portugal), Pedro Conthe (España), María Crespo-Leiro (España), Roberto Ferrari (Italia), Ferenc Follath (Suiza), Antonello Gavazzi (Italia), Uwe Janssens (Alemania), Michel Komajda (Francia), João Morais (Portugal), Rui Moreno (Portugal), Mervyn Singer (Reino Unido), Satish Singh (Reino Unido), Michal Tendera (Polonia), Kristian Thygesen (Dinamarca)
Con permiso de The European Society of Cardiology (ESC).
ÍNDICE DE CONTENIDOS
Preámbulo 390
1. Introducción 391
2. Epidemiología, etiología y contexto clínico 391
I. Definiciones, pasos diagnósticos, instrumentación y control del paciente con insuficiencia cardíaca aguda392
3. Definición y clasificación clínica de la insuficiencia cardíaca aguda392
3.1. Definición392
3.2. El síndrome clínico de la insuficiencia cardíaca aguda393
4. Fisiopatología de la insuficiencia cardíaca aguda395
4.1. El círculo vicioso en la insuficiencia cardíaca aguda395
4.2. Aturdimiento miocárdico396
4.3. Hibernación396
5. Diagnóstico de la insuficiencia cardíaca aguda397
5.1. Evaluación clínica397
5.2. Electrocardiograma398
5.3. Radiografía de tórax y técnicas de imagen398
5.4. Pruebas de laboratorio399
5.5. Ecocardiografía399
5.6. Otras investigaciones399
6. Objetivos del tratamiento en la insuficiencia cardíaca aguda400
6.1. Organización del tratamiento de la insuficiencia cardíaca aguda401
7. Instrumentación y control de los pacientes con insuficiencia cardíaca aguda401
7.1. Control no invasivo401
7.2. Control invasivo401
II. Tratamiento de la insuficiencia cardíaca aguda403
8. Aspectos médicos generales en el tratamiento de la insuficiencia cardíaca aguda403
9. Oxígeno y asistencia ventilatoria403
9.1. Bases para el uso de oxígeno en la insuficiencia cardíaca aguda403
9.2. Soporte ventilatorio sin intubación endotraqueal (ventilación no invasiva)403
9.3. Ventilación mecánica con intubación endotraqueal en la insuficiencia cardíaca aguda404
10. Tratamiento médico404
10.1. Morfina y análogos en la insuficiencia cardíaca aguda404
10.2. Anticoagulación404
10.3. Vasodilatadores en el tratamiento de la insuficiencia cardíaca aguda405
10.4. Inhibidores de la enzima de conversión de la angiotensina en la insuficiencia cardíaca aguda406
10.5. Diuréticos407
10.6. Fármacos bloqueadores beta408
10.7. Agentes inotrópicos410
11. Enfermedades subyacentes y comorbilidades en la insuficiencia cardíaca aguda413
11.1. Enfermedad arterial coronaria413
11.2. Enfermedad valvular415
11.3. Manejo de la insuficiencia cardíaca aguda debida a trombosis de válvula protésica415
11.4. Disección aórtica416
11.5. Insuficiencia cardíaca aguda e hipertensión416
11.6. Insuficiencia renal416
11.7. Enfermedades pulmonares y broncoconstricción417
11.8. Arritmias e insuficiencia cardíaca aguda417
11.9. Insuficiencia cardíaca aguda perioperatoria419
12. Tratamiento quirúrgico de la insuficiencia cardíaca aguda419
12.1. Insuficiencia cardíaca aguda relacionada con complicaciones del infarto agudo de miocardio419
13. Dispositivos de asistencia mecánica y trasplante cardíaco421
13.1. Indicación421
13.2. Trasplante cardíaco423
14. Resumen423
Bibliografía424
PREÁMBULO
Las guías de práctica clínica y los documentos de consenso de expertos tienen como objetivo presentar todas las evidencias relevantes sobre un tema específico para ayudar a los médicos a sopesar los riesgos y los beneficios de un diagnóstico particular o de un procedimiento terapéutico. Deberían ser útiles para la toma diaria de decisiones clínicas.
En los últimos años, la Sociedad Europea de Cardiología (ESC) y otras organizaciones y sociedades relacionadas han elaborado un gran número de Guías de Práctica Clínica y Documentos de Consenso de Expertos. Esta gran profusión puede poner en riesgo la autoridad y validez de las Guías, que sólo pueden estar garantizadas si se han desarrollado mediante un proceso incuestionable de toma de decisiones. Ésta es una de las razones por las que la ESC y otras sociedades han hecho pública una serie de recomendaciones para abordar y formular las Guías de Práctica Clínica y los Documentos de Consenso de Expertos.
A pesar de que los estándares para elaborar las Guías de Práctica Clínica y los Documentos de Consenso de Expertos de calidad están bien definidos, algunas evaluaciones recientes de las Guías de Práctica Clínica y los Documentos de Consenso de Expertos publicados en revistas con evaluación por pares entre 1995 y 1998 han mostrado faltas en el cumplimiento de los estándares metodológicos en la mayoría de los casos. Por lo tanto, es de la máxima importancia que las Guías y recomendaciones se presenten en formatos que puedan ser fácilmente interpretados. En consecuencia, sus programas de implementación también deben ser correctamente realizados. En este sentido, se han llevado a cabo algunos intentos para determinar si las Guías mejoran la calidad de la práctica clínica y la utilización de los recursos sanitarios.
El Comité para las Guías de Práctica Clínica (GPC) de la ESC supervisa y coordina la preparación de nuevas Guías de Práctica Clínica y Documentos de Consenso de Expertos elaborados por los Grupos de Trabajo, grupos de expertos o paneles de consenso. Se solicita a los expertos seleccionados para estos paneles que faciliten una declaración sobre todas sus posibles relaciones que puedan ser consideradas como causa de un conflicto de interés real o potencial. Estos formularios se guardan en forma de ficheros en la Casa Europea del Corazón, la oficina central de la ESC. El Comité es responsable también de la aprobación de estas Guías de Práctica Clínica y Documentos de Consenso de Expertos o de sus comunicados.
El Grupo de Trabajo ha clasificado la utilidad o eficacia del procedimiento y/o tratamiento recomendados y el Nivel de Evidencia, tal como se indica en las siguientes tablas:
GRADOS DE RECOMENDACIÓN
Clase IEvidencia y/o acuerdo general de que un determinado procedimiento diagnóstico/ tratamiento es beneficioso, útil y efectivo;
Clase IIEvidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del tratamiento;
Clase IIaEl peso de la evidencia/opinión está a favor de la utilidad/eficacia;
Clase IIbLa utilidad/eficacia está menos establecida por la evidencia/opinión;
Clase III*Evidencia o acuerdo general de que el tratamiento no es útil/efectivo y en algunos casos puede ser perjudicial.
*La ESC desaconseja el uso de la clase III.
NIVELES DE EVIDENCIA
Nivel de evidencia ADatos procedentes de múltiples ensayos clínicos aleatorizados o metaanálisis.
Nivel de evidencia BDatos procedentes de un único ensayo clínico aleatorizado o de grandes estudios no aleatorizados.
Nivel de evidencia CConsenso de opinión de expertos y/o pequeños estudios, estudios retrospectivos y registros.
1. Introducción
El objetivo de estas Guías es describir las bases del diagnóstico y el tratamiento de la insuficiencia cardíaca aguda en la población adulta.
El Grupo de Trabajo para las Guías de Práctica Clínica de la Insuficiencia Cardíaca Aguda ha sido nombrado por el Comité para la elaboración de las Guías de Práctica Clínica (GPC) de la ESC. El Grupo de Trabajo incluye representantes de la Asociación para la Insuficiencia Cardíaca de la ESC y miembros de la Sociedad Europea de Medicina Intensiva. Las recomendaciones del Grupo de Trabajo se enviaron a un panel de revisores y fueron aprobadas por el GPC de la ESC y por los miembros de la Sociedad Europea de Medicina Intensiva. Estas Guías forman, junto con las Guías de Práctica Clínica para el diagnóstico y tratamiento de la insuficiencia cardíaca crónica1, las recomendaciones sobre diagnóstico y tratamiento de la insuficiencia cardíaca.
Las recomendaciones también están publicadas en una versión íntegra del documento2, como una guía de bolsillo y como un CD educacional de la ESC.
2. Epidemiología, etiología y contexto clínico
La combinación del envejecimiento de la población en muchos países y la mejoría de la supervivencia después de un infarto agudo de miocardio3 han dado lugar a un rápido crecimiento del número de pacientes con insuficiencia cardíaca crónica4 y a un aumento concomitante del número de hospitalizaciones por insuficiencia cardíaca descompensada. La cardiopatía isquémica es la etiología de la insuficiencia cardíaca aguda en el 60-70% de los pacientes5-7, especialmente en la población de edad avanzada. Entre los individuos más jóvenes, la insuficiencia cardíaca aguda está causada con más frecuencia por una miocardiopatía dilatada, una arritmia, una enfermedad cardíaca valvular o congénita, o una miocarditis. Las causas y complicaciones de la insuficiencia cardíaca aguda se describen en la tabla 1.
El manejo de la insuficiencia cardíaca consume el 1-2% del gasto sanitario de los países europeos8,9, del que un 75% aproximadamente corresponde a gastos de hospitalización. La insuficiencia cardíaca avanzada y la descompensación aguda asociada se han convertido en los síndromes médicos individuales más caros de la cardiología10,11.
Los pacientes con insuficiencia cardíaca aguda tienen un pronóstico muy desfavorable. La mortalidad es particularmente elevada entre los pacientes con infarto agudo de miocardio acompañado de insuficiencia cardíaca grave, ya que llega a alcanzar el 30% a los 12 meses12. De manera similar, en el edema agudo de pulmón se ha descrito una mortalidad del 12% entre los pacientes hospitalizados y del 40% al cabo de 1 año13.
Alrededor del 45% de los pacientes hospitalizados con insuficiencia cardíaca aguda serán rehospitalizados al menos una vez (y un 15% al menos dos veces) en un plazo de 12 meses14,15. La estimación del riesgo de muerte o rehospitalización dentro de los primeros 60 días del ingreso oscila entre el 30 y el 60%, dependiendo de la población estudiada5,6,16-19 (*).
(*) En España se calcula que se producen cerca de 80.000 ingresos hospitalarios al año por insuficiencia cardíaca. La insuficiencia card&iacut e;aca es la primera causa de hospitalización en mayores de 65 años y supone un 5% de todas las hospitalizaciones1.
1. Rodríguez-Artalejo F, Banegas Banegas JR, Guallar-Castillón P. Epidemiología de la insuficiencia cardíaca. Rev Esp Cardiol. 2004;57:163-70.
PARTE I. DEFINICIONES, PASOS DIAGNÓSTICOS, INSTRUMENTACIÓN Y CONTROL DEL PACIENTE CON INSUFICIENCIA CARDÍACA AGUDA
3. Definición y clasificación clínica de la insuficiencia cardíaca aguda
3.1. Definición
La insuficiencia cardíaca aguda se define como el comienzo rápido de síntomas y signos secundario a una función cardíaca anormal. Puede ocurrir con o sin cardiopatía previa. La disfunción cardíaca puede estar relacionada con una disfunción sistólica o diastólica, con anomalías en el ritmo cardíaco o con desajustes de la precarga y la poscarga cardíacas. A menudo representa un riesgo para la vida y requiere un tratamiento urgente.
La insuficiencia cardíaca aguda puede presentarse en un forma aguda de novo (comienzo nuevo de una insuficiencia cardíaca aguda en un paciente sin disfunción cardíaca conocida previa) o como una descompensación aguda de una insuficiencia cardíaca crónica.
El paciente con insuficiencia cardíaca aguda puede presentarse con una o varias situaciones clínicas distintas (tabla 2):
1. Insuficiencia cardíaca descompensada aguda (de novo o como descom pensación de una insuficiencia cardíaca crónica) con signos y síntomas de insuficiencia cardíaca aguda, que son leves y no cumplen los criterios de shock cardiogénico, edema de pulmón o crisis hipertensiva.
2. Insuficiencia cardíaca aguda hipertensiva: los signos y síntomas de insuficiencia cardíaca se acompañan de presión arterial elevada y función ventricular izquierda relativamente preservada, con radiografía de tórax compatible con edema agudo de pulmón.
3. Edema de pulmón (corroborado por radiografía de tórax) acompañado de una importante dificultad respiratoria, con crepitantes pulmonares y ortopnea, y con una saturación de O2 normalmente por debajo del 90% respirando el aire ambiental, antes del tratamiento.
4. Shock cardiogénico: se define como la evidencia de una hipoperfusión tisular inducida por insuficiencia cardíaca después de la corrección de la precarga. No hay una definición clara para los parámetros hemodinámicos, lo que explica las diferencias en la prevalencia y los resultados obtenidas en los estudios (tabla 2), pero el shock cardiogénico se caracteriza normalmente por una reducción de la presión arterial (sistólica < 90 mmHg o un descenso de la presión arterial media de > 30 mmHg) y/o baja diuresis (< 0,5 ml/kg/h), con una frecuencia cardíaca > 60 lat/min con o sin evidencia de congestión orgánica. Hay un continuo desde el síndrome de bajo gasto cardíaco hasta la instauración del shock cardiogénico.
5. La insuficiencia cardíaca por alto gasto se caracteriza por un gasto cardíaco elevado, normalmente con una frecuencia cardíaca alta (causada por arritmias, tirotoxicosis, anemia, enfermedad de Paget, iatrogénica u otros mecanismos), con extremidades calientes, congestión pulmonar y, a veces, con una presión arterial baja, como en el shock séptico.
6. La insuficiencia cardíaca derecha se caracteriza por un síndrome de bajo gasto cardíaco con un aumento de la presión venosa yugular, hepatomegalia e hipotensión.
Hay otras clasificaciones del síndrome de insuficiencia cardíaca aguda que se utilizan en las unidades coronarias y en las unidades de cuidados intensivos. La clasificación de Killip se basa en signos clínicos y en hallazgos de las radiografías de tórax, y la clasificación de Forrester se basa en signos clínicos y en características hemodinámicas. Estas clasificaciones han sido validadas en la insuficiencia cardíaca aguda secundaria a infarto agudo de miocardio y, por lo tanto, se aplican mejor en el contexto de una insuficiencia cardíaca aguda de novo. La tercera clasificación de «gravedad clínica» ha sido validada en un servicio de miocardiopatías20 y se basa en hallazgos clínicos21. Se aplica fundamentalmente en la insuficiencia cardíaca crónica descompensada22.
Clasificación de Killip. La clasificación de Killip fue diseñada para proporcionar una estimación clínica de la gravedad del trastorno miocárdico en el tratamiento del infarto agudo de miocardio23:
Fase I. No hay insuficiencia cardíaca. No hay signos de descompensación cardíaca.
Fase II. Insuficiencia cardíaca. Los criterios diagnósticos incluyen estertores crepitantes, galope por tercer ruido e hipertensión venosa pulmonar. Congestión pulmonar con estertores húmedos en la mitad inferior de los campos pulmonares.
Fase III. Insuficiencia cardíaca grave. Edema pulmonar franco con estertores en la totalidad de ambos campos pulmonares.
Fase IV. Shock cardiogénico. Los signos incluyen hipotensión (presión arterial sistólica ≤ 90 mmHg) y evidencia de vasoconstricción periférica, como oliguria, cianosis y diaforesis.
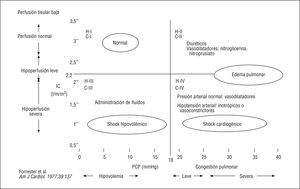
Clasificación de Forrester. La clasificación Forrester para la insuficiencia cardíaca aguda también fue desarrollada en pacientes con infarto agudo de miocardio y describe 4 grupos de acuerdo con el estado clínico y hemodinámico24 (fig. 1). Los pacientes se clasifican clínicamente basándose en la hipoperfusión periférica (pulso filiforme, sudación fría, cianosis periférica, hipotensión, taquicardia, confusión, oliguria) y la congestión pulmonar (estertores, radiografía de tórax anormal), y hemodinámicamente basándose en un índice cardíaco deprimido (≤ 2,2 l/min/m2) y una elevación de la presión capilar pulmonar (> 18 mmHg). El artículo original definió la estrategia terapéutica de acuerdo con el estado clínico y hemodinámico. La mortalidad fue del 2,2% en el grupo I, del 10,1% en el grupo II, del 22,4% en el grupo III y del 55,5% en el grupo IV.
Fig. 1. Clasificación clínica del tipo de insuficiencia cardíaca (clasificación de Forrester). H I-IV se refiere a la gravedad hemodinámica, con valores de referencia para el índice cardíaco (IC) y las presiones capilares pulmonares (PCP), que se muestran en los ejes vertical y horizontal respectivamente. C I-IV se refiere a la gravedad clínica.
Clasificación según la «gravedad clínica». La clasificación según la gravedad clínica se basa en la observación de la circulación periférica (perfusión) y en la auscultación de los pulmones (congestión). Los pacientes pueden ser clasificados como clase I (grupo A) (caliente y seco), clase II (grupo B) (caliente y húmedo), clase III (grupo L) (frío y seco) y clase IV (grupo C) (frío y húmedo). Esta clasificación ha sido validada desde el punto de vista pronóstico en un servicio de miocardiopatías20 y, por lo tanto, es aplicable en pacientes con insuficiencia cardíaca crónica, tanto si están hospitalizados como si no lo están.
3.2. El síndrome clínico de la insuficiencia cardíaca aguda
La insuficiencia cardíaca aguda es un síndrome clínico que cursa con un gasto cardíaco reducido, hipoperfusión tisular, aumento de la presión capilar pulmonar y congestión periférica. El mecanismo subyacente puede ser cardíaco o extracardíaco, y puede ser transitorio y reversible con resolución del síndrome agudo, o puede inducir un daño permanente que conduzca a insuficiencia cardíaca crónica. La disfunción cardíaca puede estar relacionada con una disfunción miocárdica sistólica o diastólica (fundamentalmente inducida por isquemia o infección), una disfunción valvular aguda, un taponamiento pericárdico, anomalías en el ritmo cardíaco, o un desajuste de la precarga y/o la poscarga. Hay múltiples enfermedades extracardíacas que pueden producir insuficiencia cardíaca aguda al modificar las condiciones de carga cardíaca como, por ejemplo, a) el aumento de la poscarga debido a una hipertensión sistémica o pulmonar o a una embolia pulmonar masiva; b) el aumento de la precarga debido a un incremento de la ingesta de líquidos o a una reducción de la excreción por insuficiencia renal o endocrinopatía, o c) un estado de gasto elevado por infección, tirotoxicosis, anemia o enfermedad grave de otros Paget. La insuficiencia cardíaca puede estar complicada por la coexistencia de una enfermedad grave de otros órganos. La insuficiencia cardíaca grave también puede inducir un fallo multiorgánico, que puede ser letal.
Un tratamiento médico adecuado a largo plazo y, si es posible, la corrección anatómica de la enfermedad subyacente, pueden prevenir nuevos «ataques» de insuficiencia cardíaca y mejorar el mal pronóstico a largo plazo que se asocia con este síndrome.
El síndrome clínico de insuficiencia cardíaca aguda puede clasificarse como insuficiencia anterógrada predominantemente izquierda o derecha, insuficiencia retrógrada izquierda o derecha, o una combinación de ambas.
Insuficiencia cardíaca anterógrada (izquierda y derecha). La insuficiencia cardíaca aguda anterógrada puede presentarse de forma entre leve y moderada y cursar solamente con fatigabilidad de esfuerzo, o grave, con manifestaciones de hipoperfusión tisular en reposo y debilidad, confusión, somnolencia, palidez con cianosis periférica, sudación fría, hipotensión, pulso filiforme y oliguria, que culminan en el cuadro completo del shock cardiogénico.
Este síndrome puede estar inducido por una gran variedad de enfermedades. Una historia adecuada puede facilitar el diagnóstico principal, por ejemplo: a) síndrome coronario agudo con factores de riesgo relevantes, antecedentes y síntomas sugestivos; b) miocarditis aguda con historia reciente sugestiva de infección vírica aguda; c) disfunción valvular aguda con historia de enfermedad valvular crónica o cirugía valvular, infección con posibilidad de endocarditis bacteriana, o traumatismo de tórax; d) embolismo pulmonar con historia relevante o síntomas sugestivos, o e) taponamiento pericárdico.
El examen físico del sistema cardiovascular puede conducir al diagnóstico principal, por ejemplo, por la presencia de distensión de las venas del cuello y pulso paradójico (taponamiento pericárdico), ruidos cardíacos apagados relacionados con una disfunción sistólica miocárdica, o la desaparición de los ruidos valvulares artificiales o de un soplo adecuado que indican un problema valvular.
En la insuficiencia cardíaca aguda anterógrada, el manejo inmediato debe incluir tratamiento de soporte para mejorar el gasto cardíaco y la oxigenación tisular. Estos objetivos se alcanzan con agentes vasodilatadores, administración de fluidos para alcanzar una precarga óptima, soporte inotrópico a corto plazo y (a veces) contrapulsación con balón intraaórtico.
Insuficiencia cardíaca izquierda retrógrada. La insuficiencia cardíaca retrógrada izquierda puede estar relacionada con una disfunción ventricular izquierda de grado variable, desde leve asrdica o infarto, la disfunción valvular aórtica o mitral, los trastornos del ritmo cardíaco o los tumores del corazón izquierdo. Las enfermedades extracardíacas pueden incluir la hipertensión severa, estados de alto gasto (anemia, tirotoxicosis) y estados neurogénicos (tumores cerebrales o traumatismos).
El examen físico del sistema cardiovascular, incluido el latido del ápex, la calidad de los tonos cardíacos, la presencia de soplos y la auscultación de los pulmones para valorar la presencia de estertores finos o de sibilancias espiratorias («asma cardíaca»), puede indicar cuál es el diagnóstico principal.
Los pacientes con insuficiencia cardíaca izquierda retrógrada deben ser tratados principalmente con vasodilatadores y, en algunos casos, puede requerirse el uso de diuréticos, broncodilatadores y narcóticos. Puede ser necesario el soporte respiratorio. Este soporte puede realizarse con presión de aire positiva continua o ventilación no invasiva con presión positiva o, en algunas circunstancias, con ventilación invasiva después de una intubación endotraqueal.
Insuficiencia cardíaca derecha retrógrada. El síndrome de insuficiencia cardíaca derecha aguda está relacionado con la disfunción pulmonar y cardíaca derechas, lo que incluye la presencia de exacerbaciones de una enfermedad pulmonar crónica con hipertensión pulmonar, o una enfermedad pulmonar masiva aguda (p. ej., neumonía extensa o embolismo pulmonar), un infarto ventricular derecho agudo, un funcionamiento deficiente de la válvula tricúspide (de origen traumático o infeccioso), y una enfermedad pericárdica aguda y subaguda. También se debe tener en cuenta la posibilidad de que haya una enfermedad cardíaca izquierda avanzada que haya progresado hacia insuficiencia derecha y, de manera similar, se debe considerar la posibilidad de una cardiopatía congénita de larga evolución que haya evolucionado hacia insuficiencia ventricular derecha. Las enfermedades no cardiopulmonares incluyen el síndrome nefrítico/nefrótico y las enfermedades hepáticas terminales. También deben considerarse algunos tumores secretores de péptidos vasoactivos.
Este síndrome se presenta típicamente con cansancio, edemas maleolares con fóvea, dolorimiento en la parte superior del abdomen (debido a la con gestión hepática), dificultad respiratoria (con derrame pleural) y distensión abdominal (con ascitis). El cuadro completo incluye anasarca con disfunción hepática y oliguria.
La historia y el examen físico deben confirmar la presencia del síndrome de insuficiencia cardíaca derecha aguda, indicar cuál es el diagnóstico de sospecha y guiar las exploraciones posteriores, que probablemente incluyan electrocardiograma (ECG), gasometría, medida de dímero-D, radiografía de tórax, ecocardiografía Doppler, angiografía o tomografía computarizada de tórax.
La sobrecarga de líquidos de la insuficiencia cardíaca derecha retrógrada se maneja con diuréticos, incluida la espironolactona y, a veces, con un tratamiento corto con dosis bajas («dosis diurética») de dopamina. El tratamiento concomitante puede incluir antibióticos para la infección pulmonar y la endocarditis bacteriana, bloqueadores de los canales de calcio, óxido nítrico o prostaglandinas para la hipertensión pulmonar primaria, y anticoagulantes, trombolíticos o trombectomía para el embolismo pulmonar agudo.
4. Fisiopatología de la insuficiencia cardíaca aguda
4.1. El círculo vicioso en la insuficiencia cardíaca aguda
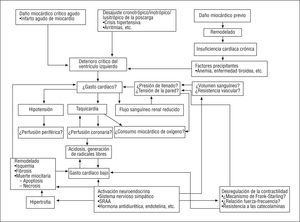
El denominador común final del síndrome de insuficiencia cardíaca aguda es una incapacidad crítica del miocardio para mantener un gasto cardíaco suficiente para satisfacer las demandas de la circulación periférica. Con independencia de la causa subyacente, en la insuficiencia cardíaca aguda se activa un círculo vicioso que, si no se trata adecuadamente, conduce al desarrollo de insuficiencia cardíaca crónica y a la muerte. Este círculo se muestra en la figura 2 y se describe en detalle en otra publicación2.
Fig. 2. Fisiopatología del síndrome de insuficiencia cardíaca aguda. Después de algunos episodios críticos agudos, el deterioro del ventrículo izquierdo ocurre de forma rápida y requiere un tratamiento médico urgente. En el esquema se muestra un resumen de la fisiopatología del síndrome de insuficiencia cardíaca aguda. Los cambios mecánicos, hemodinámicos y neurohormonales son parecidos pero no idénticos a los que se observan en la insuficiencia cardíaca crónica. El curso temporal en el que se desarrollan o revierten estos cambios varía considerablemente y depende en gran medida de la causa subyacente del deterioro del ventrículo izquierdo, así como de la enfermedad cardiovascular preexistente. No obstante, los cambios se desarrollan con rapidez y, por tanto, la insuficiencia cardíaca aguda es considerablemente diferente del síndrome de insuficiencia cardíaca crónica. SRAA: sistema renina-angiotensina-aldosterona.
Para que los pacientes con insuficiencia cardíaca aguda puedan responder al tratamiento, la disfunción miocárdica debe ser reversible. Esto es particularmente importante en la insuficiencia cardíaca aguda debida a isquemia, aturdimiento o hibernación, donde un miocardio disfuncionante puede volver a ser normal si se trata de manera adecuada.
4.2. Aturdimiento miocárdico
El aturdimiento miocárdico es la disfunción miocárdica que tiene lugar después de una isquemia prolongada y puede persistir durante un corto plazo de tiempo incluso cuando se restaura el flujo sanguíneo normal 25,26. La intensidad y dur ación del aturdimiento dependen de la gravedad y duración del daño isquémico previo 26.
4.3. Hibernación
La hibernación se define como un empeoramiento de la función miocárdica debido a una reducción importante del flujo sanguíneo coronario a pesar de que las células miocárdicas se mantienen intactas. El miocardio hibernado puede restaurar su función normal cuando se mejoran el flujo sanguíneo y la oxigenación27.
La hibernación puede coexistir con el aturdimiento. La hibernación mejora con el tiempo cuando se restauran el flujo sanguíneo y la oxigenación, mientras que el miocardio aturdido conserva una reserva inotrópica y puede responder a la estimulación inotrópica26,28. Debido a que estos mecanismos dependen de la duración del daño miocárdico, el restablecimiento rápido de la oxigenación y del flujo sanguíneo es obligatorio para revertir estas alteraciones fisiopatológicas.
5. Diagnóstico de la insuficiencia cardíaca aguda
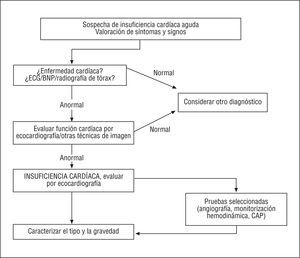
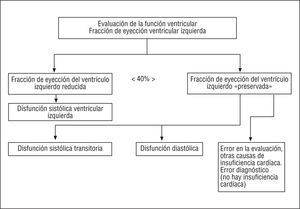
El diagnóstico de la insuficiencia cardíaca aguda se basa en los síntomas y los hallazgos clínicos, y se apoya en técnicas complementarias como el ECG, la radiografía de tórax, los biomarcadores y la ecocardiografía Doppler (fig. 3). El paciente debe ser clasificado, de acuerdo con los criterios descritos previamente, como con disfunción sistólica y/o diastólica (fig. 4) y según las características de insuficiencia cardíaca izquierda o derecha anterógrada o retrógrada (*).
Fig. 3. Diagnóstico de la insuficiencia cardíaca aguda. CAP: catéter arterial pulmonar; ECG: electrocardiograma; BNP: péptido natriurético plasmático de tipo B.
Fig. 4. Evaluación de la función del ventrículo izquierdo en la insuficiencia cardíaca aguda.
(*) Estas guías serán de gran ayuda para uniformizar criterios de diagnóstico y tratamiento de la insuficiencia cardíaca aguda ya que, tal como se ha observado en un estudio transversal (INCARGAL)1, realizado en 12 hospitales de Galicia, hay ciertas diferencias en cuanto a los protocolos de manejo intrahospitalario de los pacientes que ingresan por insuficiencia cardíaca según el servicio de ingreso (cardiología frente a medicina-interna, geriatría).
1. García Castelo A, Muñiz García J, Sesma Sánchez P, Castro Beiras A. Utilización de recursos diagnósticos y terapéuticos en pacientes ingresados por insuficiencia cardíaca: influencia del servicio de ingreso (estudio INCARGAL). Rev Esp Cardiol. 2003;56:49-56.
5.1. Evaluación clínica
Es importante la evaluación clínica sistemática de la circulación periférica, el llenado venoso y la temperatura periférica.
El llenado ventricular derecho en una insuficiencia cardíaca descompensada puede ser evaluado normalmente a partir de la presión venosa yugular central. Cuando las venas yugulares internas no son adecuadas para la evaluación (p. ej., debido a válvulas venosas), se pueden usar las venas yugulares externas. Es necesario tener precaución en la interpretación de la medida de presión venosa central elevada en la insuficiencia cardíaca aguda, ya que puede ser un reflejo de la reducción de la capacitancia venosa junto con una disminución de la capacitancia del ventrículo derecho, incluso en presencia de un bajo llenado ventricular derecho.
La presión de llenado del lado izquierdo se evalúa por auscultación de tórax, y la presencia de estertores húmedos en los campos pulmonares suele ser indicativa de aumento de presión. La confirmación, la clasificación de la gravedad y el seguimiento clínico de la congestión pulmonar y de los derrames pleurales deben realizarse utilizando radiografía de tórax.
Recomendación de clase I, nivel de evidencia C
Una vez más, en las situaciones agudas, la evaluación clínica de la presión de llenado del lado izquierdo puede inducir a error debido a la rápida evolución del cuadro clínico. Se deben realizar la palpación cardíaca y la auscultación para la determinación de ritmos de galope ventricular y auricular (S3, S4). La calidad de los ruidos cardíacos, así como la presencia de galopes auriculares y ventriculares y soplos valvulares son importantes para el diagnóstico y la evaluación clínica. Suele ser importante la evaluación de la extensión de la arteriosclerosis a partir de la detección de falta de pulsos y de la presencia de soplos carotídeos y abdominales, especialmente en individuos de edad avanzada.
5.2. Electrocardiograma
Un ECG normal no es común en la insuficiencia cardíaca aguda. El ECG es capaz de identificar el ritmo, y puede ayudar a determinar la etiología de la insuficiencia cardíaca aguda y evaluar las condiciones de carga del corazón. Es esencial en la evaluación de los síndromes coronarios agudos29-31. El ECG también puede indicar una dilatación aguda del ventrículo derecho, del ventrículo izquierdo o de la aurícula izquierda, una perimiocarditis y condiciones preexistentes, como hipertrofia ventricular izquierda, derecha o miocardiopatía dilatada. Las arritmias cardíacas deben ser evaluadas a partir de un ECG de 12 derivaciones y también de la monitorización electrocardiográfica continua.
5.3. Radiografía de tórax y técnicas de imagen
La radiografía de tórax y otras técnicas de imagen deben ser realizadas de forma precoz en todos los pacientes con insuficiencia cardíaca aguda para valorar la presencia de enfermedades preexistentes cardíacas o torácicas (tamaño y forma de las cámaras cardíacas) y para evaluar la congestión pulmonar. Se usa tanto para la confirmación del diagnóstico como para el seguimiento de la mejoría o de la respuesta insatisfactoria al tratamiento. La radiografía de tórax permite el diagnóstico diferencial de la insuficiencia cardíaca izquierda de las enfermedades pulmonares inflamatorias o infecciosas. Se pueden utilizar la tomografía computarizada (TC) de tórax con o sin angiografía de contraste y la gammagrafía para clarificar la enfermedad pulmonar y diagnosticar un embolismo pulmonar mayor. En caso de sospecha de disección aórtica se debe utilizar una TC o una ecocardiografía transesofágica.
5.4. Pruebas de laboratorio
Se deben realizar varias pruebas de laboratorio en los pacientes con insuficiencia cardíaca aguda (tabla 3). El análisis de la gasometría arterial (Astrup) permite evaluar la oxigenación (pO2), la adecuación respiratoria (pCO2), el equilibrio ácido-base (pH) y el déficit de bases, y debe realizarse en todos los pacientes con insuficiencia cardíaca grave. A menudo, la determinación no invasiva con un oxímetro de pulso puede reemplazar el Astrup (nivel de evidencia C), pero no en los casos de shock por vasoconstricción con un gasto cardíaco muy bajo. La determinación de la saturación venosa de O2 (en la vena yugular) puede ser útil para calcular el equilibrio total de aporte y demanda de oxígeno en el organismo.
El péptido natriurético plasmático de tipo B (BNP) es liberado por los ventrículos cardíacos en respuesta a un aumento del estiramiento de la pared y de la carga de volumen, y se ha utilizado para excluir y/o identificar la insuficiencia cardíaca congestiva en pacientes ingresados en urgencias por disnea1,32. Se han propuesto puntos de corte de 300 pg/ml para el NT-proBNP y de 100 pg/ml para el BNP, aunque apenas se ha estudiado la respuesta en la población de edad avanzada. En el edema de pulmón abrupto, la concentración de BNP puede permanecer normal en el momento del ingreso. Por otra parte, el BNP tiene un buen valor predictivo negativo para excluir la insuficiencia cardíaca33. Hay varias situaciones clínicas que pueden afectar a la concentración de BNP, incluidas la insuficiencia renal y la septicemia. Si hay una elevación de su concentración, se deberán realizar pruebas diagnósticas adicionales. Si se confirma la presencia de insuficiencia cardíaca aguda, la elevación de la concentración de BNP y NT-pro BNP aporta una información pronóstica importante. Todavía no se ha establecido plenamente el papel exacto que desempeña el BNP34.
5.5. Ecocardiografía
La ecocardiografía es un instrumento fundamental para la evaluación de los cambios funcionales y estructurales que subyacen en la insuficiencia cardíaca aguda o se asocian con ella, así como para la valoración de los síndromes coronarios agudos.
Recomendación de clase I, nivel de evidencia C
La ecocardiografía-Doppler debe utilizarse para evaluar y controlar la función ventricular derecha e izquierda de forma regional y global, la estructura y la función valvulares, la posible presencia de enfermedad pericárdica, las complicaciones mecánicas del infarto agudo de miocardio y, en raras ocasiones, las lesiones ocupantes de espacio. El gasto cardíaco puede calcularse a partir del análisis de la curva de velocidad de eyección aórtica o pulmonar mediante ultrasonidos Doppler. Un estudio Doppler adecuado también permite calcular las presiones arteriales pulmonares (a partir del chorro de insuficiencia tricuspídea) y también se ha utilizado para el control la precarga ventricular izquierda35-37. La ecocardiografía no ha sido validada con cateterismo cardíaco derecho en pacientes con insuficiencia cardíaca aguda38.
5.6. Otras investigaciones
En los casos de complicaciones relacionadas con las arterias coronarias, como la angina inestable o el infarto de miocard io, la angiografía es importante y el tratamiento de revascularización basado en la angiografía puede mejorar el pronóstico29,30.
Recomendación de clase I, nivel de evidencia B
La arteriografía coronaria con frecuencia también está indicada en la insuficiencia cardíaca aguda prolongada, no explicada por otras pruebas, tal como se recomienda en las Guías de Práctica Clínica para el diagnóstico de la insuficiencia cardíaca crónica1.
La inserción de un catéter en la arteria pulmonar puede ayudar en el diagnóstico de la insuficiencia cardíaca aguda. En la sección Catéter arterial pulmonar se expone este tema de manera más detallada.
6. Objetivos del tratamiento en la insuficiencia cardíaca aguda
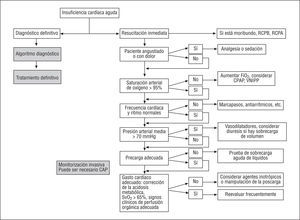
Los objetivos inmediatos son mejorar los síntomas y estabilizar las condiciones hemodinámicas (tabla 4, fig. 5)40-51. No obstante, la mejoría exclusiva de los parámetros hemodinámicos puede conducir a engaño, y normalmente es necesario conseguir una mejoría concomitante de los síntomas (disnea y/o fatiga)52. Estos objetivos a corto plazo deben acompañarse también de efectos favorables en el resultado a más largo plazo. Esto se puede conseguir evitando o limitando el daño miocárdico.
Fig. 5. Objetivos inmediatos en el tratamiento de los pacientes con insuficiencia cardíaca aguda. En los pacientes con enfermedad coronaria, la presión arterial media debe ser más alta para asegurar la perfusión coronaria. Presión arterial media > 70 mmHg o presión arterial sistólica > 90 mmHg. CAP: catéter arterial pulmonar; CPAP: presión positiva continua en la vía respiratoria; VNIPP: ventilación no invasiva con presión positiva; SvO2: saturación venosa de oxígeno; RCPB: reanimación cardiopulmonar básica; RCPA: reanimación cardiopulmonar avanzada.
Otro objetivo del tratamiento es la reducción de los signos clínicos de insuficiencia cardíaca. Una reducción del peso corporal y/o un aumento de la diuresis son efectos beneficiosos en el tratamiento de pacientes congestivos u oligúricos con insuficiencia cardíaca aguda44,53. De manera similar, también son objetivos importantes del tratamiento conseguir mejorar la saturación de oxígeno, la función renal y/o hepática y/o los electrolitos séricos. La concentración plasmática de BNP puede reflejar una mejoría hemodinámica cuando sus niveles disminuyen.
Otros objetivos beneficiosos del tratamiento incluyen reducciones en la duración de la terapia vasoactiva intravenosa, la duración del tiempo de permanencia hospitalaria y la tasa de reingresos, con un aumento del tiempo entre reingresos52,54,55. La reducción de la estancia hospitalaria y de la mortalidad a largo plazo es también uno de los principales objetivos del tratamiento.
Por último, conviene recordar que es necesario que haya un perfil favorable de seguridad y tolerabilidad para cualquier tratamiento que se use en pacientes con insuficiencia cardíaca aguda. Cualquier agente que se utilice en esta enfermedad tiene que estar asociado con una tasa baja de abandono del tratamiento y con una incidencia relativamente baja de efectos secundarios adversos.
6.1. Organización del tratamiento de la insuficiencia cardíaca aguda
Los mejores resultados se logran cuando los pacientes con insuficiencia cardíaca aguda son tratados de forma precoz por personal experto en áreas reservadas para pacientes con insuficiencia cardíaca. Los pacientes con insuficiencia cardíaca aguda deben ser tratados por cardiólogos con experiencia y/u otro personal entrenado. Los servicios diagnósticos deben garantizar un acceso rápido a los procedimientos diagnósticos, como la ecocardiografía y la angiografía coronaria, según sean las necesidades.
El tratamiento de los pacientes con insuficiencia cardíaca aguda requiere un plan terapéutico en el sistema hospitalario50.
Recomendación de clase I, nivel de evidencia B
En estudios comparativos se han obtenido tiempos de hospitalización más cortos en pacientes tratados por personal entrenado en el manejo de la insuficiencia cardíaca17. El tratamiento de la insuficiencia cardíaca aguda debe ser seguido por un programa clínico subsiguiente de insuficiencia cardíaca cuando sea necesario, tal como se recomienda en las guías de práctica clínica de la ESC1.
Los requerimientos de cuidado e información del paciente agudo y de su familia serán llevados a cabo normalmente por enfermeras expertas.
El personal de enfermería de insuficiencia cardíaca y los especialistas en cardiología/insuficiencia cardíaca/medicina intensiva deben tener la oportunidad de seguir un programa de educación profesional continua.
En este momento se encuentran en fase de preparación las recomendac iones sobre la estructura estándar, el personal de enfermería y las necesidades de equipamiento de las unidades de cuidados intensivos de cardiología, y de unidades de cuidados intermedios relevantes, según la opinión experta del Grupo de Trabajo de Cuidados Cardíacos Intensivos.
7. Instrumentación y control de los pacientes con insuficiencia cardíaca aguda
El control del paciente con insuficiencia cardíaca aguda debe iniciarse lo antes posible una vez que ha llegado al servicio de urgencias, a la vez que se llevan a cabo medidas diagnósticas encaminadas a determinar la etiología primaria. El tipo y grado de control requeridos por cada paciente individual varía ampliamente según la gravedad de la descompensación cardíaca y la respuesta a la terapia inicial. Los aspectos logísticos locales también pueden ser relevantes. Las guías de control que se discuten aquí están basadas en la opinión de expertos.
7.1. Control no invasivo
En todos los pacientes críticamente enfermos se debe realizar de forma sistemática una determinación de la presión arterial; también es obligatorio determinar la temperatura, el ritmo respiratorio y la frecuencia cardíaca, y realizar un electrocardiograma. Algunas pruebas de laboratorio se deben realizar de forma repetida, como la determinación de electrolitos, creatinina y glucosa, o los marcadores de infección o de otros trastornos metabólicos. Se deben controlar la hipocaliemia o hipercalemia. Todos estos parámetros pueden ser controlados fácilmente y de forma cuidadosa con los equipos automáticos modernos. Si el paciente empeora, la frecuencia de estas observaciones debe aumentarse.
La monitorización electrocardiográfica (arritmias y segmento ST) es necesaria durante la fase de descompensación aguda, especialmente cuando la causa del episodio agudo es isquémica o arrítmica.
Recomendación de clase I, nivel de evidencia C
El mantenimiento de la presión arterial normal es crítico durante el inicio del tratamiento y, por consiguiente, debe ser medida regularmente (p. ej., cada 5 min) hasta que la dosis de vasodilatadores, diuréticos o inotropos se ha estabilizado. La fiabilidad de las mediciones pletismográficas automáticas no invasivas de la presión arterial es adecuada en ausencia de vasoconstricción intensa y de una frecuencia cardíaca muy elevada.
Recomendación de clase I, nivel de evidencia C
El oxímetro de pulso es un dispositivo simple no invasivo que calcula la saturación arterial de hemoglobina con oxígeno (SaO2). El cálculo de la SaO2 está normalmente dentro del 2% del valor medido por un cooxímetro, a menos que los pacientes se encuentren en shock cardiogénico. El oxímetro de pulso debe ser utilizado continuamente en cualquier paciente inestable que esté siendo tratado con una fracción de oxígeno inspirado (FiO2) mayor que la del aire. También tiene que ser utilizado en intervalos regulares (cada hora) en cualquier paciente que reciba terapia de oxígeno por una descompensación aguda.
Recomendación de clase I, nivel de evidencia C
El gasto cardíaco y la precarga pueden ser medidos de forma no invasiva con técnicas Doppler (véase el apartado Ecocardiografía). Se dispone de muy poca o ninguna evidencia para ayudar a escoger las técnicas más adecuadas para la monitorización, y no se han descrito diferencias, siempre y cuando se conozcan las limitaciones de los dispositivos de monitorización individual y los resultados se utilicen adecuadamente.
7.2. Control invasivo
Vía arterial. Las indicaciones para la inserción de un catéter intraarterial pueden ser, por una parte, la conveniencia de analizar de una manera continua, latido a latido, la presióión de un catéter arterial radial de 5 cm de calibre 20 es baja.
Recomendación de clase IIb, nivel de evidencia C
Vías de presión venosa central. Las vías venosas centrales permiten el acceso a la circulación venosa central y, por tanto, son útiles para la administración de fluidos o fármacos, y también para controlar la presión venosa central y la saturación venosa de oxígeno (SvO2) en la vena cava superior de la aurícula derecha, que proporciona una aproximación del transporte de oxígeno.
Recomendación de clase IIb, nivel de evidencia C
Es importante ser cauteloso a la hora de interpretar las determinaciones de la presión auricular derecha, ya que raramente se correlacionan con las presiones auriculares izquierdas (y por tanto con las presiones de llenado del ventrículo izquierdo) en pacientes con insuficiencia cardíaca aguda. Las medidas de la presión venosa central también se encuentran afectadas por la presencia de insuficiencia tricúspide significativa y de ventilación con presión positiva al final de la expiración (PEEP).
Recomendación de clase I, nivel de evidencia C
Catéter arterial pulmonar. El catéter arterial pulmonar es un catéter con balón de flotación que mide presiones en la vena cava superior, la aurícula derecha, el ventrículo derecho y la arteria pulmonar, y también el gasto cardíaco. Los catéteres modernos pueden medir el gasto cardíaco de manera semicontinua, así como la saturación de oxígeno de la mezcla venosa y el volumen telediastólico del ventrículo derecho y la fracción de eyección.
Aunque normalmente no es necesario insertar un catéter arterial pulmonar para el diagnóstico de insuficiencia cardíaca aguda, puede usarse para diferenciar un mecanismo cardiogénico de uno no cardiogénico en pacientes complejos con enfermedad pulmonar y cardíaca concurrente. El catéter arterial pulmonar también se usa con frecuencia para calcular la presión capilar pulmonar, el gasto cardíaco y otras variables hemodinámicas y sirve, por tanto, para guiar la terapia cuando hay una enfermedad pulmonar difusa grave o un compromiso hemodinámico persistente que no ha sido resuelto con la terapia inicial57,58. La presión capilar pulmonar no refleja de forma exacta la presión telediastólica del ventrículo izquierdo en pacientes con estenosis mitral, insuficiencia aórtica, interdependencia ventricular, presión elevada en las vías respiratorias o ventrículo izquierdo rígido debido, por ejemplo, a hipertrofia ventricular, diabetes, fibrosis, inotropos, obesidad o isquemia. La presencia de insuficiencia tricúspide severa, a menudo presente en pacientes con insuficiencia cardíaca aguda, puede sobrevalorar o infravalorar el gasto cardíaco medido por termodilución.
En varios estudios retrospectivos en los que se ha evaluado el uso de catéter arterial pulmonar en el infarto agudo de miocardio se ha demostrado un aumento de la mortalidad asociado con el uso de este catéter. Estas observaciones se han explicado parcialmente por la presencia de diferencias debidas al tipo de pacientes en los distintos grupos del estudio59-61. Posteriormente se han descrito otros hallazgos observacionales similares en otros grupos de pacientes47,61,62. En un estudio prospectivo aleatorizado reciente en el que se incluye a un grupo mixto de pacientes críticamente enfermos no se han podido demostrar diferencias en los resultados, aunque la aleatorización para recibir un catéter arterial pulmonar se acompañó de una mejor evolución dentro de las primeras 24 h. No fue el catéter arterial pulmonar lo que perjudicó a los pacientes, sino más bien el uso que se hizo de la información derivada de éste (a veces inadecuado)48.
El uso del catéter arterial pulmonar está indicado en pacientes hemodinámicamente inestables que no responden de una manera predecible a los tratamientos clásicos, y en pacientes que tienen una combinación de congestión e hipoperfusión. En estos casos, se implanta para asegurar un llenado óptimo de los ventrículos y para guiar49 las terapias vasoactivas y los fármacos inotropos (tabla 5). Debido a que las complicaciones aumentan con la duración de su uso, es fundamental insertar el catéter cuando se necesitan datos específicos (normalmente relacionados con el estado de hidratación del paciente) y retirarlo en cuanto deja de ser útil (es decir, cuando se ha optimizado el tratamiento diurético y vasodilatador).
Recomendación de clase IIb, nivel de evidencia C
En el shock cardiogénico y en el síndrome de bajo gasto cardíaco prolongado y grave se recomienda medir la saturación de oxígeno de la mezcla venosa de la arteria pulmonar como una aproximación de la extracción de oxígeno (SpO2-SvO2). El objetivo debe ser mantener la SvO2 por encima del 65% en pacientes con insuficiencia ca rdíaca aguda.
PARTE II. TRATAMIENTO DE LA INSUFICIENCIA CARDÍACA AGUDA
8. Aspectos médicos generales en el tratamiento de la insuficiencia cardíaca aguda
Infecciones: los pacientes con insuficiencia cardíaca aguda avanzada son más susceptibles de presentar complicaciones infecciosas, principalmente infecciones respiratorias y del tracto urinario, septicemia o infecciones nosocomiales con bacterias grampositivas. Los únicos signos de infección (puede no haber fiebre) pueden ser un aumento de la proteína C reactiva y un empeoramiento de la situación general. En estos casos es imprescindible efectuar un control meticuloso de la infección y tomar medidas para mantener la integridad de la piel. Se recomienda realizar cultivos de manera sistemática. Cuando esté indicado se debe administrar una terapia antibiótica precoz.
Diabetes: La insuficiencia cardíaca aguda se asocia con un empeoramiento del control metabólico. A menudo se acompaña de hiperglucemia. Los fármacos hipoglucemiantes que se utilizan de manera sistemática deben ser retirados y se debe realizar un control de la glucemia con insulina de acción rápida titulada según las mediciones repetidas de glucosa sanguínea. La normoglucemia mejora la supervivencia de los pacientes diabéticos que se encuentran críticamente enfermos50.
Estado catabólico: El balance calórico y de nitrógeno negativo es un problema en la insuficiencia cardíaca aguda. Está relacionado con una ingesta calórica reducida debida a una reducción de la absorción intestinal. Se debe tener un gran cuidado en mantener el equilibrio calórico y nitrogenado. Tanto la concentración de albúmina sérica como el equilibrio de nitrógeno pueden ayudar a mantener el estado metabólico.
Insuficiencia renal: hay una estrecha interrelación entre la insuficiencia cardíaca aguda y la insuficiencia renal. Los dos síndromes pueden causar, agravar o influir en el resultado clínico del otro. Es imprescindible realizar un control estricto de la función renal. La preservación de la función renal es una consideración mayor a la hora de seleccionar la estrategia terapéutica más apropiada para estos pacientes.
9. Oxígeno y asistencia ventilatoria
9.1. Bases para el uso de oxígeno en la insuficiencia cardíaca aguda
Es muy importante el mantenimiento de una SaO2 dentro del rango normal (95-98%) para maximizar la liberación de oxígeno en los tejidos y la oxigenación tisular y ayudar, de esta forma, a prevenir la disfunción de los órganos distales y el fallo multiorgánico.
Recomendación de clase I, nivel de evidencia C
Este objetivo se alcanza asegurándose primero de que hay una vía de aire patente y administrando entonces una FiO2 aumentada. La intubación endotraqueal está indicada cuando estas medidas no mejoran la oxigenación tisular.
Recomendación de clase IIa, nivel de evidencia C
A pesar de este enfoque intuitivo para administrar oxígeno, se dispone de poca o ninguna evidencia respecto a que el aumento de las dosis de oxígeno produzca un mejor resultado clínico. Hay estudios que han demostrado que la hiperoxia puede asociarse con una reducción del flujo sanguíneo coronario, una disminución del gasto cardíaco, un aumento de la presión arterial, un incremento de la resistencia vascular sistémica y una tendencia hacia una mortalidad más alta51.
La administración de concentraciones crecientes de oxígeno en pacientes hipoxémicos con insuficiencia cardíaca aguda debe estar garantizada de manera incuestionable.
Recomendación de clase IIa, nivel de evidencia C
El uso de concentraciones crecientes de oxígeno en pacientes en los que no hay evidencia de hipoxemia es más controvertido y puede causar daño63.
9.2. Soporte ventilatorio sin intubación endotraqueal (ventilación no invasiva)
Se utilizan dos técnicas para el soporte ventilatorio: la CPAP (presión positiva continua en la vía respiratoria) o la NIPPV (ventilación no invasiva con presión positiva). La NIPPV es un método que proporciona ventilación mecánica a los pacientes sin necesidad de realizar una intubación endotraqueal. Hay consenso general acerca de que una de estas dos técnicas debe ser utilizada antes de la intubación endotraqueal y la ventilación mecánica. La utilización de técnicas no invasivas reduce de forma drástica la necesidad de intubación endotraqueal y ventilación mecánica.
Bases para su utilización. La aplicación de CPAP puede causar reclutamiento pulmonar y se asocia con un aumento de la capacidad residual funcional. La mejoría de la capacitancia pulmonar, la reducción de las oscilaciones de presión transdiafragmática y la disminución de la actividad diafragmática pueden conducir a una reducción del trabajo global de la respiración y, en consecuencia, a una menor demanda metabólica del organismo. La ventilación no invasiva con presión positiva es una técnica más sofisticada que requiere un respirador. La adición de PEEP a la asistencia inspiratoria puede dar lugar a una forma de CPAP (también conocida como soporte de presión positiva de dos niveles o BiPAP). Los beneficios fisiológicos de esta forma de ventilación son los mismos que para la CPAP, pero incluyen también la asistencia inspiratoria que posteriormente reduce el trabajo de la respiración y la demanda metabólica global.
Evidencias para el uso de CPAP y NIPPV en la insuficiencia ventricular izquierda. En los pacientes con edema de pulmón cardiogénico, la CPAP mejora la oxigenación, disminuye los síntomas y signos de insuficiencia cardíaca aguda, y reduce la necesidad de intubación endotraqueal64-68. Los estudios realizados en este campo han sido relativamente reducidos y, por tanto, no se ha obtenido una reducción estadísticamente significativa de la mortalidad. En un estudio de revisión sistemático69 en el que se han incluido los 3 estudios clínicos se ha sugerido que la CPAP se asocia con una reducción de la necesidad de intubación y con una tendencia hacia una disminución de la mortalidad hospitalaria si se compara con la terapia estándar sola. Sin embargo, no hubo evidencia de que la CPAP pudiera causar un daño potencial.
Se han realizado 3 estudios controlados y aleatorizados sobre el uso de la NIPPV en el contexto del edema de pulmón cardiogénico agudo70-72. La NIPPV parece reducir la necesidad de intubación endotraqueal, pero esto no se traduce en una reducción de la mortalidad o en una mejora de la función a largo plazo.
Conclusiones. El uso de CPAP y NIPPV en el edema de pulmón cardiogénico agudo se asocia con una disminución significativa de la necesidad de intubación traqueal y ventilación mecánica.
Recomendación de clase IIa, nivel de evidencia A
No hay suficientes datos para demostrar una reducción significativa de la mortalidad; sin embargo, los datos no parecen mostrar una tendencia en esa dirección.
9.3. Ventilación mecánica con intubación endotraqueal en la insuficiencia cardíaca aguda
La ventilación mecánica invasiva (con intubación endotraqueal) no debe utilizarse para revertir la hipoxemia, que puede ser mejorada con oxigenoterapia, CPAP o NIPPV, sino más bien para revertir la fatiga muscular respiratoria inducida por la insuficiencia cardíaca aguda. Esta última es la causa más frecuente de la intubación endotraqueal y la ventilación mecánica. La fatiga muscular respiratoria se puede diagnosticar por una disminución en la frecuencia respiratoria asociada con hipercapnia y confusión mental.
La ventilación mecánica invasiva debe usarse únicamente si la insuficiencia respiratoria aguda no responde a los vasodilatadores, la terapia c on oxígeno y/o la CPAP o la NIPPV. Otra consideración que debe tenerse en cuenta es la necesidad de intervención inmediata en pacientes con edema de pulmón secundario a síndrome coronario agudo con elevación del segmento ST.
10. Tratamiento médico
10.1. Morfina y análogos en la insuficiencia cardíaca aguda
La morfina está indicada en la fase inicial del tratamiento de un paciente que ha sido ingresado por insuficiencia cardíaca aguda grave, especialmente si se asocia con agitación y disnea.
Recomendación de clase IIb, nivel de evidencia B
La morfina induce venodilatación y una ligera dilatación arterial, y reduce la frecuencia cardíaca73. En la mayoría de estudios se han administrado bolos intravenosos de 3 mg de morfina una vez insertada la vía intravenosa. Esta dosis se puede repetir si es necesario.
10.2. Anticoagulación
La anticoagulación está bien establecida en los síndromes coronarios agudos con o sin insuficiencia cardíaca29. Lo mismo ocurre con la fibrilación auricular31. Pero hay menos evidencias para iniciar un tratamiento con heparina no fraccionada o con heparina de bajo peso molecular en la insuficiencia cardíaca aguda. En un amplio estudio clínico controlado con placebo en el que se administraron 40 mg de enoxaparina subcutánea en pacientes agudos hospitalizados, incluido un gran grupo de pacientes con insuficiencia cardíaca, no se produjo una mejoría clínica, aunque hubo una menor incidencia de trombosis venosa74. No hay amplios estudios comparativos en los que se analice la diferencia entre la utilización de heparina de bajo peso molecular y la heparina no fraccionada (administrada en dosis de 5.000 U/2-3 veces al día). Es imprescindible controlar de manera cuidadosa el estado de la coagulación en la insuficiencia cardíaca aguda, ya que a menudo hay un trastorno hepático concomitante. La heparina de bajo peso molecular está contraindicada si el aclaramiento de creatinina está por debajo de 30 ml/min, o debe utilizarse con extrema precaución y control de la concentración de los índices de actividad anti-Factor Xa.
10.3. Vasodilatadores en el tratamiento de la insuficiencia cardíaca aguda
Los vasodilatadores están indicados en la mayoría de pacientes con insuficiencia cardíaca aguda como terapia de primera línea si la hipoperfusión está asociada con una presión sanguínea adecuada y con signos de congestión con baja diuresis, para abrir la circulación periférica y reducir la precarga (tabla 6).
Nitratos. Los nitratos alivian la congestión pulmonar sin comprometer el volumen de eyección y sin aumentar la demanda miocárdica de oxígeno en la insuficiencia cardíaca aguda izquierda, especialmente en pacientes con síndrome coronario agudo. Las dosis bajas sólo inducen venodilatación, pero a medida que se aumenta gradualmente la dosis producen una dilatación de las arterias, incluidas las arterias coronarias. Con una dosis apropiada, los nitratos ejercen una vasodilatación equilibrada del lecho venoso y arterial de la circulación y, por tanto, reducen la precarga y la poscarga del ventrículo izquierdo sin empeorar la perfusión tisular. Su efecto sobre el gasto cardíaco depende de la precarga y la poscarga que había antes de iniciar el tratamiento y de la capacidad del corazón para responder a los aumentos inducidos por los barorreceptores del tono simpático.
Inicialmente, los nitratos deben administrarse por vía oral, aunque los nitratos intravenosos también son bien tolerados por los pacientes con infarto agudo de miocardio. En 2 estudios aleatorizados de insuficiencia cardíaca aguda se ha establecido la eficacia de los nitratos intravenosos combinados con furosemida y se ha demostrado que la titulación de la mayor dosis hemodinámicamente tolerable de nitratos con bajas dosis de furosemida es superior que las dosis altas del diurético solo.
Recomendación de clase I, nivel de evidencia B
En uno de estos estudios aleatorizados se probó la combinación de furosemida y dinitrato de isosorbida en forma de bolo inyectable y se observó que la dosis alta de nitrato intravenoso era más efectiva que el tratamiento con furosemida para el control del edema grave de pulmón75.
En la práctica, los nitratos tienen una curva de efecto con forma de «U». Si se administran en dosis subóptimas, los vasodilatadores pueden tener un efecto limitado sobre la prevención de recurrencias de insuficiencia cardíaca aguda. Sin embargo, la administración de dosis altas también puede reducir su eficacia. Una desventaja de los nitratos es el rápido desarrollo de tolerancia, especialmente si se administran por vía intravenosa en dosis altas, lo que limita su eficacia a sólo 16-24 h. Los nitratos deben administrarse en dosis que produzcan una vasodilatación óptima, lo que conduce a un aumento del índice cardíaco y a una disminución de la presión pulmonar de enclavamiento. Por el contrario, una vasodilatación inadecuada puede inducir una brusca y profunda reducción de la presión arterial que puede dar lugar a una inestabilidad hemodinámica.
La nitroglicerina puede administrarse oralmente o por inhalación (aerosol de trinitrato de glicerina 400 μg [2 inhalaciones] cada 5-10 min), o por vía sublingual (dinitrato de isosorbida 1 o 3 mg), mientras se está controlando la presión arterial. La administración intravenosa y la dosis de nitratos (glicerilnitrato 20 μg/min aumentando la dosis hasta 200 μg/min, o dinitrato de isosorbida 1-10 mg/h) debe llevarse a cabo con extrema precaución, con un cuidadoso control de la presión arterial, y titular la dosis administrada en función de la disminución de la presión arterial. Hay que ser particularmente cautelosos a la hora de administrar nitratos a un paciente con estenosis aórtica, aunque la terapia pueda ser de ayuda en estas situaciones complejas. La dosis de nitratos debe reducirse si la presión arterial sistólica desciende por debajo de 90-100 mmHg y debe interrumpirse definitivamente si se reduce aún más. Desde un punto de vista práctico se debe alcanzar una reducción de 10 mmHg en la presión arterial media.
Nitroprusiato sódico. El nitroprusiato sódico (0,3 μg/kg/min con un aumento cuidadoso de la dosis hasta 1 μg/kg/min y a 5 μg/kg/min) se recomienda en pacientes con insuficiencia cardíaca grave y en los que presentan un aumento predominante de la poscarga, como la que se produce en la insuficiencia cardíaca hipertensiva o en la insuficiencia mitral.
Recomendación de clase I, nivel de evidencia C
El nitroprusiato sódico debe ser titulado con precaución y normalmente requiere un control arterial invasivo y una estrecha supervisión. La administración prolongada puede asociarse con toxicidad debido a sus metabolitos, el tiocianato y el cianato, y debe evitarse sobre todo en pacientes con insuficiencia renal o hepática grave. No hay estudios clínicos en los que se analice el efecto del nitroprusiato sódico en pacientes con insuficiencia cardíaca aguda y su administración en el infarto agudo de miocardio ha proporcionado resultados equívocos76. El nitroprusiato sódico debe reducirse de manera paulatina para evitar un efecto rebote. En la insuficiencia cardíaca aguda causada por un síndrome coronario agudo, los nitratos están más recomendados que el nitroprusiato sódico, ya que este último puede causar «síndrome del robo coronario»77,78.
Nesiritide. El nesiritide, una clase nueva de vasodilatador, ha sido desarrollado recientemente para el tratamiento de la insuficiencia cardíaca aguda40. El nesiritide es un péptido natriurético recombinante humano cerebral o de tipo B que es idéntico a la hormona endógena. Tiene propiedades vasodilatadoras venosas, arteriales y coronarias que reducen la precarga y la poscarga cardíacas, y aumenta el gasto cardíaco sin tener efectos inotrópicos directos.
La infusión sistémica de nesiritide en pacientes con insuficiencia cardíaca aguda ejerce acciones hemodinámicas beneficiosas, produce un aumento de la excreción de sodio y suprime el sistema renina-angiotensina-aldosterona y el sistema nervioso simpático79. El nesiritide se ha comparado con la nitroglicerina intravenosa y ha producido una mejoría hemodinámica de forma más efectiva y con menos efectos adversos, aunque esto no se ha traducido en un resultado clínico mejor. El nesiritide puede causar hipotensión y algunos pacientes no responden a este tratamiento.
Antagonistas del calcio. Los antagonistas del calcio no están recomendados para el tratamiento de la insuficiencia cardíaca aguda. El diltiazem y el verapamilo, así como las dihidropiridinas, deben considerarse contraindicados.
10.4. Inhibidores de la enzima de conversión de la angiotensina en la insuficiencia cardíaca aguda
Indicaciones. Los inhibidores de la enzima de convesión de la angiotensina (IECA) no están indicados en la estabilización precoz de los pacientes con insuficiencia cardíaca aguda.
Recomendación de clase IIb, nivel de evidencia C
No obstante, como estos pacientes están en una situación de alto riesgo, los IECA tienen un papel en el manejo precoz de los pacientes con insuficiencia cardíaca aguda con infarto agudo de miocardio. Todavía hay discusión acerca de la selección de los pacientes y el momento adecuado para iniciar el tratamiento con un IECA.
Efectos y mecanismo de acción. Los efectos hemodinámicos de los IECA se deben a la disminución de la formación de angiotensina II y al aumento de la concentración de bradicinina que, a su vez, reduce las resistencias vasculares periféricas totales y promueve la natriuresis. El tratamiento a corto plazo se acompaña de una disminución de la angiotensina II y de la aldosterona, así como de un aumento de la angiotensina I y de la actividad de la renina plasmática.
Hasta el momento no se han realizado estudios de eficacia de los IECA en el tratamiento de la insuficiencia cardíaca aguda. Los estudios con IECA en la insuficiencia cardíaca después de un infarto de miocardio se han centrado en sus efectos a largo plazo80,81. En un metaanálisis reciente se ha encontrado que la mortalidad a los 30 días se redujo desde un 7,6% en el grupo placebo hasta un 7,1% en el grupo tratado con IECA (reducción del riesgo relativo del 7% [intervalo de confianza del 95%, 2-11%, p < 0,004]). Esto equivale a cerca de 5 muertes menos por 1.000 pacientes tratados durante 4-6 semanas (número necesario a tratar [NNT] para prevenir una muerte = 200). En los estudios en los que se seleccionó a pacientes de alto riesgo se ha encontrado que los IECA produjeron una elevada reducción de la mortalidad relativa y absoluta82.
Uso práctico. Se debe evitar el uso de IECA por vía intravenosa. La dosis inicial de un IECA debe ser baja y aumentarse progresivamente después de una estabilización precoz dentro de las primeras 48 h, con control de la presión arterial y la función renal. La duración de la terapia una vez que se ha iniciado debe ser al menos de 6 semanas.
Recomendación de clase I, nivel de evidencia A
Los IECA deben utilizarse con precaución en pacientes con gasto cardíaco reducido, ya que pueden reducir de forma significativa la filtración glomerular. El riesgo de intolerancia a un IECA aumenta con la administración concomitante de fármacos antiinflamatorios no esteroideos, así como en presencia de estenosis de arterias renales bilateral.
10.5. Diuréticos
Indicaciones. La administración de diuréticos está indicada en pacientes con insuficiencia cardíaca aguda o agudamente descompensada cuando hay síntomas secundarios a la retención de fluidos.
Recomendación de clase I, nivel de evidencia B
Los beneficios sintomáticos y su aceptación clínica universal han impedido que se llevara a cabo una evaluación formal en estudios clínicos aleatorizados a gran escala.
Efectos y mecanismo de acción. Los diuréticos aumentan el volumen urinario porque favorecen la excreción de agua, cloruro sódico y otros iones, lo que produce una reducción del volumen plasmático y del volumen de fluido extracelular, del agua corporal total y del sodio, una disminución de las presiones de llenado ventricular derecha e izquierda y un descenso de la congestión periférica y del edema de pulmón83,84. La administración intravenosa de diuréticos de asa también ejerce un efecto vasodilatador, que se manifiesta por una reducción precoz (5-r derecha y de la presión de enclavamiento pulmonar, y en las resistencias pulmonares85. La administración de dosis altas en forma de bolo (> 1 mg/kg) conlleva el riesgo de vasoconstricción refleja. Contrariamente a lo que ocurre con el uso crónico de diuréticos, la utilización de diuréticos en la insuficiencia cardíaca grave descompensada normaliza las condiciones de carga y puede reducir la activación neurohormonal a corto plaz, Times Roman, serif" SIZE=2>Uso práctico. La opción preferida para los pacientes con insuficiencia cardíaca aguda es la administración intravenosa de diuréticos de asa (furosemida, bumetanida, torasemida) con un efecto diurético fuerte y rápido. La terapia se puede iniciar de forma segura antes del ingreso hospitalario75,88-90 y la dosis debe titularse de acuerdo con la respuesta diurética y el alivio de los síntomas congestivos. La admin9 pueden utilizarse en asociación con diuréticos de asa, y la combinación de dosis bajas es más efectiva y tiene menos efectos secundarios que el uso de dosis más altas de un único fármaco96-99. La combinación de diuréticos de asa con dobutamina, dopamina92 o nitratos88 también es un enfoque terapéutico más efectivo y tiene menos efectos secundarios que el aumento de la dosis del diurético100.
Recomendación de clase IIb, nivel de evidencia C
En la tabla 7 se enumeran las recomendaciones para el uso práctico de diuréticos. En la tabla 8 se muestran las dosis recomendadas de los diuréticos comúnmente utilizados en la insuficiencia cardíaca.
Resistencia a los diuréticos. La resistencia a los diuréticos se define como el estado clínico en el que la respuesta a los diuréticos está disminuida o se ha perdido antes de que el objetivo terapéutico de aliviar el edema se haya alcanzado101. Esta resistencia se asocia con un mal pronóstico102. Es más frecuente en pacientes con insuficiencia cardíaca grave y crónica que han recibido terapia diurética a largo plazo, aunque también se ha descrito en casos de depleción aguda de volumen después de la administración intravenosa de diuréticos de asa103. La resistencia a los diuréticos puede atribuirse a muchos factores (tabla 9)101,103. Se han explorado diferentes enfoques terapéuticos para evitar esta resistencia (tabla 10), y hay algunas estrategias en la práctica clínica que pueden ser útiles para pacientes individuales. La infusión continua de furosemida es más efectiva que los bolos individuales104.
Efectos secundarios, interacciones farmacológicas. Aunque los diuréticos se pueden usar de forma segura en la mayoría de los casos, los efectos secundarios son frecuentes y pueden poner en peligro la vida del paciente. Entre éstos se incluyen la activación neurohormonal, especialmente del sistema angiotensina-aldosterona y del sistema nervioso simpático97, la hipocaliemia, la hipomagnesemia y la alcalosis hipoclorémica, que pueden producir arritmias importantes 92, así como nefrotoxicidad y agravamiento de la insuficiencia renal100,105. La diuresis excesiva puede reducir la presión venosa, la presión pulmonar y el llenado diastólico, lo que conduce a una reducción del volumen de eyección y del gasto cardíaco, particularmente en pacientes con insuficiencia cardíaca grave e insuficiencia diastólica predominante o disfunción isquémica del ventrículo derecho. La administración intravenosa de acetazolamida (1 o 2 dosis) puede ser útil para corregir la alcalosis106.
Nuevos agentes diuréticos. Se están investigando algunos compuestos nuevos con propiedades diuréticas y otros efectos, como los antagonistas del receptor V2 de la vasopresina, los péptidos natriuréticos cerebrales (véase el apartado Nesiritide) y los antagonistas del receptor de adenosina.
10.6. Fármacos bloqueadores beta
Indicaciones y bases para el uso de fármacos bloqueadores beta. No se ha realizado ningún estudio en el que se haya investigado la terapia con bloqueadores beta dirigida a mejorar de forma aguda la insuficiencia cardíaca aguda. Más bien al contrario, la insuficiencia cardíaca aguda ha sido considerada como una contraindicación para este tratamiento. Los pacientes con estertores por encima de las bases pulmonares, o hipotensión, han sido excluidos de estos estudios de forma precoz tras el infarto agudo de miocardio. En los casos de pacientes con infarto agudo de miocardio que no tienen insuficiencia cardíaca o hipotensión manifiestas, los bloqueadores beta limitan el tamaño de infarto, reducen las arritmias que pueden poner en peligro la vida del paciente y alivian el dolor30,107-109.
La administración intravenosa debe ser considerada en pacientes con dolor isquémico resistente a los opiáceos, isquemia recurrente, hipertensión, taquicardia o arritmia. En el estudio Gothenburg realizado con metoprolol, la administración intravenosa de metoprolol o de placebo se inició de forma precoz después del infarto agudo de miocardio y fue seguida por una terapia oral durante 3 meses. En el grupo metoprolol hubo menos pacientes que desarrollaron insuficiencia cardíaca110. En pacientes con signos de congestión pulmonar con estertores basales y/o tratamiento con furosemida intravenosa, la terapia con metoprolol tuvo incluso un mayor efecto y redujo la mortalidad y la morbilidad111. Hay experiencia con el bloqueador beta de acción corta esmolol, sobre todo en el contexto de la cirugía cardíaca. En un estudio pequeño se han comparado el celiprolol y el esmolol en la insuficiencia cardíaca grave. El celiprolol tuvo menor efecto sobre la reducción del índice cardíaco para una misma reducción de la frecuencia cardíaca, lo que se atribuyó a diferencias en el efecto vasodilatador112. La importancia clínica de esta diferencia no está clara. En el estudio MIAMI se llevó a cabo un control hemodinámico invasivo en pacientes con presiones pulmonares elevadas hasta 30 mmHg. Cuando estos pacientes fueron tratados con metoprolol experimentaron una reducción de las presiones de llenado113.
Uso práctico. En los pacientes con insuficiencia cardíaca aguda declarada y con estertores por encima de las bases pulmonares, los bloqueadores beta deben usarse con precaución. En los pacientes que, además, presentan isquemia y taquicardia, se puede considerar la administración intravenosa de metoprolol.
Recomendación de clase IIb, nivel de evidencia C
Sin embargo, en pacientes con infarto agudo de miocardio que se estabilizan después de desarrollar insuficiencia cardíaca aguda, el tratamiento con bloqueadores beta debe iniciarse de forma precoz.
Recomendación de clase IIa, nivel de evidencia B
En pacientes con insuficiencia cardíaca crónica, la terapia con bloqueadores beta debe iniciarse cuando el paciente se haya estabilizado después del episodio agudo (normalmente después de 4 días).
Recomendación de clase I, nivel de evidencia A
La dosis inicial de bisoprolol, carvedilol o metoprolol debe ser pequeña y aumentarse despacio y progresivamente hasta alcanzar la dosis final usada en los grandes estudios clínicos. Este incremento debe adaptarse a la respuesta individual. Los bloqueadores beta pueden reducir la presión arterial y la frecuencia cardíaca en exceso. Como norma, los pacientes con bloqueadores beta que sean ingresados en el hospital debido a un empeoramiento de la insuficiencia cardíaca deben continuar con esta terapia, a menos que se requiera soporte inotrópico, pero la dosis puede reducirse si se sospechan signos de dosificación excesiva (p. ej., bradicardia e hipotensión).
10.7. Agentes inotrópicos
Indicaciones clínicas. Los agentes inotrópicos están indicados cuando hay hipoperfusión periférica (hipotensión, función renal disminuida) con o sin congestión o edema de pulmón resistente a los diuréticos y vasodilatadores en dosis óptimas (fig. 6).
Fig. 6. Bases para el uso de agentes inotrópicos en la insuficiencia cardíaca aguda. CPAP: presión positiva continua en la vía respiratoria; BNP: péptido natriurético plasmático de tipo B; IECA: inhibidores de la enzima de conversión de la angiotensina; IPDE: inhibidores de la fosfodiesterasa.
Recomendación de clase IIa, nivel de evidencia C
Su utilización puede ser potencialmente perjudicial, ya que aumentan la demanda de oxígeno y la carga de calcio; por tanto, deben usarse con precaución114.
En pacientes con insuficiencia cardíaca descompensada, los síntomas, el curso clínico y el pronóstico de la enfermedad pueden ser críticamente dependientes del estado hemodinámico. Así pues, la mejoría de los parámetros hemodinámicos se puede convertir en un objetivo del tratamiento y los fármacos inotrópicos pueden ser útiles y salvar vidas en este contexto. Los efectos beneficiosos de la mejoría de los parámetros hemodinámicos están, no obstante, parcialmente contrarrestados por el riesgo de arritmias y, en algunos casos, de isquemia miocárdica, así como por la posible progresión a largo plazo de la disfunción miocárdica causada por un aumento excesivo del gasto energético114,115. La relación riesgo-beneficio no tiene por qué ser la misma para todos los agentes inotrópicos. Los que actúan a través de la estimulación de los receptores adrenérgicos β-1 y aumentan la concentración citoplasmática de Ca2+ en la célula miocárdica se asocian con un riesgo mayor116,117. Por último, sólo se han realizado unos pocos estudios clínicos controlados sobre fármacos inotrópicos en pacientes con insuficiencia cardíaca aguda, y en muy pocos se han evaluado sus efectos en los signos y síntomas de la insuficiencia cardíaca y sus efectos a largo plazo en el pronóstico de la enfermedad117.
Dopamina. La dopamina intravenosa en dosis bajas (< 2 μg/kg/min) sólo actúa sobre los receptores dopaminérgicos periféricos y reduce la resistencia periférica, tanto directa como indirectamente. La vasodilatación ocurre de manera primordial en los lechos vasculares renal, esplácnico, coronario y cerebral. Cuando se administra esta dosis, su acción puede mejorar el flujo sanguíneo renal, la tasa de filtración glomerular, la diuresis y la tasa de excreción de sodio, con un aumento de la respuesta a los agentes diuréticos, en pacientes con hipoperfusión renal e insuficiencia renal118-121.
Cuando se administran dosis más altas (> 2 μg/kg/min), la dopamina intravenosa estimula los receptores β-adrenérgicos, tanto directa como indirectamente, lo que produce un aumento de la contractilidad miocárdica y del gasto cardíaco. En dosis de > 5 μg/kg/min, la dopamina actúa sobre los receptores alfaadrenérgicos y produce un aumento de la resistencia vascular periférica que, aunque puede ser potencialmente útil en pacientes hipotensos, puede ser deletéreo en pacientes con insuficiencia cardíaca aguda, ya que aumenta la poscarga del ventrículo izquierdo, la presión arterial pulmonar y la resistencia pulmonar122.
Dobutamina. La dobutamina es un agente inotrópico positivo que actúa principalmente a través de la estimulación de los receptores β-1 y β-2 produciendo efectos inotrópicos positivos y cronotrópicos dependientes de la dosis123,124, así como una disminución refleja del tono simpático y, por tanto, de la resistencia vascular125. Así pues, el beneficio resultante puede variar de paciente a paciente. En dosis bajas, la dobutamina induce una vasodilatación arterial leve que aumenta el volumen de eyección por disminución de la poscarga. La utilización de dosis más altas de dobutamina produce vasoconstricción77.
La frecuencia cardíaca aumenta normalmente de forma dosis dependiente en menor medida que con otras catecolaminas. Sin embargo, en pacientes con fibrilación auricular, la frecuencia cardíaca puede aumentar hasta tasas indeseables debido a la facilitación de la conducción auriculoventricular. En general, la presión arterial sistémica aumenta un poco, pero puede permanecer estable o incluso disminuir. De forma similar, la presión arterial pulmonar y la presión capilar de enclavamiento suelen disminuir, pero pueden permanecer estables o incluso aumentar en algunos pacientes con insuficiencia cardíaca119,122,126.
La mejoría de la diuresis observada durante la infusión de dobutamina en los pacientes con insuficiencia cardíaca es el resultado de un aumento del flujo sanguíneo renal en respuesta a un mayor gasto cardíaco.
Uso práctico. La dopamina puede utilizarse como un inotropo (> 2 μg/kg/min intravenosa) en la insuficiencia cardíaca aguda con hipotensión. La infusión de dosis bajas de dopamina (≤ 2-3 μg/kg/min) puede usarse para mejorar el flujo sanguíneo renal y la diuresis en la insuficiencia cardíaca descompensada con hipotensión y baja diuresis. Sin embargo, si no se observa una respuesta, la terapia debe terminarse127 (tabla 11).
Recomendación de clase IIb, nivel de evidencia C
La dobutamina está indicada cuando hay evidencia de hipoperfusión periférica (hipotensión, disminución de la función renal) con o sin congestión o edema de pulmón resistente a los diuréticos y vasodilatadores administrados en dosis óptimas (tabla 11).
Recomendación de clase IIa, nivel de evidencia C
La dobutamina se usa para aumentar el gasto cardíaco. Normalmente el tratamiento se inicia a un ritmo de infusión de 2-3 μg/kg/min sin dosis inicial. El ritmo de infusión puede modificarse de manera progresiva de acuerdo con los síntomas, la respuesta diurética o el control hemodinámico. Sus acciones hemodinámicas son proporcionales a la dosis, que puede aumentarse hasta 20 μg/kg/min. La eliminación del fármaco se produce rápidamente después de detener la infusión, lo que lo convierte en un agente inotrópico muy apropiado.
En pacientes que reciben tratamiento bloqueador beta con metoprolol, las dosis de dobutamina deben aumentarse hasta 15-20 μg/kg/min para restaurar su efecto inotrópico128. El efecto de la dobutamina difiere en pacientes que reciben carvedilol, ya que puede producir un aumento en la resistencia vascular pulmonar durante la infusión de dosis crecientes de dobutamina (5-20 μg/kg/min)129.
Si nos basamos únicamente en los datos hemodinámicos, el efecto inotrópico de la dobutamina es aditivo al de los inhibidores de la fosfodiesterasa; la combinación de inhibidores de la fosfodiesterasa y dobutamina produce un efecto inotrópico positivo mayor que el de los fármacos por separado129,130.
La infusión prolongada de dobutamina (por encima de 24-48 h) se asocia con tolerancia y pérdida parcial de los efectos hemodinámicos122. Dejar el tratamiento con dobutamina puede ser difícil debido a la recurrencia de hipotensión, congestión o insuficiencia renal. Esto se puede solventar a veces mediante una disminución progresiva de la dosis de dobutamina (p. ej., ir disminuyendo la dosis por pasos de 2 μg/kg/min cada 2 días) y con optimización de la terapia vasodilatadora oral con fármacos, como la hidralacina y/o un IECA131. A veces es necesario tolerar un cierto grado de insuficiencia renal o hipotensión durante esta fase.
La infusión de dobutamina se acompaña de un aumento en la incidencia de arritmias, que se originan tanto en los ventrículos como en las aurículas. Este efecto es dosis-dependiente, puede ser más elevado que en el caso de los inhibidores de la fosfodiesterasa132,133 y requiere una compensación inmediata de potasio durante el uso intravenoso del diurético. La taquicardia también puede ser un parámetro limitativo y la infusión de dobutamina puede desencadenar dolor torácido en pacientes con enfermedad arterial coronaria. En pacientes con miocardio hibernado, la dobutamina parece aumentar la contractilidad a corto plazo a expensas de una necrosis miocitaria y pérdida de recuperación miocárdica134. No hay estudios clínicos controlados sobre el uso de dobutamina en pacientes con insuficiencia cardíaca aguda, y en algunos se muestran efectos desfavorables, con un aumento de los episodios cardiovasculares perjudiciales42,116.
Inhibidores de la fosfodiesterasa. La milrinona y la enoximona son los 2 inhibidores de la fosfodiesterasa de tipo III que se usan en la práctica clínica. En la insuficiencia cardíaca aguda, estos fármacos tienen efectos significativos de tipo inotrópico, lusitrópico y vasodilatador periférico con aumento del gasto cardíaco y del volumen de eyección, y disminución concomitante de la presión arterial pulmonar, la presión capilar pulmonar y la resistencia vascular sistémica y pulmonar122,135. Su perfil hemodinámico se encuentra en una zona intermedia entre el de un vasodilatador puro, como el nitroprusiato, y el de un agente predominantemente inotrópico, como la dobutamina126. Como su lugar de acción es distal al de los receptores de tipo β-adrenérgicos, los inhibidores de la fosfodiesterasa mantienen sus efectos incluso durante la terapia concomitante con bloqueadores beta128,129,136.
Los inhibidores de la fosfodiesterasa de tipo III están indicados cuando hay evidencia de hipoperfusión periférica, con o sin congestión refractaria a los diuréticos y vasodilatadores en dosis óptimas, y cuando hay una presión arterial sistémica preservada.
Recomendación de clase IIb, nivel de evidencia C
Estos agentes pueden ser más adecuados que la dobutamina en los pacientes con terapia concomitante con bloqueadores beta y/o con respuesta inadecuada a la dobutamina.
Recomendación de clase IIa, nivel de evidencia C
En el uso práctico, la milrinona se administra en un bolo de 25 μg/kg/10-20 min seguido por una infusión continua a 0,375-0,75 μg/kg/min. De forma similar, la enoximona se administra en un bolo de 0,25-0,75 mg/kg seguida por una infusión continua a 1,25-7,5 μg/kg/min (tabla 11). La hipotensión causada por una venodilatación periférica excesiva es un efecto indeseable observado fundamentalmente en pacientes con bajas presiones de llenado. Puede evitarse empezando la infusión sin ningún bolo. La trombocitopenia es poco común, tanto con la milrinona (0,4%) como con la enoximona.
Los datos sobre los efectos de la administración de inhibidores de la fosfodiesterasa en el resultado clínico de pacientes con insuficiencia cardíaca aguda son insuficientes, pero causan cierta inquietud en cuanto a su seguridad, particularmente en pacientes con insuficiencia cardíaca isquémica54,117,137.
Levosimendán. El levosimendán tiene dos mecanismos de acción principales: la sensibilización al Ca2+ de las proteínas contráctiles, causantes de la acción inotrópica positiva, y la apertura de los canales de K+ del músculo liso, que causan la vasodilatación periférica. Algunos datos sugieren que el levosimendán puede tener también un efecto de inhibición de la fosfodiesterasa. El levosimendán tiene un potente metabol ito acetilado que también es un sensibilizador al Ca2+ dependiente de la concentración de Ca2+. Su vida media es de unas 80 h, lo que probablemente explica los prolongados efectos hemodinámicos de una infusión de levosimendán de 24 h138,139.
El levosimendán está indicado en pacientes con insuficiencia cardíaca con un gasto cardíaco reducido sintomático secundario a una disfunción sistólica sin hipotensión grave (tabla 11).
Recomendación de clase IIa, n ivel de evidencia B
El levosimendán se administra generalmente en una infusión intravenosa continua en una dosis de 0,05-0,1 μg/kg/min precedida por una dosis inicial de 12-24 μg/kg administrada durante unos 10 min42,140-142. Sus efectos hemodinámicos son dependientes de la dosis y el ritmo de infusión puede incrementarse hasta un máximo de 0,2 μg/kg/min165. La mayoría de los datos clínicos se han obtenido con infusiones intravenosas que han durado desde 6 h142 hasta 24 h42,141, pero los efectos hemodinámicos persisten > 48 h después de finalizar la infusión138,143.
La infusión de levosimendán en pacientes con insuficiencia cardíaca aguda descompensada causada por una disfunción sistólica ventricular izquierda se ha asociado con un aumento, dependiente de la dosis, del gasto cardíaco y del volumen de eyección, una disminución de la presión capilar pulmonar, de la resistencia vascular periférica y de la resistencia vascular pulmonar, un ligero aumento de la frecuencia cardíaca y una disminución de la presión arterial42,143. En los estudios clínicos aleatorizados en los que se ha comparado el levosimendán con la dobutamina se ha descrito una mejoría de los síntomas de disnea y fatiga y un resultado clínico favorable42. A diferencia de la dobutamina, la respuesta hemodinámica al levosimendán se mantiene, o es incluso mayor, en los pacientes con terapia concomitante con bloqueadores beta42.
Se ha descrito la presencia de taquicardia e hipotensión asociadas con la infusión de altas dosis de levosimendán42 y actualmente no se recomienda en pacientes con presión arterial sistólica < 85 mmHg143. El levosimendán no se ha asociado con un aumento de la frecuencia de arritmias malignas en los estudios comparativos frente a placebo141,142 o dobutamina42. Se han descrito reducciones en el hematocrito, la hemoglobina y el potasio plasmático, probablemente secundarias a la vasodilatación y la activación neurohormonal42,143, y parecen ser dependientes de la dosis143.
Terapia vasopresora en el shock cardiogénico. Cuando la combinaci&oa cute;n de agentes inotrópicos y la prueba de sobrecarga aguda de líquidos no permite restaurar una perfusión arterial y orgánica adecuada a pesar de la mejoría del gasto cardíaco, puede ser necesario un tratamiento con vasopresores. Los vasopresores pueden usarse también, en caso de emergencia, para mantener la vida y la perfusión frente a una hipotensión que pone en peligro la supervivencia. Como el shock cardiogénico se asocia con altas resistencias vasculares, cualquier vasopresor debe utilizarse con precaución y de forma transitoria, ya que puede aumentar la poscarga de un corazón insuficiente y, en consecuencia, disminuir el flujo sanguíneo orgánico.
Adrenalina. La adrenalina es una catecolamina con una gran afinidad por los receptores de tipo β-1, β-2 y α. Se usa generalmente en forma de infusión en dosis de 0,05 a 0,5 μg/kg/min cuando hay resistencia a la dobutamina y la presión arterial permanece baja. Se recomienda controlar de manera directa la presión arterial y la monitorización hemodinámica con catéter de la arteria pulmonar (tabla 11).
Noradrenalina. La noradrenalina es una catecolamina con gran afinidad por los receptores de tipo α y se usa generalmente para incrementar la resistencia vascular sistémica. Los aumentos de la frecuencia cardíaca inducidos por noradrenalina son menores que los inducidos por adrenalina. La dosificación es similar a la de la adrenalina. La noradrenalina (0,2 a 1 μg/kg/min) es adecuada en situaciones de hipotensión relacionada con una reducción de la resistencia vascular sistémica, como el shock séptico. La noradrenalina se combina a menudo con dobutamina para mejorar el estado hemodinámico144. La noradrenalina puede reducir la perfusión de los órganos distales.
Glucósidos cardíacos. Los glucósidos cardíacos inhiben la ATPasa Na+/K+ miocárdica, lo que provoca un aumento del intercambio Ca2+/Na+ y da lugar a un efecto inotrópico positivo. En la insuficiencia cardíaca, el efecto inotrópico positivo que se produce por la estimulación β-adrenérgica está atenuado y la relación positiva fuerza-frecuencia está alterada. Contrariamente a lo que ocurre con los agonistas β-adrenérgicos, el efecto inotrópico positivo de los glucósidos cardíacos no está alterado en el corazón insuficiente144 y la relación fuerza-frecuencia se restaura parcialmente145. En la insuficiencia cardíaca crónica, los glucósidos cardíacos reducen los síntomas y mejoran el estado clínico, disminuyendo así el riesgo de hospitalización por insuficiencia cardíaca sin efectos sobre la supervivencia146,147. En la insuficiencia cardíaca aguda, los glucósidos cardíacos producen un pequeño aumento del gasto cardíaco148 y una reducción de las presiones de llenado149. En pacientes con insuficiencia cardíaca grave después de episodios de descompensación aguda, los glucósidos cardíacos son efectivos para reducir la recurrencia de descompensación aguda150. Los predictores de estos efectos beneficiosos son un tercer ruido cardíaco, la dilatación severa del ventrículo izquierdo y la distensión de las venas yugulares durante el episodio de insuficiencia cardíaca aguda.
Sin embargo, en un subestudio del ensayo AIRE se han demostrado efectos adversos en el pronóstico de pacientes con un infarto agudo de miocardio acompañado de insuficiencia cardíaca151. Es más, se produjo un aumento más pronunciado de la creatincinasa después de un infarto agudo de miocardio en los pacientes que recibieron glucósidos cardíacos152. Además, el uso de digitálidos fue un predictor de episodios proarrítmicos que ponían en peligro la vida en los pacientes con infarto de miocardio e insuficiencia cardíaca aguda153. Por tanto, no está recomendado el soporte inotrópico con glucósidos cardíacos en la insufa indicación para usar glucósidos cardíacos en la insuficiencia cardíaca aguda puede ser la insuficiencia cardíaca inducida por taquicardia, como la que se produce en la fibrilación auricular, y que no puede ser controlada suficientemente con otros fármacos, como los bloqueadores beta. El control riguroso de la frecuencia cardíaca en la taquiarritmia durante el curso de la insuficiencia cardíaca aguda puede controlar los síntomas de insuficiencia cardíaca154. Las contraindicaciones para usar glucósidos cardíacos son la bradicardia, el bloqueo auriculoventricular de segundo y tercer grado, la enfermedad del seno, el síT>
Hay varios procesos agudos que pueden causar una insuficiencia cardíaca aguda de novo o desencadenar una descompensación de la insuficiencia cardíaca crónica. La cardiopatía isquémica y los síndromes coronarios agudos son las causas más frecuentes de insuficiencia cardíaca aguda. Las comorbilidades no cardíacas también pueden complicar significativamente el tratamiento de la insuficiencia cardíaca aguda.
11.1. Enfermedad arterial coronaria
29,30. La intervención coronaria percutánea de urgencia, o la cirugía en algunos casos, deben ser consideradas en una primera fase y realizadas tal como está indicado. Si no se puede realizar la intervención coronaria percutánea o la cirugía de forma rápida, o sólo pueden llevarse a cabo después de un tiempo prolongado, se recomienda realizar tratamiento fibrinolítico precoz29,30.
Fig. 7. Algoritmo: insuficiencia cardíaca aguda en el infarto agudo de miocardio. BCIA: balón de contrapulsación intraaórtico; RSV: rotura septal ventricular; CAP: cateterismo arterial pulmonar; ETE: ecocardiografía transesofágica; FE: fracción de eyección; IM: insuficiencia mitral; SIV: septo intraventricular; MAS: movimiento anterior sistólico; AD: aurícula derecha; VD: ventrículo derecho; ICP: intervención coronaria percutánea; Qp:Qs: volumen de la circulación pulmonar:volumen de la circulación sistémica; DAS: dispositivo de asistencia ventricular.
Todos los pacientes con infarto agudo de miocardio y con signos y síntomas de insuficiencia cardíaca deben someterse a un estudio ecocardiográfico para evaluar la función ventricular regional y global, la disfunción valvular asociada (principalmente insuficiencia mitral) y descartar otros estados patológicos (como la miopericarditis, la miocardiopatía y el embolismo pulmonar).
Recomendación de clase I, nivel de evidencia C
A veces es necesario realizar pruebas especiales para comprobar la presencia de isquemia miocárdica reversible.
En el shock cardiogénico producido por un síndrome coronario agudo se debe realizar una angiografía y una revascularización lo antes posible155.
Recomendación de clase I, nivel de evidencia A
La estabilización temporal del paciente se puede conseguir mediante un adecuado reemplazo de fluidos, balón de contrapulsación intraaórtico, soporte farmacológico inotrópico, nitratos y ventilación artificial. Deben tomarse muestras sanguíneas repetidas para controlar los electrolitos, la glucosa, la función renal y la gasometría arterial, especialmente en pacientes diabéticos.
El soporte metabólico con glucosa en altas dosis, insulina y potasio no se puede recomendar (excepto en pacientes diabéticos) hasta que estén disponibles los resultados de los grandes estudios clínicos sobre infarto agudo de miocardio156.
Recomendación de clase II, nivel de evidencia A
Cuando el estado hemodinámico continúa inestable durante varias horas, se puede considerar la introducción de un catéter arterial pulmonar. Puede ser de ayuda la obtención de medidas repetidas de la saturación de oxígeno de la mezcla de sangre venosa obtenida por el catéter arterial pulmonar.
Recomendación de clase II, nivel de evidencia B
Cuando con todas estas medidas no se puede estabilizar la situación hemodinámica, se debe considerar la posibilidad de usar un soporte mecánico con un dispositivo de asistencia del ventrículo izquierdo, especialmente si se contempla la opción de trasplante cardíaco.
En la insuficiencia cardíaca izquierda/edema de pulmón, el manejo agudo es similar al que se emplea para otras causas de edema de pulmón. Los agentes inotrópicos pueden ser deletéreos. Se debe considerar el uso de un balón de contrapulsación intraaórtico155,157,158.
La estrategia de manejo a largo plazo debe incluir una revascularización coronaria adecuada y, cuando hay evidencia de función ventricular izquierda deprimida, debe utilizarse una terapia a largo plazo con inhibidores del sistema renina-angiotensina-aldosterona y bloqueadores beta.
La insuficiencia cardíaca derecha aguda se relaciona normalmente con la isquemia aguda del ventrículo derecho en los síndromes coronarios agudos, en particular con el infarto de ventrículo derecho, y tiene un electrograma y un ecocardiograma característicos. Se recomienda una revascularización precoz de la arteria coronaria derecha y de sus ramas ventriculares. El tratamiento de soporte debe centrarse en la administración de fluidos y en los fármacos inotropos.
11.2. Enfermedad valvular
La insuficiencia cardíaca aguda puede estar causada por enfermedades valvulares no relacionadas con los síndromes coronarios agudos, como la insuficiencia aguda de la válvula mitral o aórtica, la insuficiencia valvular aguda por endocarditis, una estenosis mitral o aórtica, la trombosis de una válvula protésica o una disección aórtica.
En pacientes con endocarditis, el tratamiento inicial es conservador y se utilizarán antibióticos y otras medidas para el tratamiento de la insuficiencia cardíaca aguda. La disfunción cardíaca puede estar agravada por una miocarditis. No obstante, la insuficiencia valvular aguda es la causa más frecuente de insuficiencia cardíaca aguda en pacientes con endocarditis infecciosa. La insuficiencia cardíaca debe ser tratada inmediatamente. Para realizar un diagnóstico rápido y poder tomar decisiones terapéuticas es necesaria la consulta con expertos. Asimismo, se deben realizar consultas quirúrgicas. La intervención quirúrgica debe realizarse de forma precoz en la insuficiencia aórtica o mitral aguda grave.
La cirugía de urgencia está indicada en pacientes con endocarditis y con insuficiencia aórtica aguda grave159-163.
11.3. Manejo de la insuficiencia cardíaca aguda debida a trombosis de válvula protésica
La insuficiencia cardíaca aguda producida por la trombosis de una válvula protésica está asociada con una alta mortalidad164-167. Todos los pacientes con síntomas de insuficiencia cardíaca y sospecha de trombosis de válvula protésica deben someterse a una fluoroscopia de tórax y a un estudio ecocardiográfico (transtorácico y/o transesofágico si la visualización del área de la válvula protésica es inadecuada).
Recomendación de clase I, nivel de evidencia B
El manejo de estos pacientes sigue siendo controvertido. La trombólisis se usa para válvulas protésicas del lado derecho y para candidatos a cirugía de alto riesgo. La cirugía está más indicada para la trombosis de válvula protésica del lado izquierdo.
Recomendación de clase IIa, nivel de evidencia C
La proliferación fibrosa (pannus) desempeña un papel importante en la obstrucción valvular y puede hacer que el tratamiento trombolítico no sea efectivo.
En pacientes con trombos muy grandes y/o móviles, la terapia trombolítica se asocia con un riesgo mucho mayor de embolismo y accidente cerebrovascular. En estos pacientes, la intervención quirúrgica debe ser considerada como una alternativa. Antes de decidir la terapia se debe descartar mediante ecocardiografía la formación de pannus o defectos estructurales de la válvula protésica168.
La ecocardiografía debe realizarse en todos los pacientes después de recibir terapia trombolítica. La intervención quirúrgica debe considerarse en todos los casos si la trombólisis no es capaz de resolver la obstrucción, aunque las infusiones repetidas de terapia trombolítica pueden ser una alternativa166,169.
Los trombolíticos que se usan son: rtPA 10 mg en forma de bolo intravenoso, seguido por una infusión de 90 mg durante 90 min; estreptocinasa 250-500.000 U durante 20 min seguido por 1-1,5 millones de U en infusión durante 10 h. Después de la trombólisis se debe administrar heparin a no fraccionada por infusión intravenosa en todos los pacientes (tiempo parcial de activación de tromboplastina 1,5-2,0 veces el control). La urocinasa también es una alternativa, en una dosis de 4.400 U/kg/h sin heparina durante 12 h, o 2.000 U/kg/h con heparina durante 24 h (*).
(*) Según datos históricos de 47 pacientes diagnosticados de trombosis protésica en dos hospitales terciarios españoles, se apreció que la trombólisis, en términos de mortalidad hospitalaria, era una alternativa mejor que la cirugía directa. Aun cuando el resultado fuese subóptimo, permitía que el paciente llegase a la cirugía en mejo res condiciones, reduciéndose el riesgo quirúrgico1.
1. Azpitarte J, Sánchez-Ramos J, Urda T, Vivancos R, Oyonarte JM, Malpartida F. Trombosis valvular protésica: ¿cuál es la terapia inicial más apropiada? Rev Esp Cardiol. 2001;54:1367-76.
11.4. Disección aórtica
La disección aórtica aguda (sobre todo la de tipo 1) puede presentarse con síntomas de insuficiencia cardíaca con o sin dolor170. Después de un período de dolor, la insuficiencia cardíaca puede convertirse en el síntoma principal170. La insuficiencia cardíaca aguda está normalmente relacionada con una crisis hipertensiva (véase el apartado Insuficiencia renal) o con insuficiencia valvular aguda. Se debe realizar un diagnóstico inmediato y una consulta quirúrgica. La ecocardiografía transesofágica es la mejor técnica para evaluar la morfología y la función de la válvula170. Es vital proceder con la máxima rapidez a la intervención quirúrgica.
11.5. Insuficiencia cardíaca aguda e hipertensión
La insuficiencia cardíaca aguda es una complicación bien conocida de las urgencias hipertensivas. Los signos clínicos de la insuficiencia cardíaca aguda asociados con una crisis hipertensiva son casi exclusivamente los signos de una congestión pulmonar, que pueden ser leves o muy graves, con edema pulmonar bilateral. Se llama edema de pulmón de tipo «flash» por la rapidez de su comienzo. Se requiere un tratamiento rápido con intervenciones específicas.
La función sistólica suele estar preservada en pacientes hospitalizados por edema de pulmón e hipertensión (más de la mitad de los pacientes tienen una fracción de eyección ventricular izquierda > 45%). Por el contrario, son frecuentes las anomalías diastólicas con reducción de la distensibilidad del ventrículo izquierdo171,172.
Los objetivos del tratamiento en el edema agudo de pulmón con hipertensión son la reducción de la precarga y la poscarga del ventrículo izquierdo, la disminución de la isquemia cardíaca y el mantenimiento de una ventilación adecuada con compensación del edema. El tratamiento debe iniciarse inmediatamente según el siguiente orden: terapia con O2; CPAP o ventilación no invasiva y, si es necesario, ventilación mecánica invasiva, normalmente durante un período muy corto; y administración de fármacos antihipertensivos intravenosos.
La terapia antihipertensiva debe dirigirse a reducir de forma inicial y rápida (en un par de minutos) la presión arterial sistólica o diastólica en 30 mmHg, seguida por una reducción más progresiva, hasta alcanzar los valores medidos antes de la crisis hipertensiva; esto último puede llevar varias horas. No se debe intentar restaurar los valores normales de presión arterial, ya que se puede producir un deterioro de la perfusión orgánica. La reducción inicial rápida de la presión arterial se puede conseguir mediante las siguientes medicaciones, solas o combinadas, si la hipertensión persiste: a) diuréticos de asa intravenosos, sobre todo si el paciente tiene sobrecarga de líquidos con historia larga de insuficiencia cardíaca crónica; b) nitroglicerina o nitroprusiato intravenosos para disminuir la precarga venosa y la poscarga arterial, y aumentar el flujo sanguíneo coronario, y c) se puede considerar un bloqueador de los canales de calcio (como la nicardipina), ya que estos pacientes suelen tener disfunción diastólica con un aumento de la poscarga.
Los bloqueadores beta no están aconsejados en casos de edema de pulmón concomitante. Sin embargo, en algunos casos, y sobre todo en las crisis hipertensivas relacionadas con feocromocitoma, puede ser eficaz el labetalol intravenoso, administrado en bolos lentos de 10 mg mientras se controlan la frecuencia cardíaca y la presión arterial, seguido por una infusión de 50-200 mg/h.
11.6. Insuficiencia renal
Es frecuente que la insuficiencia cardíaca coexista con la insuficiencia renal176-178, y cualquiera de las dos puede ser la causa de la otra. La insuficiencia cardíaca produce hipoperfusión renal de forma directa y también por la activación de mecanismos neurohormonales176. La terapia concomitante con diuréticos, IECA y fármacos antiinflamatorios no esteroideos puede contribuir al desarrollo de insuficiencia renal.
El análisis de orina puede variar según la causa de la insuficiencia renal. Cuando la insuficiencia renal es secundaria a hipoperfusión, la relación sodio/potasio urinario es típicamente < 1. La necrosis tubular aguda puede diagnosticarse por un aumento del sodio urinario, una reducción de la concentración de nitrógeno en la orina y unos patrones característicos del sedimento urinario.
El deterioro entre leve y moderado de la función renal generalmente es asintomático y bien tolerado. Sin embargo, incluso un aumento entre leve y moderado de la creatinina sérica y/o una disminución de la tasa de filtración glomerular se asocian de manera independiente con un peor pronóstico177,178.
La insuficiencia renal aguda concomitante requiere el reconocimiento y el tratamiento de las alteraciones asociadas: anemia, anomalías de los electrolitos y acidosis metabólica. Las anomalías de los electrolitos (hipocaliemia e hipercaliemia, hipomagnesemia e hipermagnesemia) y la acidosis metabólica deben ser corregidas porque pueden causar arritmias, reducir la respuesta al tratamiento y empeorar el pronóstico179.
La insuficiencia renal también tiene influencia en la respuesta y la tolerancia a los tratamientos de la insuficiencia cardíaca, principalmente a la digoxina, los IECA, los bloqueadores de los receptores de la angiotensina y la espironolactona. También debe evaluarse la estenosis arterial prerrenal y las obstrucciones posrenales. La administración de IECA se asocia con una incidencia aumentada de insuficiencia renal grave e hipercaliemia en pacientes con insuficiencia renal concomitante. Un incremento de la creatinina sérica de más de un 25-30% y/o alcanzar concentraciones > 3,5 mg/dl (> 266 μmol/l) son contraindicaciones relativas para el tratamiento con IECA (véase el apartado Diuréticos).
La insuficiencia renal entre moderada y severa (es decir, con una creatinina sérica > 2,5-3 mg/dl [> 190-226 μmol/l]) también se asocia con una respuesta reducida a los diuréticos y es un predictor significativo de la mortalidad en pacientes con insuficiencia cardíaca102. En estos pacientes puede ser necesario aumentar progresivamente la dosis de los diuréticos de asa y/o añadir un diurético con un mecanismo de acción diferente (como la metozalona). Sin embargo, esto puede asociarse con hipocaliemia y con una disminución posterior de la tasa de filtración glomerular.
En pacientes con disfunción renal severa y retención de fluidos resistente al tratamiento puede llegar a ser necesario practicar una hemofiltración venovenosa continua. Este procedimiento, combinado con un fármaco inotrópico positivo, puede aumentar el flujo sanguíneo renal, mejorar la función renal y restaurar la eficiencia diurética. Se ha asociado con un aumento de la diuresis, una reducción de los síntomas, una disminución de las presiones de llenado ventriculares derecha e izquierda, una reducción de la estimulación simpática y una mejoría de la función mecánica pulmonar, de las anomalías de laboratorio (hiponatremia) y de la respuesta al tratamiento diurético180. La pérdida de función renal puede requerir tratamiento de diálisis, especialmente si hay hiponatremia, acidosis y retención incontrolada de fluidos. La elección entre diálisis peritoneal, hemodiálisis o filtración depende normalmente de la disponibilidad técnica y de la presión arterial basal181.
Los pacientes con insuficiencia cardíaca tienen un riesgo muy elevado de presentar daño renal después de la administración de un medio de contraste. La medida preventiva más ampliamente utilizada, la hidratación previa y posterior al procedimiento, puede no ser tolerada, de manera que la sobrecarga osmótica y de volumen del material de contraste favorezca la aparición de edema de pulmón. Otras medidas preventivas que pueden ser mejor toleradas incluyen el uso de la menor cantidad posible de medio de contraste iso-osmótico, evitar los fármacos nefrotóxicos como los antiinflamatorios no esteroideos y realizar pretratamiento con N-acetilcisteína182,183 y/o el agonista selectivo del receptor DA1, el fenoldopam184. La hemodiálisis periprocedimiento es efectiva para prevenir la nefropatía en pacientes con disfunción renal grave185.
Recomendación de clase IIb, nivel de evidencia B
11.7. Enfermedades pulmonares y broncoconstricción
Cuando hay broncoconstricción en pacientes con insuficiencia cardíaca aguda se deben usar broncodilatadores. Ésta es la situación más frecuente en pacientes con problemas pulmonares concomitantes, como asma, bronquitis obstructiva crónica186 e infecciones pulmonares. Los broncodilatadores pueden mejorar la función cardíaca, pero no deben utilizarse en lugar de otros tratamientos relevantes para la insuficiencia cardíaca aguda. El tratamiento inicial consiste normalmente en 2,5 mg de albuterol (salbutamol) (0,5 ml de una solución al 0,5% en 2,5 ml de solución salina) por nebulización durante 20 min. Este procedimiento se puede repetir cada hora durante las primeras horas de tratamiento y luego seguir la pauta indicada.
11.8. Arritmias e insuficiencia cardíaca aguda
No hay una información extensa acerca de la prevalencia de arritmias, ya sea como causa o como factor de complicación de la insuficiencia cardíaca aguda descompensada. En el Euroheart Heart Failure Survey se observó fibrilación auricular en el momento de la hospitalización en un 9% de pacientes, de los que 42% tenía historia de fibrilación auricular paroxística o crónica. Las arritmias ventriculares que suponen un peligro para la vida se observaron en el momento de la hospitalización en un 2% de los pacientes, y en la población total del estudio aparecieron como un problema concomitante de aparición precoz o en forma aguda en un 8% de los pacientes5.
Bradiarritmias. La bradicardia en pacientes con insuficiencia cardíaca aguda ocurre más a menudo después de un infarto agudo de miocardio, especialmente cuando ha habido oclusión de la arteria coronaria derecha.
El tratamiento de las bradiarritmias se inicia con atropina 0,25-0,5 mg i.v. y se repite cuando es necesario. El isoproterenol 2-20 μg/min puede infundirse en casos de disociación auriculoventricular con baja respuesta ventricular, pero debe evitarse en situación de isquemia. El ritmo ventricular lento de la fibrilación auricular puede mejorarse con teofilina 0,2-0,4 mg/kg/h i.v. en forma de bolo y luego por infusión. Debe insertarse un marcapasos temporal si no se consigue una respuesta con el tratamiento médico187. La isquemia debe tratarse lo antes posible, antes o después de insertar el marcapasos cuando esté indica-do188-190 (tabla 12).
Recomendación de clase IIa, nivel de evidencia C
Taquicardia supraventricular. Las taquiarritmias supraventriculares pueden complicar o causar insuficiencia cardíaca aguda191. En raras ocasiones, las taquicardias auriculares persistentes pueden provocar una insuficiencia cardíaca descompensada que requiere hospitalización. De forma parecida, la fibrilación auricular con una respuesta ventricular rápida puede ser causa de una miocardiopatía dilatada y de insuficiencia cardíaca aguda.
Recomendaciones para el tratamiento de taquiarritmias supraventriculares en la insuficiencia cardíaca aguda. El control de la respuesta de frecuencia ventricular es importante en pacientes con fibrilación auricular e insuficiencia cardíaca aguda, sobre todo en casos de disfunción diastólica31.
Recomendación de clase IIa, nivel de evidencia A
Los pacientes con fisiología restrictiva o taponamiento pueden presentar un súbito deterioro con una reducción rápida de la frecuencia cardíaca. Se debe practicar un control rápido de la frecuencia o cardioversión, según la necesidad clínica (tabla 12). La terapia de la fibrilación auricular depende de su duración31.
Los pacientes con insuficiencia cardíaca aguda y con fibrilación auricular deben estar anticoagulados. Cuando la fibrilación auricular es paroxística se debe considerar la cardioversión médica o eléctrica después del trabajo inicial de estabilización del paciente. Si la duración de la fibrilación auricular es > 48 h, el paciente debe ser anticoagulado y se debe obtener un control óptimo de la frecuencia cardíaca con tratamiento médico durante 3 semanas antes de la cardioversión. Si el paciente está hemodinámicamente inestable, es imprescindible realizar una cardioversión urgente, pero debe excluirse la presencia de trombosis auricular mediante ecocardiografía transesofágica antes de la cardioversión31.
Se debe evitar el uso de verapamilo y diltiazem en la fibrilación auricular aguda, ya que pueden empeorar la insuficiencia cardíaca y causar bloqueo auriculoventricular de tercer grado. La amiodarona y los agentes bloqueadores beta han sido utilizados con éxito en el control de la frecuencia cardíaca en la fibrilación auricular, así como en el control de sus recurrencias3,192.
Recomendación de clase I, nivel de evidencia A
El verapamilo puede considerarse para el tratamiento de la fibrilación auricular o de la taquicardia supraventricular con un complejo QRS estrecho cuando los pacientes tienen una función sistólica ventricular normal o sólo ligeramente reducida.
Los antiarrítmicos de clase I deben evitarse en los pacientes con una fracción de eyección baja, y especialmente en los que tienen un complejo QRS ancho. El dofetilide es un fármaco nuevo que está dando resultados prometedores en la cardioversión médica y en la prevención de nuevas fibrilaciones auriculares, pero se necesitan estudios adicionales para evaluar su seguridad y eficacia en la insuficiencia cardíaca aguda193.
Los agentes bloqueadores beta pueden probarse para el tratamiento de las taquicardias supraventriculares cuando son bien tolerados194,195. En la taquicardia con un complejo QRS ancho se puede utilizar adenosina intravenosa para intentar terminar la arritmia. Debe considerarse la posibilidad de cardioversión eléctrica de la taquicardia supraventricular con sedación en los pacientes con insuficiencia cardíaca aguda e hipotensión. Los pacientes con infarto agudo de miocardio e insuficiencia cardíaca aguda y los pacientes con insuficiencia cardíaca diastólica no toleran las arritmias supraventriculares rápidas.
La concentración plasmática de potasio y magnesio debe normalizarse, sobre todo en pacientes con arritmia ventricular179,196.
Recomendación de clase IIb, nivel de evidencia B
Tratamiento de arritmias que ponen en peligro la vida. La fibrilación ventricular y la taquiarritmia ventricular requieren una inmediata cardioversión, con asistencia ventilatoria si es necesario y, en el caso de un paciente consciente, con sedación (tabla 12).
La amiodarona y los agentes bloqueadores beta pueden prevenir la repetición de estas arritmias3,192.
Recomendación de clase I, nivel de evidencia A
En caso de arritmias ventriculares recurrentes y pacientes hemodinámicamente inestables se debe realizar inmediatamente una angiografía y una prueba electrofisiológica. En los casos en los que haya un sustrato arrítmico localizado, la ablación por radio e eliminar la tendencia arrítmica, aunque no se puede asegurar el efecto a largo plazo3,197,207 (tabla 12).
Recomendación de clase IIb, nivel de evidencia C
11.9. Insuficiencia cardíaca aguda perioperatoria
La insuficiencia cardíaca aguda en el período perioperatorio se relaciona normalmente con isquemia miocárdica, que suele ser silente, es decir, sin dolor torácico.
12. Tratamiento quirúrgico de la insuficiencia cardíaca aguda
La insuficiencia cardíaca aguda es una complicación grave de muchas alteraciones cardíacas. En algunas de ellas el tratamiento micas, el reemplazo o la reconstrucción valvular y el soporte circulatorio temporal mediante dispositivos de asistencia mecánica. La ecocardiografía es la técnica más importante para el diagnóstico (fig. 3).
12.1. Insuficiencia cardíaca aguda relacionada con complicaciones del infarto agudo de miocardio
Rotura de la pared libre. La rotura de la pared libre se ha documentado en el 0,8-6,2% de los pacientes que han presentado infarto agudo de miocardio198. En general produce muerte súbita en los primeros minutos debido a tap libre es subaguda (la presencia de trombos o de adherencias sella la rotura) lo que permite realizar una intervención si se reconoce el problema a tiempo. La mayoría de estos pacientes tiene signos de shock cardiogénico, hipotensión súbita, y/o pérdida de la conciencia. En algunos casos, la rotura está precedida por dolor torácico, náuseas, emesis, reelevación del segmento ST en las derivaciones relacionadas con el infarto o cambios en la onda T199. En todos estos pacientes se debe realizar una ecocardiografía inmediata (fig. 7). La presentación clínica con un derrame pericárdico > 1 cm y densidades ecográficas elevadas en el derrame confirma el diagnóstico200. Se puede obtener una estabilización hemodinámica temporal con pericardiocentesis, fluidos y agentes inotrópicos positivos. El paciente debe ser trasladado inmediatamente al quirófano sin más pruebas complementarias. La rotura de la pared libre se ha descrito también como una complicación rara de la ecocardiografía de estrés con dobutamina después de un infarto agudo de miocardio201.
Rotura del septo interventricular postinfarto. La rotura del septo interventricular postinfarto ocurre en un 1-2% de los pacientes con infarto agudo de miocardio. Datos recientes sugieren una incidencia más baja y una presentación más prematura en la «era trombolítica»173,174,202. La rotura del septo interventricular postinfarto ocurre en los primeros 1-5 días tras el infarto. El primer signo es la presencia de un soplo pansistólico en el borde esternal inferior izquierdo en un paciente con deterioro agudo y signos de insuficiencia cardíaca aguda/shock cardiogénico después de un infarto agudo de miocardio (fig. 7A).
La ecocardiografía confirma el diagnóstico y permite evaluar la función ventricular, define el lugar de la rotura del septo interventricular postinfarto, el tamaño del cortocircuito izquierdo-derecho y la coexistencia de insuficiencia mitral (fig. 7B).
Recomendación de clase I, nivel de evidencia C
La oximetría obtenida por catéter arterial pulmonar con incremento de O2 permite la estimación de la relación flujo sanguíneo pulmonar/flujo sanguíneo sistémico (normalmente de 2 o más).
Recomendación de clase III, nivel de evidencia C para catéter arterial pulmonar para diagnóstico si la ecocardiografía es diagnóstica
Recomendación de clase IIa, nivel de evidencia C para catéter arterial pulmonar para monitorización
Los pacientes con compromiso hemodinámico deben ser tratados con un balón de contrapulsación intraaórtico, vasodilatadores, agentes inotrópicos y (si es necesario) ventilación asistida. Normalmente se realiza angiografía coronaria porque en algunos estudios pequeños retrospectivos se ha demostrado que la revascularización concomitante puede mejorar el estado funcional tardío y la supervivencia173,175.
Casi todos los pacientes que reciben tratamiento médico mueren. La cirugía debe prácticarse rápidamente después del diagnóstico en la mayoría de pacientes. La mortalidad hospitalaria es del 20-60% en pacientes con reparación quirúrgica. Las mejorías en la técnica quirúrgica y en la protección miocárdica han mejorado el resultado clínico en las series recientes173,202.
Cada vez hay mayor consenso acerca de que la cirugía debe llevarse a cabo tan pronto como se realice el diagnóstico, ya que la rotura puede expandirse abruptamente y dar lugar a un shock cardiogénico, el principal determinante de un resultado clínico adverso174,203. Los pacientes con rotura del septo interventricular postinfarto deben ser intervenidos quirúgicamente de manera urgente si se encuentran hemodinámicamente estables, y de manera inmediata si están en shock cardiogénico.
Recomendación de clase I, nivel de evidencia C
Recientemente se ha descrito la obstrucción del tracto de salida del ventrículo izquierdo con hipercinesia compensadora de los segmentos basales del corazón en algunos pacientes con infarto miocárdico anterior apical como causa de un nuevo soplo sistólico y de shock cardiogénico. Persiste hasta que se administra una terapia adecuada para reducir la obstrucción del tracto de salida del ventrículo izquierdo204.
Insuficiencia mitral aguda. La insuficiencia mitral aguda se encuentra en aproximadamente un 10% de los pacientes con shock cardiogénico después de un infarto agudo de miocardio205. Ocurre a los 1-14 días (normalmente a los 2-7 días) después del infarto. En la insuficiencia mitral aguda por rotura completa del músculo papilar, la mayoría de los pacientes que no son intervenidos quirúrgicamente mueren dentro de las primeras 24 h.
La rotura parcial de una o más cabezas de los músculos papilares es más frecuente que la rotura completa y se acompaña de una mejor supervivencia. En la mayoría de pacientes, la insuficiencia mitral aguda es secundaria a la disfunción del músculo papilar más que a la rotura. La endocarditis también puede ser una causa de insuficiencia mitral severa y requiere cirugía de reparación.
La insuficiencia mitral aguda severa se manifiesta con edema de pulmón y/o shock cardiogénico. El característico soplo sistólico apical puede estar ausente en pacientes con insuficiencia mitral severa, debido a la elevación abrupta y severa de la presión auricular sistólica. La radiografía de tórax muestra la presencia de congestión pulmonar (que puede ser unilateral). La ecocardiografía permite establecer la presencia y la gravedad de la insuficiencia mitral y facilita la evaluación de la función del ventrículo izquierdo. En general, la aurícula izquierda aparece pequeña o ligeramente aumentada de tamaño. En algunos pacientes es necesario realizar un ecocardiograma transesofágica para establecer el diagnóstico.
El catéter arterial pulmonar puede utilizarse para excluir rotura del septo interventricular; el trazado de presión pulmonar capilar puede mostrar las elevadas ondas V de la insuficiencia mitral. Las presiones de llenado ventricular pueden servir como guía para el manejo del paciente (fig. 7C).
Recomendación de clase IIb, nivel de evidencia C
La mayoría de pacientes necesita un balón de contrapulsación intraaórtico para estabilizarse antes del cateterismo cardíaco y la angiografía. Cuando un paciente desarrolla insuficiencia mitral aguda, la cirugía debe realizarse enseguida porque muchos pacientes experimentan un súbito deterioro o desarrollan otras complicaciones serias206. Los pacientes con insuficiencia mitral aguda severa y edema de pulmón o shock cardiogénico requieren cirugía de urgencia.
Recomendación de clase I, nivel de evidencia C
13. Dispositivos de asistencia mecánica y trasplante cardíaco
13.1. Indicación
La asistencia circulatoria mecánica temporal puede estar indicada en pacientes con insuficiencia cardíaca aguda que no responden al tratamiento convencional y que tienen posibilidad de recuperación miocárdica, o como un puente para el trasplante cardíaco u otras intervenciones que pueden producir una recuperación significativa de la función cardíaca (fig. 8).
Fig. 8. Selección de candidatos para la implantación de dispositivos de asistencia del ventrículo izquierdo. (a) No hay respuesta al tratamiento convencional para la insuficiencia cardíaca aguda, incluido el uso adecuado de diuréticos y fluidos, agentes inotrópicos intravenosos y vasodilatadores. (b) Disfunción de los órganos distales, incluida enfermedad sistémica grave, insuficiencia renal grave, enfermedad pulmonar o disfunción hepática, daño permanente en el sistema nervioso central. (c) Recuperación potencial de la función miocárdica o de la función cardíaca, como la isquemia miocárdica aguda, shock poscardiotomía, miocarditis aguda, enfermedad cardíaca valvular aguda o candidato a trasplante cardíaco. (d) Ausencia de mejoría clínica después de balón de contrapulsación intraaórtico y ventilación mecánica. (e) La indicación final puede depender de la disponibilidad del dispositivo y de la experiencia del equipo de atención cardiovascular.
Recomendación de clase IIb, nivel de evidencia B
El perfeccionamiento del diseño y de la función de los dispositivos permitirá aumentar el número de candidatos potenciales para su uso en el futuro a corto y largo plazo.
Balón de contrapulsación intraaórtico. La contrapulsación se ha convertido en un elemento estándar del tratamiento de pacientes con shock cardiogénico o con insuficiencia cardíaca izquierda aguda grave que: a) no responde de forma rápida a la administración de líquidos, vasodilatación y soporte inotrópico; b) está complicada con una insuficiencia mitral significativa o rotura del septo interventricular, para obtener una estabilización hemodinámica antes de estudios diagnósticos definitivos o tratamiento, o c) se acompaña de isquemia miocárdica grave, en espera de angiografía coronaria y revascularización.
La contrapulsación aórtica sincronizada con balón se realiza inflando y desinflando un balón de 30-50 ml colocado en la aorta torácica a través de la arteria femoral. Al inflar el balón en diástole se aumentan la presión diastólica aórtica y el flujo coronario, mientras que al desinflarlo durante la sístole se disminuye la poscarga y se facilita el vaciamiento del ventrículo izquierdo. El balón de contrapulsación intraaórtico puede mejorar drásticamente el estado hemodinámico, pero su uso debe restringirse a pacientes cuya situación clínica pueda mejorarse (p. ej., mediante revascularización coronaria, reemplazo valvular o trasplante cardíaco) o recuperarse espontáneamente (como en el aturdimiento miocárdico temprano después de infarto de miocardio o cirugía, miocarditis)207. El balón de contrapulsación intraaórtico está contraindicado en pacientes con disección aórtica o insuficiencia aórtica significativa. No debe usarse en pacientes con enfermedad vascular periférica grave, insuficiencia cardíaca de causa no corregible o fallo multiorgánico.
Recomendación de clase I, nivel de evidencia B
Dispositivos de asistencia ventricular. Los dispositivos de asistencia ventricular son bombas mecánicas que reemplazan parcialmente el trabajo mecánico del ventrículo (tabla 14). Descargan el ventrículo y, de esta forma, reducen el trabajo miocárdico y bombean la sangre hacia el sistema arterial, aumentando el flujo periférico y de los órganos distales208-210. Algunos de estos dispositivos incluyen un sistema de oxigenación extracorpórea211. Los nuevos dispositivos que se usan para el tratamiento de la insuficiencia cardíaca crónica (más que la aguda) restringen la progresión de la dilatación ventricular. Recientemente se han desarrollado varios tipos de dispositivos para soporte circulatorio mecánico a corto plazo en pacientes con insuficiencia cardíaca aguda o agudamente descompensada. Algunos dispositivos requieren una esternotomía media y una cirugía compleja. Otros simplemente extraen sangre del sistema arterial, bombeándola nuevamente hacia el sistema vascular arterial o venoso. En algunos p acientes, la mejoría hemodinámica y clínica es espectacular.
Cuando la recuperación de una insuficiencia cardíaca aguda o el trasplante no son posibles, el uso de dispositivos de asistencia ventricular es inaceptable. En un estudio clínico aleatorizado, el tratamiento de pacientes con dispositivos de asistencia del ventrículo izquierdo frente a un tratamiento convencional mejoró el pronóstico de la insuficiencia cardíaca terminal, pero fue un procedimiento caro y se acompañó de infecciones frecuentes y complicaciones trombóticas212. Se necesita experiencia para la implantación de la bomba y sólo debe usarse dentro del marco de un programa institucional. En la tabla 14 se resumen los sistemas utilizados con más frecuencia y sus indicaciones más importantes.
Recomendación de clase IIa, nivel de evidencia B
Las complicaciones más comunes asociadas con el uso de dispositivos de asistencia ventricular son el tromboembolismo, las hemorragias y las infecciones208-210. También son frecuentes la hemólisis y el mal funcionamiento de la bomba.
13.2. Trasplante cardíaco
El trasplante puede considerarse como una posibilidad en la insuficiencia cardíaca aguda severa que se sabe que tiene un mal pronóstico. Es el caso de la miocarditis aguda grave o la miocardiopatía pospuerperal, o el infarto de miocardio extenso con un resultado clínico malo después de la revascularización. Sin embargo, el trasplante no es posible hasta que la situación clínica del paciente se haya estabilizado con ayuda de dispositivos y bombas artificiales (*).
(*) En España, en los últimos años, la indicación de trasplante cardíaco urgente está creciendo. Según los datos del último Registro Español de Trasplante Cardíaco1, en los últimos 5 años el porcentaje medio de trasplante cardíaco urgente fue de un 21%, y aumentó a un 26% en el año 2002 y a un 29% en el año 2003.
1. Almenar Bonet L, en representación de los Grupos Españoles de Trasplante Cardiaco. Registro Español de Trasplante Cardiaco. XV Informe Oficial de la Sección de Insuficiencia Cardíaca, Trasplante y otras alternativas terapéuticas (1984-2003). Rev Esp Cardiol. 2004;57:1197-204.
14. Resumen
El síndrome clínico de insuficiencia cardíaca agud a puede presentarse como un síndrome de novo o como una descompensación de una insuficiencia cardíaca crónica con dominancia anterógrada, izquierda (retrógrada) o derecha (retrógrada) en su presentación clínica.
El paciente con insuficiencia cardíaca aguda requiere una evaluación diagnóstica y cuidados inmediatos, así como medidas frecuentes de resucitación para mejorar los síntomas y la supervivencia.
La evaluación diagnóstica inicial debe incluir el examen clínico apoyado en los antecedentes del paciente, ECG, radiografía de tórax, urea plasmática/NT-proBNP y otras pruebas de laboratorio. La ecocardiografía debe realizarse en todos los pacientes lo antes posible (a menos que se haya realizado recientemente y el resultado esté disponible).
La evaluación clínica inicial debe incluir una evaluación de la precarga, la poscarga y la presencia de insuficiencia mitral u otras complicaciones (incluidas las complicaciones valvulares, la arritmia y las comorbilidades concomitantes, como infecciones, diabetes mellitus, enfermedad respiratoria o renal). Los síndromes coronarios agudos son una causa frecuente de insuficiencia cardíaca aguda y a menudo se requiere una angiografía coronaria.
Después de la evaluación inicial se debe obtener una vía intravenosa, controlar los signos físicos y realizar un ECG y una SPO2. Se debe obtener una vía arterial cuando sea necesario.
El tratamiento inicial de la insuficiencia cardíaca aguda consiste en:
Oxigenación con mascarilla o con CPAP (se debe alcanzar una SPO2 del 94-96%).
Vasodilatación con nitratos o nitroprusiato.
Tratamiento diurético con furosemida u otros diuréticos de asa (bolo inicial intravenoso seguido de infusión intravenosa continua cuando sea necesaria).
Morfina para el alivio del malestar físico y psicológico y para mejorar los parámetros hemodinámicos.
Los líquidos intravenosos deben administrarse si la situación clínica es dependiente de la precarga y hay signos de baja presión de llenado. Esto puede requerir la evaluación de la respuesta frente a una infusión de un volumen determinado de líquido.
Se deben tratar específicamente otras complicaciones metabólicas y orgánicas.
En los pacientes con síndrome coronario agudo u otra complicación cardíaca se deben realizar cateterismo cardíaco y angiografía, con posibilidad de intervención invasiva, incluida la cirugía.
Se debe iniciar un tratamiento médico adecuado con bloqueadores beta y otros fármacos, tal como se describe en este informe.
Se deben administrar otros tratamiento específicos (figs. 5-7; tabla 14) basándose en las características clínicas y hemodinámicas del paciente que no responde al tratamiento inicial. Estos tratamientos incluyen el uso de agentes inotrópicos o sensibilizadores al calcio para la insuficiencia cardíaca descompensada grave, o agentes inotrópicos para el shock cardiogénico.
El objetivo del tratamiento de la insuficiencia cardíaca aguda es corregir la hipoxia y aumentar el gasto cardíaco, la perfusión renal, la excreción de sodio y la diuresis. Pueden ser necesarios otros tratamientos, como la aminofilina intravenosa o el agonista β2 para la broncodilatación. Puede necesitarse ultrafiltración o diálisis en casos de insuficiencia cardíaca refractaria.
Los pacientes con insuficiencia cardíaca refractaria o insuficiencia cardíaca terminal deben ser considerados candidatos para recibir tratamientos adicionales cuando esté indicado (figs. 7 y 8), entre los que se incluyen: balón de contrapulsación intraaórtico, ventilación mecánica artificial o dispositivos de asistencia circulatoria como medida temporal o como puente para el trasplante cardíaco.
El paciente con insuficiencia cardíaca aguda puede recuperarse muy bien, dependiendo de la etiología y de la fisiopatología subyacente. Se requiere un tratamiento prolongado en una unidad con equipamiento y experiencia. Para ello es necesario disponer de un equipo experto en insuficiencia cardíaca que pueda iniciar de forma rápida el manejo médico y atender las necesidades de información del paciente y la familia.
Los comentarios-anotaciones (*) incluidos en esta traducción de las guías han sido realizados por la Dra. María G. Crespo Leiro (La Coruña, España).
aCorrespondencia: Coordinador: Markku S. Nieminen, Division of Cardiology, Helsinki University Central Hospital, Haartmaninkatu 4, 00290 Helsinki, Finland. Tel: +358 9 4717 22 00; fax: +358 9 4717 40 15.
Correo electrónico: markku.nieminen@hus.fi