Palabras clave
INTRODUCCIÓN
Lavalvulopatía más frecuente en Europa en la actualidades la estenosis aórtica1. La supervivencia mediade la estenosis aórtica severa (EAS) sintomática es 2años, y la cirugía de sustitución valvular esel único tratamiento eficaz2,3. No obstante, un30-40% de los pacientes con EAS no son considerados aceptables paracirugía debido a un riesgo quirúrgico demasiadoelevado4.
Los pacientes conEAS rechazados para cirugía tienen escasa supervivencia yuna calidad de vida muy limitada. La valvuloplastiapercutánea surgió como un posible tratamiento paraestos pacientes, pero posteriormente se observó que ofreceunos resultados bastante pobres5. Recientemente se handesarrollado prótesis valvulares aórticasimplantables a través de catéter que constituyenactualmente una alternativa para los pacientes con EAS rechazadospara cirugía6-9.
Presentamos laexperiencia inicial de nuestro centro con la IPPVA(implantación percutánea de prótesisválvular aórtica).
MÉTODOS
Técnica
Actualmente secomercializan dos tipos de prótesis para IPPVA:Edwards-Sapiens (expandible con balón, catéter de22-24 Fr)6-8 y Core-valve (autoexpandible,catéter de 18 Fr)9. Con la Core-valve se hadescrito un aparentemente mayor riesgo de ictus y de necesidad demarcapasos definitivo. En nuestro centro implantamos laprótesis de Edwards-Sapiens, y los aspectos técnicosse referirán a ésta.
El procedimientose puede realizar por vía transfe-moral o transapical, quese reserva para casos con una anatomía del sistemaaortoiliaco desfavorable para la víatransfemoral8. Para evaluar esta anatomía, serealizan aortografía y tomografía computarizada (TC).En los 4 pacientes que presentamos, se realizóimplantación por vía transfemoral.
A través dela arteria femoral, se inserta un introductor 14 Fr y se realizaprimeramente una valvuloplastia percutánea (balón de20 ´ 30mm). Después se introducen dilatadores de 16, 18, 20 y 22 Fry, final-mente, el catéter de la prótesis.
La prótesisEdwards-Sapiens (Edwards Lifesciences Inc, Irvine, California,Estados Unidos) es una malla tubular de acero inoxidable unidainteriormente a tres valvas de pericardio bovino. Estádisponible en diámetros de 23 y 26 mm, que precisan para suimplantación catéteres de 22 y 24 Fr,respectivamente. Antes de su implantación, la válvulase pliega sobre un balón de 30 mm de longitud. Luego seavanza sobre una guía de 0,35" a través de la arteriailiaca, la aorta abdominal, la aorta descendente, el cayadoaórtico y la aorta ascendente, para introducirla en elventrículo izquierdo (abordaje«retrógrado»). El catéter tiene unsistema que permite cambiar la angulación de su parte distalpara adaptarla a la dirección de la aorta torácica,con lo que se evita dañar la pared aórtica y seminimiza el riesgo de ictus embólico.
El correctoposicionamiento de la prótesis previo a suimplantación es clave, y se controla mediante fluoroscopia,ecocardiografía y aortografía. Una vez laprótesis está posicionada correctamente, se implantadurante sobreestimulación con marcapasos transitorio(180-220 lat/min) para evitar su desplazamiento. Si los controlesecocardiográficos posteriores evidencian una correctaimplantación de la prótesis, se procede a retirar laguía y los catéteres.
Durante elprocedimiento, se administra heparina intravenosa (70 UI/kg).Previamente, se administran aspirina y clopidogrel, ydespués se continúa indefinidamente con aspirina a100 mg/día y clopidogrel 75 mg/día durante 1-6meses.
Criterios de inclusión
En la actualidad,los candidatos a IPPVA son aquellos con EAS, síntomasatribuibles a esta valvulopatía y que hayan sido rechazadospara cirugía. Actualmente no se considera indicaciónla simple preferencia del paciente y/o del cardiólogo. Engeneral, el rechazo para la cirugía deberá haber sidopor un índice Euro SCORE > 20% y/o un índice STS(Society of Thoracic Surgeons) > 10%.
Definiciones
Se evaluaron losresultados y los eventos a 30 días (muerte, infarto,cirugía cardiaca, ictus, complicaciones vasculares). Serealizó ecocardiograma transtorácico ytransesofágico antes y después del procedimiento,evaluándose el anillo valvular aórtico, lafracción de eyección, la insuficienciaaórtica, los gradientes transaórticos y elárea valvular. Se consideró éxito delprocedimiento la implantación correcta y normofuncionante dela prótesis (disminución de gradientestransaórtico ≥ 30% y ausencia de insuficienciaaórtica severa), en ausencia de mortalidad durante elprocedimiento.
RESULTADOS
Todos lospacientes tenían una edad avanzada (media [intervalo], 81[77-84] años) y eran varones (tabla 1). Entre lascomorbilidades destacan enfermedad coronaria, insuficiencia renal,infarto reciente, broncopatía crónica ehipertensión pulmonar severa. El índice EuroSCOREmedio fue del 23% y el STS, el 24%.
El procedimientose realizó con anestesia general e intubaciónorotraqueal. Se administraron inotrópicos según fueranecesario para mantener unas condiciones hemodinámicas lomás estables posible.
En 2 pacientes serealizó todo el procedimiento por víapercutánea (cierre con dos dispositivos Prostar de 10 Fr porpaciente). En los otros 2 se realizó exposiciónquirúrgica de la arteria y cierre quirúrgico tras elprocedimiento. Posteriormente, los pacientes fueron trasladados ala unidad de reanimación cardiaca, donde fueronextubados.
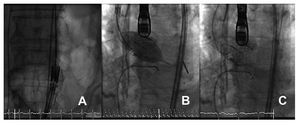
La prótesisfue implantada con éxito en todos los pacientes, sindesplazamiento, insuficiencia aórtica significativa nialteración de los ostium coronarios (fig. 1).
Fig.1. Se muestran diferentes momentos de la intervención.A: la prótesis plegada avanzando por el sistema aortoiliaco.B: momento de la implantación de la prótesis.Obsérvese que en ese momento se está sobreestimulandocon el marcapasos transitorio a una frecuencia de 180-220 lat/min,para obtener una presión arterial sistólica£ 60 mmHg.C: prótesis ya implantada.
No seobservó ninguna complicación en el periodohospitalario tras el procedimiento, excepto un hematoma inguinalsin anemización significativa. El último de lospacientes tratados tenía insuficiencia renal crónicaen programa de hemodiálisis y fibrilación auricularcrónica lenta antes de la implantación de laprótesis aórtica percutánea. Unos díasdespués de la implantación de la prótesis, sedecidió finalmente implantar marcapasos definitivo, pero sinatribuirlo a un bloqueo secundario al IPPVA.
Laevolución a 30 días continuó sin eventos y conmejoría de al menos 1 grado en la clase funcional en todoslos enfermos.
DISCUSIÓN
La EASsintomática ofrece una supervivencia media de 2 años(1 año en caso de que haya clínica de insuficienciacardiaca) y la cirugía es el único tratamiento quemejora el pronóstico y la calidad de vida2,3. Apesar de ello, una tercera parte de estos pacientes son rechazadospara cirugía por un riesgo quirúrgico demasiadoelevado4. La valvuloplastia percutáneasurgió hace más de dos décadas comoalternativa terapéutica en estos pacientes, pero es pocofrecuente obtener un área > 0,8 cm2 y losresultados a medio plazo son pobres, por la reestenosisvalvular5.
Laimplantación de válvulas aórticas mediantecatéter ha sido uno de los sueños de loscardiólogos inter-vencionistas desde hacedécadas10, pero fue la posibilidad de unir valvasbiológicas a un stent metálico lo que permitió que se pudierallevar a cabo. Inicialmente, se realizaron procedimientos enanimales11, y Bonhoeffer et al12 implantaronpor primera vez en humanos válvulas protésicas en laválvula pulmonar. En la válvula aórtica, laprimera prótesis percutánea se implantó enhumanos hace 6 años, más de una décadadespués de que comenzaran las experiencias enanimales.
En 2004, Cribieret al6 publicaron su primera experiencia con 6pacientes, de los que 1 falleció durante el procedimientopor migración de la prótesis durante suimplantación. En los otros 5 casos, el área valvularse incrementó a 1,7 cm2 y los gradientes seredujeron de forma significativa. En esa experiencia inicial, laprótesis se implantó por víaanterógrada, que tiene como principal ventaja que se realizaa través de la vena fe-moral en lugar de por la arteria, conlo que disminuyen las complicaciones vasculares y es posiblerealizar el procedimiento con anestesia local. No obstante, lavía anterógrada es técnicamente máscompleja y puede producir complicaciones en la válvulamitral y cortocircuitos interauriculares. Actualmente, se utilizala vía retrógrada, descrita por Webb etal7. En 50 pacientes con EAS y EuroSCORE del 28%,obtuvieron éxito en el 86% y una mortalidadintraprocedimiento y a 30 días del 2 y el 12%,respectivamante. Un aspecto interesante de ese estudio es que losresultados, respecto a los primeros 25 pacientes, mejoraron en lossiguientes 25. Esto refleja la mejora de los resultados tras lacurva de aprendizaje, que probablemente no se debe sólo afactores técnicos, sino también a la selecciónde los pacientes.
Las seriesposteriores incluyeron a pacientes tratados por víaretrógrada. En el registro REVIVE-I, continuado con elRECAST, la prótesis se implantó con éxito en27 (82%) de 33 pacientes. Actualmente, se ha tratado en el mundo aunos 1.000 pacientes por vía transfemoral con estaprótesis. En el REVIVE-II, con 106 pacientes tratados porvía transfemoral (Euro SCORE medio, 30%), hubo éxitode la implantación en el 88%, mortalidad a 30 díasdel 13,2%, infarto en el 8,5%, eventos neurológicos en el2,8% y complicaciones vasculares en el 13%. Actualmente, seencuentra en fase de reclutamiento el estudio aleatorizado PARTNER,con dos grupos de pacientes. El primero (n = 650) es de pacientescon riesgo quirúrgico relativamente elevado pero aceptadospara cirugía, que son aleatorizados a cirugía o IPPVAcon prótesis de Edwards. El segundo grupo (350 pacientesrechazados para cirugía) es aleatorizado a IPPVA otratamiento médico.
Actualmente, lamayor limitación de la IPPVA son las complicacionesrelacionadas con el acceso vascular. Otras complicaciones son lainsuficiencia perivalvular significativa por expansióninadecuada de la prótesis y el ictus. Probablemente, en elfuturo se diseñarán prótesis que precisen unmenor diámetro de los catéteres, lo que podríafacilitar el procedimiento y reduciría el riesgo decomplicaciones vasculares. Ya hay experiencia con unaprótesis que puede reposicionarse antes deliberarla13, y esto podría disminuir el riesgo dedesplazamiento y mala aposición. Por otra parte, un aspectopendiente es la durabilidad de la prótesis, quedeberá corroborarse con estudios a largo plazo. In vitro, seha demostrado que la función de la prótesis semantiene tras más de 200 millones de latidos, que equivalena más de 5 años de vida. Actualmente, existenpacientes vivos incluso 5 años tras la implantaciónde la prótesis, y en ellos no se han observado signos dedisfunción protésica.
Enconclusión, nuestra experiencia inicial muestra que la IPPVAconstituye una alternativa terapéutica para algunospacientes con EAS rechazados para cirugía.
AGRADECIMIENTOS
A los Dres.Thierry Lefevre y Eulogio García, por tutelar losprocedimientos descritos; a María Paños y Ana SanJuan, enfermeras de la Sección de CardiologíaIntervencionista; a los Dres. Isidro Moreno-Gómez y LuisSuárez, de la Sección de Anestesia yReanimación Cardiovascular; a los Dres. JoséMaría Mesa y Ulises Ramírez, del Servicio deCirugía Cardiaca; a la Dra. Mar Moreno, de la Secciónde Imagen Cardiaca; al Dr. Luis Riera, del Servicio deCirugía Vascular; a los Dres. Esteban López deSá y David Dobarro, del Servicio de Cardiología; aIsabel Muñoz, de Edwards Lifesciences.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. R. Moreno.
Unidad de Cardiología Intervencionista. Servicio deCardiología. Hospital La Paz.
P.o de la Castellana, 261. Hospital General, planta 1.a diagonal.Madrid. España.
Correo electrónico: raulmorenog@terra.es
Recibido el28 de agosto de 2008.
Aceptado para su publicación el 12 de septiembre de2008.