Palabras clave
INTRODUCCIÓN
La muerte cerebral provoca una serie de alteraciones extracraneales. Entre ellas se ha observado que una proporción significativa de potenciales donantes presentan disfunción sistólica ventricular que, cuando es severa, conduce a la no consideración del corazón para el trasplante. El rechazo de estos candidatos a donación hace aún mayor el principal problema que hoy día existe en el trasplante cardíaco: la escasez de donantes. Riou et al1 demostraron que el camino a través del cual se establece la disfunción sistólica del donante es el daño miocárdico. Más aún, el daño miocárdico «menor», que no es capaz de afectar significativamente a la función sistólica y, por tanto, no conduce al rechazo de la víscera para su trasplante, parece que puede aumentar el riesgo de fallo precoz del injerto en el receptor2. La causa de ese daño miocárdico inducido por la muerte cerebral no es aún bien conocida.
El hipotiroidismo es un hallazgo frecuente en los sujetos en muerte cerebral3. El perfil más común es el llamado síndrome de la enfermedad eutiroidea. Este término refleja que el defecto está en la conversión periférica de T4 a T3. Algunos investigadores han concluido que este hipotiroidismo es el causante de las alteraciones cardiovasculares que aparecen en los donantes4-6. Este estudio fue diseñado para analizar la correlación entre el daño miocárdico y el déficit tiroideo en donantes cardíacos. Para cuantificar el daño miocárdico utilizamos TnT y TnI, basados en su elevada especificidad y sensibilidad para este fin7,8.
PACIENTES Y MÉTODO
De un total de 49 trasplantes consecutivos realizados en el Hospital Virgen del Rocío se consideraron 45 donantes. Los 4 casos restantes fueron excluidos por la falta de disponibilidad de suero del donante. Veinticinco de los 45 donantes (58%) eran varones. La edad media era 29 ± 9,3 años (rango: 10-49 años). Las causas de muerte cerebral fueron traumatismo craneal en 30 casos (66,7%), hemorragia intracraneal en 13 casos (28,9%) y ahogamiento en 2 (4,4%). Hubo 32 donantes (71,1%) que precisaron de apoyo inotropo con dopamina, aunque sólo uno de ellos requirió una dosis superior a 10 µg/kg/min. La sangre de los donantes fue extraída en tubos con activador del coágulo justo antes de la cardiectomía y trasladada a nuestro hospital por el equipo extractor junto con la víscera. Una vez en nuestro centro, las muestras eran centrifugadas para la obtención del suero, el cual se congelaba a 70 ºC hasta su procesamiento. Se usó la técnica de enzimoinmunoanálisis para cuantificar tanto la TnT (Elecsys, Boehringer Mannheim), como la TnI (Opus, Behring). Los puntos de corte fueron considerados 0,2 ng/ml para la TnT y 3,1 ng/ml para la TnI, según publicaciones previas7,8. Para comparar las troponinas con marcadores clásicos de daño miocárdico se midieron tanto la creatincinasa (CK) total como su fracción CK-MB. La TSH, T4 libre y T3 libre se analizaron por método inmunorradiométrico (CIS Bio International para la TSH, y DPC para la T4 y la T3). Los rangos de normalidad para la TSH, T4 libre, y T3 libre fueron 0,12-
5 mU/l, 1,5-5 ng/l y 0,7-2,2 µg/l, respectivamente. La comparación cuantitativa de variables se realizó por medio del test de la t de Student y las correlaciones a través de la r de Pearson.
RESULTADOS
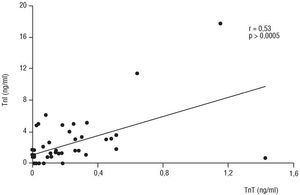
En la tabla 1 se exponen los valores de los marcadores de daño miocárdico y el perfil tiroideo junto con la causa de la muerte cerebral y los requerimientos de dopamina en cada uno de los 45 donantes. Hubo 15 donantes (33,3%) que presentaron elevación de la TnT (0,49 ± 0,35 ng/ml, rango: 0,22-1,43 ng/ml) y 12 casos (27,7%) con elevación de la TnI (6,17 ± 4,21 ng/ml, rango: 3,16-17,7 ng/ml). Ocho donantes presentaron elevación de ambas troponinas, siete sólo de la TnT y cuatro sólo de la TnI. Se observó una correlación significativa, aunque no intensa (fig. 1), entre los valores de TnT y de TnI (r = 0,53, p > 0,0005). La presencia de hipotiroidismo, diagnosticado sobre la base a una T3 libre disminuida, estuvo presente en 39 donantes (86,7%, media: 0,71 ± 0,37 µg/l, rango: 0,1-1,34 µg/l). Veintinueve de los 39 donantes hipotiroideos (74,4%) presentaron el perfil de síndrome de la enfermedad eutiroidea (T3 libre reducida, TSH y T4 libre normales).
Fig. 1. Correlación entre los valores de TnT y TnI. TnT: troponina T; TnI: troponina I.
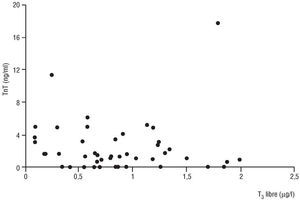
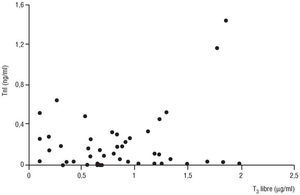
Como se aprecia en las figuras 2 y 3, no se observó ninguna correlación entre las concentraciones de T3 libre y TnT (r = 0,23, p = NS) o TnI (r = 0,05, p = NS). Para asegurar la especificidad de las troponinas como marcadores de daño miocárdico se compararon en dos grupos de donantes: aquellos fallecidos por un traumatismo, donde suele existir gran componente añadido de daño muscular esquelético, y los fallecidos por otras causas (tabla 2). No se apreciaron diferencias en los valores de TnT y TnI en ambos grupos. Sin embargo, sí las hubo en los valores de CK y CK-MB, ambos significativamente mayores en el grupo de muerte cerebral por traumatismo. Finalmente, no se apreció correlación alguna entre la dosis de dopamina requerida y las concentraciones de T3 libre (r = 0,05, p = NS), TnT (r = 0,08, p = NS) y TnI (r = 0, p = NS).
Fig. 2. Ausencia de correlación entre las concentraciones de T3 libre y las de TnT. T3: triyodotironina; TnT: troponina T.
Fig. 3. Ausencia de correlación entre las concentraciones de T3 libre y las de TnI. T3: triyodotironina; TnI: troponina I
DISCUSIÓN
Los resultados de este estudio demuestran que no existe relación entre el daño miocárdico y el hipotiroidismo que acontecen en los donantes en situación de muerte cerebral. El hipotiroidismo es una alteración que afecta a la gran mayoría de los donantes en muerte cerebral. Un 86,7% de los donantes de nuestra serie tuvieron esta alteración, cifra que concuerda con los otros estudios3. Las tres cuartas partes de los donantes hipotiroideos de nuestra serie presentaban el perfil del síndrome de la enfermedad eutiroidea. Novitzky et al4 publicaron que la muerte cerebral supone un cambio de un metabolismo aeróbico a anaeróbico, y que la administración de T3 normaliza esta alteración metabólica y mejora la función cardíaca. También otros autores han comunicado una mejoría en la función cardíaca tras la administración de hormona tiroidea, tanto en el campo experimental5 como en el clínico6. Basados en estos datos, el tratamiento hormonal sustitutivo de los donantes con T3 ha sido recomendado por estos investigadores9.
Al igual que el hipotiroidismo, el daño miocárdico, cuantificado mediante la determinación de troponinas, es también un hallazgo frecuente entre los donantes, de forma que en nuestra serie 19 de los 45 donantes (42,2%) presentaron al menos una troponina elevada. Riou et al1 cuantificaron las concentraciones de TnT en 100 potenciales donantes cardíacos y las relacionaron con la función sistólica ventricular izquierda calculada por ecocardiograma transesofágico, una vez normalizadas las condiciones de carga ventricular. Los autores apreciaron que todos los sujetos con disfunción ventricular tenían evidencia de daño miocárdico. Esta relación no sólo fue cualitativa, sino también cuantitativa, de forma que a mayor elevación de TnT mayor era la depresión de la función sistólica. Por tanto, aunque pudieran existir otros mecanismos, parece que es el daño miocárdico, cuantificado por medio de marcadores como las troponinas, la vía principal por la que se establece la disfunción del músculo cardíaco en donantes.
Según esto, y dada la ausencia de relación entre hipotiroidismo y daño miocárdico observada en nuestro estudio, las alteraciones tiroideas no deben ser la causa primordial de la depresión miocárdica que acontece en la muerte cerebral. De hecho, varios ensayos controlados y aleatorizados han demostrado que no existe un beneficio en tratar con T3 a los donantes10,11. Goarin et al10 no objetivaron mejoría alguna en los parámetros hemodinámicos o en diversos índices sistólicos y volumétricos del ventrículo izquierdo, al comparar el tratamiento con T3 frente a placebo. Esta ausencia de beneficio ocurrió a pesar de la normalización de las concentraciones plasmáticas de T3 en el grupo tratado. Randell et al11 comunicaron resultados similares.
Nuestro trabajo es el primero en investigar desde un punto de vista bioquímico la posible asociación entre el hipotiroidismo y el daño miocárdico en los donantes. El hallazgo de la ausencia de relación entre ambos contrasta con los resultados del estudio de Montero et al12. Estos autores incluyeron a 21 donantes potenciales y analizaron el estado tiroideo cuantificando en biopsias miocárdicas los receptores nucleares de T3 ocupados. El daño miocárdico fue también medido en las biopsias y categóricamente dividido en ligero o severo. El daño ligero se acompañaba de un descenso relativo de receptores T3 ocupados y el daño severo de una ausencia casi completa de receptores ocupados. Dados estos resultados concluyeron afirmativamente sobre una relación entre hipotiroidismo y daño miocárdico en donantes. Probablemente el desacuerdo entre los resultados de Montero et al12 y nuestro estudio sea debido a razones metodológicas. La biopsia endomiocárdica no es un método adecuado para detectar y cuantificar el daño miocárdico. La biopsia ha demostrado una baja rentabilidad diagnóstica en otras situaciones donde también existe daño miocárdico, como la miocarditis13. Esto puede ser debido a que la afección miocárdica no es uniforme y homogénea, sino parcheada. Este tipo de patrón está también presente en el daño miocárdico que se establece en la muerte cerebral14. La mediación de troponinas cardíacas probablemente sea un parámetro más fiel que la biopsia a la hora de reflejar el daño miocárdico global.
La ausencia de correlación entre los requerimientos de dopamina y las concentraciones, no sólo de T3, sino también de troponinas, no es un argumento en contra del papel protagonista del daño miocárdico en la disfunción cardíaca contráctil del donante. Esto es explicable por el hecho de que la hipotensión del donante, la cual conduce al uso de inotropos, no es buen índice de la contractilidad ventricular izquierda, sino que está influida por otros muchos factores como la hipovolemia secundaria a la diabetes insípida, la vasodilatación producida por el calentamiento al que se somete el donante, etc.
CONCLUSIONES
El daño miocárdico y el hipotiroidismo son hallazgos comunes en los donantes, sin que exista una relación entre ambos. Aunque pudieran existir otros mecanismos, parece que es el daño miocárdico, cuantificado por medio de marcadores como las troponinas, la vía principal para el establecimiento de la disfunción del músculo cardíaco en donantes1. Según ello, las alteraciones tiroideas no deben ser la causa primordial de la depresión miocárdica que acontece en la muerte cerebral. Algunos estudios apuntan a que es la liberación de catecolaminas la causante de la afección miocárdica14. Creemos que es necesario un gran esfuerzo investigador en este campo. Si se consiguiera evitar este daño miocárdico se incrementaría la reserva de donantes, dado que estaríamos obviando la disfunción del corazón del sujeto en muerte cerebral. Pero, además, si la asociación entre daño miocárdico «menor» en el donante y disfunción precoz del injerto en el receptor se confirma2, conseguiríamos evitar o al menos mitigar la mayor causa de mortalidad en el primer mes tras el trasplante15,16.
Correspondencia: Dr. J. López Haldón. Servicio de Cardiología. Hospital San Sebastián. Sor Cándida Saiz, 1. 41400 Écija. Sevilla.Correo electrónico: lhaldon@interbook.net. Recibido el 24 de octubre del 2000. Aceptado para su publicación el 27 de diciembre del 2001.