Palabras clave
INTRODUCCIÓN
La trombosis muy tardía (TMT) de stent, aquella que ocurre a partir del año del implante, se ha descrito y estudiado recientemente debido al uso creciente de los stents farmacoactivos (SFA) de primera generación. La incidencia suele ser del 0,4-0,6%/año y el principal mecanismo involucrado en la fisiopatología de la TMT de los SFA es la endotelización incompleta1,2. La TMT de los stents convencionales (SC) es una complicación muy infrecuente fuera del contexto de la braquiterapia y los mecanismos fisiopatológicos subyacentes son poco conocidos3. Nuestro objetivo es profundizar en el conocimiento fisiopatológico de esta complicación mediante la descripción de los hallazgos intravasculares por ecografía intracoronaria (EIC) y su correlación histológica de las muestras extraídas tras trombectomía manual en 5 pacientes con TMT definitiva tras el implante de SC. Asimismo, hacemos una breve revisión de la literatura sobre los hallazgos de EIC de la TMT tras el implante de SC.
MÉTODOS
Se estudió a 5 pacientes en los que el cuadro se inició con un síndrome coronario agudo con elevación del segmento ST secundario a trombosis muy tardía de stent convencional. A todos se les realizó intervencionismo primario urgente. Una vez que la guía de angioplastia atravesó la lesión trombótica, se realizó trombectomía manual con el dispositivo Export (Medtronic). En un caso el catéter no atrevesó la lesión y se dilató con balón. Se realizó estudio con EIC tras trombectomía a 4 pacientes y tras dilatación con balón, a 1 paciente. Con los hallazgos de la EIC se guió el intervencionismo, que finalizó con el implante de stent intra-stent en 4 pacientes y dilatación con balón no distensible exclusivamente en uno. Se administró abciximab en todos los casos y el resultado final fue satisfactorio con flujo TIMI 3 y óptima perfusión miocárdica.
Para el estudio histológico las muestras se fijaron en formaldehído al 4% un mínimo de 7 días, se incluyeron en parafina y se hicieron cortes a 4,3 μm que se tiñeron con hematoxilina-eosina. Se definió trombo reciente al formado por plaquetas y polimorfonucleares aglutinados por fibrina y mezclados con los hematíes. En el trombo más evolucionado se observa una aglutinación más compacta de los polimorfonucleares en los que los núcleos están fragmentados y las plaquetas sustituidas por la fibrina4. Se definió fragmento de placa aterosclerótica como la parte de core necrótico con calcio y presencia de macrófagos con lípidos en su citoplasma.
RESULTADOS
La tabla 1 muestra los hallazgos clínicos, intravasculares e histólogicos de cada paciente. Todos eran varones con una media de edad de 69 ± 11 años y seguían tratamiento indefinido con un antiagregante. Dos casos tuvieron lugar a nivel del segmento medio de la arteria coronaria derecha, 2 casos en el segmento proximal de la primera diagonal y un caso a nivel del segmento medio de la arteria descendente anterior. La media del tiempo transcurrido desde el procedimiento inicial al evento trombótico fue de 7 ± 4 años. El hallazgo angiográfico fue oclusión completa en el stent en todos los pacientes. Los hallazgos por EIC fueron: aterosclerosis de novo con calcificación severa circunferencial y superficial a nivel del stent con úlcera y restos de la cápsula fibrosa indicativos de rotura de placa (fig. 1). Placa compleja con trombo intraluminal en borde distal del stent con proliferación moderada dentro del stent (fig. 2). En otro paciente se observó infraexpansión del stent con proliferación ligera y, por último, en los otros 2 pacientes predominó una proliferación neointimal severa (fig. 3).
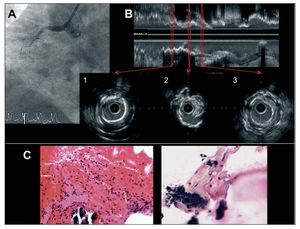
Fig. 1. Corresponde al paciente 1 de la tabla 1. A: angiografía que muestra oclusión completa a nivel del segmento medio de la coronaria derecha. B: imagen de ecografía intracoronaria con reconstrucción longitudinal y cortes transversales. El corte 1 muestra calcificación superficial circunferencial en el stent. El corte 2 muestra placa rota con restos de la cápsula fibrosa y, finalmente, el corte 3 muestra proliferación neointimal ligera. C: fragmentos de trombo con polimorfonucleares con núcleos bien conservados y restos de placa de ateroma (H-E, x200). El calcio se muestra como un material amorfo azulado en torno al cual se observan macrófagos con citoplasma microvacuolado por la presencia de lípidos, correspondientes a placa de ateroma rota (H-E, x400).
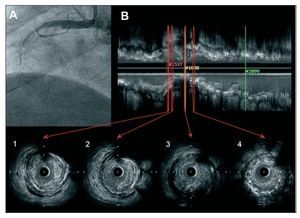
Fig. 2. Corresponde al paciente 2 de la tabla 1. A: angiografía que muestra oclusión completa a nivel del segmento medio de la coronaria derecha. B: imagen de ecografía intracoronaria con reconstrucción longitudinal y cortes transversales. Los cortes 1 a 3 muestran placa compleja con rotura y material trombótico en el borde distal del stent. El corte 4 muestra una proliferación neointimal moderada.
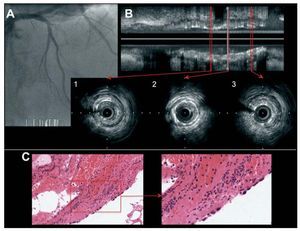
Fig. 3. Corresponde al paciente 4 de la tabla 2. A: angiografía que muestra oclusión completa a nivel proximal de la primera diagonal. B: imagen de ecografía intracoronaria con reconstrucción longitudinal y cortes transversales. Los cortes transversales muestran proliferación neointimal severa con expansión distal insuficiente del stent. C: fragmentos de trombo evolucionado con lisis de los núcleos de los polimorfonucleares y endotelización de la superficie (H-E, x200). A mayor aumento se evidencian células endoteliales de la neoíntima en el stent (H-E, x400).
Los hallazgos histológicos fueron concordantes con los de la EIC. En todos los casos había un trombo reciente, en 2 casos predominaba un trombo de larga evolución, en un caso se pudo extraer restos de placa de ateroma y en otro caso, de proliferación neointimal.
DISCUSIÓN
Los dos mecanismos fisiopatólogicos de la TMT de los SC sugeridos en este estudio son el desarrollo y la progresión de la aterosclerosis de novo en el stent o en sus bordes, así como la proliferación neointimal intra-stent. Estos factores difieren de los mecanismos implicados en la trombosis tardía o muy tardía de los SFA. El principal mecanismo local descrito en las TMT de los SFA son la endotelización incompleta y retrasada del stent, sola o en combinación con una inflamación crónica y reacción de hipersensibilidad que origina un remodelado arterial positivo y una aposición incompleta5,6. Otros factores descritos en la TMT de los SFA es la infraexpansión y la penetración del stent en el core necrótico, principalmente en pacientes con síndrome coronario agudo5,6.
La TMT de los SC es una complicación rara y hay muy pocos casos publicados3,7-12. La tabla 2 muestra los 8 casos que hemos encontrado con descripción de EIC. Nuestra serie con descripción de los hallazgos por EIC e histología es la más larga publicada hasta el momento. En todos los casos comunicados en la literatura el mecanismo subyacente es la proliferación neointimal, excepto en 2 en que el mecanismo descrito es la mala aposición del stent. En nuestra serie la proliferación neointimal fue el hallazgo principal en 3 pacientes, en 2 de ellos se observó una proliferación neointimal severa y en uno era de carácter leve. La estenosis producida por la proliferación neointimal progresiva puede promover la formación de trombo en el stent. Otra explicación que nos parece más improbable, aunque está descrita, es la regresión de la neoíntima y su posible fractura y la formación subsecuente de trombo13.
El otro mecanismo que describimos es la progresión de la aterosclerosis dentro de la neoíntima del stent o en los bordes. No hemos encontrado en la literatura la descripción de rotura por EIC de placa dentro de la neoíntima, aunque sí hay un caso con documentación angiográfica e histológica a partir del material extraído por trombectomía14. Nuestra serie describe un caso con rotura de placa en el contexto de aterosclerosis de novo en la neoíntima intra-stent y otro caso de rotura de placa aterosclerótica en el borde distal del stent. Probablemente la formación y la progresión de la aterosclerosis en la neoíntima del stent requieren del paso de varios años. En los casos de nuestra serie en los que hay aterosclerosis complicada intra-stent o en bordes han pasado 90, 110 y 120 meses. Al contrario, en los casos en que se describe la proliferación neointimal como mecanismo mecánico principal, el retraso hasta el evento fue mucho menor (15 y 63 meses).
A todos los casos de nuestra serie se los estaba tratando con un antiagregante de forma indefinida y con doble antiagregación en el primer mes tras el implante. No está claro que, al contrario de lo que ocurre con los SFA, la prolongación indefinida de la doble antiagregación pueda prevenir las TMT de los SC.
Por último, es importante realizar una técnica de imagen intracoronaria como la EIC para obtener información sobre el mecanismo de la trombosis con vistas al tratamiento percutáneo durante el evento. Así, cuando hay aterosclerosis en el stent o en los bordes y reestenosis grave, el implante de otro stent permite obtener un resultado óptimo. Si lo que predomina es el trombo con reestenosis ligera en relación o no con una expansión insuficiente, se puede optimizar mediante dilatación con balón sin implante de un nuevo stent.
Como conclusión, los hallazgos de este estudio indican que la fisiopatología de la TMT de los SC podría diferir de la de los SFA. La progresión de la aterosclerosis en el stent o en los bordes y la progresión de la proliferación neointimal son los factores principales en el desarrollo de las TMT de los SC.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. Á. Sánchez-Recalde.
Unidad de Hemodinámica y Cardiología Intervencionista. Planta 1.a
Diagonal, Hospital General Universitario La Paz.
P.o de la Castellana, 261. 28046 Madrid. España.
Correo electrónico: recalde@secardiologia.es
Recibido el 2 de noviembre de 2009.
Aceptado para su publicación el 7 de enero de 2010.