La insuficiencia cardiaca (IC) es prevalente en edades avanzadas. Nuestro objetivo es conocer el impacto de la fragilidad en la mortalidad a 1 año en pacientes mayores con IC ambulatorios.
MétodosEl estudio «Impacto de la fragilidad y otros síndromes geriátricos en el manejo clínico y pronóstico del paciente anciano ambulatorio con insuficiencia cardiaca» (FRAGIC) es un registro prospectivo multicéntrico, realizado en 16 centros españoles, que incluyó pacientes con IC ambulatorios de edad ≥ 75 años seguidos por cardiología en España.
ResultadosSe incluyó a 499 pacientes (media de edad, 81,4±4,3 años; 193 [38%] mujeres); 268 (54%) tenían una fracción de eyección del ventrículo izquierdo <40% y el 84,6% estaba en clase funcional II de la NYHA. La escala FRAIL identificó a 244 pacientes prefrágiles (49%) y 111 frágiles (22%). Los pacientes frágiles tenían una media de edad significativamente mayor, eran más frecuentemente mujeres (ambos, p <0,001) y presentaban mayores comorbilidad según el índice de Charlson (p=0,017) y prevalencia de síndromes geriátricos (p <0,001). Tras una mediana de seguimiento de 371 [361-387] días, fallecieron 58 pacientes (11,6%). En el análisis multivariado (modelo de regresión de Cox), la fragilidad mediante la escala FRAIL se asoció marginalmente con la mortalidad (HR=2,35; IC95%, 0,96-5,71; p=0,059); la identificada mediante la escala visual de movilidad (HR=2,26; IC95%, 1,16-4,38; p=0,015) fue predictor independiente de mortalidad, cuya asociación se mantuvo tras ajustar por variables confusoras (HR=2,13; IC95%, 1,08-4,20; p=0,02).
ConclusionesEn pacientes mayores ambulatorios con IC, la fragilidad es predictor independiente de mortalidad a 1 año de seguimiento. Debe identificarse como parte del abordaje integral de estos pacientes.
Palabras clave
La insuficiencia cardiaca (IC) es un problema de salud pública mundial que asocia elevada morbilidad y mortalidad y también un importante consumo de recursos1. Su incidencia aumenta con la edad2, está presente en hasta el 20% de la población de 75 y más años3 y es la primera causa de hospitalización de este grupo de edad en los países desarrollados4,5. Su pronóstico ha mejorado en los últimos años gracias a un mayor conocimiento de la fisiopatología de la enfermedad y a un mejor abordaje terapéutico6. Las recomendaciones actuales destacan la importancia de proporcionar estrategias y tratamientos individualizados, teniendo en cuenta también la situación clínica y las comorbilidades de cada paciente7. Sin embargo, los pacientes de más edad habitualmente están infrarrepresentados o incluso excluidos en los grandes ensayos clínicos3, y las condiciones prevalentes en los pacientes mayores con IC, como la fragilidad, no se evalúan en la práctica clínica habitual a pesar de su marcado impacto pronóstico, pues su identificación permitiría establecer un plan individualizado y adaptado para cada paciente8-10. En nuestro medio, la prevalencia de la fragilidad se ha estudiado en pacientes ingresados por IC aguda y atendidos mayoritariamente por geriatría o medicina interna. Nuestro trabajo es novedoso, pues valora su presencia y su pronóstico en pacientes mayores con IC ambulatoria seguidos exclusivamente por servicios de cardiología en España. Nuestro objetivo es valorar el impacto de la fragilidad en la mortalidad por cualquier causa a 1 año en estos pacientes. También se estudió su influencia en la tasa de ingresos hospitalarios durante el seguimiento.
MÉTODOSDiseño y población de estudioEl estudio «Impacto de la fragilidad y otros síndromes geriátricos en el manejo clínico y pronóstico del paciente anciano ambulatorio con insuficiencia cardiaca» (FRAGIC) es un registro observacional, prospectivo y multicéntrico11 promovido por la Sección de Cardiología Geriátrica de la Sociedad Española de Cardiología. Este estudio fue aprobado por el Comité de la Ética de Investigación con Medicamentos del Hospital de la Princesa, que actuó como centro coordinador. Se incluyó a pacientes de edad ≥ 75 años con diagnóstico de IC según las recomendaciones y guías vigentes en el momento de la inclusión12, en seguimiento ambulatorio por los servicios de cardiología de 16 centros hospitalarios españoles, sin ingresos por IC en el mes previo a la inclusión y que otorgaron el consentimiento informado. Se incluyó a todos los pacientes consecutivos que cumplían dichos criterios de inclusión en el periodo comprendido entre marzo y septiembre de 2019. Los datos se recogieron de manera prospectiva por personal investigador médico y de enfermería entrenado en la valoración geriátrica durante la consulta de IC o en el hospital de día de IC.
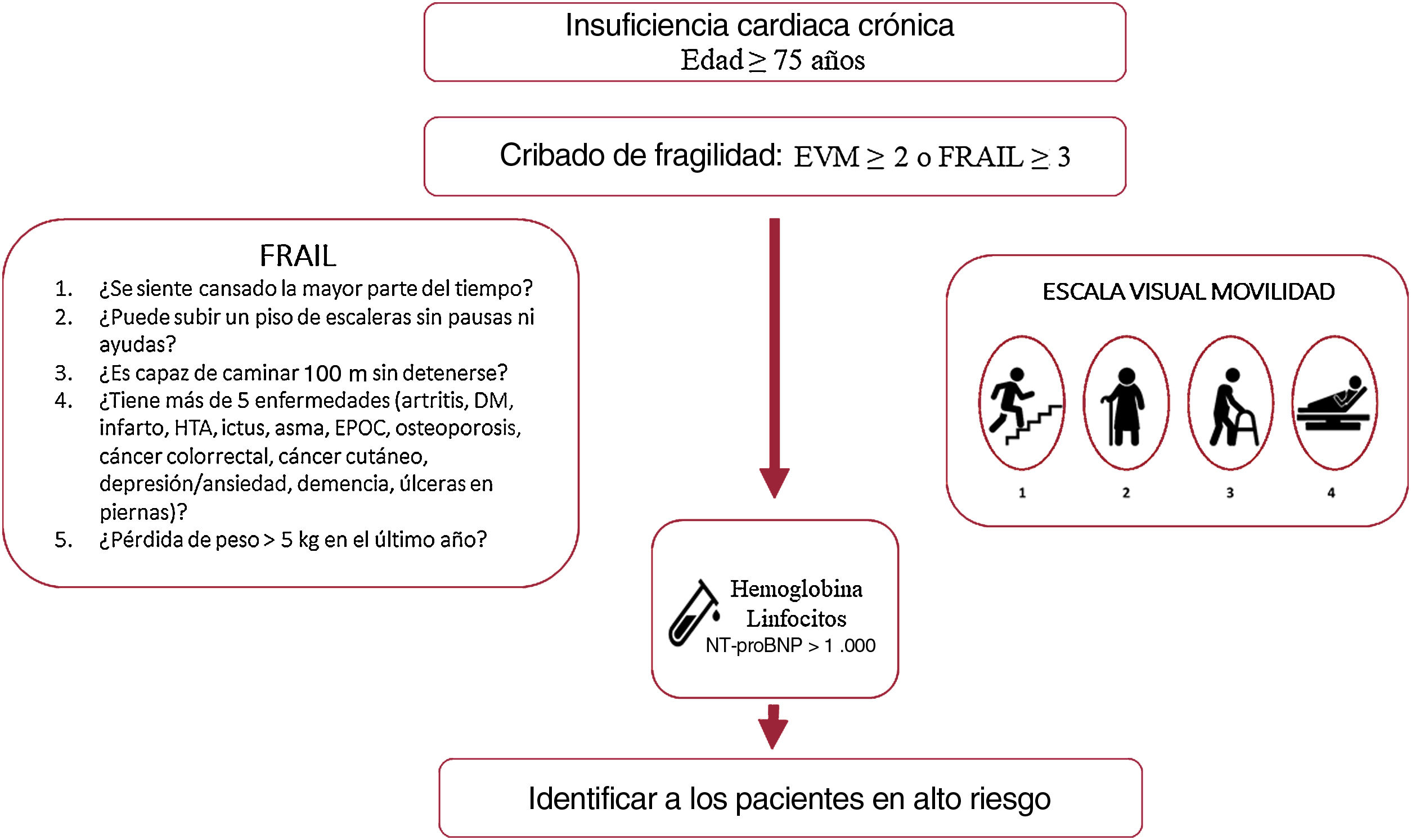
La valoración geriátrica se llevó a cabo durante la primera visita mediante una entrevista con el paciente, sus familiares o cuidadores que incluía:
- •
La capacidad funcional para las actividades básicas de la vida diaria, evaluada mediante el índice de Barthel (dependencia ≤ 60 puntos)13,14.
- •
La capacidad funcional para actividades instrumentales evaluada mediante el índice de Lawton-Brody (independencia total, 8 puntos)15.
- •
El estado cognitivo evaluado mediante la prueba de Pfeiffer (deterioro cognitivo si ≥ 3 puntos)16.
- •
La prueba de rendimiento físico, evaluado mediante el Short Physical Performance Battery (SPPB)17. Una puntuación <10 identifica a pacientes con fragilidad física.
- •
Fragilidad valorada con diversas escalas:
- –
Escala FRAIL: la fragilidad se definió con una puntuación ≥ 3 y prefrágil con 1-218.
- –
Preguntas autorreferidas según el fenotipo de fragilidad (adaptación de los criterios de Fried): se definió fragilidad como una puntuación ≥ 319.
- –
Clinical Frailty Scale: se definió fragilidad con una puntuación ≥ 420.
- –
Escala visual de movilidad: se definió fragilidad con una puntuación ≥ 2. Se utilizó una escala visual de movilidad basada en el trabajo de Martínez-Sánchez et al5.
- •
La comorbilidad se evaluó mediante el índice de Charlson21.
- •
Número de fármacos prescritos de por vida.
- •
Evaluación del riesgo nutricional evaluado mediante el Mini Nutritional Assessment Short Form (MNA-SF). Una puntuación ≥ 12 se consideró un estado nutricional normal22.
- •
Cribado de depresión con la prueba de Yesavage. Se diagnosticó de depresión con una puntuación ≥ 5 en la escala de 15 ítems23.
- •
Calidad de vida, analizada por una escala visual analógica, con valores entre 0 y 10. Valores más bajos indican peor calidad de vida. Además se aplicó una escala autorreferida graduada del 1 al 5 (1, pobre; 2, aceptable; 3, buena; 4, muy buena, y 5, excelente).
La información detallada de las escalas de fragilidad utilizadas se muestra en el material adicional.
La situación funcional se evaluó según la escala de la New York Heart Association (NYHA). El seguimiento clínico para detectar eventos se llevó a cabo también por personal investigador mediante visita presencial, revisión de historias clínicas o contacto telefónico con el paciente o sus familiares al menos cada 2 años, sin perjuicio del seguimiento clínico habitual. Se recogieron la mortalidad total y la necesidad de hospitalización urgente por cualquier causa (duración> 24 h).
Principios éticosLa inclusión en el estudio FRAGIC no implicó cambio en el tratamiento clínico de los pacientes, que se llegó a cabo según la práctica clínica habitual y las recomendaciones de las guías de práctica clínica vigentes12. El estudio cumplió con los principios de la declaración de Helsinki y fue aprobado por el Comité de la Ética de Investigación con Medicamentos del Hospital de la Princesa.
Análisis estadísticoSe utilizaron porcentajes para representar las variables categóricas; para las variables continuas, se utilizó la media±desviación estándar. La comparación univariante entre cada variable independiente y la escala FRAIL, utilizada como referencia por su sencillez y reproducibilidad, se evaluó mediante un ANOVA o un Kruskall-Wallis, según procediera. La supervivencia específica de la enfermedad o el evento acumulado de ingreso por cualquier causa y mortalidad se obtuvieron mediante el método de Kaplan-Meier. La comparación de las distribuciones de supervivencia se realizó mediante log-rank test. Para construir el modelo predictivo, se llevó a cabo un procedimiento secuencial. En primer lugar, utilizando los resultados derivados del log-rank test, se seleccionaron las variables que presentaban diferencias estadísticamente significativas (p <0,001); este valor se seleccionó debido al gran número de variables y, por lo tanto, de comparaciones para evitar el error de tipo I, es decir, la obtención de falsos positivos. A continuación, utilizando la regresión de Cox (análisis multivariante), se ajustó un modelo predictivo. A fin de evitar la colinealidad existente entre las distintas escalas de fragilidad, se realizó una regresión de Cox para cada una ellas, incluyendo en cada caso las variables significativas en el log-rank test y la escala de fragilidad correspondiente. Dichos modelos se ajustaron por variables confusoras: edad, sexo, fracción de eyección del ventrículo izquierdo (FEVI), número de ingresos en el último año, presión arterial sistólica, filtrado glomerular, tratamiento con inhibidores de la enzima de conversión de la angiotensina/antagonistas del receptor de la angiotensina II (IECA/ARA-II), bloqueadores beta, antagonistas del receptor de mineralocorticoides y diuréticos y por el índice de comorbilidad de Charlson. Este ajuste se hizo también teniendo en cuenta la colinealidad. Los datos se analizaron utilizando nuestros propios códigos y funciones base en R, versión 4.0.3 (The R Foundation for Statistical Computing, Austria).
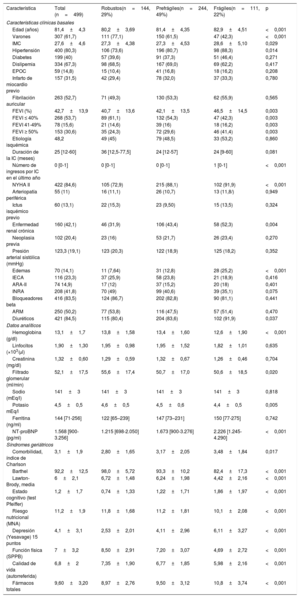
RESULTADOSSe incluyó a 499 pacientes. La media de edad fue 81,4±4,3 años y el 38% eran mujeres. La mediana de la duración de la IC desde el diagnóstico, previo a la inclusión, fue de 25 [12-60] meses. La mayoría de los pacientes (85%) se encontraban en NYHA II (solo el 0,2% en NYHA III-IV). La FEVI promedio fue del 43% y el 54% de los pacientes tenían una FEVI <40% (en la tabla 1 del material adicional se muestra el subanálisis de las características basales por categorías de FEVI de los pacientes incluidos en el registro). La cardiopatía isquémica fue la principal causa de IC (48%). La fragilidad, estimada por la escala FRAIL, identificó un 22% de pacientes frágiles y un 49% de prefrágiles. Las principales características de los pacientes distribuidas en función de la fragilidad se muestran en la tabla 1. Los pacientes frágiles y prefrágiles eran con mayor frecuencia mujeres y tenían una media de edad superior; los pacientes más frágiles presentaban significativamente mayor comorbilidad y síndromes geriátricos. Los pacientes frágiles presentaban una situación funcional significativamente peor, más datos congestivos a la exploración física y mayores FEVI y valores de la fracción aminoterminal del propéptido natriurético cerebral (tipo B) (NT-proBNP). Además, la fragilidad identificó a pacientes con mayor número de ingresos por IC en el último año.
Características basales de los pacientes según el grado de fragilidad en la escala FRAIL
| Característica | Total (n=499) | Robustos(n=144, 29%) | Prefrágiles(n=244, 49%) | Frágiles(n=111, 22%) | p |
|---|---|---|---|---|---|
| Características clínicas basales | |||||
| Edad (años) | 81,4±4,3 | 80,2±3,69 | 81,4±4,35 | 82,9±4,51 | <0,001 |
| Varones | 307 (61,7) | 111 (77,1) | 150 (61,5) | 47 (42,3) | <0,001 |
| IMC | 27,6±4,6 | 27,3±4,38 | 27,3±4,53 | 28,6±5,10 | 0,029 |
| Hipertensión | 400 (80,3) | 106 (73,6) | 196 (80,7) | 98 (88,3) | 0,014 |
| Diabetes | 199 (40) | 57 (39,6) | 91 (37,3) | 51 (46,4) | 0,271 |
| Dislipemia | 334 (67,3) | 98 (68,5) | 167 (69,0) | 69 (62,2) | 0,417 |
| EPOC | 59 (14,8) | 15 (10,4) | 41 (16,8) | 18 (16,2) | 0,208 |
| Infarto de miocardio previo | 157 (31,5) | 42 (29,4) | 78 (32,0) | 37 (33,3) | 0,780 |
| Fibrilación auricular | 263 (52,7) | 71 (49,3) | 130 (53,3) | 62 (55,9) | 0,565 |
| FEVI (%) | 42,7±13,9 | 40,7±13,6 | 42,1±13,5 | 46,5±14,5 | 0,003 |
| FEVI ≤ 40% | 268 (53,7) | 89 (61,1) | 132 (54,3) | 47 (42,3) | 0,003 |
| FEVI 41-49% | 78 (15,6) | 21 (14,6) | 39 (16) | 18 (16,2) | 0,003 |
| FEVI ≥ 50% | 153 (30,6) | 35 (24,3) | 72 (29,6) | 46 (41,4) | 0,003 |
| Etiología isquémica | 48,2 | 49 (45) | 79 (48,5) | 33 (53,2) | 0,860 |
| Duración de la IC (meses) | 25 [12-60] | 36 [12,5-77,5] | 24 [12-57] | 24 [9-60] | 0,081 |
| Número de ingresos por IC en el último año | 0 [0-1] | 0 [0-1] | 0 [0-1] | 1 [0-1] | <0,001 |
| NYHA II | 422 (84,6) | 105 (72,9) | 215 (88,1) | 102 (91,9) | <0,001 |
| Arteriopatía periférica | 55 (11) | 16 (11,1) | 26 (10,7) | 13 (11,8/) | 0,949 |
| Ictus isquémico previo | 60 (13,1) | 22 (15,3) | 23 (9,50) | 15 (13,5) | 0,324 |
| Enfermedad renal crónica | 160 (42,1) | 46 (31,9) | 106 (43,4) | 58 (52,3) | 0,004 |
| Neoplasia previa | 102 (20,4) | 23 (16) | 53 (21,7) | 26 (23,4) | 0,270 |
| Presión arterial sistólica (mmHg) | 123,3 (19,1) | 123 (20,3) | 122 (18,9) | 125 (18,2) | 0,352 |
| Edemas | 70 (14,1) | 11 (7,64) | 31 (12,8) | 28 (25,2) | <0,001 |
| IECA | 116 (23,3) | 37 (25,9) | 58 (23,8) | 21 (18,9) | 0,416 |
| ARA-II | 74 14,9) | 17 (12) | 37 (15,2) | 20 (18) | 0,401 |
| INRA | 208 (41,8) | 70 (49) | 99 (40,6) | 39 (35,1) | 0,075 |
| Bloqueadores beta | 416 (83,5) | 124 (86,7) | 202 (82,8) | 90 (81,1) | 0,441 |
| ARM | 250 (50,2) | 77 (53,8) | 116 (47,5) | 57 (51,4) | 0,470 |
| Diuréticos | 421 (84,5) | 115 (80,4) | 204 (83,6) | 102 (91,9) | 0,037 |
| Datos analíticos | |||||
| Hemoglobina (g/dl) | 13,1±1,7 | 13,8±1,58 | 13,4±1,60 | 12,6±1,90 | <0,001 |
| Linfocitos (×103/μl) | 1,90±1,30 | 1,95±0,98 | 1,95±1,52 | 1,82±1,01 | 0,635 |
| Creatinina (mg/dl) | 1,32±0,60 | 1,29±0,59 | 1,32±0,67 | 1,26±0,46 | 0,704 |
| Filtrado glomerular (ml/min) | 52,1±17,5 | 55,6±17,4 | 50,7±17,0 | 50,6±18,5 | 0,020 |
| Sodio (mEq/l) | 141±3 | 141±3 | 141±3 | 141±3 | 0,818 |
| Potasio mEq/l | 4,5±0,5 | 4,6±0,5 | 4,5±0,6 | 4,4±0,5 | 0,005 |
| Ferritina (ng/ml) | 144 [71-256] | 122 [65–239] | 147 [73–231] | 150 [77-275] | 0,742 |
| NT-proBNP (pg/ml) | 1.568 [900-3.256] | 1.215 [698-2.050] | 1.673 [900-3.276] | 2.226 [1.245-4.290] | <0,001 |
| Síndromes geriátricos | |||||
| Comorbilidad, índice de Charlson | 3,1±1,9 | 2,80±1,65 | 3,17±2,05 | 3,48±1,84 | 0,017 |
| Barthel | 92,2±12,5 | 98,0±5,72 | 93,3±10,2 | 82,4±17,3 | <0,001 |
| Lawton-Brody, media | 6±2,1 | 6,72±1,48 | 6,24±1,98 | 4,42±2,16 | <0,001 |
| Estado cognitivo (test Pfeiffer) | 1,2±1,7 | 0,74±1,33 | 1,22±1,71 | 1,86±1,97 | <0,001 |
| Riesgo nutricional (MNA) | 11,2±1,9 | 11,8±1,68 | 11,2±1,81 | 10,1±2,08 | <0,001 |
| Depresión (Yesavage) 15 puntos | 4,1±3,1 | 2,53±2,01 | 4,11±2,96 | 6,11±3,27 | <0,001 |
| Función física (SPPB) | 7±3,2 | 8,50±2,91 | 7,20±3,07 | 4,69±2,72 | <0,001 |
| Calidad de vida (autorreferida) | 6,8±2 | 7,35±1,90 | 6,77±1,85 | 5,98±2,16 | <0,001 |
| Fármacos totales | 9,60±3,20 | 8,97±2,76 | 9,50±3,12 | 10,8±3,74 | <0,001 |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; CFS: Clinical Frailty Scale; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; INRA: inhibidores duales de la neprilisina y del receptor de la angiotensina; MNA-SF: Mini Nutritional Assessment Short Form; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral (tipo B); NYHA: clase funcional de la New York Heart Association; SPPB: Short Physical Performance Battery.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
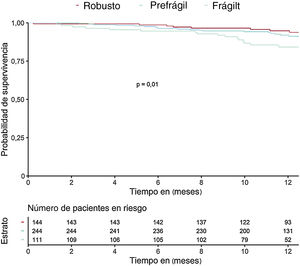
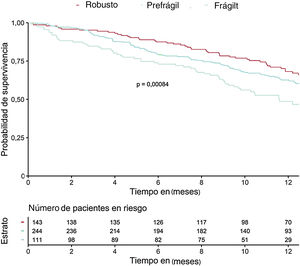
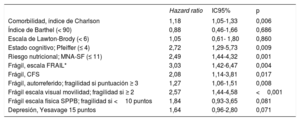
Durante una mediana de seguimiento de 371 [361-387] días, fallecieron 58 pacientes (11,6%); la mortalidad no cardiovascular fue la principal causa de muerte (34 pacientes, 58%). La IC fue la principal causa de mortalidad cardiovascular (13 pacientes, 22%). En la tabla 2 se muestra la asociación de los síndromes geriátricos con la mortalidad a 1 año de seguimiento. Se asociaron con la mortalidad la fragilidad, el riesgo nutricional, la presencia de comorbilidad y el deterioro cognitivo.
Asociación entre los síndromes geriátricos y la mortalidad a 1 año
| Hazard ratio | IC95% | p | |
|---|---|---|---|
| Comorbilidad, índice de Charlson | 1,18 | 1,05-1,33 | 0,006 |
| Índice de Barthel (< 90) | 0,88 | 0,46-1,66 | 0,686 |
| Escala de Lawton-Brody (< 6) | 1,05 | 0,61- 1,80 | 0,860 |
| Estado cognitivo; Pfeiffer (≤ 4) | 2,72 | 1,29-5,73 | 0,009 |
| Riesgo nutricional; MNA-SF (≤ 11) | 2,49 | 1,44-4,32 | 0,001 |
| Frágil, escala FRAIL* | 3,03 | 1,42-6,47 | 0,004 |
| Frágil, CFS | 2,08 | 1,14-3,81 | 0,017 |
| Frágil, autorreferido; fragilidad si puntuación ≥ 3 | 1,27 | 1,06-1,51 | 0,008 |
| Frágil escala visual movilidad; fragilidad si ≥ 2 | 2,57 | 1,44-4,58 | <0,001 |
| Frágil escala física SPPB; fragilidad si <10 puntos | 1,84 | 0,93-3,65 | 0,081 |
| Depresión, Yesavage 15 puntos | 1,64 | 0,96-2,80 | 0,071 |
CFS: Clinical Frailty Scale; MNA-SF: Mini Nutritional Assessment Short Form; SPPB: Short Physical Performance Battery.
La asociación de los componentes de la escala FRAIL con la mortalidad a 1 año se recogen en la tabla 7 del material adicional.
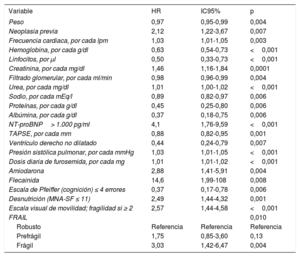
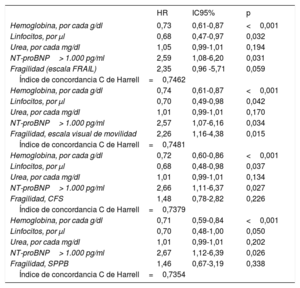
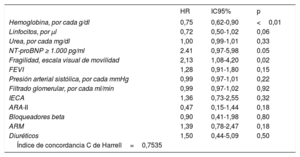
En la tabla 3 se muestran las variables que presentaron una asociación con la mortalidad al año de seguimiento en el análisis univariado (se muestran las variables con p <0,01). Las incidencias de mortalidad y mortalidad o reingreso hospitalario en los pacientes atendiendo a la presencia de fragilidad se muestran en la figura 1 y la figura 2 respectivamente. Los pacientes frágiles tuvieron mayor mortalidad durante el seguimiento y también con más frecuencia el objetivo combinado de muerte o ingreso hospitalario. En el análisis multivariado, la fragilidad identificada mediante la escala visual de movilidad fue uno de los predictores independientes de mortalidad (hazard ratio [HR]=2,26; intervalo de confianza del 95% [IC95%], 1,16-4,38; p=0,015), mientras que fue marginal la asociación de la fragilidad mediante la escala FRAIL (HR=2,35; IC95%, 0,96-5,71; p=0,059) (tabla 4). Tras ajustar por variables confusoras, la escala visual de movilidad se mantuvo como predictor independiente de mortalidad a 1 año de seguimiento (HR=2,13, IC95%, 1,08-4,20; p=0,02) (tabla 5).
Variables asociadas con la mortalidad a 1 año de seguimiento
| Variable | HR | IC95% | p |
|---|---|---|---|
| Peso | 0,97 | 0,95-0,99 | 0,004 |
| Neoplasia previa | 2,12 | 1,22-3,67 | 0,007 |
| Frecuencia cardiaca, por cada lpm | 1,03 | 1,01-1,05 | 0,003 |
| Hemoglobina, por cada g/dl | 0,63 | 0,54-0,73 | <0,001 |
| Linfocitos, por μl | 0,50 | 0,33-0,73 | <0,001 |
| Creatinina, por cada mg/dl | 1,46 | 1,16-1,84 | 0,0001 |
| Filtrado glomerular, por cada ml/min | 0,98 | 0,96-0,99 | 0,004 |
| Urea, por cada mg/dl | 1,01 | 1,00-1,02 | <0,001 |
| Sodio, por cada mEq/l | 0,89 | 0,82-0,97 | 0,006 |
| Proteínas, por cada g/dl | 0,45 | 0,25-0,80 | 0,006 |
| Albúmina, por cada g/dl | 0,37 | 0,18-0,75 | 0,006 |
| NT-proBNP> 1.000 pg/ml | 4,1 | 1,76-9,59 | <0,001 |
| TAPSE, por cada mm | 0,88 | 0,82-0,95 | 0,001 |
| Ventrículo derecho no dilatado | 0,44 | 0,24-0,79 | 0,007 |
| Presión sistólica pulmonar, por cada mmHg | 1,03 | 1,01-1,05 | <0,001 |
| Dosis diaria de furosemida, por cada mg | 1,01 | 1,01-1,02 | <0,001 |
| Amiodarona | 2,88 | 1,41-5,91 | 0,004 |
| Flecainida | 14,6 | 1,99-108 | 0,008 |
| Escala de Pfeiffer (cognición) ≤ 4 errores | 0,37 | 0,17-0,78 | 0,006 |
| Desnutrición (MNA-SF ≤ 11) | 2,49 | 1,44-4,32 | 0,001 |
| Escala visual de movilidad; fragilidad si ≥ 2 | 2,57 | 1,44-4,58 | <0,001 |
| FRAIL | 0,010 | ||
| Robusto | Referencia | Referencia | Referencia |
| Prefrágil | 1,75 | 0,85-3,60 | 0,13 |
| Frágil | 3,03 | 1,42-6,47 | 0,004 |
MNA-SF: Mini Nutritional Assessment Short Form; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral (tipo B); TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo.
Análisis univariado. Se muestran las variables con p <0,01.
Predictores independientes de mortalidad a 1 año con cada una de las escalas de fragilidad
| HR | IC95% | p | |
|---|---|---|---|
| Hemoglobina, por cada g/dl | 0,73 | 0,61-0,87 | <0,001 |
| Linfocitos, por μl | 0,68 | 0,47-0,97 | 0,032 |
| Urea, por cada mg/dl | 1,05 | 0,99-1,01 | 0,194 |
| NT-proBNP> 1.000 pg/ml | 2,59 | 1,08-6,20 | 0,031 |
| Fragilidad (escala FRAIL) | 2,35 | 0,96 -5,71 | 0,059 |
| Índice de concordancia C de Harrell=0,7462 | |||
| Hemoglobina, por cada g/dl | 0,74 | 0,61-0,87 | <0,001 |
| Linfocitos, por μl | 0,70 | 0,49-0,98 | 0,042 |
| Urea, por cada mg/dl | 1,01 | 0,99-1,01 | 0,170 |
| NT-proBNP> 1.000 pg/ml | 2,57 | 1,07-6,16 | 0,034 |
| Fragilidad, escala visual de movilidad | 2,26 | 1,16-4,38 | 0,015 |
| Índice de concordancia C de Harrell=0,7481 | |||
| Hemoglobina, por cada g/dl | 0,72 | 0,60-0,86 | <0,001 |
| Linfocitos, por μl | 0,68 | 0,48-0,98 | 0,037 |
| Urea, por cada mg/dl | 1,01 | 0,99-1,01 | 0,134 |
| NT-proBNP> 1.000 pg/ml | 2,66 | 1,11-6,37 | 0,027 |
| Fragilidad, CFS | 1,48 | 0,78-2,82 | 0,226 |
| Índice de concordancia C de Harrell=0,7379 | |||
| Hemoglobina, por cada g/dl | 0,71 | 0,59-0,84 | <0,001 |
| Linfocitos, por μl | 0,70 | 0,48-1,00 | 0,050 |
| Urea, por cada mg/dl | 1,01 | 0,99-1,01 | 0,202 |
| NT-proBNP> 1.000 pg/ml | 2,67 | 1,12-6,39 | 0,026 |
| Fragilidad, SPPB | 1,46 | 0,67-3,19 | 0,338 |
| Índice de concordancia C de Harrell=0,7354 | |||
CFS: Clinical Frailty Scale; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral (tipo B); SPPB: Short Physical Performance Battery.
Predictores independientes de mortalidad a 1 año tras ajustar por variables confusoras
| HR | IC95% | p | |
|---|---|---|---|
| Hemoglobina, por cada g/dl | 0,75 | 0,62-0,90 | <0,01 |
| Linfocitos, por μl | 0,72 | 0,50-1,02 | 0,06 |
| Urea, por cada mg/dl | 1,00 | 0,99-1,01 | 0,33 |
| NT-proBNP ≥ 1.000 pg/ml | 2.41 | 0,97-5,98 | 0.05 |
| Fragilidad, escala visual de movilidad | 2,13 | 1,08-4,20 | 0,02 |
| FEVI | 1,28 | 0,91-1,80 | 0,15 |
| Presión arterial sistólica, por cada mmHg | 0,99 | 0,97-1,01 | 0,22 |
| Filtrado glomerular, por cada ml/min | 0,99 | 0,97-1,02 | 0,92 |
| IECA | 1,36 | 0,73-2,55 | 0,32 |
| ARA-II | 0,47 | 0,15-1,44 | 0,18 |
| Bloqueadores beta | 0,90 | 0,41-1,98 | 0,80 |
| ARM | 1,39 | 0,78-2,47 | 0,18 |
| Diuréticos | 1,50 | 0,44-5,09 | 0,50 |
| Índice de concordancia C de Harrell=0,7535 |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral (tipo B).
El análisis multivariado con los factores de confusión de las otras escalas de fragilidad utilizadas se muestra en las tablas 8-10 del material adicional.
Por otro lado, 164 pacientes (32,8%) ingresaron durante el seguimiento. Las variables asociadas con el ingreso por cualquier causa en los análisis univariado y multivariado se recogen en las tablas 2-5 del material adicional. Las variables que se asociaron de manera independiente con la hospitalización fueron la presencia de crepitantes, la dosis diaria de furosemida y la fragilidad (en este caso identificada mediante la escala Clinical Frailty).
DISCUSIÓNLos principales resultados de nuestro trabajo son: a) la prevalencia de la fragilidad es elevada en la población de pacientes de edad ≥ 75 años con IC ambulatoria seguida por especialistas de cardiología en España, y b) la fragilidad se asocia de manera independiente con la mortalidad total y la hospitalización por cualquier causa a 1 año de seguimiento.
Las sociedades occidentales actuales están cada vez más envejecidas y se espera que esta tendencia continúe en los próximos años. La prevalencia de los síndromes geriátricos y especialmente la fragilidad aumentan en nuestro entorno, por lo que se recomienda su evaluación, dado su impacto pronóstico en distintas situaciones clínicas8,24,25. La fragilidad se define como una disminución de la reserva biológica asociada con el envejecimiento, lo que conlleva una mayor vulnerabilidad del individuo frente a situaciones estresantes8. Disponer de medios (fiables y fáciles de utilizar por el clínico) para identificarla resulta fundamental, en gran medida para planificar estrategias de intervención en ella y adaptar también los cuidados a las características de cada paciente. Su estimación no es fácil, dado que existen 2 aproximaciones diferentes. Una vertiente considera la fragilidad como un fenotipo de mal funcionamiento físico y, por ende, utiliza para definirla variables físicas objetivas, como son la velocidad de la marcha y la fuerza de prensión, y está representada por la escala Fried19 y la Short Physical Performance Battery (SPPB)17. Otra vertiente considera la fragilidad como una entidad multidimensional consecuencia de la acumulación de déficits; las escalas más utilizadas en esta definición son la Clinical Frailty20 y la FRAIL18. La escala FRAIL, por su sencillez, es fácil de utilizar en la práctica clínica diaria.
En nuestro medio y en el ámbito de la IC, la fragilidad y la discapacidad se han estudiado mayoritariamente en pacientes atendidos por geriatría o medicina interna durante la hospitalización por IC aguda5,26–28. En el registro RICA26, Chivite et al. analizaron a 2.195 pacientes de edad ≥ 75 años ingresados por IC aguda en los servicios de medicina interna de varios hospitales nacionales. En su mayoría (57%) presentaban discapacidad moderada o grave para las actividades de la vida diaria evaluada mediante el índice de Barthel, y la discapacidad se asoció con mayor mortalidad por cualquier causa al año de seguimiento26. En ese trabajo no se valoraron la fragilidad u otros síndromes geriátricos. Por su parte, Rodríguez-Pascual et al. estudiaron el impacto pronóstico de la fragilidad, empleando la definición de fragilidad de Fried, en 497 pacientes de 75 o más años tras un ingreso por IC aguda y seguidos por geriatría. El 57% de los pacientes eran frágiles y presentaban significativamente más mortalidad, reingresos o deterioro funcional al año de seguimiento27. Por último, Vidán et al. incluyeron a 416 pacientes de edad ≥ 70 años, también hospitalizados por IC en servicios de geriatría, medicina interna y cardiología. Se identificó al 76% como frágiles (no se distinguió entre pacientes robustos y prefrágiles) según la escala de Fried, pacientes estos que presentaban más mortalidad y reingresos28.
Por su parte, los trabajos que evalúan la prevalencia y el pronóstico de la fragilidad en pacientes con IC ambulatoria son muy escasos. Cacciatore et al. estudiaron la asociación de la fragilidad en 120 pacientes con IC ambulatoria seguidos por geriatría (media de edad, 74±6,3 años) en un único centro. La fragilidad, definida mediante el Frailty Staging System (FSS) se asoció con mayor mortalidad en el seguimiento29. En nuestro medio, Lupon et al. observaron, de nuevo en un estudio unicéntrico, mayor mortalidad en los pacientes que presentaban síndromes geriátricos seguidos en una unidad de IC ambulatoria30. La principal limitación de estos trabajos, aparte de ser monocéntricos, es la definición de fragilidad como una combinación de ítems diferentes entre sí, en ocasiones escasamente relacionados, y que se aproximan más a la definición de discapacidad que a la de fragilidad31.
Nuestro trabajo es novedoso porque, a diferencia de estudios previos, el registro FRAGIC es el primer estudio prospectivo y multicéntrico realizado en nuestro país en el que, además, todos los pacientes incluidos estaban en seguimiento ambulatorio (IC crónica sin ingresos recientes) por servicios de cardiología. Este es un aspecto muy relevante, dado que la valoración de la fragilidad y otros síndromes geriátricos varía según la situación clínica del paciente, aguda o crónica, y la pérdida de funcionalidad coincidiendo con el ingreso hospitalario está ampliamente documentada. De este modo, la inclusión ambulatoria proporciona una perspectiva en la vida real de la población en estudio, además de ser el ámbito recomendado para valorar la fragilidad8. Por otro lado, las características basales de nuestra población no difieren sustancialmente de las de estudios previos llevados a cabo en el ámbito de la geriatría o la medicina interna26–28, si bien en nuestro estudio los porcentajes de mujeres y de pacientes con IC de etiología no isquémica fueron menores. Además, la mortalidad observada en nuestro estudio durante el seguimiento fue menor (las principales características de los distintos estudios en comparación con nuestro trabajo se recogen en la tabla 6 del material adicional). En consecuencia, los pacientes mayores con IC seguidos actualmente por cardiología presentan características y complejidad similares a las de los seguidos por otros especialistas, a diferencia de lo señalado en trabajos previos32–34, en los que se relacionaba un mejor pronóstico en los pacientes seguidos por cardiología según unas características basales más favorables y quizás también por la mayor prescripción de tratamiento médico óptimo o tratamientos avanzados35. A raíz de nuestros resultados, parecen necesarios más estudios al respecto.
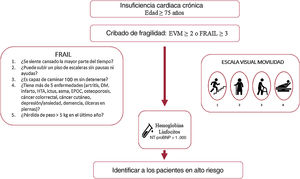
En nuestro estudio, unas cifras de hemoglobina bajas se asociaron de forma independiente con una mayor mortalidad, en línea con trabajos previos en los que se han asociado con mayor morbimortalidad y peor calidad de vida36. Unas cifras de linfocitos bajas y de NT-proBNP más altas también identificaron, como en estudios previos, a pacientes con peor pronóstico6,37–40, si bien su asociación con la mortalidad se encontró en el límite de la significación estadística al incluir distintas variables confusoras en el modelo (tabla 5). La fragilidad, evaluada por la escala visual de movilidad, resultó ser un predictor independiente de mortalidad antes y después del ajuste del modelo, resistiendo la inclusión de dichos factores y a pesar del tamaño de nuestra muestra, y resultó una herramienta útil y sencilla para identificar a los pacientes con mayor mortalidad durante el seguimiento. En conjunto, tanto las cifras de hemoglobina, linfocitos o NT-proBNP como la fragilidad estimada por la escala visual de movilidad son datos fácilmente disponibles en consulta cuyo empleo permite identificar a pacientes con peor pronóstico y que, por lo tanto, se beneficiarían de un abordaje específico y un seguimiento estrecho (figura 3). La importancia de la estimación de la fragilidad radica en su potencial reversibilidad, y se han demostrado beneficios claros derivados de la inclusión de pacientes frágiles en programas de rehabilitación multimodal41. Dada la naturaleza observacional de nuestro estudio, no se aplicaron intervenciones específicas para la fragilidad pese a su identificación, y llama la atención que menos de un tercio de los pacientes eran robustos y, sin embargo, solo se había incluido en programas de rehabilitación cardiaca al 1,8%, lo que pone de manifiesto los retos a los que nos enfrentamos42–44.
Nuestro estudio presenta algunas limitaciones. Al tratarse de un estudio observacional, no se pueden descartar sesgos de selección. Otra posible limitación es una prevalencia de mujeres en nuestro trabajo ligeramente menor (38%) que el de estudios previos. Sin embargo, como ya se ha comentado, la media de edad de los pacientes incluidos en nuestro estudio, las comorbilidades y las características basales no difieren sustancialmente de las otros trabajos realizados en otros ámbitos26–28.
CONCLUSIONESLa fragilidad es muy prevalente en los pacientes mayores con IC ambulatoria seguidos por cardiología en nuestro país, y se asocia de manera independiente con la mortalidad a 1 año de seguimiento. Identificarla es fundamental, dada su potencial reversibilidad y el abordaje y el seguimiento que deberían ser especialmente cuidadosos en estos pacientes. Se necesitan nuevos estudios enfocados en la prevención y el tratamiento de la fragilidad de estos pacientes.
FINANCIACIÓNNo hay.
CONTRIBUCIÓN DE LOS AUTORESDiseño del estudio: P. Díez-Villanueva, C. Bonanad, F. Formiga, F. J. Martín-Sánchez, M. T. Vidán, A. Ariza, M. Martínez-Sellés. Recogida de datos: C. Jiménez-Méndez, P. Díez-Villanueva, C. Bonanad, C. Ortiz-Cortés, E. Barge-Caballero, J. Goirigolzarri, A. Esteban-Fernández, Á. Pérez-Rivera, M. Cobo, J. López, C. Guerrero, H. García Pardo, C. Robles, D. Iglesias, J. M. García Pinilla, L. López Rodríguez, A. Ariza y M. Martínez-Sellés. Revisión de los datos y análisis estadístico: P. Díez-Villanueva y A. Sanz-García. Elaboración del manuscrito: C. Jiménez-Méndez, P. Díez-Villanueva, C. Bonanad, A. Sanz-García, F. Formiga, F. J. Martín-Sánchez, M. T. Vidán, A. Ariza, M. Martínez-Sellés y F. Alfonso. Revisión y edición y aprobación del manuscrito: todos los autores.
CONFLICTO DE INTERESESNo hay conflictos en relación con este artículo.
- –
La IC está estrechamente asociada con el envejecimiento.
- –
La fragilidad y otros síndromes geriátricos son frecuentes en los pacientes ancianos y esta asociación se ha relacionado con un peor pronóstico en varias enfermedades cardiovasculares.
- –
La fragilidad es muy prevalente en los pacientes mayores con IC ambulatoria seguidos por cardiología en nuestro país, y su presencia se asocia con mayor mortalidad.
- –
La evaluación de la fragilidad mediante escalas fáciles de implementar en la práctica clínica habitual, como la escala visual de movilidad, permite identificar a los pacientes con mayor riesgo de sufrir eventos.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2022.04.019.