En China, los casos de infección por el coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2) en niños constituyen aproximadamente el 1%1. Aunque los datos siguen siendo escasos, la mayoría de las series muestran casos generalmente leves, incluso en lactantes. Los pacientes más graves representan el 0,6% de los niños, y el 50% de ellos son menores de 1 año2. Se han descrito muy pocos fallecidos. En una serie de Wuhan, un lactante de 10 meses con invaginación intestinal sufrió fallo multiorgánico y falleció, mientras que otros 3 pacientes (el 1,7% de los niños) sufrieron enfermedades subyacentes3.
España se encuentra en el momento actual en una situación de intensa transmisión comunitaria, con más de 100.000 casos notificados.
Entre el 11 y el 18 de marzo de 2020, 12 niños con infección confirmada por el SARS-CoV-2 ingresaron en un hospital universitario, 5 de ellos (41,6%) tenían una enfermedad subyacente (1 trasplante de hígado, 1 vasculitis con hemodiálisis, 2 cardiopatías congénitas y 1 síndrome de Hurler con miocardiopatía dilatada asociada).
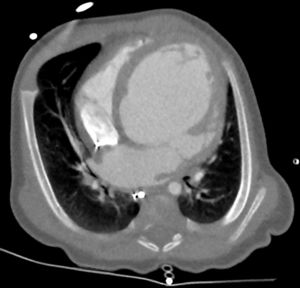
Uno de los 12 niños era un lactante de 5 meses al que se había diagnosticado insuficiencia cardiaca y mucopolisacaridosis de tipo I/síndrome de Hurler cuando tenía 1 mes. A la evaluación mediante ecocardiografía y tomografía computarizada, el lactante presentaba dilatación leve del ventrículo izquierdo (figura 1), diámetro diastólico final del ventrículo izquierdo de 30mm (Z-score, +3,8) y disfunción moderada del ventrículo izquierdo (fracción de eyección del 48%). Después de la valoración de neurología y hematología, se inició el tratamiento enzimático sustitutivo (TES) con α-L-iduronidasa humana recombinante semanal hasta el trasplante de médula ósea. Al cabo de 7 semanas, la función cardiaca del paciente se deterioró y aumentó el volumen del ventrículo izquierdo (diámetro diastólico final del ventrículo izquierdo, 48 mm; Z-score, +8,5), disminuyó la fracción de eyección (FEVI < 30%) y se observó insuficiencia mitral moderada y dilatación de la aurícula izquierda. Precisó ingreso en la unidad de cuidados intensivos y perfusión de adrenalina y milrinona. Se le realizó una tomografía computarizada para descartar lesiones coronarias. Teniendo en cuenta la afección extracardiaca, tras una reunión multidisciplinaria se decidió no incluirlo en lista de trasplante cardiaco. Tras el tratamiento intenso de la insuficiencia cardiaca, se suspendió el tratamiento intravenoso y se cambió a tratamiento oral con captopril, diuréticos, carvedilol y digoxina, con una leve mejoría que permitió el alta tras 8 semanas. Se prosiguió con el TES con intención de realizar un trasplante de médula ósea si la función cardiaca mejoraba.
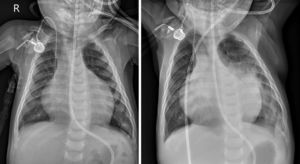
A los 5 meses de edad, el paciente ingresó tras un periodo de 24 h con irritabilidad, febrícula (< 38°C), tos, rinorrea y vómitos. Presentaba palidez, ligera disnea y estertores pulmonares bibasales. En la radiografía de tórax se apreciaba cardiomegalia sin consolidaciones (figura 2A). En el electrocardiograma se vio un ritmo sinusal de 160 lpm e hipertrofia biventricular. El último ecocardiograma, realizado 2 semanas antes del ingreso, mostraba dilatación del ventrículo izquierdo con diámetro diastólico final del ventrículo izquierdo de 39mm (Z-score, +7,3), FEVI <30% y deformación longitudinal global −10%. El número de leucocitos era 21.400/μl con 12.890 neutrófilos/μl y el valor de la proteína C reactiva de 36 mg/l. Se inició el tratamiento con restricción de líquidos y oxigenoterapia convencional (1-2 l/min).
A: radiografía de tórax tomada al ingreso hospitalario que muestra una relación cardiotorácica anómala (amplia), sin alteraciones pulmonares visibles. R: derecha. B: radiografía de seguimiento obtenida al cabo de 3 días del ingreso, que muestra consolidación perihiliar bilateral con broncogramas aéreos que se extienden hacia la base del pulmón izquierdo, incluso en el espacio retrocardiaco.
Se sospechó enfermedad COVID-19, y la reacción en cadena de la polimerasa para el SARS-CoV-2 fue positiva. Se suspendió el captropril en urgencias antes de la confirmación del diagnóstico. A las 24 h del ingreso, el paciente se hallaba estable y sin oxigenoterapia. Al cabo de 48 h, se observó un aumento bilateral de los estertores pulmonares y edema palpebral. El paciente presentaba febrícula sin alteración analítica, de modo que se interpretó como un empeoramiento de la insuficiencia cardiaca, con buena respuesta al tratamiento con diuréticos. Sin embargo, 72 h después del ingreso, el paciente presentó fiebre alta (39,6°C) y disnea, y la radiografía de tórax reveló consolidaciones parahiliares simétricas que se extendían hacia la región del pericardio y la base pulmonar izquierda (figura 2B). El análisis de sangre mostró ausencia de linfocitopenia (2.540/μl), proteína C reactiva de 244 mg/l y dímero D de 973 ng/ml. El hemocultivo fue negativo. Se prescribieron hidroxicloroquina y ceftriaxona y se solicitó remdesivir, pero 2 h después el paciente sufrió una parada cardiaca que requirió intubación y reanimación cardiopulmonar avanzada. Tras ingresarlo en la unidad de cuidados intensivos pediátricos, sufrió una segunda parada cardiaca y falleció.
Este caso resalta el curso clínico mortal de un lactante ingresado con infección por el SARS-CoV-2 y con comorbilidad significativa. En la actual crisis por la COVID-19, la mayor parte de las muertes son de pacientes ancianos con o sin comorbilidad1. La lesión cardiaca es una enfermedad frecuente entre los pacientes adultos hospitalizados con COVID-19 en Wuhan, China, y se ha relacionado con un mayor riesgo de la mortalidad hospitalaria4. No hay información sobre resultados en lactantes con una enfermedad cardiaca grave relacionada con infección causada por el SARS-CoV-2.
La mucopolisacaridosis I-síndrome de Hurler es una enfermedad por depósito lisosomal causada por una deficiencia de la enzima lisosomal α-L-iduronidasa. La evolución clínica se caracteriza por morbilidad multisistémica progresiva con deterioro cardiovascular y muerte de menores de 1 año. El tratamiento actual incluye TES y trasplante de médula ósea5. La miocardiopatía dilatada grave ha sido un factor claramente determinante de la mala evolución de este paciente, a pesar de que se hubiera descrito mejoría de la función cardiaca en otros casos tras el TES5.
Se cree que la infección causada por el SARS-CoV-2 evoluciona en 3 fases y causa la muerte en la tercera fase, al cabo de 2 semanas o más6. En la fase inicial, el SARS-CoV-2 se multiplica en el huésped, principalmente en el sistema respiratorio, con síntomas leves. El SARS-CoV-2 se une a las células mediante el receptor 2 de la enzima de conversión de la angiotensina de las células humanas, muy abundantes en el pulmón humano. En la segunda fase, tiene lugar la afección pulmonar y aparece la linfocitopenia. Una minoría de los pacientes llegarán a la tercera fase de la hiperinflamación sistémica, con un aumento de las citocinas inflamatorias, las interleucinas, la proteína C reactiva, la ferritina, el dímero D y otros. La troponina y la fracción aminoterminal del péptido natriurético cerebral también pueden estar elevados.
La evolución clínica del paciente fue muy corta, ya que entró en fase de hiperinflamación justo 3 o 4 días después de que se iniciaran los síntomas. La situación de insuficiencia cardiaca previa podría contribuir, sin ninguna duda, a una baja reserva miocárdica que condujera a la parada cardiaca. El tratamiento previo con un inhibidor de la enzima de conversión de la angiotensina o su suspensión pudieron haber influido en este rápido deterioro, pero todavía queda por dilucidar el papel de los inhibidores de la enzima de conversión de la angiotensina en esta infección.
Hay poca información sobre la infección causada por el SARS-CoV-2 en niños con enfermedad subyacente. Es reseñable que, en la primera semana de la pandemia, en nuestro centro, 5 de los 12 niños ingresados padecían comorbilidades importantes. Los pacientes con insuficiencia cardiaca debida a miocardiopatías o enfermedad cardiaca congénita pueden constituir un grupo especialmente preocupante.
Los autores quieren agradecer al Dr. Samuel Ignacio Pascual sus consejos (Departamento de Neurología Pediátrica).