El remodelado vascular pulmonar es prevalente en la insuficiencia cardiaca avanzada. El cateterismo derecho es la prueba de elección, pero está limitado por la asunción de medidas indirectas, un enfoque de flujo no pulsátil, su dependencia de la carga o la variabilidad en la interpretación. Nuestro objetivo es evaluar la vasculopatía pulmonar mediante tomografía de coherencia óptica (OCT) intravascular y correlacionarla con los parámetros hemodinámicos.
MétodosEstudio observacional, prospectivo y multicéntrico que incluyó a 100 pacientes en estudio previo al trasplante cardiaco. Todos se sometieron a un cateterismo derecho con OCT de la arteria pulmonar.
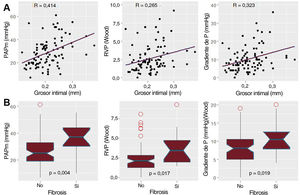
ResultadosLa OCT se pudo analizar en 90 casos. La mediana de edad fue 57,50 [intervalo intercuartílico, 48,75-63,25] años y 71 eran varones (78,88%). La cardiopatía subyacente más frecuente fue la miocardiopatía dilatada no isquémica (33 pacientes [36,66%]). El grosor intimal se correlacionó con la presión arterial pulmonar media, las resistencias vasculares y el gradiente transpulmonar (coeficiente R de 0,42, 0,27 y 0,32 respectivamente). La estimación no invasiva de la presión sistólica pulmonar, el tiempo de aceleración y el acoplamiento ventriculoarterial también se correlacionaron con el grosor intimal (coeficiente R de 0,42, 0,27 y 0,49 respectivamente). Los pacientes con un grosor intimal > 0,25mm presentaron mayores presión pulmonar media (37,00 frente a 25,00mmHg; p=0,004) y resistencias vasculares (3,44 frente a 2,08 UW; p=0,017).
ConclusionesLa OCT pulmonar es factible y está significativamente asociada con los datos hemodinámicos. La correlación débil indica que el remodelado vascular no explica por completo la hipertensión pulmonar.
Palabras clave
La prevalencia de la insuficiencia cardiaca continúa aumentando debido al envejecimiento de la población y al aumento de la supervivencia de las personas con enfermedad coronaria o valvulopatías1,2. Alrededor del 5% de los pacientes con insuficiencia cardiaca presentan una insuficiencia cardiaca avanzada con un mal pronóstico a corto plazo si no se les practica un trasplante de corazón o se usa un dispositivo de asistencia ventricular izquierda3. La hipertensión pulmonar (HP) secundaria a una cardiopatía izquierda (HP-CPI) constituye una de las formas más frecuentes de HP, afecta a más del 50% de los pacientes con insuficiencia cardiaca izquierda y se asocia a la presencia de síntomas más graves, una menor tolerancia al ejercicio y una mortalidad más elevada4,5. Una caracterización detallada de la HP es esencial en la evaluación de un paciente como posible candidato a un trasplante de corazón, ya que la presencia de una HP significativa se considera una contraindicación para ello6.
El cateterismo cardiaco derecho continúa siendo el patrón de referencia para el análisis de la hemodinámica de la circulación pulmonar4. Sin embargo, esta intervención tiene varias limitaciones. En primer lugar, los parámetros hemodinámicos son indicadores indirectos de una vasculopatía pulmonar y se ven muy influidos por múltiples determinantes, como la frecuencia cardiaca o a volemia. En segundo lugar, la correlación con los hallazgos histopatológicos es mala, y las consecuencias pronósticas de los datos obtenidos en el cateterismo cardiaco derecho son controvertidas7–12. Por último, las dificultades y la variabilidad de su interpretación limitan la fiabilidad de los resultados4,13. Así pues, existe una necesidad insatisfecha de una mejor evaluación del remodelado vascular pulmonar. Hasta hace poco, la evaluación morfológica de la HP se limitaba a lo observado en la biopsia o la autopsia. La tomografía de coherencia óptica (OCT) está evolucionando rápidamente y se emplea en algunos tipos de HP, en los que aporta información de interés respecto al diagnóstico y el tratamiento14–17. Sin embargo, la evidencia existente acerca de su viabilidad y utilidad clínica en la insuficiencia cardiaca avanzada es escasa. Los datos ya existentes sugieren que el remodelado vascular pulmonar podría traducirse en un mayor grosor intimal (GI)14. El objetivo de nuestra investigación fue estudiar la correlación entre los resultados de la OCT y la hemodinámica en los pacientes con insuficiencia cardiaca avanzada.
MÉTODOSDiseño del estudioEl diseño del estudio Optical coherence tomography observation of pulmonary ultra-structural changes in heart failure (OCTOPUS-CHF) se ha publicado ya con anterioridad18. El OCTOPUS-CHF es un estudio multicéntrico, observacional, prospectivo, para el que se incluyó a 100 pacientes adultos con insuficiencia cardiaca avanzada que habían sido remitidos para valoración pretrasplante cardiaco en 9 hospitales entre el 10 de enero de 2019 y el 15 de diciembre de 2020. A todos los pacientes se les practicó un cateterismo cardiaco derecho junto con una evaluación mediante OCT de una arteria pulmonar subsegmentaria de lóbulo inferior derecho o medio derecho (diámetro luminal <5mm y longitud mínima de 50mm) según lo establecido en el protocolo del estudio. La intervención se llevó a cabo bajo un tratamiento médico óptimo y con el paciente en euvolemia18. Se excluyó a los pacientes bajo soporte con asistencia circulatoria mecánica y a los que presentaban un shock cardiogénico o una descompensación de la insuficiencia cardiaca o estaban en lista de espera para un trasplante de corazón urgente. Todos los pacientes eran posibles candidatos a un trasplante de corazón. Por consiguiente, se descartaron las comorbilidades importantes, como enfermedad renal crónica, enfermedad pulmonar obstructiva crónica u otras causas de HP, antes de la inclusión. El único cateterismo registrado en este estudio fue el realizado para la inclusión de los pacientes en la lista de espera para el trasplante de corazón. Lo mismo ocurrió con los pacientes dependientes de inotropos o que requerían pruebas con vasodilatadores.
Manejo de los datosLos datos se registraron en un formulario de recogida de datos electrónico diseñado específicamente para este fin. Las exploraciones de hemodinámica, ecocardiografía y OCT se anonimizaron y se mandaron directamente al laboratorio central del centro encargado de la coordinación. Los datos hemodinámicos fueron interpretados en cada centro por un cardiólogo intervencionista experimentado, según la práctica clínica habitual. Las exploraciones de ecocardiografía se analizaron retrospectivamente, utilizando un diseño ciego, por el laboratorio central del centro encargado de la coordinación, siguiendo las recomendaciones actuales19. La evaluación de la OCT se centralizó en el centro encargado de la coordinación y la llevó a cabo un cardiólogo intervencionista experimentado (EGI), al que se ocultaron los datos de hemodinámica. JMS realizó las mediciones en 20 exploraciones de OCT pulmonar elegidas de forma aleatoria. Se llevó a cabo un análisis de la concordancia para evaluar la reproducibilidad de esta técnica.
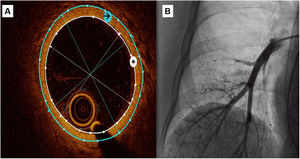
Mediciones de la OCTSe utilizó un método semiautomático para medir el área de la luz y el área de la pared vascular externa así como los diámetros interno y externo (figura 1). Estos datos se obtuvieron como media de las mediciones realizadas en 3 fotogramas seleccionados con un diámetro del vaso de alrededor de 3mm.
Figura central. Registro de OCT de una arteria pulmonar subsegmentaria. A: se utilizó un método semiautomático para medir el área de la luz (asterisco blanco) y el área de la pared vascular externa (flecha negra), y luego se obtuvieron automáticamente los diámetros medios interno y externo. Se calculó el grosor intimal como (diámetro externo - diámetro interno)/2 y el área del grosor intimal como diferencia entre el área externa y el área interna. B: angiografía pulmonar durante el registro de OCT.
El GI se calculó como (diámetro externo - diámetro interno)/2 (mm); el índice de GI se calculó como 2 x GI/diámetro interno x 100 (%); el área de GI se calculó como la diferencia entre el área externa y el área interna (mm2); y el índice del área de GI (iAGI) se calculó como área de GI/área interna x 100 (%). Utilizamos el valor del GI como criterio de valoración principal del estudio. Utilizamos las variables indexadas, índice de GI e iAGI, para introducir una corrección respecto a la variabilidad del tamaño del vaso sanguíneo.
Análisis estadísticoLa normalidad de la distribución de las variables continuas se examinó con la prueba de Shapiro-Wilk. Las variables con una distribución normal se expresan mediante la media±desviación estándar; y las variables con una distribución no normal con la mediana [rango intercuartílico]. Las variables discretas se presentan en forma de valores absolutos y porcentajes. Se eligió arbitrariamente el percentil 75 de 0,25mm como valor de corte del GI para considerar de manera dicotómica la presencia de “fibrosis”. De igual modo, se estableció de forma dicotómica un valor de resistencia pulmonar de 3 unidades Wood como «resistencia alta» ya que este punto define el componente precapilar en la clasificación actualizada de la HP20. Se utilizó la prueba de t de Student para comparar las variables de distribución normal, la prueba de Kruskal-Wallis para las variables de distribución no normal y la prueba de χ2 para las variables cualitativas. La correlación entre las mediciones de la OCT (GI e iAGI) y las variables hemodinámicas o ecocardiográficas se analizó con el empleo del coeficiente de correlación lineal de Pearson R. El acuerdo entre los 2 operadores que realizaron las mediciones de la OCT pulmonar se analizó con el coeficiente de correlación para la concordancia. Se elaboró una curva de características operativas del receptor para ilustrar la capacidad diagnóstica del GI y el iAGI para diferenciar la presencia de una resistencia vascular pulmonar elevada. El análisis se llevó a cabo con el programa R versión 4.0.2 (R Core Team, Austria) y el programa SPSS 25.0 (SPSS Inc, Estados Unidos).
Aspectos éticosEl estudio se atuvo a lo establecido en la Declaración de Helsinki. El protocolo fue aprobado por el comité de ética de investigación de cada uno de los centros participantes. Todos los pacientes dieron su consentimiento informado por escrito.
RESULTADOSLa OCT pudo realizarse y se pudo analizar de manera adecuada en 90 de los 100 pacientes reclutados para el estudio. No se pudo obtener la OCT en 4 pacientes por razones técnicas (es decir, soporte de guía y tortuosidad del vaso); tres de los registros de OCT no tuvieron la calidad necesaria para el análisis, y 3 pacientes presentaron complicaciones que condujeron a una finalización prematura de la exploración (2 arritmias ventriculares inducidas por el catéter que requirieron cardioversión, sin otras consecuencias posteriores y 1 edema pulmonar agudo). Se pudieron realizar exploraciones ecocardiográficas completas en 78 de estos 90 pacientes.
Los datos demográficos, hemodinámicos, ecocardiográficos y morfológicos se presentan en la tabla 1. La mediana de edad fue de 57,5 años. Tiene interés señalar que la edad mostró una asociación significativa con la resistencia vascular pulmonar, pero no con los datos morfológicos. La cardiopatía subyacente más frecuente fue la miocardiopatía dilatada no isquémica, seguida de la cardiopatía isquémica.
Características de los pacientes en la situación inicial
| Número | 90 |
| Edad | 57,50 [48,75-63,25] |
| Sexo masculino | 71 (78,88%) |
| Peso, kg | 78,00 [68,50-90,25] |
| Altura, cm | 170,00 [163,75-175,25] |
| Enfermedad subyacente | |
| Miocardiopatía dilatada no isquémica | 33 (36,66%) |
| Cardiopatía isquémica | 30 (33,33%) |
| Valvulopatía | 4 (4,44%) |
| Miocardiopatía hipertrófica | 12 (13,33%) |
| Otras | 11 (12,22%) |
| Tiempo tras el diagnóstico de la enfermedad subyacente, años | 9,00 [2,00-15,50] |
| Medicación para la insuficiencia cardiaca | |
| Antagonistas de receptores de mineralocorticoides | 69 (76,70%) |
| Bloqueadores beta | 67 (74,40%) |
| Antagonista de receptores de angiotensina | 9 (10,00%) |
| Inhibidores de la enzima de conversión de la angiotensina | 12 (13,30%) |
| Sacubitrilo-valsartán | 48 (53,30%) |
| Clase de la NYHA | |
| I | 2 (2,20%) |
| II | 12 (13,30%) |
| III | 55 (61,11%) |
| IV | 21 (23,30%) |
| Clasificación INTERMACS | |
| 1 | 0 (0,00%) |
| 2 | 0 (0,00%) |
| 3 | 22 (24,40%) |
| 4 | 28 (31,10%) |
| 5 | 14 (15,60%) |
| 6 | 14 (15,60%) |
| 7 | 12 (13,30%) |
| Fibrilación auricular | 48 (53,33%) |
| Mediciones ecocardiográficas | |
| FEVI, % | 25,50 [19,00-33,25] |
| Diámetro basal telediastólico del VD | 40,66±8,14 |
| ESAT, mm | 15,49±3,53 |
| CAF de VD, % | 33,74±9,43 |
| TAAP, ms | 90,00 [70,00-106,50] |
| Insuficiencia mitral | |
| 1 | 38 (42,22%) |
| 2 | 19 (21,10%) |
| 3 | 22 (24,40%) |
| 4 | 11 (12,20%) |
| Insuficiencia tricuspídea | |
| 1 | 23 (29,50%) |
| 2 | 23 (29,50%) |
| 3 | 23 (29,50%) |
| 4 | 9 (11,50%) |
| PAPs estimada de forma no invasiva, mmHg | 45,00 [31,00-56,00] |
| ESAT/PAPs, mm/mmHg | 0,32 [0,24-0,44] |
| Mediciones de CCD | |
| AD, mmHg | 7,00 [4,00-10,00] |
| PAPs, mmHg | 40,00 [31,00-54,75] |
| PAPm, mmHg | 27,00 [20,00-35,00] |
| PAPd, mmHg | 20,00 [14,00-26,00] |
| PCPE, mmHg | 18,00 [13,00-25,00] |
| GTP | 9,00 [5,25-12,00] |
| GPD | 1,00 [-1,00-3,00] |
| GC, l/min | 4,10 [3,50-4,58] |
| RVP, UW | 2,11 [1,46-3,33] |
| Frecuencia cardiaca, lpm | 71,00 [65,00-82,00] |
| Volumen de eyección, ml | 57,24 [47,36-66,39] |
| Distensibilidad arterial pulmonar, ml/mmHg | 2,53 [1,67-3,54] |
| Mediciones de OCT | |
| Diámetro interno, mm | 3,34±0,46 |
| Diámetro externo, mm | 3,76±0,52 |
| Grosor intimal, mm | 0,21±0,05 |
| Área de grosor intimal, mm2 | 2,39±0,83 |
| Índice de grosor intimal, % | 12,62±2,67 |
| Índice de área de grosor intimal, % | 26,49±5,81 |
GC: gasto cardiaco; GPD: gradiente pulmonar diastólico; INTERMACS: Interagency Registry for Mechanically Assisted Circulatory Support; CAF: cambio del área fraccional; FEVI: fracción de eyección del ventrículo izquierdo; IMitral: insuficiencia mitral; NYHA: New York Heart Association; OCT: tomografía de coherencia óptica; TAAP: tiempo de aceleración de arteria pulmonar; PAPs/m/d: presión arterial pulmonar sistólica/media/diastólica; RVP: resistencia vascular pulmonar; AD: aurícula derecha; VD: ventrículo derecho; ESAT: extrusión sistólica del anillo tricúspide; GTP: gradiente transpulmonar.
Los valores se expresan en forma de media±desviación estándar para las variables continuas paramétricas y de mediana [rango intercuartílico] para las variables no paramétricas.
La clasificación INTERMACS no mostró una asociación con los valores de resistencia vascular pulmonar ni con las evaluaciones morfológicas (tabla 2 y tabla 3), mientras que la clase functional evaluada mediante la clasificación NYHA sí mostraron una relación con los valores más elevados de la resistencia vascular pulmonar (tabla 2).
Diferencias en la resistencia vascular pulmonar
| RVP <3 | RVP ≥ 3 | p | |
|---|---|---|---|
| N | 62 | 27 | |
| Edad | 58,50 [52,50-64,00] | 53,00 [43,00-60,50] | 0,04 |
| Sexo masculino | 50 (80,60) | 20 (74,10) | 0,68 |
| Peso, kg | 78,50 [69,75-92,00] | 79,00 [68,50-90,00] | 0,90 |
| Altura, cm | 170,00 [164,00-177,25] | 169,00 [161,00-174,00] | 0,50 |
| Enfermedad subyacente | |||
| Miocardiopatía dilatada no isquémica | 25 (40,32) | 8 (29,63) | 0,72 |
| Cardiopatía isquémica | 20 (32,26) | 9 (33,34) | 0,98 |
| Valvulopatía | 2 (3,23) | 2 (7,41) | 0,57 |
| Miocardiopatía hipertrófica | 8 (12,90) | 4 (14,81) | 0,91 |
| Otras | 7 (11,29) | 4 (14,81) | 0,68 |
| Tiempo tras el diagnóstico de la enfermedad subyacente, años | 10,00 [4,00-17,00] | 8,00 [2,00-14,50] | 0,35 |
| Medicación para la insuficiencia cardiaca | |||
| Antagonistas de receptores de mineralocorticoides | 46 (74,20) | 22 (81,50) | 0,46 |
| Bloqueadores beta | 47 (75,80) | 19 (70,40) | 0,59 |
| Antagonista de receptores de angiotensina | 5 (8,10) | 4 (14,80) | 0,33 |
| Inhibidores de la enzima de conversión de la angiotensina | 8 (12,90) | 3 (11,10) | 0,81 |
| Sacubitrilo-valsartán | 39 (62,90) | 9 (33,33) | 0,02 |
| Clase III-IV de la NYHA | 49 (79,00) | 26 (96,30) | 0,04 |
| INTERMACS 1-4 | 34 (54,80) | 15 (55,60) | 0,95 |
| Fibrilación auricular | 37 (59,70) | 11 (40,70) | 0,16 |
| Mediciones ecocardiográficas | |||
| FEVI, % | 25,00 [18,75-32,25] | 26,00 [19,50-39,00] | 0,76 |
| Diámetro basal telediastólico del VD | 40,43±8,25 | 41,46±8,11 | 0,61 |
| ESAT, mm | 15,74±3,53 | 14,75±3,47 | 0,25 |
| CAF de VD, % | 34,74±9,64 | 31,04±8,44 | 0,11 |
| TAAP, ms | 95,00 [81,75-127,00] | 72,00 [62,50-88,50] | 0,02 |
| Insuficiencia mitral | 0,79 | ||
| 1 | 24 (38,70) | 14 (51,80) | |
| 2 | 15 (24,20) | 4 (14,80) | |
| 3 | 15 (24,20) | 6 (22,20) | |
| 4 | 8 (12,90) | 3 (11,10) | |
| Insuficiencia tricuspídea | 0,72 | ||
| 1 | 16 (29,63) | 8 (34,78) | |
| 2 | 14 (25,93) | 7 (30,43) | |
| 3 | 17 (31,48) | 6 (26,09) | |
| 4 | 7 (12,96) | 2 (8,70) | |
| PAPs estimada de forma no invasiva, mmHg | 41,00 [30,00-56,00] | 50,00 [44,25-62,50] | 0,03 |
| ESAT/PAPs, mm/mmHg | 0,37 [0,26-0,54] | 0,27 [0,23-0,35] | 0,02 |
| Mediciones de CCD | |||
| AD, mmHg | 6,00 [3,25-10,00] | 9,00 [5,25-13,00] | 0,03 |
| PAPs, mmHg | 35,00 [28,50-46,00] | 60,00 [43,50-71,00] | <0,001 |
| PAPm, mmHg | 22,50 [18,00-31,75] | 36,00 [31,00-49,00] | <0,001 |
| PAPd, mmHg | 16,00 [11,25-24,00] | 28,50 [22,50-35,25] | <0,001 |
| PCPE, mmHg | 16,00 [12,00-23,75] | 23,00 [14,75-28,00] | 0,02 |
| GTP | 7,00 [4,00-9,00] | 16,00 [12,50-21,00] | <0,001 |
| GPD | 0,00 [-2,00-2,00] | 5,00 [2,00-11,00] | <0,001 |
| GC, l/min | 4,22 [3,76-4,80] | 3,52 [3,12-4,13] | 0,001 |
| RVP, UW | 1,73 [1,12-2,18] | 4,33 [3,61-6,22] | <0,001 |
| Frecuencia cardiaca, lpm | 71,00 [63,75-81,25] | 71,50 [68,00-85,00] | 0,44 |
| Volumen de eyección, ml | 61,00 [48,02-71,96] | 48,69 [37,67-55,52] | 0,001 |
| Distensibilidad arterial pulmonar, ml/mmHg | 3,04 [2,14-4,18] | 1,67 [1,20-2,11] | <0,001 |
| Mediciones de OCT | |||
| Diámetro interno, mm | 3,34±0,50 | 3,35±0,37 | 0,93 |
| Diámetro externo, mm | 3,75±0,55 | 3,81±0,45 | 0,59 |
| Grosor intimal, mm | 0,20±0,04 | 0,23±0,06 | 0,02 |
| Área de grosor intimal, mm2 | 2,29±0,76 | 2,63±0,97 | 0,08 |
| Índice de grosor intimal, % | 12,17±2,33 | 13,67±3,16 | 0,02 |
| Índice de área de grosor intimal, % | 25,67±5,23 | 28,54±6,83 | 0,04 |
GC: gasto cardiaco; GPD: gradiente pulmonar diastólico; INTERMACS: Interagency Registry for Mechanically Assisted Circulatory Support; CAF: cambio del área fraccional; FEVI: fracción de eyección del ventrículo izquierdo; IMitral: insuficiencia mitral; NYHA: New York Heart Association; OCT: tomografía de coherencia óptica; TAAP: tiempo de aceleración de arteria pulmonar; PAPs/m/d: presión arterial pulmonar sistólica/media/diastólica; RVP: resistencia vascular pulmonar; AD: aurícula derecha; VD: ventrículo derecho; ESAT: extrusión sistólica del anillo tricúspide; GTP: gradiente transpulmonar.
Los valores se expresan en forma de media±desviación estándar para las variables continuas paramétricas y de mediana [rango intercuartílico] para las variables no paramétricas. La fibrosis se define como un grosor intimal> 0,25mm evaluado mediante OCT. Es de destacar que no fue posible obtener el valor del gasto cardiaco en 1 paciente y, por lo tanto, no se dispone de su valor de RVP.
Diferencias en presencia o ausencia de engrosamiento por fibrosis medido mediante OCT
| Sin fibrosis | Con fibrosis | p | |
|---|---|---|---|
| Número | 75 | 15 | |
| Edad | 58,00 [49,00-64,00] | 56,00 [48,50-62,00] | 0,49 |
| Sexo masculino | 59 (78,70%) | 12 (80,00%) | 1,00 |
| Peso, kg | 77,00 [70,00-90,00] | 90,00 [65,00-95,50] | 0,60 |
| Altura, cm | 168,00 [162,00-175,00] | 171,00 [168,00-181,00] | 0,12 |
| Enfermedad subyacente | |||
| Miocardiopatía dilatada no isquémica | 28 (37,33) | 5 (33,33) | 0,96 |
| Cardiopatía isquémica | 25 (33,33) | 5 (33,33) | 0,83 |
| Valvulopatía | 3 (4,00) | 1 (6,66) | 1,00 |
| Miocardiopatía hipertrófica | 11 (14,66) | 1 (6,66) | 0,44 |
| Otras | 8 (10,66) | 3 (20,00) | 0,46 |
| Tiempo tras el diagnóstico de la enfermedad subyacente, años | 9,00 [2,50-15,00] | 9,00 [4,00-16,00] | 0,71 |
| Medicación para la insuficiencia cardiaca | |||
| Antagonistas de receptores de mineralocorticoides | 59 (78,70) | 10 (66,70) | 0,32 |
| Bloqueadores beta | 53 (70,70) | 14 (93,30) | 0,05 |
| Antagonista de receptores de angiotensina | 6 (8,00) | 3 (20,00) | 0,16 |
| Inhibidores de la enzima de conversión de la angiotensina | 9 (12,00) | 3 (20,00) | 0,41 |
| Sacubitrilo-valsartán | 41 (54,70) | 7 (46,70) | 0,57 |
| Clase III-IV de la NYHA | 63 (84,00) | 13 (86,70) | 0,80 |
| Clasificación INTERMACS 1-4 | 43 (57,30) | 7 (46,70) | 0,45 |
| Fibrilación auricular | 41 (54,66) | 7 (46,66) | 0,49 |
| Mediciones ecocardiográficas | |||
| FEVI, % | 26,00 [20,00-33,75] | 19,50 [15,50-28,75] | 0,16 |
| Diámetro basal telediastólico del VD | 40,20±7,68 | 42,60±10,01 | 0,31 |
| ESAT, mm | 15,67±3,60 | 14,62±3,15 | 0,33 |
| CAF de VD, % | 34,32±9,68 | 30,85±7,73 | 0,22 |
| TAAP, ms | 90,00 [70,25-116,25] | 78,00 [65,00-92,00] | 0,42 |
| Insuficiencia mitral | 0,56 | ||
| 1 | 34 (45,33) | 4 (26,70) | |
| 2 | 15 (20,00) | 4 (26,70) | |
| 3 | 17 (22,70) | 5 (33,33) | |
| 4 | 9 (12,00) | 2 (13,33) | |
| Insuficiencia tricuspídea | 0,81 | ||
| 1 | 20 (30,30) | 3 (25,00) | |
| 2 | 19 (28,79) | 4 (33,33) | |
| 3 | 20 (30,30) | 3 (25,00) | |
| 4 | 7 (10,60) | 2 (16,67) | |
| PAPs estimada de forma no invasiva, mmHg | 45,00 [30,52-52,75] | 48,50 [43,75-61,25] | 0,15 |
| ESAT/PAPs, mm/mmHg | 0,33 [0,24-0,48] | 0,28 [0,25-0,38] | 0,35 |
| Mediciones de CCD | |||
| AD, mmHg | 7,00 [4,00-10,00] | 8,50 [4,25-13,00] | 0,47 |
| PAPs, mmHg | 37,00 [30,00-52,00] | 54,00 [44,00-64,00] | 0,02 |
| PAPm, mmHg | 25,00 [19,00-33,00] | 37,00 [30,00-44,00] | 0,004 |
| PAPd, mmHg | 20,00 [12,50-24,00] | 27,00 [19,50-29,00] | 0,03 |
| PCPE, mmHg | 17,50 [12,00-24,00] | 20,00 [18,50-28,50] | 0,07 |
| GTP | 8,00 [5,00-11,00] | 11,00 [8,50-19,50] | 0,02 |
| GPD | 1,00 [-1,00-3,00] | 2,00 [-1,00-3,50] | 0,61 |
| GC, l/min | 4,10 [3,52-4,63] | 3,90 [3,34-4,36] | 0,28 |
| RVP, UW | 2,08 [1,28-2,83] | 3,44 [1,94-4,73] | 0,02 |
| Frecuencia cardiaca, lpm | 74,00 [64,00-83,00] | 70,00 [67,25-73,50] | 0,80 |
| Volumen de eyección, ml | 57,84 [47,28-67,89] | 53,46 [48,05-61,60] | 0,46 |
| Distensibilidad arterial pulmonar, ml/mmHg | 2,73 [1,75-3,60] | 1,70 [1,39-2,25] | 0,03 |
| Mediciones de OCT | |||
| Diámetro interno, mm | 3,29±0,46 | 3,58±0,41 | 0,02 |
| Diámetro externo, mm | 3,68±0,49 | 4,17±0,47 | <0,001 |
| Grosor intimal, mm | 0,19±0,04 | 0,29±0,04 | <0,001 |
| Área de grosor intimal, mm2 | 2,15±0,59 | 3,57±0,87 | <0,001 |
| Índice de grosor intimal, % | 11,88±2,18 | 16,28±1,66 | <0,001 |
| Índice de área de grosor intimal, % | 25,04±4,83 | 34,70±3,80 | <0,001 |
GC: gasto cardiaco; GPD: gradiente pulmonar diastólico; INTERMACS: Interagency Registry for Mechanically Assisted Circulatory Support; CAF: cambio del área fraccional; FEVI: fracción de eyección del ventrículo izquierdo; IMitral: insuficiencia mitral; NYHA: New York Heart Association; OCT: tomografía de coherencia óptica; TAAP: tiempo de aceleración de arteria pulmonar; PAPs/m/d: presión arterial pulmonar sistólica/media/diastólica; RVP: resistencia vascular pulmonar; AD: aurícula derecha; VD: ventrículo derecho; ESAT: extrusión sistólica del anillo tricúspide; GTP: gradiente transpulmonar.
Los valores se expresan en forma de media±desviación estándar para las variables continuas paramétricas y de mediana [rango intercuartílico] para las variables no paramétricas.
Hubo una buena correlación entre las mediciones de la OCT obtenidas por los 2 operadores. La diferencia media no tuvo relevancia estadística para ninguna de las variables (GI, índice de GI, área de GI e iAGI) (figura 1 del material adicional).
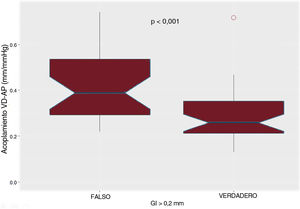
El GI mostró una asociación significativa con valores elevados de la presión arterial pulmonar, el gradiente transpulmonar, la distensibilidad arterial pulmonar y la resistencia vascular pulmonar (figura 2). Además, estaba correlacionado también con parámetros ecocardiográficos como el tiempo de aceleración de la arteria pulmonar, la presión pulmonar sistólica y el acoplamiento ventrículo derecho-arteria pulmonar (figura 3 y figura 4). Sin embargo, no hubo asociación alguna con la gravedad de la insuficiencia tricuspídea ni con ningún parámetro medido de la función sistólica del ventrículo derecho.
Correlación de Pearson entre el grosor intimal y los resultados ecocardiográficos de la hipertensión pulmonar y la función del ventrículo derecho. A: acoplamiento ventricular derecho-pulmonar arterial medido como el cociente entre la extrusión sistólica del anillo tricúspide y la presión sistólica arterial pulmonar estimada de forma no invasiva; la correlación no es lineal, y el mejor ajuste es polinómico. B: tiempo de aceleración de la arteria pulmonar. C: presión arterial pulmonar sistólica estimada de forma no invasiva.
Los pacientes con un GI superior a 0,25mm presentaron valores superiores de presión pulmonar media, gradiente transpulmonar y resistencia vascular pulmonar, en comparación con los observados en los pacientes que se encontraban en los percentiles inferiores (tabla 3). Estos resultados fueron independientes de la enfermedad subyacente y del tiempo transcurrido desde el diagnóstico, así como de la presencia de fibrilación auricular o de insuficiencia mitral. Por lo que respecta al uso de fármacos de bloqueo neurohormonal, los pacientes tratados con sacubitrilo-valsartán presentaron una resistencia vascular pulmonar significativamente inferior, pero con un valor de GI similar (tabla 2). El uso de bloqueadores beta se asoció a mayor grosor intimal.
Por lo que respecta al acoplamiento ventrículo derecho-arteria pulmonar, el mejor valor de corte del GI fue el de 0,20mm; los pacientes con un GI superior a ese valor mostraron un acoplamiento ventrículo derecho-arteria pulmonar significativamente inferior (figura 4). Los pacientes con una resistencia vascular pulmonar superior a 3 unidades Wood mostraron una medición indexada del GI más elevada (tabla 2). El índice de área de GI presentó también una asociación significativa con la hemodinámica pulmonar (figura 2 del material adicional). En la figura 3 del material adicional se presentan las curvas de características operativas del receptor para el GI y el iAGI por lo que respecta a la predicción de una resistencia vascular pulmonar elevada.
DISCUSIÓNEl estudio OCTOPUS-CHF muestra que la OCT de arterias pulmonares es viable en los pacientes con una insuficiencia cardiaca avanzada. Además, el grosor de la íntima se asocia a los valores de las mediciones hemodinámicas clásicas de la HP. Se ha observado una asociación de la OCT con la resistencia vascular pulmonar en otras formas de hipertensión pulmonar, pero la información relativa a la HP-CPI es escasa. Un estudio pequeño en pacientes con valvulopatía mitral ha aportado los únicos datos previos en este contexto, por lo que el estudio OCTOPUS-CHF es el que tiene la muestra más grande analizada hasta la fecha.
La HP puede ser producida por cualquier enfermedad valvular, coronaria o miocárdica que aumente las presiones de llenado. Afecta a la mayor parte de los pacientes con insuficiencia cardiaca y su gravedad es uno de los factores pronósticos más potentes4. Sin embargo, no disponemos de tratamientos específicos para la HP-CPI4,21. Aunque el cateterismo cardiaco derecho continúa siendo el patrón de referencia para la evaluación del remodelado vascular pulmonar, su empleo tiene varios inconvenientes. En primer lugar, tiene limitaciones técnicas y hay variabilidad en el análisis de las ondas. Además, el concepto actual de flujo constante de la HP es demasiado simplista puesto que no tiene en cuenta factores determinantes de interés, como la potente influencia de las condiciones de carga (estado de volumen, frecuencia cardiaca y tratamiento recibido)4, el acoplamiento ventriculoarterial, la rigidez de la aurícula izquierda, la distensibilidad vascular o la transmisión de la onda en sentido ascendente y descendente22–24. El gradiente diastólico parecía prometedor pero no resultó útil, mientras que el gradiente transpulmonar se ve aún más influido por la precarga izquierda25,26. Así pues, la resistencia vascular pulmonar continúa siendo la piedra angular en la evaluación de la HP-CPI, puesto que se ha observado de manera uniforme que tiene una correlación lineal con la mortalidad, a pesar de que también depende en gran medida de la presión pulmonar enclavada8,10,27. Por último, hay cierta incertidumbre respecto al valor pronóstico de los datos hemodinámicos, junto con su idoneidad para orientar el tratamiento de la insuficiencia cardiaca7–10,12,28.
Los mecanismos que producen la HP-CPI continúan sin conocerse bien, puesto que la mayor parte de los datos existentes proceden del ámbito de la HP primaria. Es probable que haya diferentes fenotipos de HP-CPI, y no está claro porqué pacientes con la misma cardiopatía izquierda presentan diferencias amplias de gravedad de la HP-CPI. Se propone que la sobrecarga de presión puede inducir una disfunción endotelial, una activación de vías inflamatorias y una respuesta proliferativa de la matriz extracelular a través de una interacción compleja de señalización entre los lechos poscapilares y precapilares en un subgrupo de pacientes con predisposición genética29,30. Los datos actuales van en contra del paradigma clásico de que la enfermedad vascular pulmonar protege frente a la sobrecarga cardiaca izquierda. De hecho, no solo aumenta la gravedad de la afectación del remodelado de la interfase alveolocapilar, el deterioro de la difusión pulmonar, el desacoplamiento de ventrículo derecho-arteria pulmonar y las alteraciones del emparejamiento de ventilación y perfusión, sino que también es mayor la congestión pulmonar en la cardiopatía izquierda con una hipertensión pulmonar combinada31. En estudios morfológicos recientes se observó un mayor aumento del engrosamiento de la íntima, la hipertrofia muscular y la fibrosis en las venas pulmonares en comparación con las arteriolas en la HP-CPI. Estas observaciones ponen en duda la compartimentación hemodinámica clásica del árbol vascular7. Un conocimiento más profundo de estos procesos biológicos podría ser útil para establecer futuras dianas terapéuticas.
Por todas estas razones, los parámetros morfológicos podrían aportar una información adicional valiosa. Sin embargo, hasta el reciente surgimiento de las técnicas de imagen intravascular, la evaluación morfológica se limitaba a la obtenida mediante biopsias. Los signos histopatológicos en la vasculopatía pulmonar congestiva se han descrito principalmente en el contexto de la valvulopatía mitral reumática32–35. La mayor presión arterial pulmonar parece asociarse a la fibrosis, el grosor de la íntima y la hipertrofia de la media en el árbol vascular pulmonar en la HP-CPI7,36. Recientemente ha habido un interés creciente por la evaluación in vivo del remodelado vascular pulmonar con el empleo de diferentes técnicas de imagen intravascular, de entre las cuales la OCT parece ser la más prometedora. La OCT es una técnica de imagen que se basa en una fuente del infrarrojo cercano, con una resolución de 10 a 20mm, que resulta de especial utilidad para la caracterización de los tejidos37. En estudios previos de la OCT se ha descrito que la pared del vaso arterial pulmonar es una estructura homogénea, de una sola capa y rica en señales, sin que se aprecie una distinción clara entre las capas íntima y media14,38. El engrosamiento de la pared por una estructura de alta reflectividad y baja atenuación corresponde a la fibrosis en los estudios anatomopatológicos38. Por consiguiente, la distancia entre el borde luminal de la pared del vaso y la interfase entre la pared del vaso y el tejido pulmonar define el GI en las exploraciones de OCT pulmonar con los mismos cálculos que se describen en el presente proyecto. En un estudio en el que se compararon las imágenes de OCT pulmonar de 79 pacientes con diferentes formas de HP y 35 participantes sin HP, se observó una asociación entre la gravedad de la fibrosis de la íntima y la poscarga ventricular derecha. Además, los autores pudieron identificar no solo las fases iniciales del engrosamiento de la íntima en los pacientes con una HP limítrofe, sino también el remodelado reverso después de un tratamiento vasodilatador en una proporción significativa de los pacientes con HP primaria, lo cual sugiere una sensibilidad elevada de la OCT para el diagnóstico precoz17. Por lo que respecta a la HP primaria, la fibrosis de la íntima predice los resultados clínicos y está correlacionada con los signos histológicos38. La OCT emerge como herramienta diagnóstica en diferentes formas de HP, como la HP tromboembólica crónica, en la que ha permitido demostrar satisfactoriamente la presencia de trombos y colgajos o flaps y ha permitido guiar la angioplastia14,16,39. Además, un estudio más grande realizado en 64 pacientes con HP primaria y 23 pacientes con HP tromboembólica crónica demostró también una buena correlación entre el grosor de la íntima determinado mediante OCT y los datos hemodinámicos40.
No obstante, hasta la fecha continúa existiendo poca información sobre la OCT en la HP-CPI. La única evidencia relevante de que se dispone acerca de la OCT pulmonar en la HP-CPI es la que procede de una muestra de 20 pacientes con valvulopatía mitral en los que el índice de GI mostró una asociación significativa con la resistencia vascular pulmonar, el gradiente transpulmonar y la presión arterial pulmonar41.
Esta asociación entre la evaluación mediante OCT y los datos hemodinámicos se reprodujo también en nuestro estudio. Observamos una correlación significativa entre la evaluación mediante OCT del remodelado vascular y las medidas funcionales, como las presiones y resistencias pulmonares. Sin embargo, esta asociación no fue intensa. De hecho, un área bajo la curva de 0,622 para el GI en la predicción de una resistencia vascular pulmonar elevada puede considerarse débil. Esto no resulta necesariamente inesperado, puesto que es bien sabido que los datos hemodinámicos no explican por completo las alteraciones estructurales. En primer lugar, muchos pacientes pueden presentar valores elevados de presión y de resistencia vascular pulmonar que se normalizan rápidamente después de un trasplante de corazón36 o una descarga del ventrículo izquierdo mediante un soporte mecánico, lo cual sugiere la ausencia de un remodelado vascular pulmonar significativo6,42. En segundo lugar, la correlación entre la evaluación morfológica y la funcional en nuestro estudio es notable, a pesar de la heterogeneidad existente en la muestra, con una amplia variedad de enfermedades subyacentes y de condiciones de carga. Además, resulta difícil demostrar una correlación intensa entre datos morfológicos y datos funcionales, puesto que la resistencia vascular pulmonar era normal o estaba solo ligeramente aumentada en la mayor parte de nuestros pacientes. Esto se debía a que nuestros resultados hemodinámicos se utilizaron para incluir a los pacientes en la lista de espera para un trasplante de corazón.
Por lo que respecta a los datos clínicos, la clase de la NYHA no mostró una asociación con el GI, ni tampoco con la clasificación INTERMACS. Además, aunque algunos subgrupos de miocardiopatías subyacentes, la enfermedad de larga evolución o la presencia de fibrilación auricular o insuficiencia mitral podrían estar asociados con el remodelado vascular pulmonar, en nuestro estudio no pudimos demostrar esas asociaciones. Por lo que respecta a los fármacos para la insuficiencia cardiaca, es posible que la tolerancia al bloqueo neurohormonal seleccione a los pacientes de bajo riesgo. Por consiguiente, la interpretación de nuestros resultados debe hacerse con precaución. Además, este es el primer estudio en el que se evalúa la relación entre el remodelado vascular pulmonar medido mediante la OCT y la evaluación no invasiva de la HP. Tanto la presión arterial pulmonar sistólica como el tiempo de aceleración pulmonar, que es bien sabido que son los mejores parámetros ecocardiográficos para estimar la HP19,43, mostraron una correlación significativa con los resultados de la OCT. Por otro lado, la falta de asociación con las mediciones de la función sistólica del ventrículo derecho y la gravedad de la insuficiencia tricuspídea no son de extrañar, dada la amplia variedad de enfermedades subyacentes que afectan al corazón derecho independientemente de la aparición de una HP-CPI. Además, en nuestro estudio, el acoplamiento de ventrículo derecho-arteria pulmonar, indicado por el cociente entre la excursión sistólica del anillo tricuspídeo y la presión sistólica pulmonar estimada de forma no invasiva, mostraron una correlación no lineal significativa con el GI. En estudios recientes se ha observado que este parámetro refleja la idoneidad de la adaptación del ventrículo derecho a la poscarga y constituye un factor predictivo temprano e independiente para los resultados clínicos en los pacientes con HP y una insuficiencia cardiaca avanzada44–46.
LimitacionesHasta donde nosotros sabemos, esta es la muestra más amplia de pacientes con HP-CPI que se ha analizado mediante OCT hasta la fecha. Sin embargo, nuestro estudio tiene algunas limitaciones. En primer lugar, se trata de un estudio observacional realizado en una muestra pequeña de pacientes pero cuyos resultados son un estímulo para una mayor investigación. En segundo lugar, la OCT es una técnica costosa y laboriosa, que requiere el uso de un contraste yodado, pero que resultó factible y se realizó de forma segura en la mayoría de los pacientes. Aunque los pacientes tenían una insuficiencia cardiaca avanzada, la intervención fue bien tolerada, sin que se produjera un empeoramiento de la función renal, y hubo un solo caso de edema pulmonar. En tercer lugar, las mediciones se realizaron con un método semiautomático que mostró una concordancia elevada entre los 2 operadores. No obstante, su reproducibilidad requerirá una validación externa. Además, pusimos de manifiesto una asociación con el acoplamiento ventriculoarterial y con las mediciones realizadas de forma invasiva en el análisis como variables discretas, aunque utilizando diferentes valores de corte de GI, puesto que no se ha determinado aún cual es el valor de corte más adecuado. Además, el GI de las arterias pulmonares constituye un abordaje incompleto para definir el proceso histológico subyacente, puesto que la enfermedad vascular pulmonar que se da en la HP-CPI predomina en el lecho vascular venoso7. Sin embargo, no se realizó una OCT venosa pulmonar por motivos de seguridad. Tiene interés señalar que la viabilidad de la OCT pulmonar en los vasos arteriales distales (diámetro del vaso <2mm) se ha demostrado ya en un estudio de la HP secundaria a la esclerosis sistémica47. Por último, la correlación entre los datos funcionales y los morfológicos es estadísticamente relevante pero la concordancia es débil. No resulta extraño que la hemodinámica no explique por completo la enfermedad vascular pulmonar. Sin embargo, también es determinada probablemente por la heterogeneidad de las enfermedades subyacentes junto con el deterioro leve de la resistencia vascular pulmonar en la muestra. Una reevaluación de la hemodinámica en el subgrupo de pacientes con una mayor dependencia de la carga podría haber proporcionado una información más exacta, por ejemplo con un nuevo cateterismo cardiaco derecho después de una prueba con un vasodilatador, una optimización inotrópica, un trasplante de corazón o una descarga de las cavidades izquierdas. No obstante, la OCT parece prometedora para el estudio diagnóstico de la HP-CPI puesto que añade una información morfológica a la visión clásica del diagnóstico del remodelado vascular. Además, más allá de la correlación con los parámetros del cateterismo cardiaco derecho o los resultados histológicos, se espera que los resultados del seguimiento del estudio OCTOPUS-CHF aporten nueva luz sobre el valor pronóstico de esta técnica.
CONCLUSIONESLa cuantificación de la fibrosis arterial pulmonar es viable y puede realizarse de forma segura con la OCT. Tiene el potencial de emerger como nueva herramienta diagnóstica para la HP-CPI ya que muestra una correlación significativa con los parámetros hemodinámicos, y aporta una evaluación morfológica directa del remodelado vascular.
La carga de la insuficiencia cardiaca para la salud constituye un motivo de preocupación importante en todo el mundo. La hipertensión pulmonar secundaria a una cardiopatía izquierda es muy frecuente en este contexto y tiene un mal pronóstico. Sin embargo, continúa existiendo una necesidad insatisfecha de un conocimiento más profundo de la hemodinámica pulmonar y de desarrollar un tratamiento dirigido. El cateterismo cardiaco derecho continúa siendo el patrón de referencia para medir la hipertensión pulmonar, pero tiene varios inconvenientes que limitan su viabilidad y su repercusión clínica.
¿QUÉ APORTA DE NUEVO?La evaluación morfológica del remodelado vascular pulmonar mediante la OCT es viable y segura en los pacientes con una insuficiencia cardiaca avanzada. Esta técnica parece prometedora como nueva herramienta diagnóstica para la hipertensión pulmonar secundaria a una cardiopatía izquierda y es necesario obtener más información al respecto.
Este trabajo fue financiado por el Instituto de Salud Carlos III (PI18/00254) y cofinanciado por el Fondo Europeo de Desarrollo Regional, a través de CIBERCV (CB16/11/00502).
CONTRIBUCIÓN DE LOS AUTORESConcepción y diseño del estudio; inclusión de los pacientes y obtención de los datos: todos los autores. Mediciones de OCT: J. Martínez-Solano y E. Gutiérrez-Ibañes. Presentación al comité de ética de investigación: E. Gutiérrez-Ibañes y M. Martínez-Sellés. Redacción de la versión inicial: J. Martínez-Solano, C. Ortiz-Bautista, E. Gutiérrez-Ibañes y M. Martínez-Sellés. Análisis estadístico: J. Martínez-Solano y E. Gutiérrez-Ibañes.
CONFLICTO DE INTERESESNo se declara ninguno.
Damos las gracias a Pablo Martínez-Legazpi y Javier Bermejo por su consejo y ayuda.