Se han implicado diversos mecanismos en la respuesta mecánica al estiramiento miocárdico, que incluyen la activación del intercambiador Na+/H+ por acciones autocrinas y paracrinas. Se estudia la participación de estos mecanismos en las respuestas electrofisiológicas al estiramiento agudo miocárdico mediante el análisis de los cambios inducidos con fármacos.
MétodosSe analizan las modificaciones de la fibrilación ventricular inducidas por el estiramiento agudo miocárdico en corazones de conejo aislados y perfundidos utilizando electrodos múltiples epicárdicos y técnicas cartográficas. Se estudian 4 series: control (n = 9); durante la perfusión del antagonista de los receptores de la angiotensina II, losartán (1μM, n = 8); durante la perfusión del bloqueador del receptor de la endotelina A, BQ-123 (0,1μM, n = 9), y durante la perfusión del inhibidor del intercambiador Na+/H+, EIPA (5-[N-ethyl-N-isopropyl]-amiloride) (1μM, n = 9).
ResultadosEIPA atenuó el aumento de la frecuencia dominante de la fibrilación producido por el estiramiento (control=40,4%; losartán=36% [no significativo]; BQ-123=46% [no significativo], y EIPA=22% [p<0,001]). Durante el estiramiento, la complejidad de los mapas de activación fue menor en la serie con EIPA (p<0,0001) y también en esta serie fue mayor la concentración espectral de la arritmia (mayor regularidad): control=18±3%; EIPA = 26 ± 9% (p < 0,02); losartán = 18 ± 5% (no significativo), y BQ-123 = 18 ± 4% (no significativo).
ConclusionesEl inhibidor del intercambiador Na+/H+ EIPA atenúa los efectos electrofisiológicos responsables de la aceleración y del aumento de la complejidad de la fibrilación ventricular producidos por el estiramiento agudo miocárdico. Por el contrario, el antagonista de los receptores de la angiotensina II, losartán, y el del receptor A de la endotelina, BQ-123, no modifican estos efectos.
Palabras clave
Se han implicado diversos mecanismos en la respuesta mecánica de los miocitos ante el estiramiento, que incluyen, entre otros, la liberación local de angiotensina II y de endotelina, la activación del intercambiador Na+/H+, el aumento de la entrada de Na+, la activación del modo inverso del intercambiador Na+/Ca2+ y el aumento de los transitorios de Ca2+,1,2. La información sobre la participación de estos mecanismos en las respuestas electrofisiológicas ante el estiramiento miocárdico (feedback mecanoeléctrico) es escasa, así como el estudio de las modificaciones farmacológicas de los efectos proarrítmicos del estiramiento3–10.
La inhibición de los intercambiadores Na+/H+ o Na+/Ca2+ da lugar a una disminución de la respuesta inotrópica lenta ante el estiramiento y de la magnitud de los transitorios de Ca2+,1,2,11–14. A su vez, en relación con el feedback mecanoeléctrico, el bloqueador del intercambiador Na+/Ca2+, KB-R7943, reduce las modificaciones electrofisiológicas inducidas por el estiramiento5, pero se desconoce si la inhibición del intercambiador Na+/H+ o el bloqueo de los efectos de sustancias que pueden intervenir en su activación tras el estiramiento miocárdico, como la angiotensina II y la endotelina1,15, también lo hacen.
En el presente estudio se utiliza un modelo experimental para aportar más información sobre los mecanismos implicados en las respuestas electrofisiológicas ante el estiramiento miocárdico y en sus modificaciones farmacológicas. El análisis de las características de la activación miocárdica durante la fibrilación ventricular (FV) permite objetivar el curso temporal de las modificaciones de las propiedades electrofisiológicas miocárdicas producidas por el estiramiento agudo aplicado en la pared libre ventricular izquierda5,16,17. Los objetivos del estudio han sido: a) determinar si la inhibición del intercambiador Na+/H+, cuya activación durante el estiramiento es un paso previo a la activación del intercambiador Na+/Ca2+ en su modo inverso, también bloquea o atenúa las respuestas electrofisiológicas al estiramiento, y b) determinar si la inhibición de los receptores tipo 1 de la angiotensina II o de los receptores A de la endotelina, cuya activación se ha sugerido que interviene en la respuesta mecánica de los miocitos ante el estiramiento, también modifica las manifestaciones del feedback mecanoeléctrico en el modelo experimental utilizado.
MÉTODOSPreparación experimentalEl presente estudio cumple con las recomendaciones de la directiva de la Unión Europea 2010/63/EU para la experimentación con animales. Se han utilizado conejos Nueva Zelanda que tras premedicación con ketamina y heparinización fueron sacrificados con tiopental sódico. Tras extraer el corazón se canuló la aorta utilizando un sistema de Langendorff para perfundir Tyrode oxigenado a 80mmHg y 37±0,5°C.
Tal como se ha descrito en estudios previos5,16–18 se insertó un dispositivo en la cavidad ventricular izquierda a través de la aurícula, con la finalidad de provocar el estiramiento de una zona circunscrita de la pared ventricular. Se utilizaron 2 electrodos múltiples compuestos por 121 y 115 electrodos unipolares de acero inoxidable (distancia interelectrodos=1mm) situados en el epicardio de la pared anterior (zona estirada) y en el de la pared posterior (zona no estirada) (figura 1). Los registros y las técnicas de estimulación fueron similares a los de los estudios mencionados.
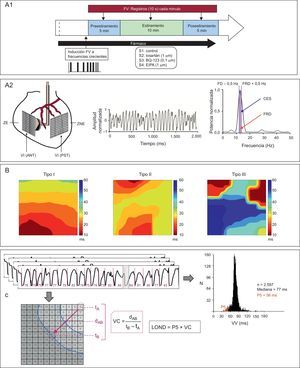
A.1: esquema del protocolo experimental. A.2: ubicación de los electrodos múltiples del dispositivo utilizado para efectuar el estiramiento miocárdico y ejemplos de registro y de análisis espectral. B: tipos de mapas de activación según su complejidad. C: parámetros electrofisiológicos utilizados. CES: concentración espectral; FRD: frecuencia dominante; dAB: distancia entre 2 electrodos situados en la dirección del frente de activación (perpendicular a las isócronas); EIPA: 5-(N-ethyl-N-isopropyl)-amiloride; FV: fibrilación ventricular; LOND: longitud de onda; P5: percentil 5; tA y tB: tiempos de activación en los electrodos A y B; VC: velocidad de conducción; VI (ANT): pared anterior del ventrículo izquierdo; VI (PST): pared posterolateral del ventrículo izquierdo; VV: mediana de los intervalos de activación consecutivos durante la fibrilación ventricular; ZE: zona estirada; ZNE: zona no estirada.
Se estudiaron 4 series: a) control (n=9); b) durante la perfusión del antagonista de los receptores de la angiotensina II, losartán (1 μM, n=8); c) durante la perfusión del bloqueador del receptor de la endotelina A, BQ-123 (0,1 μM, n=9), y d) durante la perfusión del inhibidor del intercambiador Na+/H+, EIPA (5-[N-ethyl-N-isopropyl]-amiloride) (1 μM, n = 9). La concentración de estas sustancias estuvo dentro de los márgenes utilizados en estudios experimentales15,19–22 y su perfusión se inició 15min antes del estudio electrofisiológico.
En cada serie, 30min después de situar los electrodos, se indujo la FV mediante estimulación a frecuencias crecientes y se mantuvo la perfusión coronaria. Cinco minutos tras la inducción de la FV se aplicó el estiramiento con incrementos longitudinales del 12% en los ejes vertical y horizontal de la zona modificada16. El estiramiento local se suprimió tras 10min.
Análisis de los datosAnálisis espectral de la fibrilación ventricularSe utilizó el método de Welch23 para obtener el espectro de potencia de las señales registradas con cada electrodo unipolar localizado en las 2 zonas de estudio. Este análisis se efectuó cada minuto antes del estiramiento, durante él y tras su supresión (figura 1). El espectro correspondió a los primeros 4 s de cada registro (4.096 puntos, frecuencia de muestreo=1kHz). La frecuencia dominante (FRD) en cada electrodo consistió en el valor máximo de la densidad espectral de potencia. Se calculó también la concentración espectral (CES) que corresponde al porcentaje de la energía total contenida en el intervalo FRD±0,5Hz.
Análisis en el dominio del tiempoSe determinaron los tiempos de activación local en cada electrodo siguiendo la metodología descrita con anterioridad5,16–18. Se determinó la mediana de los intervalos de activación consecutivos durante la FV (VV) y el percentil 5 (P5) en cada electrodo durante ventanas de tiempo de 2 s basalmente, a los 3min del inicio del estiramiento y a los 3min tras su supresión. Estas 3 ventanas de tiempo se eligieron tras efectuar el análisis espectral, que permitió la determinación rápida del momento de máximo efecto durante el estiramiento y el intervalo de tiempo necesario para la desaparición de estos efectos.
Mapas de activaciónSe construyeron los mapas de activación durante la FV cada 100ms en las ventanas de tiempo anteriormente mencionadas, tal como ha sido descrito en estudios previos5,16,17,24. Cada mapa se clasificó según su complejidad: baja (tipo I), intermedia (tipo II) o alta (tipo III) (figuras 1 y 2). Se consideró un patrón de afloramiento cuando se localizaba la activación más precoz en el área del multielectrodo, con activación centrífuga. La velocidad de conducción durante la FV se determinó efectuando el cociente entre la distancia entre 2 electrodos separados por 5 espacios interelectrodo en una dirección perpendicular a las isócronas y la diferencia entre sus tiempos de activación (promedio de 3 determinaciones) (figura 1). Se consideró al P5 de los intervalos VV como una aproximación a los intervalos más cortos y, por lo tanto, al periodo refractario funcional durante la FV16. La longitud de onda del proceso de activación durante la FV se determinó como el producto de la velocidad de conducción y P5.
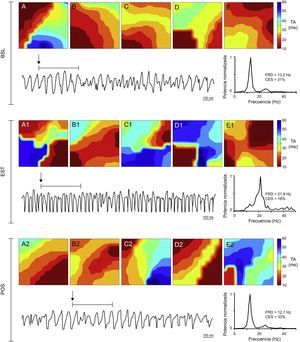
Mapas de activación, registros de la fibrilación ventricular obtenidos con uno de los electrodos y espectro de potencia de la señal registrada en la zona estirada inmediatamente antes del estiramiento, durante el estiramiento y en la fase posestiramiento en un experimento control. Durante el estiramiento se acelera el registro, aumenta la frecuencia dominante y predominan los mapas activación más complejos (tipo III). BSL: basal; CES: concentración espectral; EST: estiramiento; FRD: frecuencia dominante; POS: posestiramiento; TA: tiempo de activación.
Las variables continuas se presentan como valores medios±desviación estándar y las variables categóricas se presentan como porcentajes. Se utilizó el modelo general lineal para analizar las diferencias en cada serie (diferencias intrasujetos, medidas repetidas: basal, estiramiento, posestiramiento) y para comparar las series (diferencias entre sujetos). Las diferencias entre variables cualitativas se analizaron utilizando el test de χ2. Se consideró significación estadística cuando p<0,05. Los datos se analizaron utilizando el paquete estadístico SPSS 19.0.
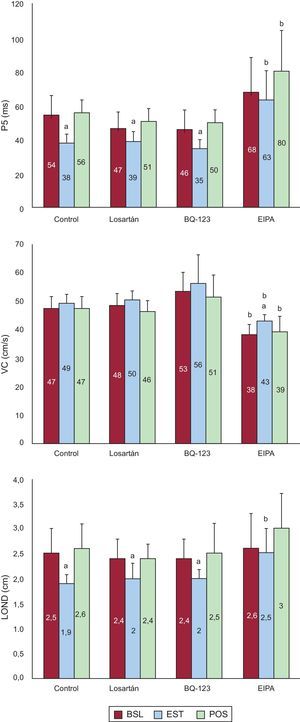
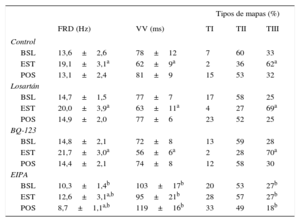
RESULTADOSEfectos del estiramiento sobre la frecuencia de activación durante la fibrilación ventricularLa tabla muestra los resultados en cada serie. En todas ellas FRD aumentó significativamente durante el estiramiento. Sin embargo, la magnitud del incremento fue menor bajo la acción de EIPA (figura 3). El incremento porcentual respecto al valor basal fue del 40,4% en la serie control, del 36% con losartán (no significativo [ns] frente a control), del 46% con BQ-123 (ns frente a control), y del 22% con EIPA (p<0,001 frente a control). La FRD basal fue similar en las series control, losartán y BQ-123, y menor con EIPA (p<0,01 frente a control). No hubo diferencias entre las series control, losartán y BQ-123, en la máxima FRD alcanzada durante el estiramiento, mientras que esta fue menor con EIPA (p<0,0001 frente a control). Asimismo, tras suprimir el estiramiento las diferencias con respecto a la serie control fueron significativas con EIPA (p<0,0001).
Frecuencia dominante, intervalos de activación consecutivos durante la fibrilación ventricular y tipos de mapas de activación durante la fibrilación ventricular obtenidos en cada serie experimental antes, durante y después del estiramiento
| Tipos de mapas (%) | |||||
|---|---|---|---|---|---|
| FRD (Hz) | VV (ms) | TI | TII | TIII | |
| Control | |||||
| BSL | 13,6±2,6 | 78±12 | 7 | 60 | 33 |
| EST | 19,1±3,1a | 62±9a | 2 | 36 | 62a |
| POS | 13,1±2,4 | 81±9 | 15 | 53 | 32 |
| Losartán | |||||
| BSL | 14,7±1,5 | 77±7 | 17 | 58 | 25 |
| EST | 20,0±3,9a | 63±11a | 4 | 27 | 69a |
| POS | 14,9±2,0 | 77±6 | 23 | 52 | 25 |
| BQ-123 | |||||
| BSL | 14,8±2,1 | 72±8 | 13 | 59 | 28 |
| EST | 21,7±3,0a | 56±6a | 2 | 28 | 70a |
| POS | 14,4±2,1 | 74±8 | 12 | 58 | 30 |
| EIPA | |||||
| BSL | 10,3±1,4b | 103±17b | 20 | 53 | 27b |
| EST | 12,6±3,1a,b | 95±21b | 28 | 57 | 27b |
| POS | 8,7±1,1a,b | 119±16b | 33 | 49 | 18b |
BSL: basal, antes del estiramiento; EST: durante el estiramiento; FRD: frecuencia dominante de la fibrilación ventricular; POS: posestiramiento; TI, TII y TIII: mapas tipo I, II y III; VV: mediana de los intervalos de activación consecutivos durante la fibrilación ventricular.
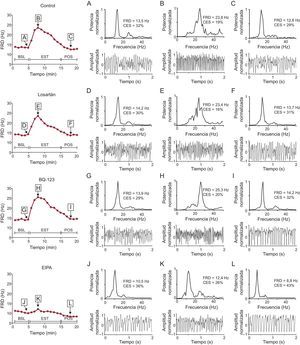
Frecuencia dominante durante la fibrilación ventricular registrada con uno de los electrodos situado en la zona estirada en un experimento de cada serie. Se muestra también el espectro de potencia de la señal registrada antes del estiramiento, 3min tras su inicio y 3min tras su supresión. Para mayor claridad los registros de la fibrilación ventricular mostrados corresponden a 2 s, aunque el espectrograma se obtuvo a partir de bloques de datos de 4.096 puntos a una frecuencia de muestreo de 1kHz. BSL: basal; CES: concentración espectral; EIPA: 5-(N-ethyl-N-isopropyl)-amiloride; EST: estiramiento; FV: fibrilación ventricular; FRD: frecuencia dominante; POS: posestiramiento.
La tabla también muestra los resultados obtenidos al determinar VV. En las series control, losartán y BQ-123, se observó una disminución significativa durante el estiramiento. Este descenso no alcanzó significación en la serie con EIPA. Basalmente, VV fue similar en las series control, losartán y BQ-123, y fue mayor con EIPA (p<0,002 frente a control). Durante el estiramiento, VV alcanzó valores similares en las series control, losartán y BQ-123, y hubo una reducción menor en la serie con EIPA (p<0,0001 frente a control). Tras suprimir el estiramiento, VV también fue mayor con EIPA que en la serie control (p<0,0001).
Durante el estiramiento y tras él, en la zona no estirada no se observaron variaciones significativas con respecto a los valores basales de FRD o VV, excepto en la serie con EIPA, en la que tras suprimir el estiramiento FRD fue inferior y VV fue mayor, de manera similar a lo observado en la zona estirada.
Efectos del estiramiento sobre la organización de la fibrilación ventricularConcentración espectralEn la zona estirada CES disminuyó durante el estiramiento en las cuatro series (figuras 2-4). Basalmente, las diferencias con respecto a la serie control no alcanzaron significación en ninguna de las series. Durante el estiramiento, los valores con EIPA fueron mayores (p<0,02) que en la serie control, mientras que la disminución observada con losartán y BQ-123 fue similar a la de la serie control. Tras el estiramiento, CES fue mayor con EIPA (p<0,02) que en la serie control. En la zona no estirada, durante y tras el estiramiento no se observaron variaciones significativas con respecto a los valores basales, excepto en la serie con EIPA, en la que se observó un aumento significativo en la fase posestiramiento.
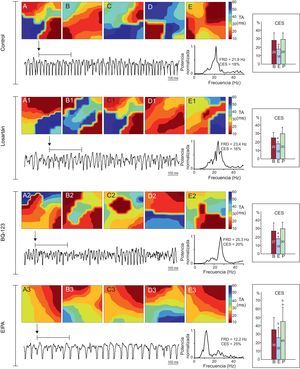
Mapas de activación obtenidos durante el estiramiento en un experimento de cada serie. En el de control, losartán y BQ-123 se observa un predominio de los mapas de activación más complejos (tipo III), mientras que con EIPA se observan mapas más simples. La frecuencia dominante es menor en los registros con EIPA. En la parte derecha se muestran también los promedios de la concentración espectral de cada una de las series en las 3 fases de los experimentos. B: basal; CES: concentración espectral; E: estiramiento; EIPA: 5-(N-ethyl-N-isopropyl)-amiloride; FRD: frecuencia dominante; P: posestiramiento; TA: tiempo de activación. aDiferencias significativas con respecto a los valores basales. bDiferencias significativas con respecto a la serie control.
En las series control, losartán y BQ-123, el estiramiento aumentó de manera similar la complejidad de la activación ventricular durante la FV (p<0,0001), que se evaluó mediante los porcentajes de los tipos de mapas, con aumento de los del tipo III y disminución de los de los tipos I y II (tabla). La complejidad no aumentó durante el estiramiento bajo la acción de EIPA. Antes del estiramiento, las diferencias no fueron significativas en las series control, losartán y BQ-123, mientras que la complejidad fue menor con EIPA (p<0,02). En comparación con la serie control, la activación de la FV durante el estiramiento fue menos compleja con EIPA (p<0,0001) (figura 4).
Durante el estiramiento, los porcentajes de mapas con patrones de afloramiento no se modificaron significativamente con respecto a los valores basales en las series control (basal 23%, estiramiento 32%, posestiramiento 26%, ns), losartán (basal 24%, estiramiento 20%, posestiramiento 31%, ns), BQ-123 (basal 27%, estiramiento 21%, posestiramiento 18%, ns) y EIPA (basal 31%, estiramiento 22%, posestiramiento 21%, ns). Los porcentajes fueron similares a los obtenidos en el grupo control en las 3 fases.
Efectos del estiramiento sobre los parámetros electrofisiológicos durante la fibrilación ventricularLa figura 5 muestra los valores de P5 obtenidos en las 4 series. En todas, excepto en la de EIPA, este parámetro disminuyó significativamente durante el estiramiento. Basalmente, P5 fue similar en control, losartán y BQ-123, y fue ligeramente mayor, pero sin alcanzar significación estadística, con EIPA (p<0,07). Durante el estiramiento, P5 mostró disminuciones similares en control, losartán y BQ-123, mientras que con EIPA los valores fueron mayores que en la serie control (p<0,0001). En relación con la velocidad de conducción, las variaciones durante el estiramiento con respecto a los valores basales no alcanzaron significación en ninguna de las series, excepto en la serie con EIPA (figura 5). Las diferencias con respecto a la serie control —basalmente, durante el estiramiento y tras él— no fueron significativas excepto en la serie con EIPA. Durante el estiramiento, la longitud de onda del proceso de activación durante la FV disminuyó en control, losartán y BQ-123, mientras que no varió con EIPA. En esta serie fue mayor que en la serie control durante el estiramiento.
Valores medios del percentil 5 de los intervalos de activación consecutivos durante la fibrilación ventricular, de la velocidad de conducción y de la longitud de onda del proceso de activación obtenidos en la zona estirada durante las 3 fases experimentales en las 4 series. BSL: basal; EIPA: 5-(N-ethyl-N-isopropyl)-amiloride; EST: estiramiento; LOND: longitud de onda, P5: percentil 5; POS: posestiramiento. aDiferencias significativas con respecto a los valores basales. bDiferencias significativas con respecto a la serie control.
Los principales resultados del estudio son: a) EIPA reduce las manifestaciones electrofisiológicas inducidas por el estiramiento miocárdico agudo, y b) losartán y BQ-123 no modifican estos efectos.
Efectos de EIPAEl estiramiento miocárdico produce un aumento de la entrada de Na+ al miocito, que puede ocurrir por diferentes mecanismos11,14,15,25–28. Estos incluyen las acciones de los canales activados por el estiramiento11,25–28, el desencadenamiento de mecanismos autocrinos y paracrinos con estimulación de los receptores de la angiotensina II y de la endotelina y la activación del intercambiador Na+/H+2,15, así como el aumento de la actividad del intercambiador Na+/H+ mediado por la estimulación mecánica14. En el presente estudio, la intervención dirigida hacia el intercambiador Na+/H+ redujo los efectos electrofisiológicos inducidos por el estiramiento miocárdico agudo, del mismo modo que la inhibición de este intercambiador atenúa el incremento lento de la fuerza de contracción tras el estiramiento2,11,13,14. Las acciones de EIPA sobre el intercambiador Na+/H+ y sobre el aumento de la concentración intracelular de Na+ disminuirían la activación del modo inverso del intercambiador Na+/Ca2+ y sus efectos sobre el feedback mecanoeléctrico. La atenuación de estos efectos bajo la acción del inhibidor del intercambiador Na+/Ca2+, KB-R7943, se ha descrito en un trabajo previo5. La disminución de la actividad del modo inverso del intercambiador Na+/Ca2+ reduciría la entrada de Ca2+ durante el estiramiento y, con ello, las modificaciones de las propiedades electrofisiológicas celulares28–30 y de las características de la curva de restitución eléctrica que relaciona la duración del potencial de acción con el intervalo diastólico precedente31.
Sin embargo, EIPA no es un inhibidor puro del intercambiador Na+/H+,32,33 y sus acciones sobre otras corrientes iónicas también podrían estar implicadas en los efectos observados. Se ha descrito un bloqueo dependiente de la frecuencia de la corriente rápida de sodio bajo la acción de EIPA32. Aunque la reducción en la corriente observada por estos autores con la concentración 1μM fue ligera, la frecuencia de activación rápida durante la FV podría aumentar este efecto. Por otra parte, EIPA, de la misma manera que el amiloride, podría reducir la corriente persistente de sodio actuando, de esta manera, sobre el aumento de la entrada de Na+ inducida por el estiramiento. En el presente estudio, la serie con EIPA mostró un enlentecimiento de la arritmia y una disminución de la velocidad de conducción. También se observó una disminución de la complejidad de la FV antes de aplicar el estiramiento y este efecto fue más pronunciado en la fase posestiramiento, probablemente debido a un efecto acumulativo sobre la refractariedad a lo largo del tiempo en el que se perfundió el fármaco.
Durante el estiramiento, bajo la acción de EIPA no se incrementó la complejidad de los mapas y no fueron significativos los cambios en P5 y en la longitud de onda. CES mostró una reducción porcentual (26%) con respecto al valor basal, aunque fue inferior a la de la serie control (36%). No obstante, durante el estiramiento, CES fue significativamente mayor que en la serie control, con valores similares a los obtenidos en dicha serie antes del estiramiento. Estos resultados indican que EIPA atenúa la reducción de la regularidad y homogeneidad de los electrogramas inducidas por el estiramiento. Esta menor heterogeneidad de la arritmia durante el estiramiento con EIPA se objetivó también, aunque en mayor medida, al observar la ausencia de cambios significativos en la complejidad de los mapas de activación. Este comportamiento fue similar al observado con otros parámetros como P5 y la longitud de onda. Así pues, CES ha sido un parámetro más sensible a la hora de mostrar los cambios producidos por el estiramiento, indicando que la regularidad y la homogeneidad de las señales registradas también se han visto afectadas por el estiramiento en la serie con EIPA, pero menos que en los controles. Tomadas conjuntamente todas las modificaciones de los efectos del estiramiento producidas por EIPA, se podría especular que la mayor homogeneidad de la activación durante la FV indicaría una situación más favorable ante acciones encaminadas a conseguir la interrupción de esta y también a una mayor dificultad para su inducción en presencia de factores arritmogénicos como el estiramiento miocárdico, aunque el análisis de estos efectos queda fuera de los objetivos del presente estudio.
Efectos del losartán y del BQ-123El incremento lento de la fuerza de contracción en respuesta al estiramiento miocárdico se ha relacionado con la puesta en marcha de fenómenos autocrinos y paracrinos, tras observar que es abolido mediante el bloqueo de los receptores tipo 1 de la angiotensina II y de los receptores A de la endotelina2,15. Se ha sugerido que la liberación de angiotensina II inducida por el estiramiento miocárdico estimula la liberación de endotelina que, a través de mecanismos interpuestos, conduce a la activación del intercambiador Na+/H+ dando lugar a un aumento de la entrada de Na+ y a la activación subsiguiente del modo inverso del intercambiador Na+/Ca2+,1,2,15. El aumento en los transitorios de Ca2+ sería responsable de la respuesta inotrópica al estiramiento mecánico. En otro estudio, también se ha observado que la respuesta inotrópica lenta al estiramiento agudo en músculos papilares de conejo estaba mediada por la activación de los receptores tipo 1 de la angiotensina y por sus efectores los intercambiadores Na+/H+ y Na+/Ca2+ en su modo inverso34. Sin embargo, algunos autores han observado que la respuesta inotrópica lenta no es abolida mediante el bloqueo de los receptores de la angiotensina II12,14,35 y que tampoco es modificada mediante el bloqueo de los receptores de la endotelina28. Una posible explicación de estas discrepancias es la existencia de diferencias entre especies o entre los diseños experimentales2,14, aunque también es posible que mecanismos distintos den lugar a efectos similares2. En el presente estudio, al explorar si existe un paralelismo entre los mecanismos implicados en las respuestas mecánicas y electrofisiológicas tras el estiramiento miocárdico agudo, se ha observado que el bloqueo de los receptores tipo 1 de la angiotensina II con losartán y de los receptores A de la endotelina con BQ-123 no han modificado la aceleración de la FV y el aumento de la complejidad de la arritmia producidos por el estiramiento miocárdico. Así pues, la estimulación de los receptores de la angiotensina II y de la endotelina no parece implicada en la cadena de acontecimientos que conducen a las manifestaciones electrofisiológicas del feedback mecanoeléctrico observadas en el modelo experimental utilizado.
LimitacionesLos resultados obtenidos dependen de las características y condiciones de la preparación experimental utilizada, en la que se aplica un estiramiento miocárdico agudo. Los efectos del estiramiento pueden dar lugar a diferentes manifestaciones en preparaciones crónicas y en preparaciones de corazón in situ debido, entre otros factores, a la existencia de reflejos neurohumorales asociados. Por otra parte, también se debe tener en cuenta la posible existencia de diferencias interespecies al extrapolar los resultados obtenidos.
CONCLUSIONESEn el modelo experimental utilizado, el inhibidor del intercambiador Na+/H+, EIPA, atenúa los efectos electrofisiológicos responsables de la aceleración y del aumento de la complejidad de la FV producidos por el estiramiento miocárdico agudo. El bloqueador del receptor de la angiotensina II, losartán, y el del receptor A de la endotelina, BQ-123, no modifican estos efectos.
FINANCIACIÓNMinisterio de Ciencia (Instituto de Salud Carlos III): proyectos FIS PS09/02417, FIS PI12/00407 y RETIC «RIC» RD12/0042/0048, y Generalitat Valenciana: proyecto PROMETEO 2010/093.
CONFLICTO DE INTERESESNinguno.