Los efectos beneficiosos clínicos de la intervención coronaria percutánea guiada por tomografía de coherencia óptica no están claros. Por ello en este estudio se intenta evaluar la influencia del uso de la guía de tomografía de coherencia óptica en la cobertura de los struts de los stents tras el implante de stents liberadores de fármacos.
MétodosSe asignó aleatoriamente a 101 pacientes con 105 lesiones a tratamiento de intervención coronaria percutánea guiada por tomografía de coherencia óptica (n = 51 lesiones de 50 pacientes) o por angiografía (n = 54 lesiones de 51 pacientes), y se les realizó un examen de seguimiento por tomografía de coherencia óptica a los 6 meses del implante de un stent liberador de zotarolimus. Los objetivos principal y secundario eran el porcentaje de struts no cubiertos y con mala aposición, respectivamente, en el seguimiento realizado a los 6 meses con tomografía de coherencia óptica.
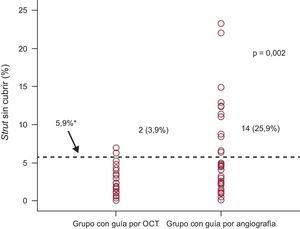
ResultadosEl porcentaje de struts no cubiertos fue significativamente inferior en el grupo de tomografía de coherencia óptica (el 1,60 ± 1,84% [mediana, 1,06%] frente al 4,51 ± 5,43% [mediana, 2,38%]; p = 0,0004) en el seguimiento realizado a los 6 meses. La incidencia de stents con ≥ 5,9% de struts no cubiertos fue también significativamente inferior en el grupo de tomografía de coherencia óptica (2 pacientes [3,9%] frente a 14 [25,9%]; p = 0,002). El porcentaje de struts con mala aposición fue significativamente inferior en el grupo de tomografía de coherencia óptica (el 0,19 ± 0,51% [mediana, 0,0%] frente al 0,98 ± 2,53% [mediana, 0,0%]; p = 0,027).
ConclusionesLa intervención coronaria percutánea guiada por tomografía de coherencia óptica redujo significativamente la incidencia de struts de stents no cubiertos a los 6 meses, en comparación con la intervención coronaria percutánea guiada por angiografía. Estos resultados indican que la intervención coronaria percutánea guiada por tomografía de coherencia óptica tiene un efecto beneficioso en cobertura de los struts de los stents liberadores de fármacos.
Palabras clave
El retraso en la cicatrización vascular y endotelial se asocia a la trombosis del stent tras el implante de stents liberadores de fármacos (SLF) en los estudios anatomopatológicos1,2. La evaluación de alta resolución in vivo de los struts de los stents3 mediante tomografía de coherencia óptica (OCT) muestra que los struts no cubiertos se asocian a trombosis tardía del stent tras el implante de SLF4,5. En estudios previos se ha puesto de relieve que una mala aposición aguda del stent puede ser causa de una mala aposición persistente y de que haya struts de stent no cubiertos en los exámenes de seguimiento6,7. En comparación con la ecografía intravascular (IVUS), la OCT de alta resolución aporta una mejor visualización de la aposición de los struts de los stents en la pared vascular. Con objeto de determinar si esta mejor evaluación de la aposición de los struts se asocia a una mejora de la cobertura de los struts del stent, se llevó a cabo un estudio prospectivo y aleatorizado para comparar la cobertura de los struts en el seguimiento del implante de SLF guiado por OCT y por angiografía.
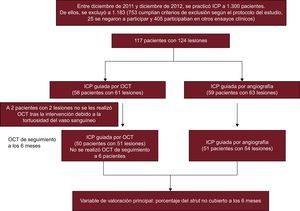
MÉTODOSPoblación en estudioEste estudio es un ensayo prospectivo, abierto, aleatorizado y unicéntrico, registrado en ClinicalTrials.gov (NCT01869842). Se incluyó a un total de 117 pacientes con 124 lesiones coronarias entre diciembre de 2011 y diciembre de 2012, y se los asignó aleatoriamente a implante de stent liberador de zotarolimus (Endeavor ResoluteTM, Medtronic Cardiovascular; Santa Rosa, California, Estados Unidos) guiado por OCT o angiografía. Los criterios de inclusión fueron: a) edad ≥ 20 años y al menos una lesión coronaria significativa (estenosis ≥ 70% del diámetro en una estimación visual) y de novo, y b) una arteria coronaria nativa con diámetro del vaso de referencia de 2,5-4,0 mm que pudiera cubrirse con un solo stent. Los criterios de exclusión fueron: a) negativa a participar; b) participación en otros protocolos de estudio; c) lesiones con una afección significativa u oclusión total de la coronaria principal izquierda; d) lesiones en un vaso injertado, trombosis o lesiones de bifurcación que requirieran dos stents; e) fracción de eyección ≤ 30%; f) alergia a los antiagregantes plaquetarios o al medio de contraste; g) insuficiencia renal conocida, con creatinina basal ≥ 2,0 mg/dl o enfermedad renal terminal; h) esperanza de vida < 1 año; i) tratamiento de otro vaso con SLF en los 3 meses previos; j) presencia de un stent con solapamiento o un stent largo (> 30 mm); k) lesión con calcificación visible en la angiografía, y l) mujeres con embarazo en curso o fértiles. Durante el mismo periodo de estudio, se realizó una intervención coronaria percutánea (ICP) a 1.300 pacientes. De ellos, se excluyó a 1.183. Rechazaron la participación 25 pacientes, 405 estaban participando en otros protocolos de estudios y 753 cumplían los demás criterios: afección de la coronaria principal izquierda en 75, oclusión total crónica en 55, afección de vaso injertado en 23, lesión trombótica con oclusión total en 125, lesiones de bifurcación que requerían dos stents en 45, fracción de eyección < 30% en 48, insuficiencia renal crónica (creatinina ≥ 2 mg/dl) en 92, lesión larga (stent > 30 mm) o stents con solapamiento en 135, y anatomía no apropiada para la técnica de OCT en 155. Este estudio aleatorizado recibió la aprobación del consejo de revisión interno de nuestro instituto y se obtuvo el consentimiento por escrito de todos los pacientes incluidos.
Aleatorización y procedimientos del estudioSe incluyó en la asignación aleatoria a todos los participantes en el estudio que cumplían los criterios de inclusión en una proporción 1:1, mediante un sistema de respuesta interactiva a través de internet, a los grupos de ICP guiada por OCT y guiada por angiografía. Para mantener el equilibrio entre las dos estrategias, la asignación aleatoria se estratificó según la presencia de diabetes mellitus y síndrome coronario agudo y la longitud y el diámetro estimado del implante prospectivo del SLF. Todos los pacientes recibieron al menos 75 mg de ácido acetilsalicílico y una dosis de carga de 300 mg de clopidogrel al menos 12 h antes de la ICP. Se administró heparina no fraccionada según se necesitara para mantener un tiempo de coagulación activado > 250 s. Todas las ICP se llevaron a cabo según las técnicas estándares actuales. En el grupo de ICP guiada por OCT, se realizó una posdilatación adyuvante a criterio del operador, según los resultados de la OCT. En el grupo de ICP guiada por angiografía, la optimización del stent, incluida la posdilatación adyuvante, se basó en una estimación visual de los resultados angiográficos, y el éxito de la intervención se definió como una estenosis residual ≤ 20% según la estimación visual después de implantar el stent. El tratamiento tras la intervención incluyó terapia antiagregante plaquetaria combinada doble con 100 mg/día de ácido acetilsalicílico y 75 mg/día de clopidogrel durante 12 meses.
Análisis de angiografía coronaria cuantitativaSe realizó un análisis de angiografía coronaria cuantitativa antes y después de implantar el stent y en el seguimiento a los 6 meses mediante un sistema off-line de angiografía coronaria cuantitativa (CASS system, Pie Medical Instruments; Maastricht, Países Bajos) en un laboratorio central independiente (Cardiovascular Research Center, Seúl, Corea). Los diámetros del vaso de referencia y de la luz mínima se obtuvieron mediante comparación con el catéter guía a partir de fotogramas diastólicos en una sola imagen igualada que mostraba el diámetro luminal mínimo más bajo: se evaluaron angiografías obtenidas tras la ICP y en el seguimiento utilizando la misma proyección. La ganancia aguda se definió como la diferencia entre el diámetro luminal mínimo antes y después de la intervención. La pérdida tardía se definió como el cambio del diámetro luminal mínimo entre la evaluación realizada tras la intervención y en el seguimiento.
Imagen de tomografía de coherencia óptica y su análisisDespués de la intervención y en el seguimiento realizado a los 6 meses de la ICP, se obtuvieron exploraciones de OCT de la lesión diana con un sistema de OCT de dominio de frecuencia (C7-XR OCT imaging system, LightLab Imaging, Inc., St. Jude Medical; St. Paul, Minnesota, Estados Unidos). En este estudio, se registraron imágenes transversales de OCT a 100 fps mientras se retraía un catéter a una velocidad de 20 mm/s dentro de la vaina de obtención de imagen estacionaria. Todas las imágenes de OCT se analizaron en el laboratorio central (Cardiovascular Research Center) por evaluadores independientes que no conocían la identidad de los pacientes.
Se analizaron imágenes de OCT en cortes transversales a intervalos de 1 mm. Se midieron las áreas de corte transversal del stent y de la luz, y se determinó el área de corte transversal de la hiperplasia de neoíntima mediante la diferencia entre el área de corte transversal del stent y la luminal. En este estudio se presentan los valores de media y mediana. El grosor de la hiperplasia de neoíntima se determinó mediante la distancia entre la superficie endoluminal de la neoíntima y el strut, y se definió strut no cubierto por un grosor de la hiperplasia de neoíntima de 0 μm8. La mala aposición de un strut de stent liberador de zotarolimus se definió como una separación de la pared vascular ≥ 110 μm (grosor del strut de stent, 91 μm + grosor de polímero abluminal, 6 μm, teniendo en cuenta el artefacto de blooming). Las proporciones de struts no cubiertos o con mala aposición se identificaron en los cortes transversales de la OCT y se expresaron como porcentaje del total de struts visibles en el examen. Además, los struts no cubiertos asociados a eventos adversos cardiovasculares mayores, como muerte cardiovascular, infarto de miocardio no mortal y trombosis del stent, se subclasificaron en función del grado de cobertura del strut descrito (cobertura favorable, < 5,9% no cubierto; cobertura desfavorable, ≥ 5,9% no cubierto)9. Los struts con cualquier grado de mala aposición se subclasificaron en mala aposición del stent persistente, resuelta o tardía, según el cambio de la mala aposición visible en las imágenes correspondientes obtenidas en la OCT después de la intervención y en el seguimiento10. Los trombos en el stent se definieron como masas irregulares con protrusió al interior de la luz > 250 μm en el punto de máximo grosor11.
Variables de valoración del estudio y seguimiento clínicoEl seguimiento clínico se llevó a cabo 1, 3, 6 y 12 meses después de realizada la ICP; el seguimiento mediante angiografía y OCT se llevó a cabo a los 6 meses. El objetivo principal fue el porcentaje de struts no cubiertos en las evaluaciones mediante OCT en el seguimiento realizado a los 6 meses. Las variables de valoración secundarias fueron: a) la presencia de struts con mala aposición en el seguimiento de OCT realizado a los 6 meses; b) la frecuencia en 12 meses de eventos adversos cardiacos mayores, definidos como el conjunto de eventos de muerte cardiaca, infarto de miocardio no mortal o necesidad de revascularización de la lesión diana, y c) la trombosis del stent a los 12 meses, según la definición del Academic Research Consortium12.
Análisis estadísticoEste estudio se diseñó para comparar a los 6 meses de seguimiento la cobertura de los struts con ICP guiada por OCT y la ICP guiada por angiografía. la hipótesis era que la mejora de la aposición del stent asociada al uso de OCT de alta resolución podría reducir la incidencia de struts no cubiertos en un 50% en la OCT de seguimiento a los 6 meses, en comparación con lo obtenido al utilizar la ICP guiada por angiografía. Partiendo del supuesto de una incidencia del 4,8 ± 4,3% de struts no cubiertos en el seguimiento a los 6 meses, con base en nuestros estudios previos de stents liberadores de zotarolimus a los 3 meses (6,2%) y a los 9 meses (3,4%)13,14, un tamaño muestral de 51 pacientes en cada grupo debía proporcionar una potencia estadística del 80% y un error alfa del 5%. Considerando un 10% de pérdidas y exclusiones por mala calidad de la imagen de OCT, eran necesarios 114 pacientes para el estudio. El análisis estadístico se llevó a cabo con el programa informático Statistical Analysis System (SAS 9.1.3., SAS Institute; North Carolina, Estados Unidos). Las variables discretas se presentan como número y porcentaje y se compararon con la prueba de la χ2 o con la prueba exacta de Fisher. Las variables continuas se presentan en forma de media ± desviación estándar (mediana) y se compararon mediante la prueba de la t de Student. En el caso de distribuciones asimétricas, se utilizó una prueba no paramétrica. Se aplicó un modelo lineal jerárquico para el problema de la agrupación. Concretamente, los datos correspondientes a lesiones, áreas transversales y struts se modelizaron para cada paciente como una variable de efectos aleatorios. Con este modelado se pudo controlar los problemas de agrupación y correlación. Si había variables agrupadas con distribuciones no normales, se integraron los resultados del modelo lineal jerárquico con un análisis no paramétrico. Se consideró estadísticamente significativo un valor de p < 0,05.
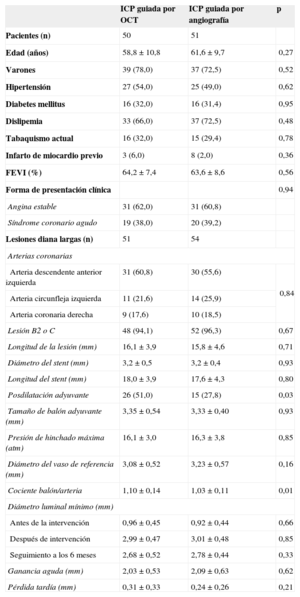
RESULTADOSSe incluyó a 117 pacientes con 124 lesiones coronarias en la asignación aleatoria a los grupos de tratamiento con ICP guiada por OCT (n = 58) e ICP guiada por angiografía (n = 59). Se realizó una OCT después de la intervención a 56 pacientes (59 lesiones) del grupo de ICP guiada por OCT, que reveló que el catéter de OCT no había superado las lesiones en 2 pacientes (2 lesiones). En el grupo de ICP guiada por OCT, 50 pacientes (51 lesiones) fueron objeto de seguimiento a los 6 meses, en comparación con 51 pacientes (54 lesiones) del grupo de ICP guiada por angiografía; 10 pacientes rechazaron la angiografía coronaria de seguimiento; 1 paciente presentó reestenosis en el stent con gran estrechamiento; 1 paciente tuvo una trombosis subaguda en el stent; el catéter de OCT no superó las lesiones tratadas con stent en 2 pacientes. En la figura 1 se presenta el diagrama general del estudio. Las características basales de los pacientes eran comparables en los dos grupos de tratamiento (tabla 1). La posdilatación adyuvante fue más frecuente en el grupo de ICP guiada por OCT (el 51,0 frente al 27,8%; p = 0,03). Sin embargo, no se aplicó un tratamiento adicional en los casos de trombos de pequeño tamaño detectados en la OCT o de prolapso tisular y disecciones menores en los bordes. En total, se evaluó mediante OCT a 101 pacientes (105 lesiones) en el seguimiento, y no hubo complicaciones graves durante la intervención. En la tabla 2 se resumen los resultados de la serie de OCT.
Características de los pacientes
| ICP guiada por OCT | ICP guiada por angiografía | p | |
|---|---|---|---|
| Pacientes (n) | 50 | 51 | |
| Edad (años) | 58,8 ± 10,8 | 61,6 ± 9,7 | 0,27 |
| Varones | 39 (78,0) | 37 (72,5) | 0,52 |
| Hipertensión | 27 (54,0) | 25 (49,0) | 0,62 |
| Diabetes mellitus | 16 (32,0) | 16 (31,4) | 0,95 |
| Dislipemia | 33 (66,0) | 37 (72,5) | 0,48 |
| Tabaquismo actual | 16 (32,0) | 15 (29,4) | 0,78 |
| Infarto de miocardio previo | 3 (6,0) | 8 (2,0) | 0,36 |
| FEVI (%) | 64,2 ± 7,4 | 63,6 ± 8,6 | 0,56 |
| Forma de presentación clínica | 0,94 | ||
| Angina estable | 31 (62,0) | 31 (60,8) | |
| Síndrome coronario agudo | 19 (38,0) | 20 (39,2) | |
| Lesiones diana largas (n) | 51 | 54 | |
| Arterias coronarias | |||
| Arteria descendente anterior izquierda | 31 (60,8) | 30 (55,6) | 0,84 |
| Arteria circunfleja izquierda | 11 (21,6) | 14 (25,9) | |
| Arteria coronaria derecha | 9 (17,6) | 10 (18,5) | |
| Lesión B2 o C | 48 (94,1) | 52 (96,3) | 0,67 |
| Longitud de la lesión (mm) | 16,1 ± 3,9 | 15,8 ± 4,6 | 0,71 |
| Diámetro del stent (mm) | 3,2 ± 0,5 | 3,2 ± 0,4 | 0,93 |
| Longitud del stent (mm) | 18,0 ± 3,9 | 17,6 ± 4,3 | 0,80 |
| Posdilatación adyuvante | 26 (51,0) | 15 (27,8) | 0,03 |
| Tamaño de balón adyuvante (mm) | 3,35 ± 0,54 | 3,33 ± 0,40 | 0,93 |
| Presión de hinchado máxima (atm) | 16,1 ± 3,0 | 16,3 ± 3,8 | 0,85 |
| Diámetro del vaso de referencia (mm) | 3,08 ± 0,52 | 3,23 ± 0,57 | 0,16 |
| Cociente balón/arteria | 1,10 ± 0,14 | 1,03 ± 0,11 | 0,01 |
| Diámetro luminal mínimo (mm) | |||
| Antes de la intervención | 0,96 ± 0,45 | 0,92 ± 0,44 | 0,66 |
| Después de intervención | 2,99 ± 0,47 | 3,01 ± 0,48 | 0,85 |
| Seguimiento a los 6 meses | 2,68 ± 0,52 | 2,78 ± 0,44 | 0,33 |
| Ganancia aguda (mm) | 2,03 ± 0,53 | 2,09 ± 0,63 | 0,62 |
| Pérdida tardía (mm) | 0,31 ± 0,33 | 0,24 ± 0,26 | 0,21 |
ICP: intervención coronaria percutánea; FEVI: fracción de eyección del ventrículo izquierdo; OCT: tomografía de coherencia óptica.
Salvo otra indicación, los datos expresan n (%) o media ± desviación estándar.
Evaluación de los stents por tomografía de coherencia óptica inmediatamente después de la intervención y en el seguimiento a los 6 meses
| ICP guiada por OCT (después de la intervención) | ICP guiada por OCT (seguimiento) | ICP guiada por angiografía (seguimiento) | p* | |
|---|---|---|---|---|
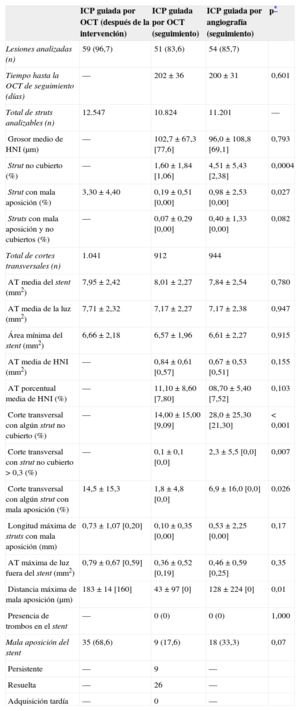
| Lesiones analizadas (n) | 59 (96,7) | 51 (83,6) | 54 (85,7) | |
| Tiempo hasta la OCT de seguimiento (días) | — | 202 ± 36 | 200 ± 31 | 0,601 |
| Total de struts analizables (n) | 12.547 | 10.824 | 11.201 | — |
| Grosor medio de HNI (μm) | — | 102,7 ± 67,3 [77,6] | 96,0 ± 108,8 [69,1] | 0,793 |
| Strut no cubierto (%) | — | 1,60 ± 1,84 [1,06] | 4,51 ± 5,43 [2,38] | 0,0004 |
| Strut con mala aposición (%) | 3,30 ± 4,40 | 0,19 ± 0,51 [0,00] | 0,98 ± 2,53 [0,00] | 0,027 |
| Struts con mala aposición y no cubiertos (%) | — | 0,07 ± 0,29 [0,00] | 0,40 ± 1,33 [0,00] | 0,082 |
| Total de cortes transversales (n) | 1.041 | 912 | 944 | |
| AT media del stent (mm2) | 7,95 ± 2,42 | 8,01 ± 2,27 | 7,84 ± 2,54 | 0,780 |
| AT media de la luz (mm2) | 7,71 ± 2,32 | 7,17 ± 2,27 | 7,17 ± 2,38 | 0,947 |
| Área mínima del stent (mm2) | 6,66 ± 2,18 | 6,57 ± 1,96 | 6,61 ± 2,27 | 0,915 |
| AT media de HNI (mm2) | — | 0,84 ± 0,61 [0,57] | 0,67 ± 0,53 [0,51] | 0,155 |
| AT porcentual media de HNI (%) | — | 11,10 ± 8,60 [7,80] | 08,70 ± 5,40 [7,52] | 0,103 |
| Corte transversal con algún strut no cubierto (%) | — | 14,00 ± 15,00 [9,09] | 28,0 ± 25,30 [21,30] | < 0,001 |
| Corte transversal con strut no cubierto > 0,3 (%) | — | 0,1 ± 0,1 [0,0] | 2,3 ± 5,5 [0,0] | 0,007 |
| Corte transversal con algún strut con mala aposición (%) | 14,5 ± 15,3 | 1,8 ± 4,8 [0,0] | 6,9 ± 16,0 [0,0] | 0,026 |
| Longitud máxima de struts con mala aposición (mm) | 0,73 ± 1,07 [0,20] | 0,10 ± 0,35 [0,00] | 0,53 ± 2,25 [0,00] | 0,17 |
| AT máxima de luz fuera del stent (mm2) | 0,79 ± 0,67 [0,59] | 0,36 ± 0,52 [0,19] | 0,46 ± 0,59 [0,25] | 0,35 |
| Distancia máxima de mala aposición (μm) | 183 ± 14 [160] | 43 ± 97 [0] | 128 ± 224 [0] | 0,01 |
| Presencia de trombos en el stent | — | 0 (0) | 0 (0) | 1,000 |
| Mala aposición del stent | 35 (68,6) | 9 (17,6) | 18 (33,3) | 0,07 |
| Persistente | — | 9 | — | |
| Resuelta | — | 26 | — | |
| Adquisición tardía | — | 0 | — |
AT: área transversal; ICP: intervención coronaria percutánea; HNI: hiperplasia de neoíntima; OCT: tomografía de coherencia óptica.
Los valores se presentan como n (%) o media ± desviación estándar [mediana].
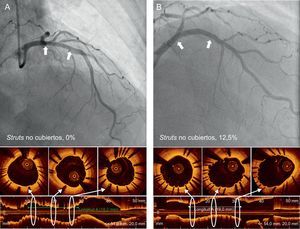
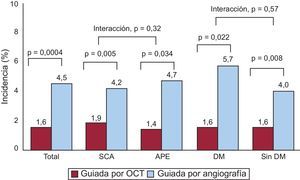
En el grupo de ICP guiada por OCT, la incidencia de struts con mala aposición y lesiones con algún strut con mala aposición era del 3,3 y el 66,1% (39 de 59), respectivamente, inmediatamente después de la intervención de cualificación para el estudio. El porcentaje de struts no cubiertos a los 6 meses era significativamente inferior con la guía por OCT (el 1,60 ± 1,84% [mediana, 1,06%] frente al 4,51 ± 5,43% [mediana, 2,38%] de la angiografía; p = 0,0004). En la figura 2 se muestran algunos ejemplos representativos del seguimiento mediante angiografía y OCT en los grupos tratados con ICP guiada por OCT e ICP guiada por angiografía. La angiografía no permite detectar la cobertura de los struts. Además, la cobertura de estos fue más favorable en los casos tratados con ICP guiada por OCT, con independencia de la forma de presentación clínica o la presencia de diabetes mellitus (figura 3). En el seguimiento realizado a los 6 meses con OCT, la incidencia de una cobertura de struts desfavorable (≥ 5,9% de los struts no cubiertos) fue significativamente inferior en el grupo tratado con ICP guiada por OCT (2 [3,9%] frente a 14 pacientes [25,9%]; p = 0,002) (figura 4), al igual que ocurrió con el porcentaje de struts con mala aposición (el 0,19 ± 0,51% [mediana, 0,0%] frente al 0,98% ± 2,53% [mediana, 0,0%]; p = 0,027).
Incidencia y gravedad de los struts de stents no cubiertos. La frecuencia y la gravedad de los stents con cobertura de los struts desfavorable (≥ 5,9%) fue significativamente inferior en las evaluaciones guiadas por tomografía de coherencia óptica que con las guiadas por angiografía. OCT: tomografía de coherencia óptica.
*El valor de corte en el 5,9% se basa en los resultados clínicos indicados por el estudio previo9.
Se completó el seguimiento clínico de 1 año de todos los pacientes participantes. No hubo diferencias significativas en los eventos adversos cardiacos mayores (2 de 58 [3,4%] en el grupo de OCT frente a 3 de 59 [5,1%] en el grupo de angiografía). Se produjo una trombosis del stent en un paciente del grupo de angiografía 2 días después del implante; se llevó a cabo revascularización de la lesión diana en 4 pacientes (2 tratados con ICP guiada por OCT y 2 con ICP guiada por angiografía). De estos 5 pacientes, no se realizó la evaluación con OCT de seguimiento a los 6 meses al paciente con trombosis del stent, y en uno de los pacientes con ICP guiada por OCT sometidos a revascularización de la lesión diana, no se pudo superar con el catéter de OCT la lesión, muy estenosada.
DISCUSIÓNEste estudio prospectivo y aleatorizado de comparación de ICP guiada por OCT frente a ICP guiada por angiografía indica que la guía de OCT se asocia a un resultado significativamente mejor en cuanto a la cobertura de los struts y la aposición del stent a los 6 meses. Además, la incidencia de stents con una cobertura desfavorable de los struts (≥ 5,9% de struts no cubiertos) fue significativamente inferior tras la ICP guiada por OCT en comparación con la guiada por angiografía. El uso de posdilatación adyuvante fue más frecuente en el grupo de ICP guiada por OCT. Estos resultados indican que la ICP guiada por OCT tiene efecto beneficioso en cuanto a la cobertura de los struts de los stents.
Aunque la guía de angiografía se utiliza ampliamente en la realización de las ICP, este método tiene poca capacidad para evaluar con exactitud el tamaño del vaso, la longitud de la lesión, la expansión del stent, la mala aposición y las complicaciones tras el implante del stent15. La IVUS se introdujo para superar esas limitaciones de la guía por angiografía, y puede ser útil en las intervenciones coronarias complejas como las que se realizan sobre la coronaria principal izquierda, una bifurcación o lesiones largas y difusas16–19. La resolución de la IVUS es de 100 μm en el plano axial y de 200–250 μm en el plano lateral, mientras que la resolución de la OCT es ∼ 10 veces mayor (10-15 μm) y basta para visualizar los diversos struts del stent y las estructuras vasculares más detalladamente. En consonancia con ello, la cobertura de neoíntima fue visible en el 99,9% de los struts de stents empleando OCT, en comparación con solo un 25,8% con la IVUS, ya que una parte considerable de la neoíntima tiene un grosor < 100 μm, es decir, inferior a la resolución de la IVUS20. A pesar de ello, son pocos los estudios prospectivos que han evaluado los posibles beneficios de la ICP guiada por OCT.
Partiendo de un análisis de muestras de autopsia, se ha propuesto que la endotelización incompleta y la cobertura de neoíntima en los struts de los SLF son factores de riesgo anatomopatológicos significativos para la trombosis del stent1,2, y los estudios de OCT y de angioscopia han identificado una correlación significativa entre los struts no cubiertos y los trombos intracoronarios subclínicos21,22. Además, los resultados de un reciente estudio retrospectivo de casos y controles que utilizó OCT indican que la longitud de los struts no cubiertos es un significativo factor de riesgo de trombosis del stent tardía5. Además, estudios recientes de este grupo han intentado identificar la utilidad de los valores umbral de struts no cubiertos que mejor predicen una evolución clínica adversa (muerte cardiovascular, infarto de miocardio y trombosis en el stent) después del implante de SLF. Durante una mediana de 851 [intervalo intercuartílico, 488-1.215] días después del examen de OCT, se produjeron eventos clínicos en 6 de 489 pacientes (4 trombosis de stent definitivas y 2 muertes súbitas cardiacas); el estudio propuso que el mejor valor de corte del porcentaje de struts no cubiertos para predecir eventos cardiovasculares era el del 5,9%, con una sensibilidad del 83,3% y una especificidad del 70,3%9. Por consiguiente, la identificación de técnicas útiles para mejorar el grado de cobertura de los struts puede traducirse en una disminución de la incidencia de eventos adversos cardiovasculares y trombos intracoronarios durante el seguimiento. Dado que la mala aposición aguda del stent se asocia a un retraso en la cobertura de los struts de los stents liberadores de sirolimus a los 10 meses6, minimizar la mala aposición aguda de los stents puede reducir la tasa de stents no cubiertos posterior.
En el presente estudio se ha evaluado esta hipótesis empleando la guía por OCT para optimizar la aposición del stent y una evaluación de la cobertura de los struts a los 6 meses. El principal hallazgo fue que el porcentaje de struts no cubiertos era significativamente inferior en el grupo tratado con ICP guiada por OCT que en el de ICP guiada por angiografía (el 1,60 ± 1,84% frente al 4,51 ± 5,43%; p = 0,0004) en el seguimiento realizado a los 6 meses. La proporción de struts no cubiertos y el grosor de la hiperplasia de neoíntima utilizando la guía por angiografía en el presente estudio fueron comparables a lo señalado en estudios previos13,14 que utilizaron stents liberadores de zotarolimus (el 4,51% a los 6 meses [el 6,2 a los 3 meses y el 3,3 a los 9 meses] y 96 μm a los 6 meses [74 μm a los 3 meses y 139 μm a los 9 meses] respectivamente). Estas observaciones indicaban que la guía por OCT puede reducir la incidencia de struts no cubiertos con menos variabilidad a los 6 meses de implantado el stent. Además, la incidencia de cobertura desfavorable de los struts fue significativamente inferior en el grupo tratado con ICP guiada por OCT (2 [3,9%] en comparación con 14 pacientes [25,9%]; p = 0,002) y el grado de cobertura de los struts fue menos variable en el grupo de ICP guiada por OCT. Estos resultados indican que adoptar la guía por OCT durante la ICP asegurará una cobertura de los struts uniformemente favorable. La estrategia con guía por OCT puede tener utilidad para reducir la duración del tratamiento antiagregante plaquetario combinado doble después del tratamiento con SLF de lesiones con cobertura de los struts favorable23. Los resultados concuerdan con los datos retrospectivos que indican que la ICP guiada por OCT se asocia a una mejora de los resultados clínicos a los 12 meses a causa de una disminución de las muertes cardiacas y los infartos de miocardio24. Se ha señalado también que la guía por OCT aporta beneficio en otros contextos clínicos cuando se identifica la neoaterosclerosis como causa de la reestenosis o la trombosis de un stent25,26. Tal como se observa al utilizar la guía por IVUS, la OCT aporta información durante la ICP sobre la expansión insuficiente del stent y la mala aposición de este, y ello permitió la dilatación con balón adyuvante con más frecuencia en el grupo de ICP guiada por OCT en este estudio (el 51,0 frente al 27,8%; p = 0,03).
Limitaciones del estudioEl presente estudio tiene ciertas limitaciones. En primer lugar, no se puede comparar la incidencia de la mala aposición aguda del stent asociada a la guía por OCT con la asociada a la guía por angiografía, ya que el examen de OCT posterior a la intervención se llevó a cabo solo en el grupo con ICP guiada por OCT. Además, en este ensayo la posdilatación adyuvante por mala aposición o mala expansión del stent no se definió como un criterio específico, sino que se llevó a cabo a criterio del operador. Será necesario investigar los criterios óptimos de OCT para mejorar la cobertura de struts de los stents, la aposición y los resultados clínicos durante el seguimiento. En segundo lugar, estos resultados solo son informativos respecto a las lesiones simples, ya que se excluyó específicamente a los pacientes con lesiones coronarias complejas —lesiones largas difusas, enfermedades de vasos pequeños (< 2,5 mm) o grandes (> 4,0 mm), enfermedad de la coronaria principal izquierda, oclusión total crónica, y lesiones de bifurcación—. En consecuencia, no se puede especular con la posibilidad de que la influencia de la guía por OCT pudiera ser mayor en las lesiones complejas y no es posible recomendar el uso de OCT para todos los pacientes con lesiones simples, ya que todavía no se ha identificado plenamente su relación coste-efectividad. Esto se está investigando actualmente, pero otros estudios previos han señalado ya un posible beneficio clínico de emplear la ICP guiada por OCT24,27. En tercer lugar, solo se han usado stents liberadores de zotarolimus y un seguimiento de 6 meses; en consecuencia, debe hacerse con precaución cualquier extrapolación de estos resultados a otros SLF y a seguimientos más largos. Por último, aunque el tamaño muestral era suficiente para evaluar con OCT la cobertura de los struts de los stents en el seguimiento a los 6 meses, era demasiado bajo para evaluar los resultados clínicos a largo plazo de la ICP guiada por OCT.
CONCLUSIONESMediante un estudio prospectivo y aleatorizado, se ha demostrado que la ICP guiada por OCT empleando un SLF produjo una mejora significativa de la cobertura de los struts y una disminución de los struts con mala aposición en el seguimiento realizado a los 6 meses, en comparación con lo observado con la ICP convencional guiada por angiografía.
FINANCIACIÓNEste estudio obtuvo financiación del Korea Healthcare Technology R&D Project (Ministerio de Salud, Bienestar y Asuntos Familiares de la República de Corea) (A085012 y A102064), el Korea Health 21 R&D Project (Ministerio de Salud, Bienestar y Asuntos Familiares de la República de Corea) (A085136) y el Cardiovascular Research Center de Seúl.
CONFLICTO DE INTERESESNinguno.