Palabras clave
La ablación mediante radiofrecuencia del nodo auriculoventricular (AV) seguida de la implantación de un marcapasos definitivo (MPD) ha demostrado ser un método eficaz y seguro para controlar la frecuencia cardÍaca en pacientes con fibrilación auricular aguda o crónica y respuesta ventricular rápida1-8. Sin embargo, algunos autores han comunicado casos ocasionales de desarrollo o empeoramiento del grado de regurgitación mitral y de la contractilidad9,10. Dado que la contracción asíncrona del ventrículo izquierdo bajo el efecto de la estimulación en la punta del ventrículo derecho (PVD) puede estar implicada en estos fenómenos, lugares o modos diferentes de estimulación, como el tracto de salida del ventrículo derecho, la estimulación bifocal de ventrículo derecho o la estimulación biventricular han sido propuestas como alternativas. La estimulación permanente del haz de His (EPHH) tras ablación del nodo AV en pacientes con un sistema de conducción infrahisiano completamente normal, o en aquellos con trastorno de la conducción suprahisiano, podría evitar los efectos hemodinámicos indeseables asociados a la estimulación en la PVD, pero hasta el momento sólo se han comunicado algunos ensayos en animales y datos preliminares en humanos. El objetivo de nuestro estudio es analizar las posibilidades de estimulación permanente del haz de His evaluando la técnica de implante y la evolución a medio plazo de los umbrales de estimulación y de la función ventricular.
PACIENTES Y MÉTODO
Pacientes
Entre junio de 1999 y octubre del 2000 seleccionamos para EPHH a aquellos pacientes con fibrilación auricular paroxística, sin evidencia de cardiopatía estructural, que fueron propuestos para ablación de nodo AV y aquellos pacientes con indicación de MPD por trastorno de la conducción suprahisiano que cumplieron los criterios de inclusión reflejados en la tabla 1.
La indicación para ablación del nodo AV fue establecida por el clínico responsable atendiendo a la frecuencia de las recurrencias y a la mala tolerancia hemodinámica, y se requirió el fallo de al menos dos fármacos antiarrítmicos en el control de la respuesta ventricular o de las recurrencias.
A todos los pacientes se les practicó un estudio electrofisiológico diagnóstico previo. En aquellos enfermos en los que se propuso ablación descartamos, mediante supraestimulación auricular y ventricular, así como mediante extraestímulos acoplados en ambas cámaras, la existencia de arritmias precursoras de fibrilación auricular (FA) potencialmente tratables con radiofrecuencia (RF).
Sólo se consideraron susceptibles de EPHH aquellos pacientes que presentaban una conducción infrahisiana normal en función de los criterios electrofisiológicos que se describirán más adelante.
Todos los enfermos manifestaron por escrito su consentimiento para la ablación del nodo AV y el subsiguiente implante de un MPD. El protocolo de estudio fue aceptado y aprobado por el comité ético del hospital.
Ablación del nodo auriculoventricular
Los pacientes fueron sedados con cloracepato y fentanilo. Todos lo fármacos antiarrítmicos se habían retirado previamente durante un tiempo superior a 5 vidas medias. Introdujimos en todos los casos un catéter bipolar y otro de ablación con punta de 4 mm (Cordis-Webster) a través de la vena femoral derecha; el primero, colocado en la PVD fue conectado a un marcapasos externo programado a 50 spm para estimulación temporal, mientras que el catéter de ablación fue colocado en posición His. Seguidamente se retiró lentamente el catéter de ablación aplicando un pulso de radiofrecuencia, con salida máxima de energía programada a 50 W y temperatura de corte de 60 ºC, en aquella posición en la que se registró el mayor electrograma auricular con la menor deflexión del hisiograma. Si no se obtenía una temperatura adecuada ni un ritmo de la unión rápido como predictor de bloqueo AV en 10 s, se suspendía la aplicación y se reposicionaba el catéter siguiendo los pasos anteriores; en caso contrario, se prolongaba la aplicación durante 60 s hasta alcanzar el bloqueo AV como objetivo final. Por último, comprobamos la persistencia del bloqueo AV completo 30 min más tarde bajo los efectos de isoproterenol a una dosis máxima de 3 μg/min y la existencia de ritmo de escape suprahisiano estable.
Evaluación de la conducción a través del sistema de His-Purkinje y del ritmo de escape
En los pacientes con fibrilación auricular paroxística disminuimos lentamente la frecuencia de estimulación temporal tras la ablación hasta que apreciamos la aparición de ritmo de escape propio. Con posterioridad recolocamos el catéter de ablación hasta registrar la mayor deflexión posible del potencial de His. El origen nodal suprahisiano del ritmo de escape se confirmó comprobando que la morfología del QRS era semejante a la del ritmo sinusal previo y la actividad ventricular en el catéter de ablación se encontraba precedida por un potencial de His con un intervalo HV igual al registrado antes del procedimiento. En todos los pacientes se realizó una estimulación incremental a través del catéter en posición hisiana comprobando la captura del haz de His. Consideramos que la conducción a través del sistema de His-Purkinje era normal si los pacientes mantenían conducción 1:1 durante la estimulación hisiana hasta al menos 150 spm y el intervalo estímulo-electrograma ventricular era menor de 55 ms y la duración del QRS era inferior 140 ms. Igualmente, para ser candidato a EPHH, exigimos, por razones de seguridad, en los pacientes con ablación un ritmo de escape nodal estable a una frecuencia mayor de 40 spm que se acelerase hasta al menos 50 spm bajo la infusión de isoproterenol y que fuese bien tolerado clínicamente por el paciente en reposo.
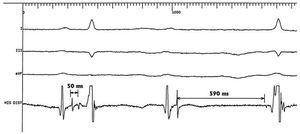
Fueron excluidos para EPHH aquellos pacientes con QRS basal o del ritmo de escape mayor de 140 ms, los que presentaban un HV mayor de 55 ms y aquellos con bloqueo troncular del haz de His (fig. 1).
Fig. 1. Trastorno de la conducción intrahisiano en un paciente con bloqueo AV de primer grado y QRS fino que fue rechazado para estimulación permanente del haz de His. Se observa un doble potencial de His separado 50 ms que, tras una extrasístole auricular, se alarga hasta 590 ms.
Implante de electrodos
Introdujimos los electrodos de estimulación definitivos a través de doble punción de la vena subclavia izquierda. El catéter de diagnóstico o de ablación fue reubicado en posición de His para ser utilizado como referencia anatómica y eléctrica. Para la estimulación hisiana elegimos un electrodo de fijación activa Tendril 1488 T SDX (Paceseter, Veddesta, Suecia) con hélice retráctil y activa de 1,8 mm de longitud extendida. Inicialmente lo posicionamos en el tracto de salida del ventrículo derecho; con posterioridad introdujimos una guía dirigible Locator 4046 (Pacesetter, Veddesta, Suecia) y retiramos lentamente el electrodo ajustando la curva de manera que consiguiésemos llevar su punta lo más próxima posible al par de electrodos del catéter de referencia a través de los cuales se registraba el potencial de His más amplio. En este punto tratábamos de enfrentar la punta del electrodo al septo registrando la actividad del haz de His y realizábamos la maniobra de extracción de la hélice, comprobando con posterioridad la estabilidad del electrodo mediante una ligera tracción. Seguidamente estimulábamos a través de la punta mediante una configuración monopolar y comprobábamos la morfología del QRS estimulado. Un QRS estrecho similar o muy parecido al ritmo de escape nodal o al QRS conducido era considerado un signo de captura del haz de His. Si los umbrales de estimulación agudos eran menores de 1,5 voltios a 0,5 ms y la estabilidad era considerada buena, el electrodo se fijaba al plano muscular según técnica convencional; en caso contrario repetíamos la maniobra hasta conseguir los objetivos.
Adicionalmente insertamos un electrodo en la orejuela derecha para el sensado y la estimulación auricular.
Durante el implante, los umbrales fueron medidos utilizando el medidor Analyzer 8090 de Medtronic, mientras que en el seguimiento la medición se hizo a través del software propio del generador.
Modo de estimulación
Los electrodos se conectaron a un generador Affinity (Pacesetter) programado en modo DDDR, a una frecuencia básica de 90 spm en los pacientes abladidos por fibrilación auricular rápida durante el primer mes, y a una frecuencia de 60 spm el resto de los pacientes y los primeros a partir del segundo mes. En todos los casos activamos la función "Switch mode".
Evaluación de la función cardíaca
La función cardíaca fue evaluada por un médico ajeno al estudio mediante ecocardiografía bidimensional y Doppler previo al procedimiento y a los 3 meses.
Los parámetros evaluados fueron: tamaño de las cavidades izquierdas, fracción de eyección, grado de regurgitación mitral y movimiento del septo.
La fracción de eyección fue calculada según la fórmula de Teichholz que parece correlacionarse bien con los valores obtenidos mediante angiografía cuando las dimensiones de las cavidades y la contractilidad global son normales.
Duración del procedimiento
La duración total del procedimiento fue calculada desde la punción femoral para la inserción del catéter de ablación o diagnóstico de referencia hasta el cierre completo de la piel tras el implante del marcapasos definitivo.
Seguimiento
Los pacientes permanecieron monitorizados en la UCI durante 24 h y posteriormente fueron trasladados a una planta de hospitalización convencional. A todos se les administró profilaxis antibiótica y se les mantuvo un electrodo temporal de seguridad en ventrículo derecho durante 48 horas. El alta a domicilio se consideró a los 7 días si mantenían umbrales de estimulación menores de 2 voltios a 0,5 ms y ritmo de escape estable bien tolerado en reposo. De manera ambulatoria fueron evaluados mensualmente, realizando un nuevo control ecocardiográfico a los 3 meses del implante.
Estadística
Los datos ecocardiográficos y los umbrales fueron comparados utilizando la prueba de la t de Student para datos apareados.
RESULTADOS
Un total de 12 pacientes, nueve de 17 tratados con ablación del nodo AV durante el tiempo de estudio, y 3 pacientes con trastorno de la conducción suprahisiano que precisaron MPD, fueron seleccionados para EPHH al cumplir los criterios de inclusión requeridos (tabla 1).
Estimulación del haz de His
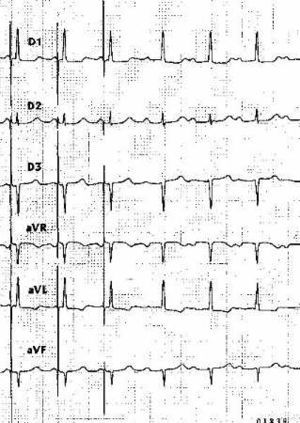
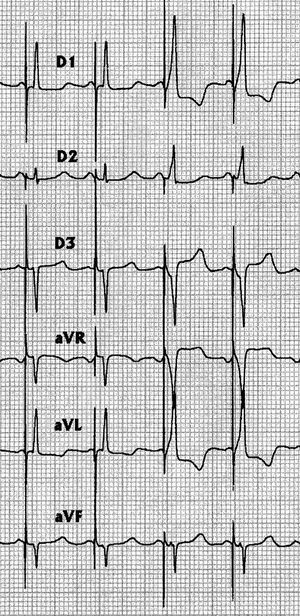
La EPHH fue lograda de manera consistente en 8 pacientes. En 4 enfermos conseguimos un QRS estimulado idéntico al ritmo de escape nodal o al QRS conducido en todas las derivaciones (fig. 2) y un intervalo espiga QRS semejante al HV. En estos casos, cuando aumentábamos progresivamente la salida de estimulación, a partir de un determinado voltaje se producía un ligero cambio en la morfología del QRS estimulado, despareciendo la latencia espícula-QRS (fig. 3).
Fig. 2. Estimulación selectiva del haz de His en uno de los pacientes con bloqueo AV de primer grado. Se observan en el trazado varios complejos estimulados con un intervalo espiga QRS de 40 ms y varios complejos conducidos a través del sistema específico con PR largo e idéntica morfología en las 6 derivaciones de los miembros.
Fig. 3. El mismo paciente de la figura 2. Al aumentar el voltaje de salida en el generador se observa un cambio en la morfología del QRS estimulado, con desaparición de la latencia espícula QRS que puede representar una captura del miocardio vecino a altos voltajes. En cualquier caso, el QRS estimulado continúa siendo estrecho.
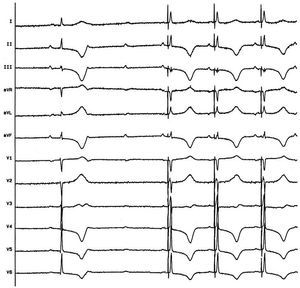
En otros 4 pacientes conseguimos un ECG fino pero con ligeros cambios respecto al ECG nodal y sin latencia espícula-QRS (fig. 4).
Fig. 4. Estimulación no selectiva del haz de His. Se observan varios latidos estimulados con QRS fino muy parecidos a los ritmos de escape pero que no reproducen la morfología con total exactitud, tanto a altos como a bajos voltajes, probablemente por imposibilidad de aislar la captura del His de la del miocardio vecino.
En 4 casos el procedimiento fue abandonado por imposibilidad de conseguir estabilidad del electrodo tras múltiples intentos.
La duración media del procedimiento fue de 192 min (rango, 176-210 min).
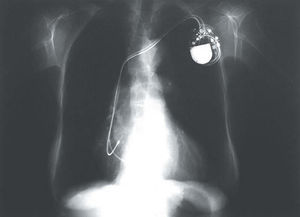
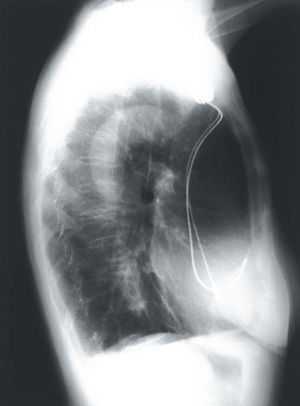
El patrón radiológico en 2 derivaciones ortogonales de uno de los electrodos implantados se observa en la figura 5.
Fig. 5. Posición radiológica, en las proyecciones PA y lateral de tórax, de los electrodos definitivos en uno de los casos de estimulación permanente del haz de His.
Los datos de la función cardíaca y los umbrales de estimulación al implante y a los 3 meses de seguimiento se reflejan en la tabla 2.
DISCUSION
El principal hallazgo de este estudio preliminar es que la estimulación a largo plazo del haz de His es posible en aquellos pacientes con sistema de conducción distal normal, tras la ablación del nodo AV para el control de la respuesta ventricular, en caso de fibrilación auricular paroxística, sin que aparezca deterioro hemodinámico en comparación con el ritmo sinusal previo a la ablación. Asimismo, es posible en pacientes con deterioro de la conducción AV suprahisiano que precisan estimulación definitva.
La ablación del nodo AV mediante RF ha demostrado ser un método eficaz y seguro para el control de la frecuencia cardíaca en pacientes con FA paroxística o crónica1-8. Sin embargo, algunos autores han manifestado cierta preocupación por casos ocasionales de deterioro de la función de bomba y de desarrollo o deterioro de la regurgitación mitral tras la ablación del nodo AV y la estimulación en la PVD9,10. El mecanismo íntimo por el que ocurre este deterioro en algunos pacientes es aún desconocido, pero algunos fenómenos ya descritos, relacionados con la estimulación en PVD, pueden con tribuir a esta complicación.
1. Es bien conocido que la estimulación en la PVD altera la activación eléctrica del ventrículo izquierdo y se asocia a un movimiento asincrónico del septo interventricular y a una disminución de la función ventricular. Ya en 1925, Wiggers11 y algunos estudios posteriores comunicaron que la estimulación artificial del VD produce una contracción ventricular menos eficaz que la activación a través del sistema específico de conducción, y que la asincronía de la contracción ventricular era un factor independiente que contribuía al deterioro hemodinámico asociado a la estimulación en PVD12-15. También se ha demostrado en humanos que la asincronía de la contracción ventricular en presencia de bloqueo completo de la rama izquierda natural o inducido por estimulación produce efectos hemodinámicos negativos16-20. Rosenquist et al16 demostraron que los latidos sinusales propios normalmente conducidos se asociaban a un mejor gasto cardíaco que los latidos estimulados en modo VVI o DDD.
2. La estimulación de PVD puede originar regurgitación mitral o tricuspídea significativa en algunos individuos, por asincronía de la estimulación auricular y ventricular y cierre asíncrono de las válvulas AV21-24 debido a cambios en el tiempo de activación del aparato valvular mitral que pueden originar una activación aberrante de los músculos papilares, con deterioro de la presión de las valvas y pérdida de coaptación y un aumento del orifico durante la sístole.
3. Además, la estimulación en PVD origina un flujo miocárdico alterado25, concentraciones elevadas de catecolaminas26, cambios histopatológicos27-29, remodelamiento de la geometría ventricular y cambios progresivos en la función de ventrículo izquierdo.
Por tanto, podemos afirmar que la PVD ha sido elegida como lugar de estimulación en la mayoría de los pacientes por conveniencia en términos de facilidad en el implante y estabilidad, sin atender a cuestiones de mejora hemodinámica. Solamente en la miocardiopatía hipertrófica obstructiva la estimulación en PVD parece ser mejor en términos hemodinámcos que la activación ventricular a través del sistema de conducción específico30-32.
La estimulación en tracto de salida de ventrículo derecho ha surgido como alternativa a la estimulación en PVD. Todos los estudios de la bibliografía que comparan ambos modos han demostrado que la primera se asocia a mejores resultados hemodinámicos agudos que la segunda33-36.
Otros autores han estudiado, en pacientes con insuficiencia cardíaca crónica, el resultado hemodinámico de la estimulación simultánea de ambos ventrículos o del ventrículo izquierdo37-41.
Por todo ello continúa abierto el debate acerca del lugar ideal de estimulación en cada entidad clínica y en cada paciente en concreto para conseguir el mejor resultado hemodinámico. Desde este punto de vista, el lugar teóricamente más adecuado para la estimulación permanente sería aquél que consiguiese activar los ventrículos sincrónicamente a través del sistema de conducción específico, siempre que éste no estuviese alterado. Un estudio reciente de Karpawich y Mitral35 compara en términos hemodinámicos los latidos originados mediante estimulación en el haz His con los latidos espontáneos. Cowell et al36 demostraron que la estimulación en el haz His produce una mejoría adicional sobre la estimulación en PVD en los pacientes en fallo cardíaco con intervalo PR prolongado.
A pesar de las ventajas hemodinámicas asociadas al mantenimiento de las activación ventricular a través del sistema de His-Purkinje, solamente un estudio realizado en caninos42, y recientemente Deshmukh et al43 en humanos, han probado la posibilidad de estimulación a largo plazo del haz de His. Nuestro trabajo aporta información adicional que confirma la posibilidad de estimular con seguridad el haz de His de manera permanente en pacientes seleccionados fundamentalmente tras ablación del nodo AV para control de la fibrilación auricular y en los casos de deterioro de la conducción AV de origen suprahisiano. Tras un período de seguimiento entre 3 y 12 meses, los umbrales de estimulación de nuestros pacientes permanecieron estables e inferiores a los comunicados por Deshmukh et al.
Nuestros pacientes presentaron parámetros ecocardiográficos de función cardíaca semejantes durante los latidos de escape nodales y durante los latidos estimulados en el haz de His; el movimiento septal no se alteró durante la estimulación hisiana. El tamaño de las cavidades cardíacas no se modificó y no se registraron mediante Doppler nuevas malfunciones valvulares o deterioro de las preexistentes. Por tanto, nuestros hallazgos confirman que la estimulación sincrónica con la aurícula del haz de His reproduce las activación normal del ventrículo a través del sistema específico de conducción con resultados hemodinámicos semejantes a los obtenidos durante el ritmo sinusal normalmente conducido. Sin embargo, Deshmukh et al demuestran una mejoría hemodinámica en sus pacientes tras la estimulación en el haz de His. Estas discrepancias en términos de umbrales y comportamiento hemodinámico creemos que se pueden atribuir a los diferentes criterios utilizados en la selección de los pacientes: mientras nuestros pacientes no tenían cardiopatía estructural, y como ritmo de base presentaban ritmo sinusal, Deshmukh et al seleccionaron a los suyos entre aquellos con miocardiopatía dilatada con un ritmo de base en fibrilación auricular. Por tanto, el beneficio hemodinámico que este autor encuentra podría deberse al control de la frecuencia cardíaca y a la regularización del ritmo cardíaco, pero no a la estimulación en el haz de His por sí misma. En nuestros pacientes, la ausencia de deterioro en los parámetros ecocardiográficos debe considerarse un hallazgo positivo puesto que, como ya se comentó previamente, los latidos estimulados en PVD se asocian a un peor comportamiento de la mecánica cardíaca que los latidos sinusales11-15.
En 4 pacientes conseguimos un QRS estrecho no exactamente igual al ECG espontáneo, con mínima o nula latencia espícula-QRS (fig. 4), mientras que en otros cuatro el ECG estimulado a bajo voltaje reprodujo con total exactitud la morfología del ECG espontáneo con intervalo espícula-QRS semejante al intervalo HV basal (fig. 2). En estos últimos, al aumentar progresivamente la salida del generador, a partir de un determinado voltaje, la morfología del QRS obtenido cambiaba, desapareciendo la latencia espícula-QRS pero manteniéndose estrecho (fig. 3). Este hallazgo, así como la imposibilidad de reproducir exactamente la morfología del QRS espontáneo en 4 pacientes fue interpretado como una captura del miocardio próximo. Dada la localización anatómica del haz de His, profunda en el septo interventricular, en muchos pacientes puede resultar imposible con la tecnología actual su estimulación selectiva sin la captura adicional del miocardio vecino, sobre todo a altos voltajes; en estos casos, la obtención de un QRS estrecho alterado fundamentalmente en su porción inicial con respecto al latido conducido es representativo de despolarización de la mayor parte del miocardio a través del sistema específico, mientras que los potenciales iniciales del QRS estimulado representarían la captura del miocardio vecino. Es posible que electrodos con hélice más larga, que consigan una penetración más profunda en el septo interventricular, nos permitan conseguir una estimulación selectiva del haz de His de manera mucho más fácil, reduciendo el tiempo de implante y la tasa de fracasos.
El implante de un electrodo permanente en el haz de His es aún un procedimiento de larga duración que requiere habilidad y experiencia en la manipulación de los electrodos. Deshmuckh et al comunicaron una duración media superior a 3 h, con un tiempo de exposición a rayos X prolongado; en nuestro estudio, el tiempo medio del procedimiento fue semejante y decidimos abandonarlo en 4 pacientes tras múltiples intentos de colocación del electrodo en una posición estable, sin éxito. Igualmente, tuvimos las mismas dificultades que este autor comunica a la hora de posicionar los electrodos de estimulación convencionales en el septo, de manera que, incluso en los pacientes en que se logró finalmente la EPHH, precisamos muchos reintentos antes de conseguir la fijación definitiva. No dudamos que el desarrollo en el futuro de electrodos especiales para implante en el haz de His y la mejora de la técnica, asumiendo una curva de aprendizaje por parte de los implantadores, contribuirá a una reducción significativa del tiempo medio del procedimiento, mejorando la tolerancia de los pacientes, la mayoría con un perfil de edad avanzado, bajo anestesia local.
Nuestros datos apoyan la posibilidad de EPHH en un grupo seleccionado de pacientes con sistema de conducción distal normal; sin embargo, creemos que los pacientes con bloqueo AV suprahisiano de otra naturaleza, como bloqueo AV congénito, podrían ser excelentes candidatos para este tipo de estimulación. Parece claro que aquellos pacientes con trastorno de la conducción en el sistema His-Purkinje o intraventricular, manifestado por QRS ancho y HV prolongado, no serían adecuados para EPHH.
A partir de este momento nuestros esfuerzos deben ir dirigidos principalmente al diseño de electrodos que faciliten su implante en el haz de His y a la realización de estudios prospectivos que nos permitan establecer con exactitud las indicaciones concretas de esta nueva y fisiológica modalidad de estimulación.
Limitaciones
Se trata de un estudio observacional, no ciego, sin un grupo control, con una población muy seleccionada, de manera que no nos permite establecer conclusiones definitivas ni recomendar el uso sistemático de la EPHH.
Estudios prospectivos con diseños adecuados nos permitirán establecer las repercusiones hemodinámicas en pacientes sin daño estructural o con diferentes cardiopatías, así como el impacto en la calidad de vida y en la mortalidad de la EPHH.
Correspondencia: Dr. P. Moriña Vázquez. Urb. Sta. María del Pilar, 39. 21005 Huelva. Recibido el 13 de febrero de 2001. Aceptado para su publicación el 6 de agosto de 2001.