La cardiopatía relacionada con el cáncer y sus tratamientos supone una preocupación creciente para el cardiólogo clínico1. La guía europea de fibrilación auricular (FA) no recomienda un tratamiento diferencial para los pacientes oncológicos, y se aplican los mismos criterios de anticoagulación que para la población general2. El riesgo embólico-hemorrágico puede verse modificado por la presencia de cáncer, y las escalas de riesgo CHA2DS2-VASc y HAS-BLED no se han validado específicamente en población oncológica.
La evidencia acerca de la utilización de los anticoagulantes orales de acción directa (ACOD) en población oncológica con FA es escasa. Los estudios pivotales de los ACOD excluyeron a los pacientes con corta supervivencia estimada o trombocitopenia < 100.000/μl. Por lo tanto, no se dispone de datos específicos de seguridad y eficacia de los ACOD en pacientes con FA y cáncer.
El cáncer de mama (CaM) es muy prevalente, y es habitual el uso de quimioterápicos que se asocian con mayor incidencia de FA. Su gran supervivencia habitual permite un seguimiento largo.
Nuestro objetivo principal es evaluar si existen diferencias en la aparición de eventos isquémicos y hemorrágicos en las pacientes con CaM y FA no valvular, en función del perfil de riesgo y la estrategia antitrombótica. Otros objetivos son describir nuestra muestra y calcular las puntuaciones de riesgo para evaluar su validez para predecir eventos.
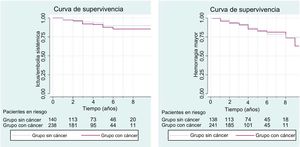
Se realizó un estudio observacional retrospectivo multicéntrico en 9 hospitales terciarios nacionales en pacientes con diagnósticos concomitantes de FA no valvular y CaM entre enero de 2011 y enero de 2018. Se incluyó a las pacientes consecutivas con CaM y FA de consultas de oncología y cardiología (independientemente del estadio del cáncer). El criterio de exclusión fue FA valvular y/o prótesis mecánicas. Esta muestra se comparó con una cohorte de mujeres con FA sin cáncer que acudieron consecutivamente a consultas de cardiología. Se incluyó a 465 mujeres: 312 con FA y CaM (cohorte con cáncer) y 153 con FA sin cáncer (cohorte sin cáncer). Las comparaciones entre ambos grupos se realizaron mediante la prueba de la χ2 o la de la t de Student para variables categóricas o continuas de distribución paramétrica respectivamente. Se realizó un análisis de supervivencia mediante regresión de Cox para determinar la capacidad predictiva de las escalas CHA2DS2-VASc y HAS-BLED en esta población. Se utilizaron curvas de Kaplan-Meier para comparar el tiempo hasta un evento isquémico o hemorrágico entre pacientes oncológicas y no oncológicas (figura). Se analizaron las hazard ratio (HR) con sus respectivos intervalos de confianza del 95% (IC95%). El análisis estadístico se realizó con SPSS versión 22.
Se recogieron los datos clínicos y se calcularon las puntuaciones de riesgo en ambos grupos. Los eventos embólicos incluyeron ictus y tromboembolia. Los eventos hemorrágicos incluyeron hemorragia intracraneal o gastrointestinal, epistaxis y anemización.
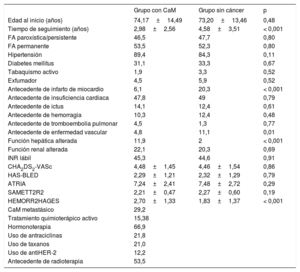
Las características basales se recogen en la tabla. El 97,4% de las pacientes tenían indicación de anticoagulación2, pese a lo cual el 15,5% del grupo con cáncer y el 11,3% del grupo de control no la recibían (p = 0,005). El uso de ACOD fue menor en el grupo de CaM (el 16 frente al 25,3%; p = 0,004). En el 26,2% de la muestra se realizó algún cambio de tratamiento antitrombótico en el seguimiento (de antagonista de la vitamina K a ACOD, el 15,1%).
Características basales de la muestra
| Grupo con CaM | Grupo sin cáncer | p | |
|---|---|---|---|
| Edad al inicio (años) | 74,17±14,49 | 73,20±13,46 | 0,48 |
| Tiempo de seguimiento (años) | 2,98±2,56 | 4,58±3,51 | < 0,001 |
| FA paroxística/persistente | 46,5 | 47,7 | 0,80 |
| FA permanente | 53,5 | 52,3 | 0,80 |
| Hipertensión | 89,4 | 84,3 | 0,11 |
| Diabetes mellitus | 31,1 | 33,3 | 0,67 |
| Tabaquismo activo | 1,9 | 3,3 | 0,52 |
| Exfumador | 4,5 | 5,9 | 0,52 |
| Antecedente de infarto de miocardio | 6,1 | 20,3 | < 0,001 |
| Antecedente de insuficiencia cardiaca | 47,8 | 49 | 0,79 |
| Antecedente de ictus | 14,1 | 12,4 | 0,61 |
| Antecedente de hemorragia | 10,3 | 12,4 | 0,48 |
| Antecedente de tromboembolia pulmonar | 4,5 | 1,3 | 0,77 |
| Antecedente de enfermedad vascular | 4,8 | 11,1 | 0,01 |
| Función hepática alterada | 11,9 | 2 | < 0,001 |
| Función renal alterada | 22,1 | 20,3 | 0,69 |
| INR lábil | 45,3 | 44,6 | 0,91 |
| CHA2DS2-VASc | 4,48±1,45 | 4,46±1,54 | 0,86 |
| HAS-BLED | 2,29±1,21 | 2,32±1,29 | 0,79 |
| ATRIA | 7,24±2,41 | 7,48±2,72 | 0,29 |
| SAMETT2R2 | 2,21±0,47 | 2,27±0,60 | 0,19 |
| HEMORR2HAGES | 2,70±1,33 | 1,83±1,37 | < 0,001 |
| CaM metastásico | 29,2 | ||
| Tratamiento quimioterápico activo | 15,38 | ||
| Hormonoterapia | 66,9 | ||
| Uso de antraciclinas | 21,8 | ||
| Uso de taxanos | 21,0 | ||
| Uso de antiHER-2 | 12,2 | ||
| Antecedente de radioterapia | 53,5 |
CaM: cáncer de mama; FA: fibrilación auricular.
Los valores expresan porcentaje o media±desviación estándar.
La presencia de CaM no supuso un incremento en eventos embólicos o hemorrágicos. Un 11% del grupo con cáncer sufrió algún evento embólico, frente al 13,2% del grupo sin cáncer (log-rank test, 0,71; p = 0,72). El 15,9% del grupo con CaM sufrió algún evento hemorrágico, frente al 18,2% del grupo sin cáncer (log-rank test, 0,73; p = 0,74).
No se observaron diferencias entre ambos grupos en el poder predictivo de las puntuaciones de riesgo. La escala CHA2DS2-VASc fue útil para predecir eventos embólicos (HR = 1,4; IC95%, 1,2-1,6, p < 0,001). La capacidad discriminativa medida mediante área bajo la curva fue superior en el grupo con cáncer (0,69) que en el de control (0,53), con valores del estadístico C de 0,67 y 0,56 respectivamente. La HAS-BLED fue útil para predecir eventos hemorrágicos en ambos grupos por igual (HR = 1,5; IC95%, 1,3-1,8; p < 0,001). El área bajo la curva en los grupos con (0,67) y sin cáncer (0,64) fueron similares, mientras que el valor del estadístico C fue superior en el grupo sin cáncer (0,60 y 0,75 respectivamente). Estos resultados son congruentes con los de estudios similares3.
En el análisis por subgrupos de los estudios ROCKET4 y RELY5, el riesgo de hemorragia de los pacientes oncológicos fue 2-6 veces superior. El CaM no confiere una especial tendencia a la hemorragia, y en estos estudios los pocos pacientes con cáncer incluían otros con mayor riesgo de hemorragia (cáncer colorrectal).
Nuestro estudio tiene varias limitaciones, ya que es observacional, con datos de registros hospitalarios. Las pacientes con cáncer más avanzado tienen menos representación. El grupo de pacientes con FA sin cáncer se seleccionó de consultas de cardiología (probable sesgo de selección).
Como conclusiones, la presencia de CaM no implica una mayor incidencia de eventos embólicos o hemorrágicos en pacientes con FA. El antecedente de CaM implica un peor tratamiento antitrombótico para las pacientes con FA: menor uso de ACOD y mayor porcentaje de pacientes no anticoaguladas pese a tener indicación. Las puntuaciones de riesgo CHA2DS2-VASc y HAS-BLED predicen eventos embólicos y hemorrágicos (respectivamente) en pacientes con CaM y FA, sin diferencias con la población general en su poder predictivo. Estas pacientes deberían seguir las guías clínicas de la población general en cuanto a anticoagulación.
FINANCIACIÓNBeca no condicionada de Abbott.