Si dejamos a un lado los casos de fibrilación auricular de mecanismo predominantemente eléctrico, como en el síndrome de Wolff-Parkinson-White o en la fibrilación auricular inducida por otra taquicardia (taquicardia inducida por taquicardia), en la mayoría de los casos la fibrilación auricular es la vía final de enfermedades cardiovasculares y factores de riesgo que desembocan en un proceso degenerativo de la aurícula. El problema es que la fibrilación auricular adquiere protagonismo propio y se erige en un factor independiente de morbimortalidad. Es necesario aumentar el conocimiento de la epidemiología de la fibrilación auricular, mejorar modalidades no invasivas para la identificación de los componentes que intervienen en el remodelado cardiaco que promueven la fibrilación auricular y desarrollar nuevos modelos animales para mejorar el conocimiento fisiopatológico de la fibrilación auricular humana. Una vez que se produce la fibrilación auricular, los esfuerzos se encaminan a evitar su progresión hacia formas más persistentes y sus consecuencias principales (insuficiencia cardiaca e ictus). A pesar de que las estrategias de prevención, en paralelismo con lo que podría ser el modelo de la aterosclerosis, se hacen fundamentales, también hay un margen de mejora terapéutica importante en el tratamiento de los pacientes con fibrilación auricular clínica, especialmente aquellos con insuficiencia cardiaca o riesgo alto de enfermedad tromboembólica. En este artículo se hace una revisión de los aspectos epidemiológicos de la fibrilación auricular, sus comorbilidades asociadas y las estrategias de prevención y tratamiento.
Palabras clave
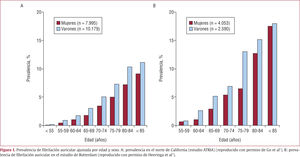
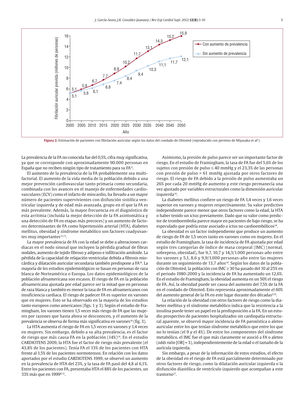
La fibrilación auricular (FA) es la arritmia sostenida crónica más común, su prevalencia se dobla con cada década de la vida, desde el 0,55% a los 50–59 años hasta el 9% en la década de los 80–89 años. Según el estudio ATRIA, 3 millones de norteamericanos padecerán FA en 2020 y 5,6 millones en 20501 (fig. 1 A). Sin embargo, estas estimaciones son más conservadoras que las de Miyasaka et al2, que consideran que la cifra de pacientes con FA alcanzará casi 9 millones en 2020 y 16 millones en 2050 si se mantiene la tasa de aumento de prevalencia del 12% que se ha observado en los últimos 21 años (fig. 2). Esta diferencia de estimaciones puede deberse a que en el estudio del Condado de Olmsted (Minnesota, Estados Unidos) se incluyó a pacientes con FA paroxística y asintomática2. Esta observación es muy importante, ya que los grandes estudios epidemiológicos de FA (Framingham, West of Australia, Clínica Mayo) se han basado en FA crónica o permanente, por lo que es posible que se haya subestimado su prevalencia3–5. Así, según las estimaciones de Framingham, 1 de cada 4 personas entre 40 y 49 años padecerá FA a lo largo de su vida y aproximadamente 1 de cada 6 personas si no presenta en su evolución infarto de miocardio ni insuficiencia cardiaca6.
Estimación de pacientes con fibrilación auricular según los datos del condado de Olmsted (reproducido con permiso de Miyasaka et al2).
En Europa, en el estudio de Rotterdam se observó una prevalencia ajustada por edad similar, si bien los valores fueron más altos en todos los grupos de edad, hasta alcanzar el 17% en el grupo de mayores de 85 años7 (fig. 1B).
Varios estudios han analizado la prevalencia de la FA en España:
- •
El estudio CARDIOTENS 1999 mostró una prevalencia general de FA del 4,8%. Se trata de un estudio transversal en el que se recogió información de 32.051 pacientes que acudían a la consulta del médico de atención primaria o del cardiólogo. La prevalencia aumentaba con la edad entre el 1% en pacientes mayores de 50 años y el 11,1% en los de 80 o más años. Sin embargo, debido a la forma de selección de los pacientes, no es un estudio poblacional8. En el estudio transversal y multicéntrico CARDIOTENS 2, que se llevó a cabo en 2009 y recogió información de 25.137 pacientes que acudían a la consulta de aten ción primaria o de cardiología, la prevalencia de FA fue del 6,1%15.
- •
El estudio REGICOR, realizado sobre estratos de población aleatorizada, mostró una prevalencia del 0,7%. Sin embargo, tiene la limitación de haber excluido a pacientes mayores de 74 años9.
- •
El estudio PREV-ICTUS, transversal de base poblacional, incluyó a 7.108 sujetos de más de 60 años que acudían a la consulta de atención primaria o especializada con el objetivo de valorar el riesgo de ictus en la población española. La prevalencia de FA fue del 8,5%, oscilando entre el 4,5% en sujetos de 60–64 años y el 16,5% en los de edad > 80 años. La prevalencia fue significativamente mayor entre los varones10.
Las diferencias entre los resultados publicados se deben fundamentalmente a dos factores: la edad de la población incluida y que el criterio utilizado para definir la FA fuera electrocardiográfico, clínico o ambos. Además, los estudios que incluían a pacientes que acudían a la consulta del especialista presentaban valores más altos, lo que constituye un importante sesgo de selección.
Recientemente se ha presentado el estudio OFRECE, que se diseñó como un estudio observacional poblacional para conocer la prevalencia de la FA y la angina estable en la población española mayor de 40 años. Se incluyó a 6.566 pacientes con una media de edad de 60 años. La prevalencia general fue del 4,2% (el 4,7% de los varones y el 3,9% de las mujeres), lo que representa aproximadamente 900.000 personas en España. La prevalencia oscilaba entre el 0,2% en la década de los 40 años hasta el 15,7% en edades > 80 años. La prevalencia ajustada por edad fue del 3,8%. Este dato es muy superior al 1–2% manejado en la literatura2. La prevalencia de la FA no conocida fue del 0,5%, cifra muy significativa, ya que se corresponde con aproximadamente 90.000 personas en España que no reciben ningún tipo de tratamiento para su FA11.
El aumento de la prevalencia de la FA probablemente sea multi-factorial. El aumento de la vida media de la población debido a una mejor prevención cardiovascular tanto primaria como secundaria, combinada con los avances en el manejo de enfermedades cardiovasculares (ECV) como el infarto de miocardio, ha llevado a un mayor número de pacientes supervivientes con disfunción sistólica ventricular izquierda y de edad más avanzada, grupo en el que la FA es más prevalente. Además, la mayor frecuencia en el diagnóstico de esta arritmia (incluida la mejor detección de la FA asintomática y una detección de FA en etapas más precoces) y un aumento de factores determinantes de FA como hipertensión arterial (HTA), diabetes mellitus, obesidad y síndrome metabólico son factores coadyuvantes muy importantes12,13.
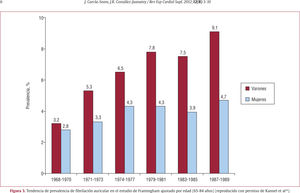
La mayor prevalencia de FA con la edad se debe a alteraciones cardiacas en el nodo sinusal que incluyen la pérdida gradual de fibras nodales, aumento de tejido fibroso y adiposo e infiltración amiloide. La pérdida de la capacidad de relajación ventricular debida a fibrosis miocárdica y dilatación auricular secundaria también predispone a FA14. La mayoría de los estudios epidemiológicos se basan en personas de raza blanca de Norteamérica o Europa. Los datos epidemiológicos de la población afroamericana son escasos. El riesgo de FA en la población afroamericana ajustada por edad parece ser la mitad que en personas de raza blanca y también es menor la tasa de FA en afroamericanos con insuficiencia cardiaca. El riesgo de padecer FA es superior en varones que en mujeres. Esto se ha observado en la mayoría de los estudios tanto europeos como americanos (figs. 1 y 3). Según el estudio de Framingham, los varones tienen 1,5 veces más riesgo de FA que las mujeres por razones que hasta ahora se desconocen, y el aumento de la prevalencia se observa de forma más significativa en varones14 (fig. 3).
Tendencia de prevalencia de fibrilación auricular en el estudio de Framingham ajustado por edad (65–84 años) (reproducido con permiso de Kannel et al14).
La HTA aumenta el riesgo de FA en 1,5 veces en varones y 1,4 veces en mujeres. Sin embargo, debido a su alta prevalencia, es el factor de riesgo que más causa FA en la población (14%)14. En el estudio CARDIOTENS 2009, la HTA fue el factor de riesgo más prevalente (el 43,8% de los pacientes). Tenía FA el 13% de los pacientes con HTA frente al 1,5% de los pacientes normotensos. En relación con los datos aportados por el estudio CARDIOTENS 1999, se observó un aumento en la prevalencia de HTA del 23%, y la tasa de FA pasó del 4,8 al 6,1%. Entre los pacientes con FA, presentaba HTA el 88% de los pacientes, un 33% más que en 19998,15.
Asimismo, la presión de pulso parece ser un importante factor de riesgo. En el estudio de Framingham, la tasa de FA fue del 5,6% de los sujetos con presión de pulso < 40mmHg y el 23,3% de las personas con presión de pulso > 61mmHg ajustada por otros factores de riesgo. El riesgo de FA debido a la presión de pulso aumentaba un 26% por cada 20mmHg de aumento y este riesgo permanecía una vez ajustado por variables estructurales como la dimensión auricular izquierda14.
La diabetes mellitus confiere un riesgo de FA 1,4 veces y 1,6 veces superior en varones y mujeres respectivamente. Su valor predictivo independiente parece menor que otros factores como la edad, la HTA o haber tenido un ictus previamente. Dado que su valor como predictor de tromboembolia parece mayor en pacientes de bajo riesgo, se ha especulado que podría estar asociado a ictus no cardioembólicos14.
La obesidad es un factor independiente que produce un aumento de riesgo de FA de 1,5 veces tanto en varones como en mujeres. En el estudio de Framingham, la tasa de incidencia de FA ajustada por edad según tres categorías de índice de masa corporal (IMC) (normal, sobrepeso, obesidad), fue 9,7, 10,7 y 14,3/1.000 personas-año entre los varones y 5,1, 8,6 y 9,9/1.000 personas-año entre las mujeres durante un seguimiento de 13,7 años14. Según los datos de la población de Olmsted, la población con IMC > 30 ha pasado del 10 al 25% en el periodo 1980–2000 y la incidencia de FA ha aumentado un 12,6%. En el estudio de Framingham, la obesidad aumenta en un 50% el riesgo de FA. Así, la obesidad puede ser causa del aumento del 7,5% de la FA en el condado de Olmsted. Esto representa aproximadamente el 60% del aumento general de la FA en este lugar durante dos décadas2,16.
La relación de la obesidad con otros factores de riesgo como la diabetes mellitus y el síndrome metabólico indica que la resistencia a la insulina puede tener un papel en la predisposición a la FA. En un estudio prospectivo de pacientes hospitalizados sin cardiopatía estructural aparente, se observó mayor incidencia de FA paroxística o aleteo auricular entre los que tenían síndrome metabólico que entre los que no lo tenían (el 9 y el 4%). De entre los componentes del síndrome metabólico, el IMC fue el que más claramente se asoció a FA o aleteo (odds ratio [OR]=3), independientemente de la edad o el tamaño de la aurícula izquierda.
Sin embargo, a pesar de la información de estos estudios, el efecto de la obesidad en el riesgo de FA está parcialmente determinado por otros factores de riesgo, como la dilatación auricular izquierda o la disfunción diastólica de ventrículo izquierdo que acompañan a este trastorno17.
El síndrome de apnea/hipopnea del sueño es un trastorno caracterizado por la presencia de apneas/hipopneas de 10 s o más de duración, que condicionan la hipoxemia arterial. Ocurre en un 4–5% de la población y en un 32–49% de los pacientes con FA. La tasa de recurrencia de FA tras una cardioversión eléctrica es mayor en pacientes con apnea del sueño no tratada que en aquellos en tratamiento con presión positiva continua en la vía aérea (CPAP, del inglés continuous positive airway pressure). Sin embargo, es necesario realizar estudios prospectivos para analizar la interacción de la apnea del sueño con la FA debido a la relación del síndrome de apnea del sueño con la obesidad, el síndrome metabólico, la cardiopatía isquémica, la insuficiencia cardiaca y el ictus18.
La disfunción diastólica acompaña frecuentemente a la edad, la HTA, la obesidad, la diabetes mellitus, la insuficiencia cardiaca y la cardiopatía isquémica y es un marcador de FA de nueva aparición en personas de edad avanzada; además, ofrece información complementaria a los marcadores clínicos. Así, la ocurrencia de FA de nueva aparición se observa en el 1% de los pacientes de edad avanzada con disfunción diastólica ligera, el 12% si la disfunción es moderada y el 20% si la disfunción es grave19.
El hipertiroidismo ha sido durante décadas un controvertido factor de riesgo de FA. Un 10–15% de los pacientes con hipertiroidismo y FA han tenido un evento tromboembólico. El estudio de Framingham ha establecido una relación entre cifras bajas de tirotropina (TSH) (< 0,1mU/l) y un riesgo 3 veces mayor de FA durante una década. Esta relación entre el hipertiroidismo subclínico y la FA se ha corroborado por el Cardiovascular Health Study, que mostró una incidencia de FA 2 veces mayor entre las personas con hipertiroidismo subclínico (el 1,5% de los mayores de 65 años) respecto a los eutiroideos. No obstante, no se observaron diferencias en ECV ni mortalidad entre los eutiroideos y los sujetos con hipertiroidismo subclínico14.
Existen otros factores de riesgo asociados al desarrollo de FA. Algunos, como la inflamación, el consumo de alcohol, la práctica de deportes de alta resistencia y la predisposición genética, están sustentados en varios estudios clínicos. Otros, con un nivel de evidencia menor, son talla alta, consumo de tabaco, enfermedad pulmonar obstructiva crónica (EPOC), prolongación del intervalo PR, bloqueo incompleto de rama izquierda e insuficiencia renal o microalbuminuria20.
Mortalidad asociada a la fibrilación auricularMúltiples cohortes muestran una asociación entre la FA y mortalidad, aunque no se conoce con precisión el mecanismo por el que la FA produce de forma independiente una mayor mortalidad. En el estudio de Framingham se observó un aumento de mortalidad de 1,5 a 1,9 veces entre los pacientes que sufrieron FA respecto a los que no21. En las cohortes de Renfrew/Paisley de Reino Unido22 y Canadá23, se observaron resultados similares. En el estudio epidemiológico del área de Marshfield (Estados Unidos), el riesgo de muerte atribuible a FA fue todavía mayor, con un aumento de 2,4 veces en el grupo que sufrió FA en un seguimiento a 4 años24.
La ocurrencia de FA se ha demostrado de valor pronóstico adverso en subgrupos más específicos de pacientes con ECV. Así, en el estudio VALIANT, que comparó el efecto de valsartán, captopril o ambos en pacientes con infarto agudo de miocardio complicado con insuficiencia cardiaca o disfunción sistólica ventricular izquierda, se observó un aumento del riesgo de muerte o eventos cardiovasculares mayores (insuficiencia cardiaca, infarto de miocardio, parada cardiaca o ictus) entre quienes sufrieron FA en el seguimiento respecto a los que no25.
Los datos obtenidos del seguimiento de estas cohortes han puesto de manifiesto el valor predictivo independiente de mortalidad de la FA, los factores de riesgo de FA y el riesgo aumentado de padecer comorbilidades (insuficiencia cardiaca e ictus) de los pacientes con FA. Sin embargo, la mayor parte de los estudios presentaban la forma de FA permanente y no ofrecían información de la FA solitaria. Existen muy pocos datos epidemiológicos de la FA solitaria. Además, el conocimiento de nuevos factores de riesgo ha reducido notablemente este subgrupo. Una de las series que ofrece información de la historia natural de la FA solitaria es la cohorte del condado de Olmsted, en la que se incluyó a 76 pacientes con un primer episodio de FA documentado entre 1950 y 1980, sin cardiopatía concomitante, HTA ni EPOC y edad < 60 años en el momento de la inclusión, a los que se siguió durante 30 años. La supervivencia general de la cohorte con FA fue del 92% a los 15 años y el 68% a los 25 años, similar a la de la población de Minnesota ajustada por edad y sexo. La presencia de insuficiencia cardiaca fue ligeramente superior en la cohorte con FA y el riesgo de ictus o accidente isquémico transitorio fue similar al de la población general durante los primeros 25 años, aunque se observó un aumento significativo desde entonces. Sin embargo, todos los pacientes que sufrieron un evento cerebrovascular habían desarrollado más de un factor de riesgo de tromboembolia. La edad fue el único factor predic-tivo independiente de mortalidad (hazard ratio [HR] = 3,45) y mortalidad cardiovascular (HR = 4,57) por cada 10 años de aumento en la edad del diagnóstico inicial de FA. El estudio de Minnesota pone de relieve dos aspectos fundamentales. Primero: la FA aislada es muy infrecuente y abarca aproximadamente al 2% de los pacientes con FA. Segundo: sólo la edad al diagnóstico de FA fue un factor independiente de mortalidad, mortalidad cardiovascular y riesgo de ictus. Pero la edad avanzada también es un factor de riesgo de HTA, diabetes mellitus e insuficiencia cardiaca, todos ellos factores de riesgo de ictus26.
Recientemente se ha publicado un subestudio del Women's Health Study (WHS) que incluyó a una gran cohorte (34.722) de mujeres sanas sin FA ni cardiopatía estructural basal, seguidas durante 15 años. Este estudio ofrece información muy valiosa del pronóstico de la FA en las mujeres en general y particularmente de la forma paroxística de FA en jóvenes sin cardiopatía estructural. La aparición de FA en el seguimiento fue un factor independiente de mortalidad, mortalidad cardiovascular y mortalidad no cardiovascular. No obstante, el ajuste por la presencia de eventos cardiovasculares no mortales, particularmente insuficiencia cardiaca o ictus, atenuó el riesgo de muerte atribuida a la FA. Las mujeres con FA paroxística solamente presentaron aumento en la mortalidad cardiovascular, pero no en la mortalidad total y la no cardiovascular. Este aumento desapareció al ajustar por eventos cardiovasculares no mortales. Ninguna de las 74 personas con FA solitaria murió o sufrió un ictus durante 7 años de seguimiento, y sólo 2 pacientes sufrieron insuficiencia cardiaca. Estos datos, aunque limitados, concuerdan con la baja morbilidad observada en la cohorte con FA solitaria del Condado de Olmsted27.
La morbimortalidad de la FA está determinada fundamentalmente por las complicaciones asociadas. Para conocer el pronóstico de la FA, se realizó la European Heart Survey, que reclutó a 5.333 pacientes a los que se diagnóstico FA en 2003–2004, con un seguimiento de 1 año28. La mortalidad total al cabo del año fue del 5,3%, con un 67% de las causas de origen cardiovascular. La mortalidad fue más alta entre los pacientes con la forma permanente (8,2%) y un primer episodio detectado (5,7%) respecto a las formas paroxística y persistente. La mortalidad entre los pacientes que padecieron un ictus isquémico fue del 21%. Respecto a la morbilidad, el 1,6% de los pacientes sufrieron un ictus y el 4,3%, una complicación tromboembólica. Se observó un primer episodio de insuficiencia cardiaca en el 5% de los pacientes y un empeoramiento de esta en casi el 25%. El valor pronóstico negativo del cambio de estadio de la FA hacia formas más persistentes se ha confirmado recientemente en una cohorte de pacientes con FA seguidos en atención primaria29.
Fibrilación auricular asintomáticaConstituyen un grupo con interés relevante los pacientes con FA asintomática. El diagnóstico de FA asintomática es un reto en la actualidad. Se estima que su prevalencia es de un 25–30% de la totalidad de la FA, pero los dispositivos modernos de estimulación y desfibrilación, con capacidad de almacenamiento de electrogramas, han puesto en evidencia que hasta un 50–60% de los pacientes tienen episodios no sospechados de FA, la mitad de los cuales dura más de 48h30. En una serie de 110 pacientes sometidos a implante de marcapasos y con antecedentes de FA paroxística o persistente, se observó una recu-rrencia de FA en el dispositivo del 88% al cabo de 19 meses. Un 46% de los pacientes tenía episodios de FA > 48h y el 17% tenía episodios de FA > 48h y estaba asintomático y en ritmo sinusal en las visitas de seguimiento31.
El tratamiento farmacológico antiarrítmico y el tratamiento con ablación con catéter han producido un cambio en el perfil clínico de los pacientes al convertir episodios de FA sintomáticos en asintomáticos. En una serie de ablación con catéter de radiofrecuencia en pacientes con FA sintomática refractaria a tratamiento farmacológico, se observó, en el estudio Holter de 7 días previo a la ablación, que el 57% de los pacientes presentaba episodios de FA sintomáticos y asintomáticos y el 5%, sólo FA asintomática. A los 6 meses de la ablación, el 37% presentaba sólo FA asintomática32. Esto indica que incluso en una población con FA altamente sintomática pueden ocurrir episodios de FA asintomáticos, que aumentan tras la ablación probablemente por la denervación secundaria. Estos pacientes con FA no reconocida no reciben el tratamiento preventivo apropiado y están en riesgo de ictus o de taquicardiomiopatía en caso de frecuencias cardiacas elevadas.
En el estudio AFFIRM33, el 57% de los ictus en el grupo control de ritmo fueron en pacientes en quienes se había suspendido la anticoagulación oral por la creencia de que la FA se había suprimido. Muy probablemente se debió a FA asintomática. Las características de los pacientes con FA asintomática y su valor pronóstico se han evaluado en un subestudio del AFFIRM33. Un 12% de los pacientes de ese estudio estaban asintomáticos, eran en su mayoría varones y tenían incidencias de enfermedad coronaria e insuficiencia cardiaca más bajas, pero una mayor tasa de eventos cerebrovasculares respecto a los sintomáticos. La duración de la FA era más larga, con una frecuencia máxima más baja y mejor función ventricular izquierda que los sintomáticos. La mortalidad y los eventos mayores (ictus discapacitante, encefalopatía anóxica, parada cardiaca o hemorragia mayor) fueron similares que en el grupo de sintomáticos.
La estimación de la frecuencia de pacientes con FA asintomática varía según la duración de la arritmia. En el estudio ALFA34, que reclutó un 51% de FA crónica, la tasa de FA asintomática fue del 11%. En una serie de FA crónica exclusivamente, la tasa de pacientes asintomáticos fue del 32%35. En el estudio SPAAF-III, el 85% tenía una FA crónica y el 45% estaba asintomático, y se los reclutó por un ECG que detectó casualmente la FA36. Estos datos indican que los síntomas disminuyen a medida que la duración de la FA es mayor.
Consecuencias de la fibrilación auricularInsuficiencia cardiacaLa coexistencia de FA e insuficiencia cardiaca es un problema de una magnitud epidemiológica importante. Según el estudio de Framingham6, 1/4 personas padecerá FA a lo largo de su vida y 1/4 pacientes con FA sufrirá insuficiencia cardiaca en un periodo de 6 años desde el diagnóstico, según datos de la cohorte de Olmsted37. La FAy la insuficiencia cardiaca están interrelacionadas de tal forma que la FA promueve la aparición de insuficiencia cardiaca y esta promueve la aparición de FA.
La insuficiencia cardiaca aumenta el riesgo de FA en 4,5 veces en varones y 5,9 veces en mujeres. La prevalencia de FA se correlaciona con la extensión de la disfunción sistólica ventricular izquierda y con la clase funcional. Así, ocurre FA en el 10% de los pacientes en clase funcional I-II de la New York Heart Association (NYHA) y en el 50% de los pacientes en clase IV38.
El valor pronóstico de la FA en pacientes con disfunción sistólica previa es controvertido. El estudio SOLVD (Studies Of Left Ventricular Dysfunction) de prevención y tratamiento incluyó a 6.517 pacientes con disfunción sistólica, de los que 419 tenían FA basalmente, y los siguió durante 3 años. La mortalidad total fue mayor en el grupo con FA basal que en el grupo con ritmo sinusal (el 34 y el 23%) independientemente de la edad, la fracción de eyección ventricular izquierda y la clase funcional39. El estudio DIG ha demostrado también un aumento de mortalidad entre los pacientes con arritmias supraventri-culares. Incluyó a 7.788 pacientes con insuficiencia cardiaca seguidos durante 38 meses. Durante el seguimiento, un 11% de los pacientes sufrió arritmias supraventriculares; este grupo presentó un riesgo de muerte más alto (HR=2,45) y mayor riesgo de hospitalización por insuficiencia cardiaca (HR=3)40.
Sin embargo, no todos los estudios han identificado la FA como un factor independiente de mortalidad en pacientes con insuficiencia cardiaca. Los estudios V-HeFT41 y PRIME no mostraron valor predic-tivo independiente de la FA sobre la mortalidad42.
Otro aspecto diferente es el valor pronóstico de la FA de nueva aparición en pacientes con insuficiencia cardiaca. Este aspecto se analizó en la EuroHeart Failure Survey43. En esa encuesta, la FA de nueva aparición en una cohorte de 10.701 pacientes se asoció a un exceso de mortalidad hospitalaria entre los pacientes ingresados por insuficiencia cardiaca, con un aumento del 53% del riesgo de muerte intrahospi-talaria respecto a los pacientes sin antecedentes de FA que no la sufrieron durante el ingreso y los pacientes con FA previa. Otros estudios en este subgrupo de pacientes44,45 han confirmado esos datos.
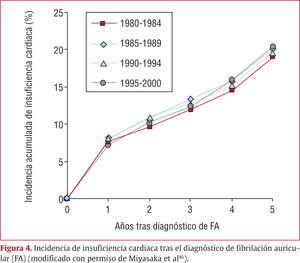
La incidencia y la mortalidad de la insuficiencia cardiaca en pacientes con FA se evaluaron en un estudio poblacional que incluyó a 3.224 pacientes diagnosticados de primer episodio de FA sin insuficiencia cardiaca previa en el condado de Olmsted durante dos décadas (1980–2000). El 24% sufrió insuficiencia cardiaca durante un seguimiento medio de 6 años. Los pacientes que padecieron insuficiencia cardiaca tuvieron mayor riesgo de muerte (HR = 3,4) que quienes no la padecieron en su evolución. La aparición de insuficiencia cardiaca fue más frecuente en el primer año del diagnóstico de FA, y luego tuvo una incidencia estable. No se observó una reducción significativa en la incidencia y el riesgo de muerte de la insuficiencia cardiaca tras el diagnóstico de FA durante las dos décadas (fig. 4). Esta observación se ha corroborado en la European Heart Survey, en la que se incluyó a 1.816 pacientes (34%) con FA e insuficiencia cardiaca con disfunción sistólica de ventrículo izquierdo. Sólo un 40% de ellos estaba en tratamiento con bloqueadores beta e inhibidores del sistema renina-angiotensina (inhibidores de la enzima de conversión de la angiotensina [IECA] o antagonistas del receptor de la angiotensina II [ARA-II]). Además, sólo el 29% recibió tratamiento para FA e insuficiencia cardiaca consistente en bloqueadores beta, IECA o ARA-II y anticoagulantes orales46.
Incidencia de insuficiencia cardiaca tras el diagnóstico de fibrilación auricular (FA) (modificado con permiso de Miyasaka et al46).
Los progresos terapéuticos en pacientes con insuficiencia cardiaca en las últimas décadas no se han visto en el subgrupo con FA. Estos datos ponen de manifiesto que existe un amplio margen de mejora en el tratamiento de los pacientes en que coexisten ambos trastornos.
IctusEl ictus es la complicación más devastadora de los pacientes con FA. La FA se asocia a un estado protrombótico que incrementa el riesgo de ictus con respecto a la población general ajustada por edad47. En el estudio de Framingham, el riesgo de ictus fue de 4 a 5 veces mayor en los pacientes con FA que en los que no la tenían48. En el estudio de Renfrew/Paisley, la tasa de ictus fue 2,5 a 3,2 veces mayor en pacientes con FA en un seguimiento de 25 años22.
El ictus cardioembólico es el tipo más frecuente, el que presenta mayor tasa de recurrencia y el que tiene la supervivencia más baja. Además, es el tipo de ictus con mayor repercusión clínica al ingreso y menor recuperación durante su estancia hospitalaria49. Asimismo, presenta una estancia hospitalaria más prolongada, mayor tasa de complicaciones hospitalarias y una mortalidad 3,5 veces mayor respecto al ictus no cardioembólico50.
Se han observado diferencias en el coste según el tipo de ictus. El gasto medio del cuidado de un ictus agudo cardioembólico fue de 4.890 euros, significativamente mayor que el gasto por cuidados del ictus agudo no cardioembólico (3.550 euros por paciente). El coste de rehabilitación también fue mayor en el ictus cardioembólico50.
Aproximadamente el 30% de los ictus son de origen cardioembólico, y se estima que un 60–70% se deben a FA. Es considerable el impacto clínico y económico relacionado con la salud que la embolia cardiaca en el ictus origina no sólo por su frecuencia alta entre los pacientes con ictus, sino porque los pacientes con la forma cardioembólica sufren consecuencias más incapacitantes, su tratamiento hospitalario es más largo y la utilización de recursos es mayor. Se estima que el coste del ictus cardioembólico puede exceder un 40% el coste del ictus no cardioembólico50.
En conclusión, el ictus cardioembólico es la forma más frecuente de los ictus isquémicos, se asocia a ictus más graves y más incapacitantes y mayores recurrencia, mortalidad y coste económico.
La HTA es el más frecuente factor de riesgo de FA y contribuye a aumentar la tasa de ictus o embolia sistémica. En los estudios SPOR-TIF III y V (ximelagatrán frente a warfarina en FA), se detectó en pacientes anticoagulados un aumento del riesgo de eventos (ictus o embolia sistémica) del 83% en el cuartil superior (presión arterial sistólica [PAS] > 140mmHg) respecto al cuartil inferior (PAS < 122mmHg), con tasas de sangrado mayor similares. En ambos estudios se detectó un porcentaje alto de pacientes con cifras de PAS > 140mmHg (el 36% en el SPORTIFIII y el 21% en el SPORTIF V)51. Un adecuado control de la presión arterial supone una mejora importante para los pacientes con FA para reducir la incidencia de ictus.
A pesar del beneficio del tratamiento anticoagulante en la prevención del ictus, su prescripción no supera el 60% de los pacientes con alto riesgo52. En España, en el estudio CARDIOTENS 2009, el 62,7% de los pacientes con FA estaban anticoagulados, respecto al 33% en 1999, lo que constituye un aumento en el 90% en la tasa de anticoagulación. Aun así, el 35% de los pacientes con CHADS > 2 no estaban anticoagulados15. En el estudio OFRECE11, la tasa de anticoagulación en pacientes con FA alcanzaba el 70%. Como contrapartida, muchos pacientes de bajo riesgo continúan recibiendo tratamiento anticoagulante, lo que aumenta innecesariamente el riesgo de sangrado. Independientemente del esquema de riesgo de ictus utilizado, la profilaxis antitrombótica se ajusta de forma muy moderada al perfil de riesgo del paciente. Factores como el riesgo de sangrado, la dificultad de acceso a la monitorización de la International Normalized Ratio (INR) o residencia muy alejada de los centros de monitorización afectan a la prescripción del tratamiento anticoagulante. Sin embargo, el factor más influyente es la menor prescripción médica de anticoagulantes en la forma paroxística en pacientes con factores de riesgo a pesar de la evidencia proporcionada por los estudios Stroke Prevention in Atrial Fibrillation (SPAF), The Atrial Fibrillation Clopidogrel Trial with Irbesartan for Prevention of Vascular Events (ACTIVE W) y Stockholm Cohort on Atrial Fibrillation (SCAF) de que los pacientes con la forma paroxística tenían el mismo riesgo que los que tenían una forma persistente o permanente53–55.
Una vez prescrito el tratamiento anticoagulante, otro punto de clara mejoría es alcanzar un nivel de anticoagulación en ventana terapéutica (time in therapeutic range [TTR]) durante el mayor tiempo posible. Es frecuente que los pacientes presenten valores bajos de TTR, lo que se asocia a peor pronóstico. En los estudios SPORTIF III y V, el riesgo de ictus o embolia sistémica fue 2 veces mayor entre los pacientes que presentaban un TTR < 60% que entre los que presentaban un TTR > 70%. Cada 10% de aumento del tiempo fuera de ventana terapéutica se asocia a un riesgo de ictus del 10%. En los estudios SPORTIF III y V, un tercio de los pacientes tuvieron un TTR < 60%.
El INR en la práctica clínica es incluso más bajo que en los ensayos clínicos, con valores de TTR en un 55–60% y en algún caso tan bajos como el 29%51. En la European Heart Survey en FA27, se evaluó a 3.634 pacientes con alto riesgo de ictus. El 28% estaba infratratado y el 11%, sobretratado. Los pacientes infratratados tuvieron un pronóstico peor, con una tasa significativamente más alta de tromboembolia.
Los nuevos anticoagulantes orales, con un efecto más predecible que los antagonistas de la vitamina K, ofrecen una clara ventaja en este aspecto. En el estudio RE-LY, el TTR de los pacientes en el grupo de warfarina tendría que ser del 79% para igualar el beneficio obtenido en el grupo de dabigatrán 150mg56. Estos valores no se alcanzan en los ensayos clínicos y tampoco en la práctica clínica habitual.
Conflicto de interesesNinguno.