Las infecciones suponen la primera causa de fallecimiento de los 250 trasplantes cardiacos (TxC) realizados en 2014 en nuestro país en el periodo comprendido entre el primer mes y el primer año tras el trasplante (36,6%)1. La incidencia de infecciones fúngicas ha aumentado por el auge de las terapias inmunosupresoras y condiciona la elevada morbimortalidad de los pacientes de trasplante cardiaco a pesar de la eficacia de los nuevos tratamientos2.
El empiema pleural fúngico es una entidad rara, no incluida en la clasificación de enfermedades pulmonares relacionadas con Aspergillus, con una mortalidad superior al 70%. El mecanismo más frecuente de llegada del hongo a la cavidad pleural es la rotura de una cavidad aspergillar o complicación de un empiema crónico preexistente. Se presentan 2 casos de empiema pleural fúngico en trasplantados cardiacos entre octubre y diciembre de 2015 en nuestro centro.
El primero es el de un varón de 65 años, incluido en lista de TxC por miocardiopatía dilatada idiopática en situación de insuficiencia cardiaca avanzada. Tras 3 meses en lista, ingresó en situación de shock cardiogénico que precisó implante de asistencia ventricular percutánea (Impella CP) y TxC en condición de urgencia. Las serologías antes del trasplante (citomegalovirus, LUES, virus de la hepatitis B, virus de la hepatitis C, virus de la inmunodeficiencia humana, herpes zóster y toxoplasma) y el Mantoux fueron negativos. La biopsia miocárdica de control mostró ausencia de datos que indicaran rechazo agudo celular. El día 34 tras el trasplante se detectó derrame pleural derecho asintomático. Se procedió a la colocación de drenaje endotorácico, con débito de 850 ml de líquido purulento maloliente y tratamiento antibiótico de amplio espectro (meropenem y linezolid) además de uroquinasa intrapleural. Se mantuvo el tratamiento profiláctico (trimetoprim/sulfametoxazol, vanglanciclovir) y la inmunosupresión con micofenolato mofetilo, prednisona y tacrolimus. El cultivo del empiema pleural detectó crecimiento de más de 103 unidades formadoras de colonias de Aspergillus fumigatus, y el día 39 tras el trasplante se inició voriconazol en monoterapia. Las determinaciones de Aspergillus, Pneumocystis, Mycobacterium tuberculosis y galactomanano por reacción en cadena de la polimerasa de lavado bronquiolo-alveolar fueron negativos. El paciente completó 2 meses de tratamiento con voriconazol (con determinaciones de la concentración de tacrolimus cada 2 semanas) y continuó profilaxis con anfotericina B inhalada, con buena evolución clínica y radiológica.
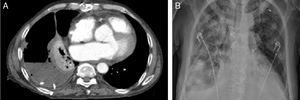
El segundo paciente es un varón de 63 años, con diagnóstico de miocardiopatía hipertrófica en fase dilatada e insuficiencia cardiaca avanzada, que ingresó en shock cardiogénico con requerimiento de fármacos inotrópicos y balón de contrapulsación intraaórtico. Tras inclusión en código urgente, recibió TxC. Las serologías antes del trasplante y el Mantoux fueron negativos. Un mes y medio tras el TxC (día 50), presentó primoinfección por citomegalovirus sintomática que precisó tratamiento con ganciclovir intravenoso. Se desarrolló una pancitopenia grave que obligó a suspender el micofenolato mofetilo y reducir la dosis de tacrolimus. Tras 3 semanas sufrió un empeoramiento clínico, y se detectó disfunción ventricular grave. Se realizó biopsia endomiocárdica, con el resultado de rechazo agudo humoral, que se trató con metilprednisolona, plasmaféresis, gammaglobulinas, rituximab y ajuste de medicación inmunosupresora. En la radiografía de tórax de control realizada el día 123 tras el trasplante, se observó derrame pleural derecho y febrícula. Esto condicionó el inicio de antibioterapia empírica. Ante la mala evolución y la sospecha de infección oportunista coexistente (figura), se aumentó el esquema antibiótico en las siguientes 48 h (piperacilina-tazobactam y linezolid). Se realizó una fibrobroncoscopia flexible, sin alteraciones endobronquiales, con reacción en cadena de la polimerasa positiva para Aspergillus. El análisis bioquímico del derrame pleural resultó compatible con empiema, se aisló crecimiento de Aspergillus fumigatus y se inició tratamiento con voriconazol intravenoso el día 137 tras el trasplante. A pesar de la cobertura farmacológica, el paciente falleció tras 12 días de tratamiento.
El tratamiento del empiema micótico es infrecuente y no está estandarizado, debido a la variable penetrancia de los antifúngicos sistémicos en la pleura; se utilizan combinaciones que incluyen 1, 2 o 3 fármacos (voriconazol, anfotericina B y equinocandina)4,5. Las recomendaciones actuales abogan por el inicio inmediato de tratamiento antifúngico en monoterapia tras el aislamiento de Aspergillus fumigatus en pacientes inmunodeprimidos. Las combinaciones antifúngicas quedan relegadas a casos de fracaso terapéutico, por lo que es necesaria la individualización5.
La profilaxis farmacológica contra las infecciones micóticas en los receptores de trasplantes de órganos sólidos, como el TxC, no es una práctica general, pero las normas recientes recomiendan valorar la instauración de profilaxis fúngica con equinocandinas, voriconazol o anfotericina B en pacientes considerados en alto riesgo (sometidos a hemodiálisis, reexploración quirúrgica tras el trasplante, colonización ambiental por Aspergillus o infección por citomegalovirus documentada)3. La sospecha clínica y el inicio temprano del tratamiento se asocian con la minimización de la mortalidad, pero suele ser necesario un tratamiento de larga duración y, en ocasiones, la resección quirúrgica.
Resultan imprescindibles una valoración individual del riesgo-beneficio, sospecha temprana de infección por agentes oportunistas y el ajuste de los factores riesgo individuales (obesidad, diagnóstico previo de diabetes mellitus, reintervención por etiología hemorrágica y los resultados de los programas de vigilancia epidemiológica)6 a los algoritmos terapéuticos de cada hospital. En nuestro centro se realiza vigilancia epidemiológica mensual en las zonas quirúrgicas que conciernen al servicio de cirugía cardiaca, sin hallazgos microbiológicos durante el periodo mencionado. A pesar de estos resultados, tras demostrar el aislamiento de Aspergillus fumigatus en 4 pacientes sometidos a TxC (2 casos de afección parenquimatosa y 2 de empiema pleural), se decidió retomar la profilaxis universal con anfotericina B inhalada semanalmente durante los primeros 6 meses tras el trasplante, debido a la menor interacción de este fármaco con la terapia inmunosupresora. Tras esos primeros 6 meses, se individualiza cada caso.
CONFLICTO DE INTERESESL.H. Varela Falcón tiene una beca de la Fundación Carolina-BBVA.