INTRODUCCIÓN Y OBJETIVOS
La eyección ventricular genera, en el sistema arterial, flujos y presiones altamente pulsátiles. Los vasos sanguíneos poseen características estructurales y funcionales que disminuyen o amortiguan la pulsatilidad. Esto determina que el flujo capilar sea continuo para optimizar la perfusión tisular y que la pulsatilidad de la onda de presión sea suficientemente baja como para no dañar la fina pared capilar1. Además, un adecuado amortiguamiento es beneficioso, tanto para el corazón, ya que disminuye el trabajo cardíaco y la tensión desarrollada por el miocardio, como para las grandes arterias, ya que reduce la fatiga por estrés de la propia pared arterial2.
Existen varios factores cardiovasculares que contribuyen a la función de amortiguamiento total o global (FAG) de las ondas de presión y flujo en ambos circuitos. Las grandes arterias contribuyen a dicha función mediante su capacidad o función de amortiguamiento parietal (FAP)1. La FAP puede cuantificarse por el análisis del comportamiento mecánico parietal como un sistema viscoelástico, conformado por un conjunto resorte-amortiguador del tipo Kelvin-Voigt3,4. En consecuencia, los 2 determinantes principales de la FAP serían la viscosidad y la elasticidad parietales, que indican la capacidad de disipación de energía de los componentes de la onda del pulso y de almacenamiento de energía potencial, respectivamente1,3,4.
Los cambios en las propiedades viscoelásticas arteriales están determinados por: a) cambios crónicos en la estructura o composición histológica parietal (remodelación parietal)5-9, y b) cambios agudos secundarios a variaciones de la presión10 o volumen intravascular11 (cambios pasivos), y/o provocados por cambios en el grado de activación del músculo liso vascular (MLV) (cambios activos)3,4,8,12. La activación del MLV de las grandes arterias sistémicas permite aumentar la presión intravascular manteniendo acotada la rigidez parietal3,4,10,12.
La mayoría de los trabajos que han intentado caracterizar la función de amortiguamiento y el efecto que la activación muscular ejerce sobre ésta se han realizado en arterias sistémicas. Debido a las diferencias hemodinámicas y estructurales entre ambos circuitos, es inadecuado realizar extrapolaciones del circuito sistémico al pulmonar12,13. Según nuestro conocimiento, se han comunicado pocos estudios en los que se caractericen las propiedades viscoelásticas de la arteria pulmonar, y menos aún del circuito pulmonar y sistémico simultáneamente, en animales vivos.
El objetivo de este trabajo fue caracterizar de manera simultánea y comparativa in vivo: a) las propiedades viscoelásticas de la aorta y arteria pulmonar y su relación con la FAP, y b) el efecto directo de la activación del MLV sobre dichas propiedades y la FAP.
MATERIAL Y MÉTODO
Instrumentación y cirugía
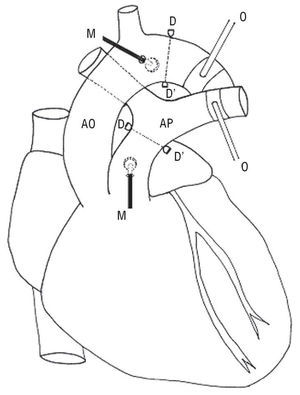
Seis ovejas de la raza Merino (26 ± 4,5 kg) anestesiadas con pentobarbital sódico intravenoso (35 mg/kg) fueron ventiladas mecánicamente. El volumen corriente y la frecuencia respiratoria se ajustaron para mantener la pO2 superior a 85 mmHg, la pCO2 entre 35-40 mmHg y el pH entre 7,35 y 7,4. Se cateterizó la vena safena para la administración de solución salina y anestésica, y el agente vasoactivo. Se expusieron los grandes vasos mediante una toracotomía lateral izquierda. Se colocaron transductores de presión (Konigsberg Instruments, Inc., Pasadena, CA) en la aorta ascendente y la arteria pulmonar principal mediante mínimas incisiones en la pared vascular. Distalmente a cada transductor de presión se suturaron, sobre la adventicia arterial, un par de cristales ultrasónicos (5 MHz, 3 mm de diámetro). Los cristales ultrasónicos fueron conectados a un sonomicrómetro (Triton Technology, San Diego, CA), el cual permitió medir la distancia entre los cristales teniendo en cuenta que el tiempo de tránsito de la señal ultrasónica en los tejidos es de 1.580 m/s. Se confirmó la calidad óptima de la señal ultrasónica mediante su visualización en un osciloscopio. Esta metodología permite obtener mediciones precisas y reproducibles de presión y diámetro debido a la elevada respuesta de la frecuencia y linealidad de los sensores3,4,10,12. Se colocaron oclusores neumáticos alrededor de la aorta descendente y de la rama izquierda de la arteria pulmonar. En la figura 1 se muestra un esquema de la instrumentación.
Fig. 1. Esquema de la instrumentación experimental. AO: arteria aorta; AP: arteria pulmonar; D-D': cristales ultrasónicos; M: microtransductores de presión; O: oclusores pulmonar y aórtico.
Protocolo experimental
Las presiones y diámetros fueron registrados durante tres condiciones experimentales:
1. Estado estable de normopresión (control).
2. Hipertensión arterial aguda pasiva (HP), obtenida mediante la oclusión parcial durante menos de 7 s de la aorta descendente y la rama izquierda de la arteria pulmonar. Debido al rápido incremento de la presión y diámetro arteriales, las respuestas parietales reflejaron cambios pasivos en las propiedades viscoelásticas parietales10,12. En cada arteria, las oclusiones se realizaron hasta alcanzar una presión arterial media y sistólica similar a la obtenida durante la hipertensión activa.
3. Hipertensión arterial activa (HA): obtenida mediante una infusión continua intravenosa (i.v.) de fenilefrina (Sigma, St. Louis, MO) a dosis de 5 μg/kg/min. Los registros se realizaron tras 15 min de iniciada la administración del fármaco para asegurar valores estables de presión y diámetro.
Se dejó que transcurrieran 10 min después de cada maniobra para permitir el retorno de las señales de presión y diámetro a los valores del estado control. Los animales fueron sacrificados al finalizar el experimento y durante la necroscopia se confirmó la correcta posición de los sensores de presión y diámetro. El protocolo quirúrgico se llevó a cabo siguiendo las normas éticas y las recomendaciones internacionales sobre investigación en animales de laboratorio14.
Recolección y análisis de datos
Se monitorizaron las presiones y diámetros de la aorta y arteria pulmonar en tiempo real mediante la utilización de un hardware y software especialmente diseñados en nuestro laboratorio (SAMAY M16), con una frecuencia de muestreo de 200 Hz12. Durante la adquisición de datos el animal fue desconectado del ventilador al final de la espiración debido a que las propiedades viscoelásticas de la arteria pulmonar varían durante el ciclo ventilatorio11. Se analizaron entre 10-15 latidos consecutivos y simultáneos de cada arteria durante las tres condiciones experimentales. A partir del bucle presión-diámetro arterial (fig. 2) se minimizó el área de histéresis aumentando los valores del módulo viscoso, que es proporcional a la primera derivada del diámetro arterial (anexo). Una vez obtenida la relación presión-diámetro elástica pura, se calculó la elasticidad como la primera derivada de la presión diastólica media (anexo). La FAP se cuantificó mediante el cociente viscosidad/elasticidad, y la FAG fue estimada a partir del modelo de Windkessel de 2 elementos mediante el ajuste de una función exponencial a la porción diastólica final de la curva de presión arterial (anexo).
Fig. 2. A: Relación presión-diámetro pulmonar en un animal en situación control. B: Relación presión-diámetro aórtico en un animal en situación control.
Análisis estadístico
Los datos se expresaron como la media ± DE (desviación estándar). El análisis estadístico se realizó mediante el test de ANOVA, seguido de un test de la t de Student para muestras apareadas. Un valor de t o F con una p < 0,05 fue considerado estadísticamente significativo.
RESULTADOS
En la tabla 1 se muestran los valores de las variables hemodinámicas aórticas y pulmonares durante las tres condiciones experimentales. Durante cada estado, en la aorta las presiones fueron mayores (p < 0,05) y los diámetros menores (p < 0,05) respecto a la arteria pulmonar. En cada arteria, las presiones media, diastólica y sistólica alcanzadas durante ambos estados hipertensivos (HP y HA) fueron mayores que las halladas en el control (p < 0,05), pero similares entre sí. En ambas arterias, la maniobra de HP incrementó los diámetros sistólico, diastólico y medio, respecto a los valores obtenidos durante el control (p < 0,05) y los de HA (p < 0,05). Durante la HA, en la arteria pulmonar los diámetros arteriales fueron menores que en el control (p < 0,05), mientras que en la aorta fueron similares. La frecuencia cardíaca fue similar durante las tres condiciones experimentales.
En la tabla 2 se muestran los valores de los índices viscoelásticos y de FAP de la aorta y arteria pulmonar, así como la FAG del circuito sistémico y pulmonar durante las tres condiciones experimentales. Durante cada estado, la elasticidad y la viscosidad fueron siempre mayores (p < 0,05) en la aorta que en la arteria pulmonar. En ambas arterias, no se observaron diferencias en la viscosidad entre el control y la HP, mientras que ésta aumentó significativamente durante la HA. En ambas arterias, la elasticidad fue menor durante la HA (p < 0,05) que durante la HP. Sólo en la aorta, la elasticidad durante la HA mostró un valor significativamente mayor respecto al control (p < 0,05).
La FAP tendió a incrementarse durante la HA respecto del control, pero no fue significativa, tanto para una misma arteria como al comparar las arterias. En ambas arterias, la FAP durante la HP fue menor (p < 0,05) a la hallada durante el control y la HA. Durante las diferentes condiciones experimentales, la FAP aórtica y pulmonar tuvo valores similares.
En todas las condiciones experimentales, la FAG sistémica fue mayor que la del circuito pulmonar (p < 0,05). En cada circuito, los valores de FAG fueron menores durante la HP (p < 0,05) que en el control y la HA, mientras que durante la HA fueron similares a los del control. La bondad del ajuste exponencial durante el cálculo de la FAG fue corroborada en cada condición por el r2, el cual se mantuvo siempre mayor de 0,99.
DISCUSIÓN
El objetivo de este trabajo fue caracterizar simultáneamente de forma comparativa in vivo: a) las propiedades viscoelásticas de la aorta y arteria pulmonar y su relación con la función de amortiguamiento, y b) el efecto de la activación del MLV sobre dichas propiedades. Se presenta un nuevo índice que permite caracterizar la capacidad de amortiguamiento parietal local y que resulta del cociente viscosidad/elasticidad parietal4. Se calculó la constante de tiempo diastólica con el objetivo de caracterizar la FAG de cada circuito.
Propiedades viscoelásticas basales
Tanto la presión media de cada arteria como la elasticidad y viscosidad arterial resultaron entre 4,5 y 5,5 veces mayores en la aorta que en la arteria pulmonar durante el control. Estas diferencias en los índices viscoelásticos de ambas arterias podrían estar determinadas principalmente por las distintas presiones que soporta cada circuito5,7,8. Dado que ambas arterias poseen componentes parietales similares6,15, las diferencias cuantitativas en los índices viscoelásticos podrían estar determinadas por: a) diferentes propiedades mecánicas de un mismo constituyente parietal; b) distintas proporciones netas y relativas; c) diversa orientación geométrica parietal de sus constituyentes; d) diferencias en la conformación molecular de un mismo material; e) diferencias en el funcionamiento acoplado de los distintos componentes parietales, y/o f) diferencias en la cantidad neta y/o relativa de la matriz extracelular8,16. Con respecto a la elasticidad, Keeley y Alatawi5 observaron que la hipertensión arterial determina un incremento de las cantidades absolutas de colágeno y elastina aórticas, manteniendo constante su proporción5, lo que permite plantear la existencia de un «cuanto» o «unidad» de elasticidad, determinada por la relación colágeno/elastina17, y que el número de «dichas unidades» y, por ende, el nivel de elasticidad parietal serían función del valor de presión arterial media basal intravascular. Con respecto a la viscosidad parietal, se ha aceptado ampliamente que el principal determinante son las células de MLV7,8. Se ha demostrado que el incremento de la presión arterial se corresponde con un aumento de la proliferación de células de MLV7,8,18,19. A su vez, un número más elevado de células musculares sometidas a mayor estiramiento o desplazamiento cíclico determinan una mayor síntesis de colágeno y elastina7. Por consiguiente, un valor de presión arterial más elevado, como el existente en la aorta respecto a la arteria pulmonar, determinaría un mayor número de células de MLV y, por ende, un valor basal de viscosidad más alto, así como una mayor síntesis y depósito de fibras elásticas, responsable de la mayor elasticidad parietal. No obstante, podría plantearse la existencia de una proporción fija de elastina, colágeno y MLV en la pared arterial, con un determinado ordenamiento geométrico, que explicaría la similitud del cociente viscosidad/elasticidad (FAP) obtenido en ambas arterias. Esto se correspondería con la unidad anatomofuncional básica contráctil-elástica planteada por Davies17, que estaría ajustada en un valor viscoelástico operativo (set point) similar en ambas arterias.
Elasticidad durante la hipertensión arterial
En ambas arterias, durante HP la elasticidad aumentó significativamente debido a su gran dependencia de la presión3,4,10,12. Tanto la elastina como el colágeno y el MLV poseen diferentes módulos de elasticidad3 y comienzan a ser deformados a diferentes valores de tensión parietal, lo que determina que la relación presión-diámetro sea alineal3,10,12. Cuanto más elevada sea la presión, mayor será el reclutamiento de las fibras de colágeno más rigidas, lo que determina el aumento de la elasticidad observado3,12.
Durante la HA, la elasticidad presentó una tendencia similar en ambas arterias, si bien sólo en la aorta aumentó significativamente respecto al control. El grado de activación del MLV también determina la elasticidad arterial. La función de la elastina y el colágeno es la de mantener un valor de tensión parietal estable que permita la expansión y recuperación elástica cíclica arterial pero que, a la vez, impida la sobredistensión y rotura parietal, respectivamente3. El MLV, en cambio, es un componente dinámico cuya elasticidad dependerá no sólo de la presión de distensión, sino del grado en que se encuentre activado. Estudios previos realizados en arterias sistémicas3,4,10 y en la arteria pulmonar12 pusieron de manifiesto que la activación del MLV aumenta la elasticidad parietal en función de la deformación o diámetro (análisis isométrico) o la disminuye en función de la tensión o presión (análisis isobárico). Nuestros datos coinciden con dichos trabajos, ya que isobáricamente (HP frente a HA) la elasticidad disminuyó durante la activación. Esto podría deberse a que la contracción isobárica del diámetro arterial durante la HA reduciría la participación de las fibras de colágeno, impidiendo el reclutamiento de éstas y, por tanto, la elevación de la elasticidad parietal (como sucede en la HP)3,12. A diferencia de la aorta, en la arteria pulmonar no se observó una diferencia significativa entre la elasticidad en el control y la existente en la HA. Esto podría deberse al diferente comportamiento de los diámetros durante la activación muscular. Mientras que en la aorta el diámetro arterial durante la HA no se modificó respecto al control, en la arteria pulmonar, la vasoconstricción del MLV de la arteria pulmonar determinó una reducción del diámetro arterial respecto al control y, por tanto, un menor reclutamiento de colágeno.
Viscosidad durante la hipertensión arterial
En ambas arterias, sólo la activación del MLV aumentó de la viscosidad respecto al control. Además, en las diferentes condiciones experimentales, la viscosidad aórtica fue mayor que la pulmonar. La viscosidad parietal ha sido relacionada fundamentalmente con la pérdida de energía que ocurre latido a latido por efecto de la cantidad y grado de activación del MLV existente en la pared vascular3,7,8,10. Existen dos teorías al respecto que intentan explicar esta propiedad de los tejidos arteriales. La teoría «pasiva» asume que la viscosidad es una propiedad de los constituyentes de la pared arterial, siendo el MLV el principal responsable3,7. La teoría «activa» considera como determinantes los mecanismos generadores de tensión del músculo (activación) y la respuesta miogénica al estiramiento7. Nuestro trabajo pone de manifiesto que, en condiciones basales, la pared arterial presenta viscosidad y que ésta aumenta durante la activación muscular. Por tanto, al igual que en las arterias sitémicas3,10,12, la activación del MLV pulmonar modifica la elasticidad y viscosidad parietales.
Funciones de amortiguamiento parietal y global
En el presente trabajo, se caracterizó la FAP mediante el cociente viscosidad/elasticidad parietal. Si bien en la aorta, la elasticidad y viscosidad resultaron mayores que en la arteria pulmonar durante el control, en ambas arterias el cociente viscosidad/elasticidad fue similar. Es decir, aunque los valores absolutos de elasticidad y viscosidad para cada arteria son netamente diferentes, la capacidad de amortiguar sería la misma en ambas paredes vasculares en relación con el valor de presión de cada arteria. Esta similitud en la FAP entre la aorta y la arteria pulmonar podría indicar una adaptación funcional de las grandes arterias a sus particulares regímenes de presión y flujo, constituyendo un valor óptimo de amortiguamiento local. La relación viscosidad/elasticidad protegería a la pared en sí misma de las altas frecuencias presentes en la onda del pulso (fatiga por estrés)4 y sufriría modificaciones hacia la periferia en función de los cambios histológicos estructurales.
Durante HP, la FAP disminuyó significativamente en ambas arterias, ya que la pared arterial se hace más rígida. En cambio, durante la HA, la FAP no mostró diferencias respecto al control. Esto evidencia que la activación del MLV impide la disminución de la FAP, a pesar de que las paredes arteriales se encuentran sometidas a mayores valores de presión. Nuestros datos revelan claramente que la pared de una arteria sometida a iguales valores de presión intravascular puede encontrarse en condiciones distintas de capacidad de amortiguamiento y protección local. Esto evidencia, además, que el valor de presión de pulso intravascular no es un indicador adecuado para valorar el estado funcional de la pared arterial.
Para analizar el amortiguamiento parietal en un contexto hemodinámico global se calculó la FAG de cada circuito durante los mismos latidos. La FAG caracteriza la habilidad de cada circuito vascular para amortiguar la onda de presión y es determinada principalmente por la compliancia total y la resistencia periférica total del circuito4. La FAG resultó siempre mayor en el circuito sistémico que en el pulmonar, a pesar que la FAP fue similar para ambas arterias. Entre los determinantes del mayor valor de FAG sistémica podrían incluirse la mayor resistencia periférica y la mayor longitud vascular13. En ambas arterias, durante la HP, la FAG disminuyó significativamente respecto al control. Al comparar isobáricamente la FAG entre HA y HP se observó que la activación muscular determinó una mayor FAG. Así, la FAG mostró una tendencia similar a la de la FAP, lo que podría indicar que durante la activación muscular la pared arterial modifica su capacidad de amortiguamiento, colaborando así a generar un mayor nivel de amortiguamiento global del circuito vascular. A diferencia de la FAP, la FAG es significativamente mayor en el circuito sistémico, lo que es probable que esté vinculado con la necesidad de un filtrado más selectivo debido a un mayor número y amplitud de los armónicos generados por el ventrículo izquierdo20.
Al mantener constante tanto la FAG como la FAP, la activación del MLV tendría un triple papel beneficioso en el sistema cardiovascular en situaciones de hipertensión arterial: a) a nivel ventricular, favorecería el acoplamiento ventriculoarterial manteniendo acotada la impedancia arterial característica (relacionada inversamente con el área de sección vascular y directamente con el grado de rigidez parietal); b) en las grandes arterias, mantiene la protección local mediante la disminución de la fatiga por estrés parietal, y c) en la microcirculación, permite la llegada de un flujo continuo y con baja presión.
Teniendo en cuenta que los mecanismos de control global del sistema arterial tienen lugar fundamentalmente en las variaciones de la resistencia periférica total y la compliancia total, y que modifican la constante de tiempo de descenso diastólico, podría plantearse un mecanismo de control local a través de las modificaciones de la viscosidad parietal, directamente relacionada con el grado de activación del MLV, el cual modularía la constante de tiempo local parietal. A favor del papel del endotelio en dicha regulación local, varios estudios han demostrado que el endotelio tiene una función activa en la remodelación vascular y en el control de las propiedades viscoelásticas de la pared vascular18. En el futuro será necesario caracterizar la relación «control global-control local» del sistema arterial en las respuestas cardiovasculares integradas, tanto en situaciones fisiológicas como fisiopatológicas.
Implicaciones clínicas
Si bien desde el punto de vista clínico la presión de pulso refiere al componente pulsátil de la presión arterial, configura un parámetro complejo dependiente del patrón de eyección ventricular, la FAG, la onda refleja y la rigidez arterial21. Esto explicaría el aumento similar de la presión de pulso en ambas arterias, en los dos estados hipertensivos. De este modo, el análisis aislado de la presión de pulso es insuficiente para diferenciar cambios de la rigidez parietal secundarios al valor de la presión intravascular y/o a la mecánica parietal (FAP), así como sus consecuencias sobre el acoplamiento ventriculoarterial. La aplicación de las modernas técnicas ecocardiográficas de alta resolución (echotracking) posibilitará el registro no invasivo y continuo de la variación sistólica del diámetro de la aorta y la arteria pulmonar en el ser humano22, lo que, junto con el registro de la presión arterial, hará posible la caracterización de la elasticidad y viscosidad parietales a partir del bucle presión-diámetro.
CONCLUSIONES
La circulación sistémica presenta una mayor viscoelasticidad en su arteria principal, así como un mayor nivel de amortiguamiento global, respecto a la circulación pulmonar. No obstante, la aorta y la arteria pulmonar tienen valores similares de FAP. Ambas arterias presentan una elasticidad altamente dependiente de la presión intravascular y valores de viscosidad relacionados con la cantidad y el grado de activación del MLV. Durante la HP, la FAP y la FAG disminuyen significativamente. La activación del MLV tiene efectos beneficiosos sobre la circulación arterial debido a que recupera los valores de la FAP y la FAG mediante la disminución de elasticidad y el aumento de viscosidad concomitantes, a pesar del incremento de la presión arterial.
AGRADECIMIENTO
Los autores agradecen la asistencia técnica del Sr. Elbio Agote y la Sra. Edith Moraes, así como el dibujo realizado por el bachiller Ismael Aguirre.
Correspondencia: Dr. D. Bia.
Departamento de Fisiología. Facultad de Medicina.
General Flores, 2125. 11800 Montevideo. Uruguay.
Correo electrónico: dbia@fmed.edu.uy