La hipertensión arterial es una enfermedad crónica de elevada prevalencia y un factor de riesgo de primer orden para el desarrollo de enfermedad cardiovascular. Entre el 25 y el 40% de la población adulta es hipertensa y en más del 90% de los casos su origen es desconocido. A pesar del gran esfuerzo realizado hasta el momento en la exploración de la susceptibilidad genética a la hipertensión esencial, la búsqueda de genes candidatos con elevada repercusión en la población, en su mayor parte, ha sido infructuosa, lo que refleja el carácter multifactorial del fenotipo hipertensivo. Aunque las bases genéticas de la regulación de la presión arterial son aún mal conocidas, la identificación de los mecanismos genéticos y moleculares implicados en la fisiopatología y la predicción de la hipertensión resultan de extrema importancia en salud pública y para el desarrollo de tratamientos antihipertensivos.
Palabras clave
La presión arterial elevada o hipertensión no es solamente una enfermedad, sino que también tiene un riesgo atribuible muy elevado para desarrollar afecciones del corazón, el cerebro y el riñón1,2. En este sentido, puesto que el 25-40% de la población adulta es hipertensa y que en más del 90% de los casos su origen es desconocido, lo que define la hipertensión esencial, identificar los mecanismos moleculares implicados en la fisiopatología y predecir la hipertensión resultan de extrema importancia en salud pública y para el desarrollo de tratamientos antihipertensivos.
A pesar del gran esfuerzo realizado hasta el momento en la exploración de la susceptibilidad genética a la hipertensión esencial, la búsqueda de genes candidatos con elevada repercusión en la población, en su mayor parte, ha sido frustrante y descorazonadora3-5, lo que en sí mismo es un reflejo del carácter multifactorial del fenotipo hipertensivo6,7.
En este artículo pretendemos abordar la implicación de la genética en la fisiopatología de la hipertensión arterial, las cada vez más convincentes evidencias de la influencia genética en la respuesta al tratamiento farmacológico, y discutir las limitaciones de la información genotípica en la aplicación clínica.
La presión arterial es un rasgo cuantitativo que muestra una variación continua en sus valores entre bajos y altos. Al igual que ocurre con la mayoría de los factores cuantitativos, las diferencias en la presión arterial resultan de contribuciones de un gran número de genes que interactúan entre sí y, cada uno de ellos, con factores ambientales. Se entiende, por lo tanto, la dificultad de emprender un abordaje sistemático de los factores implicados en la génesis de la hipertensión arterial. Hay diferentes aproximaciones para caracterizar las bases genéticas de la hipertensión. Cada una de ellas, con sus limitaciones, ha contribuido sustancialmente a dilucidar algunos de los mecanismos de la regulación genética de la presión arterial elevada. Siendo esto esencial, probablemente es prematuro confiar en que este conocimiento permita modificar en gran manera el impacto clínico de la enfermedad. Sin embargo, cabe decir aquí que estos conocimientos están abriendo nuevas vías de investigación hacia objetivos más relacionados con el tono vascular del sistema arterial.
ENFERMEDADES MONOGÉNICAS QUE ELEVAN O DISMINUYEN LA PRESIÓN ARTERIALSiendo estrictos, la mayor contribución de los estudios de las raras formas mendelianas de la hipertensión humana ha sido proporcionar pruebas muy consistentes de que el riñón es un órgano clave en la regulación a largo plazo de la presión arterial. Sin embargo, es importante tener en cuenta que, hasta ahora, ninguno de los alelos asociados con estas formas raras de hipertensión se ha relacionado con las formas comunes de hipertensión8. A pesar de ello, la investigación de las formas mendelianas raras relacionadas con variación de los valores de presión arterial en las que genes determinados causan valores extremos de presión arterial ha sido enormemente informativa, y algunos ejemplos de estas enfermedades monogénicas se muestran en la tabla 1. La mayoría, sino todas, de las mutaciones implicadas en estos trastornos afectan la regulación de sal por el riñón y su estudio nos ha proporcionado un mejor entendimiento de las bases moleculares de la patogenia renal de la hipertensión. Además, es indudable que, fruto de estas investigaciones, se han identificado nuevos marcadores susceptibles de terapia antihipertensiva, como el canal epitelial de sodio y otros canales de sodio. En definitiva, aunque contribuyen en un pequeño porcentaje de variación de la presión arterial en la población, el estudio de las mutaciones raras es relevante porque justifica la hipótesis de que otras variantes más comunes podrían actuar mediante mecanismos metabólicos similares.
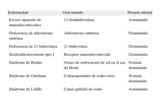
Algunas enfermedades monogénicas relacionadas con cifras alteradas de presión arterial
| Enfermedad | Gen mutado | Presión arterial |
| Exceso aparente de mineralocorticoides | 11-betahidroxilasa | Aumentada |
| Deficiencia de aldosterona sintetasa | Aldosterona sintetasa | Disminuida |
| Deficiencia de 21-hidroxilasa | 21-hidroxilasa | Disminuida |
| Seudoaldosteronismo tipo I | Receptor mineralocorticoide | Disminuida |
| Síndrome de Bartter | Genes de reabsorción de sal en el asa de Henle | Normal, disminuida |
| Síndrome de Gitelman | Cotransportador de sodio-cloro | Normal, disminuida |
| Síndrome de Liddle | Canal epitelial de sodio | Aumentada |
En términos generales, este tipo de estudios están basados en el conocimiento biológico de las funciones de las proteínas codificadas por estos genes «candidatos» con respecto a la regulación de la presión arterial. Aunque en algunas ocasiones estos estudios han abierto nuevos caminos en la evaluación de la respuesta individual a los tratamientos farmacológicos en uso, en su gran mayoría los resultados o son contradictorios o aguardan confirmación.
Si uno revisa la literatura específica, rápidamente se da cuenta de que se han publicado varios miles de artículos sobre hipertensión y polimorfismos genéticos. Tal vez como resultado de lo que conocemos sobre los raros trastornos monogénicos, la investigación se ha centrado con mayor énfasis en polimorfismos genéticos de los genes del sistema renina-angiotensina-aldosterona, es decir, un ámbito propiamente renal, y en particular, en el polimorfismo inserción/deleción de la enzima de conversión de angiotensina (ECA I/D) que ha sido objeto de más de mil artículos hasta el momento. Este énfasis no es, en absoluto, sorprendente si recordamos que el producto final de la vía renina-angiotensina, la angiotensina II, es capaz de incrementar la reabsorción de sodio directa o indirectamente mediante la estimulación de la síntesis y la liberación de aldosterona.
El polimorfismo ECA I/D ha sido involucrado en multitud de procesos diferentes, desde la arteriosclerosis, la hipertrofia ventricular o la hipertensión hasta la artritis reumatoide o la gravedad de la enfermedad de Alzheimer. Sin embargo, en cuanto al tema que nos ocupa, cabe decir que las expectativas generadas por la promesa de que los polimorfismos de la ECA eran el fundamento para el desarrollo de un tratamiento con sus inhibidores han disminuido considerablemente tras un estudio negativo reciente, ciertamente demoledor9. El gen de la ECA es un ejemplo paradigmático de lo que solemos encontrar en los estudios genéticos de asociación. Porque algo similar podemos decir del gen del angiotensinógeno, otro de los ampliamente estudiados en este contexto. A pesar de ciertos resultados iniciales positivos que describen la relación de ciertos polimorfismos del angiotensinógeno con la hipertensión esencial10, las observaciones efectuadas en un estudio más reciente de gran tamaño muestral11 parecen indicar que ni polimorfismos del promotor ni combinaciones de alelos o haplotipos predicen en absoluto los valores de presión sistólica, diastólica, presión del pulso y tampoco el riesgo de enfermedad isquémica cardiaca o cerebral.
Algunos trabajos han encaminado sus esfuerzos al estudio de varios polimorfismos simultáneamente. Por ejemplo, partiendo de la idea de que el polimorfismo ECA I/D y la aducina regulan, al parecer, la diuresis12, en el Atherosclerosis Risk in Communities study13, el gen de la aducina y el de la subunidad beta 3 de la proteína G (GNB3) se analizaron conjuntamente. Su hallazgo principal fue una modesta relación de la aducina con la enfermedad vascular periférica. En justicia, lo que puede decirse de este tipo de estudios es que son los primeros en intentar investigar estos genes en el marco de la regulación de la presión arterial, como ocurre con tantos otros con los que se están iniciando nuevas investigaciones. Éste es el caso, por ejemplo, de genes que codifican enzimas, receptores, proteínas de señalización y que no podemos detallar aquí.
Como ocurre en todos los procesos complejos, y la hipertensión es un buen ejemplo de ellos, la dificultad de replicación de estudios genéticos de asociación en polimorfismos resulta un fenómeno común, llamativo y, hasta cierto punto, frustrante. Por ello, no es extraño que surjan cada vez más artículos de opinión sobre la necesidad de establecer unos criterios de rigurosidad para estos estudios. En este sentido, conceptos relacionados con plausibilidad biológica, replicación independiente, bajos valores de probabilidad de error, metodologías estrictas de genotipificación y fenotipificación y análisis estadísticos apropiados son actualmente referentes, sinónimos de calidad y, además, exigibles en el abordaje de estudios de esta naturaleza. Tales exigencias toman fuerza a la vista de los resultados de algún metaanálisis14, que indican que es usual que el estudio inicial muestre una asociación más intensa que los posteriores y que, en general, los estudios de asociación dicen muy poco acerca de la función del gen en la regulación de la presión arterial. Tal vez una de las claves sea esto último: sobre la base de las exigencias mencionadas para los estudios genéticos de asociación, necesitamos «descubrir», con las metodologías más apropiadas, la funcionalidad de las variantes genéticas que exploremos, es decir, debería combinarse el estudio de asociación genética con su análisis molecular y funcional.
PAPEL DE LOS ESTUDIOS INTEGRALES DEL GENOMARecientemente, han surgido nuevas iniciativas para prevenir o evitar incertidumbres y minimizar la falta de replicabilidad tan frecuente en los estudios genéticos de la hipertensión. Estamos hablando de los cada vez más utilizados estudios integrales del genoma (genome-wide scan), que pueden realizarse en modelos animales y en humanos para identificar nuevas regiones genómicas potencialmente implicadas en el riesgo de hipertensión15. Como ocurre con los estudios de asociación con diseños de casos y controles, la mayoría de los estudios amplios del genoma aguardan confirmación e investigación adicional. No obstante, es muy posible que la realización de estos estudios permita, en un futuro próximo, detectar nuevos polimorfismos y complementar con éxito la hipótesis, hasta ahora de partida, basada en genes candidatos y, en definitiva, contribuir al hallazgo de nuevos genes implicados en vías metabólicas y mecanismos biológicos hasta el momento desconocidos en la patogenia de la hipertensión.
GENES «NO RENALES» RELACIONADOS CON EL TONO VASCULARPuesto que el tono vascular de las arterias es un determinante principal de la presión arterial, hasta cierto punto es sorprendente que la idea de que posibles alteraciones del tono vascular pueden originar, de alguna manera, variaciones de la presión arterial no se haya contrastado con mayor énfasis hasta el momento. De acuerdo con la que podríamos llamar hipótesis del tono vascular, una vasodilatación o una vasoconstricción primarias serían suficientes para promover hipotensión o hipertensión, respectivamente. En este sentido, las proteínas que tienen el crítico papel de la regulación del estado contráctil de la célula muscular lisa de la pared arterial serían unos magníficos candidatos a tener en cuenta en la compleja constelación de factores que influyen en la variación de la presión arterial. El estudio de nuevas variantes genéticas relacionadas con el control del tono vascular, y muy especialmente los canales iónicos, ha sido y es uno de los pilares sobre los que se fundamenta HERACLES (Hipertensión Esencial: Red de Análisis de Canales iónicos de la musculatura Lisa arterial y su Explotación terapéutica Sistemática), una red temática de investigación cardiovascular española dedicada, en parte, a aumentar y mejorar el conocimiento de los mecanismos epidemiológicos, clínicos y moleculares de la hipertensión16.
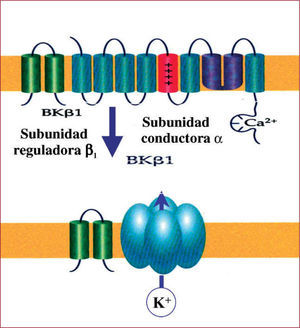
Uno de los canales iónicos en los que los investigadores de la red HERACLES han trabajado multidisciplinariamente con éxito es el canal MaxiK+, un canal de potasio compuesto por una subunidad reguladora beta y una conductora alfa (fig. 1). En un estudio de amplio tamaño muestral se identificó un polimorfismo genético, presente en el 20% de las personas estudiadas, que conlleva un cambio en la secuencia de la subunidad beta 1 humana (KCNMβ1) del canal MaxiK+ (de ácido glutámico a lisina en la posición 65, E65K), que está asociado a un menor riesgo de hipertensión diastólica moderada y grave a escala poblacional17. De particular interés es que análisis funcionales in vitro revelaron que el polimorfismo E65K suponía un aumento en la sensibilidad al Ca2+ y al voltaje del canal MaxiK+ y, en general, expresa una ganancia de función que favorece el estado de relajación arterial que explicaría el efecto protector contra la hipertensión diastólica moderada-severa. De esta forma, el uso combinado de la epidemiología genética en humanos y estudios funcionales en canales expresados exógenamente in vitro han establecido el mecanismo básico que conecta el canal MaxiK+ con una forma de hipertensión humana. Tal vez sea éste un buen ejemplo de investigación funcional en combinación con una asociación genética, lo cual probablemente será más frecuente en genética de la hipertensión. En una fase posterior también se pudo demostrar un importante efecto protector del polimorfismo E65K contra el infarto de miocardio y el accidente cerebrovascular18. Cabe resaltar también que investigaciones posteriores han contribuido a confirmar, directa o indirectamente, estos hallazgos preliminares19,20. El MaxiK+ no es, lógicamente, el único canal estudiado en el marco de HERACLES o en otros grupos interesados en los mecanismos moleculares de la hipertensión y queda, por lo tanto, un largo camino por recorrer en el estudio de otros canales, como los de la superfamilia de canales catiónicos TRP, canales de K+ dependientes de Ca++ (KCNN), dependientes de voltaje (Kv) y una larga lista de canales que operan en el seno de la pared arterial y que ahora sabemos que condicionan la resistencia periférica, el tono vascular y, en consecuencia, son de enorme importancia en la regulación de la presión arterial. La identificación de nuevos genes no relacionados directamente con el sistema renal, como los de los canales iónicos, capaces de influir en la regulación de la presión arterial tiene y tendrá, con toda probabilidad, importantes implicaciones para el diagnóstico y el tratamiento de la hipertensión.
¿GENÉTICA Y MEDICINA PERSONALIZADA PARA EL TRATAMIENTO ANTIHIPERTENSIVO?La medicina antihipertensiva personalizada tiene, teóricamente, el potencial de aprovechar los nuevos hallazgos genómicos para proveerse de mecanismos diagnósticos adicionales y de información pronóstica relevante que pueda complementarse con los marcadores biológicos ya establecidos. Para las enfermedades comunes, como la hipertensión, la etiología del fenotipo es heterogénea, relacionada de forma múltiple con los efectos de numerosos genes que actúan en el contexto de un marco genético que interactúa con múltiples factores ambientales. Seguramente, la medicina personalizada para cada paciente nunca será del todo posible y, probablemente, el máximo rendimiento terapéutico se obtenga al identificar pequeños subgrupos de población en los que los factores fisiopatológicos sean más homogéneos. Estos subgrupos serán, sin duda, los más beneficiados con determinadas estrategias preventivas y terapéuticas.
Ya hemos hablado de los importantes esfuerzos que se han llevado a cabo con el objetivo de identificar los genes que contribuyen al desarrollo de la hipertensión y también de lo descorazonador de sus resultados en su mayor parte. Cabría preguntarse, pues, si tales esfuerzos siguen teniendo sentido en el contexto de la medicina práctica. Una hipótesis de trabajo que merece atención en la compleja relación entre genética y tratamiento de la hipertensión podría basarse en la cuestión de si el efecto genético es primario, por la influencia directa en la presión arterial, si es secundario, mediante mecanismos independientes de la presión arterial, o bien una combinación de ambos. Huelga decir que estos posibles efectos, sin duda, deben investigarse debidamente.
En cualquier caso, la investigación genética tiene un valor intrínseco indudable, al margen de otros beneficios añadidos, cuando consideramos la respuesta al tratamiento antihipertensivo. Seguramente, es en este campo, que forma parte de la farmacogenómica, donde hay numerosas razones por las cuales el estudio de variaciones genéticas puede mejorar sustancialmente nuestra predicción de la respuesta a los fármacos antihipertensivos, más allá de las aproximaciones bioquímicas o demográficas convencionales. Y ello es especialmente cierto para la hipertensión, si tenemos en cuenta que menos del 40% de los pacientes hipertensos tratados tienen sus cifras de presión arterial controladas21. Para cada tipo de fármaco antihipertensivo la respuesta de la presión arterial varía considerablemente según los pacientes e incluso algunos de ellos no experimentan ninguna mejoría o su respuesta al tratamiento es anómala o paradójica. Honestamente, cabe decir que, en parte, tales diferencias obedecen a aspectos farmacodinámicos; sin embargo, es más que probable que, en conjunto, la variabilidad no sea más que un reflejo de la complejidad de la fisiopatología de la hipertensión de la que la genética es una pieza más.
Cabe considerar, además, que la información contenida en los genes permanece invariable con el tiempo y ello supone grandes diferencias con respecto a los factores bioquímicos y fisiológicos. Los genes contienen información sobre la actividad reguladora de diferentes sistemas. Por otra parte, la determinación de polimorfismos, que son la forma más abundante de variación genética del genoma humano, hoy por hoy, es sencilla y técnicamente asumible a gran escala.
CONCLUSIONESEs probable que el mayor desafío actual en la investigación de la genética de la hipertensión sea el descubrimiento de nuevos genes implicados en vías metabólicas y mecanismos aún desconocidos, que influyen en la presión arterial y el análisis de su impacto en la enfermedad y su tratamiento. Para dilucidar estas incógnitas se requiere la combinación coordinada de estudios integrales del genoma, exploración de los genes candidatos a escala poblacional y los estudios funcionales de las variantes de interés. El estudio de genes candidatos, que pueden contribuir a explicar las bases moleculares de una respuesta reducida o anómala al tratamiento antihipertensivo y la variación interindividual de la respuesta asociada a esos genes, tiene un enorme potencial en la prevención, la evaluación y el tratamiento de la hipertensión y sus complicaciones.
Conflicto de interesesEl autor declara no tener conflicto de intereses.