El cociente de flujo cuantitativo (quantitative flow ratio [QFR]) es un método novedoso y no invasivo para evaluar la fisiología coronaria. Sin embargo, los datos sobre QFR en pacientes con estenosis aórtica (EA) y enfermedad coronaria son escasos. Por lo tanto, se evaluó el rendimiento diagnóstico del QFR contra la relación del cociente de presión coronaria en reposo distal/aórtica (Pd/Pa), la reserva fraccional de flujo (FFR) y el índice diastólico instantáneo sin ondas (iFR), así como índices angiográficos.
MétodosSe incluyó un total de 221 pacientes con EA con 416 vasos en los que se midieron los valores de FFR/iFR.
ResultadosEl porcentaje medio de estenosis del diámetro (%DS) fue 58,6±13,4% y las medias de Pd/Pa, FFR, iFR y QFR, 0,95±0,03, 0,85±0,07, 0,90±0,04 y 0,84±0,07 respectivamente. Se observó una FFR ≤ 0,80 en el 26,0% de los vasos evaluados, iFR ≤ 0,89 en el 33,2% y QFR ≤ 0,80 en el 31,7%. El QFR tuvo mejor correlación con la FFR (coeficiente de correlación intraclase [ICC]=0,96; intervalo de confianza del 95% [IC95%], 0,95-0,96) que con el iFR (ICC=0,79; IC95%, 0,75-0,82) y la Pd/Pa (ICC=0.52; IC95%, 0,44-0,58). Además, el QFR mostró una mejor precisión diagnóstica (el 98,6 frente al 94,2%; p <0,001) y la función discriminatoria (área bajo la curva, 0,996 frente a 0,988; p <0,001) al utilizar como referencia el iFR en lugar de la FFR.
ConclusionesEn pacientes con EA, el QFR muestra una buena correlación con la FFR y el iFR. Sin embargo, esta podría ser aún mejor utilizando el iFR como referencia, presumiblemente debido a la naturaleza compleja de la fisiología coronaria en la evaluación de la enfermedad coronaria de pacientes con EA grave.
Palabras clave
La estenosis aórtica (EA) se acompaña de enfermedad coronaria (EC) en hasta un 60% de los pacientes tratados con un reemplazo quirúrgico o un implante percutáneo de válvula aórtica (TAVI)1–3. Dada la base multifactorial de la isquemia miocárdica en la EA, la evaluación de la importancia de las lesiones coronarias intermedias en los pacientes con EA puede resultar difícil. Dicha evaluación debe basarse no solo en la valoración visual de la coronariografía, sino también en una evaluación más exacta de la isquemia miocárdica por métodos invasivos4. La reserva fraccional de flujo (FFR) y el índice diastólico instantáneo sin ondas (iFR) son criterios establecidos en los laboratorios de cateterismo para este fin, y tienen una repercusión demostrada en la revascularización coronaria y los resultados obtenidos en los pacientes sin EA5–7. El cociente de presión coronaria en reposo distal/aórtica (Pd/Pa) es un índice más sencillo para la evaluación funcional de la estenosis coronaria, tiene una buena correlación con la FFR y no requiere la inducción de hiperemia8. Por otra parte, el cociente de flujo cuantitativo (quantitative flow ratio [QFR]) es un nuevo instrumento basado en la dinámica de fluidos computacional del que se cree que permite evaluar de forma virtual la EC intermedia9,10. Sin embargo, esta técnica no ha sido validada todavía en el contexto de la EA grave. Así pues, se comparó el rendimiento diagnóstico del QFR con los del cociente Pd/Pa en reposo, la FFR y el iFR, así como con índices angiográficos, en pacientes con EA y una EC intermedia.
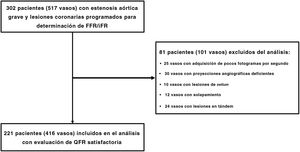
MÉTODOSEntre enero de 2018 y enero de 2020, se incluyó prospectivamente en el estudio a pacientes consecutivos con EA grave a los que se realizó una coronariografía de rutina que mostró la presencia de una EC intermedia (un 40%-90% de estenosis del diámetro [%DS] en la evaluación visual) y se programó una determinación de FFR/iFR. La EA grave se definió por un área valvular <1,0cm2 y un gradiente medio de presión de la válvula aórtica >40mmHg. El estudio es un registro prospectivo, orientado a la determinación del QFR. En la figura 1 se presenta el diagrama de flujo del estudio. Los criterios de exclusión fueron los siguientes: adquisición con pocos fotogramas por segundo, proyecciones angiográficas deficientes, solapamiento, lesiones de ostium no apropiadas para la determinación del QFR y lesiones en tándem. Se obtuvieron y evaluaron los datos clínicos basales. A todos los pacientes se les realizó una determinación de FFR/iFR mediante guía. La metodología detallada de la técnica de determinación de FFR/iFR se ha descrito ya con anterioridad11–14. El iFR se determinó 3 veces y para este análisis se empleó el valor medio. Se administró adenosina por vía intravenosa mediante una infusión de 140μg/kg/min para la medición de la FFR. El QFR se obtuvo mediante coronariografía cuantitativa tridimensional (Medis Suite 2.1.12.2, Medis Medical Imaging System, Países Bajos). Para el QFR se utilizó un método de pullback (retirada) con análisis de recuento de fotogramas por separado en las 2 proyecciones angiográficas diagnósticas sin hiperemia inducida farmacológicamente. Los evaluadores independientes del laboratorio central eligieron el pullback para el QFR con la mejor calidad de imagen (con el flujo de contraste mejor definido) del análisis de recuento de fotogramas. Las evaluaciones de la coronariografía, la fisiología y el QFR las llevaron a cabo de manera independiente 2 evaluadores del laboratorio central a los que se ocultó la información relativa a los pacientes. Se obtuvo la autorización ética mediante el proceso de examen del comité de ética del centro y todos los pacientes dieron su consentimiento informado por escrito.
Las variables cualitativas se expresan en número de pacientes (porcentaje). Las variables continuas se expresan como media±desviación estándar. Los datos de distribución no normal se presentan con la mediana [intervalo intercuartílico]. Las diferencias medias entre los índices se calcularon en forma de valores absolutos. La concordancia de los resultados de los métodos evaluados se determinó con el método gráfico de Bland-Altman y el coeficiente de correlación intraclase (CCI). Se utilizó un análisis del área bajo la curva (AUC) de características operativas del receptor (ROC) para evaluar la capacidad del cociente Pd/Pa en reposo, el QFR y los índices angiográficos de predecir una FFR ≤ 0,80 y un iFR ≤ 0,89. Los datos se presentan mediante el AUC sin ajustar con el intervalo de confianza del 95% (IC95%), y se utilizó el método de DeLong para las comparaciones. El rendimiento diagnóstico del QFR se presenta mediante la sensibilidad, la especificidad y la exactitud diagnóstica y se compara con la prueba de McNemar o con el estadígrafo de puntuación generalizada ponderada. Todos los análisis fueron bilaterales y se consideró estadísticamente significativo un valor de p <0,05. Todos los análisis estadísticos se realizaron con el programa STATISTICA 13.3 (TIBCO Software Inc., Estados Unidos).
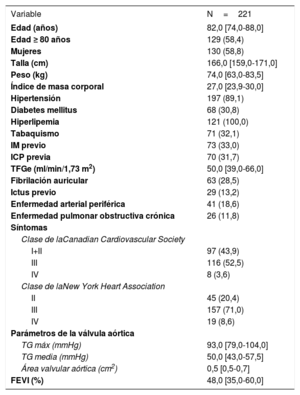
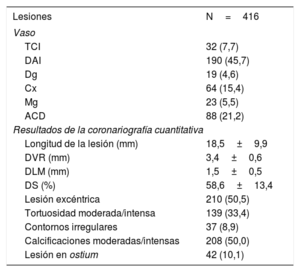
RESULTADOSSe evaluaron 416 estenosis coronarias intermedias en 221 pacientes con EA grave (figura 1). En la tabla 1 se presentan las características basales de los pacientes, mientras que en la tabla 2 se muestran las características de las lesiones. La mediana de edad de los pacientes incluidos fue 82,0 años, con un 58,8% de mujeres. La mediana del área valvular aórtica fue de 0,5cm2 y la del gradiente de presión de la válvula aórtica, 50mmHg.
Características basales
| Variable | N=221 |
|---|---|
| Edad (años) | 82,0 [74,0-88,0] |
| Edad ≥ 80 años | 129 (58,4) |
| Mujeres | 130 (58,8) |
| Talla (cm) | 166,0 [159,0-171,0] |
| Peso (kg) | 74,0 [63,0-83,5] |
| Índice de masa corporal | 27,0 [23,9-30,0] |
| Hipertensión | 197 (89,1) |
| Diabetes mellitus | 68 (30,8) |
| Hiperlipemia | 121 (100,0) |
| Tabaquismo | 71 (32,1) |
| IM previo | 73 (33,0) |
| ICP previa | 70 (31,7) |
| TFGe (ml/min/1,73 m2) | 50,0 [39,0-66,0] |
| Fibrilación auricular | 63 (28,5) |
| Ictus previo | 29 (13,2) |
| Enfermedad arterial periférica | 41 (18,6) |
| Enfermedad pulmonar obstructiva crónica | 26 (11,8) |
| Síntomas | |
| Clase de laCanadian Cardiovascular Society | |
| I+II | 97 (43,9) |
| III | 116 (52,5) |
| IV | 8 (3,6) |
| Clase de laNew York Heart Association | |
| II | 45 (20,4) |
| III | 157 (71,0) |
| IV | 19 (8,6) |
| Parámetros de la válvula aórtica | |
| TG máx (mmHg) | 93,0 [79,0-104,0] |
| TG media (mmHg) | 50,0 [43,0-57,5] |
| Área valvular aórtica (cm2) | 0,5 [0,5-0,7] |
| FEVI (%) | 48,0 [35,0-60,0] |
FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IM: infarto de miocardio; TFGe: tasa de filtrado glomerular estimada; TG: gradiente transaórtico.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Características de la lesión
| Lesiones | N=416 |
|---|---|
| Vaso | |
| TCI | 32 (7,7) |
| DAI | 190 (45,7) |
| Dg | 19 (4,6) |
| Cx | 64 (15,4) |
| Mg | 23 (5,5) |
| ACD | 88 (21,2) |
| Resultados de la coronariografía cuantitativa | |
| Longitud de la lesión (mm) | 18,5±9,9 |
| DVR (mm) | 3,4±0,6 |
| DLM (mm) | 1,5±0,5 |
| DS (%) | 58,6±13,4 |
| Lesión excéntrica | 210 (50,5) |
| Tortuosidad moderada/intensa | 139 (33,4) |
| Contornos irregulares | 37 (8,9) |
| Calcificaciones moderadas/intensas | 208 (50,0) |
| Lesión en ostium | 42 (10,1) |
ACD: arteria coronaria derecha; Cx: arteria circunfleja; DAI: arteria descendente anterior izquierda; Dg: arteria diagonal; DLM: diámetro luminal mínimo; DS: estenosis del diámetro; DVR: diámetro del vaso de referencia; Mg: rama marginal; TCI: tronco coronario izquierdo.
Los valores expresan n (%) o media±desviación estándar.
Formaron la población del estudio pacientes con estenosis coronarias de una gravedad angiográfica intermedia (%DS, 58,6%±13,4% en la coronariografía cuantitativa). Los valores medios del cociente Pd/Pa, FFR, iFR y QFR fueron 0,95±0,03, 0,85±0,07, 0,90±0,04 y 0,84±0,07 respectivamente. Se observó una FFR ≤ 0,80 en el 26,0% de los vasos analizados, así como un iFR ≤ 0,89 en el 33,2% y un QFR ≤ 0,80 en el 31,7%.
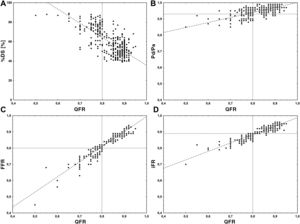
Se confirmó una escasa variabilidad intraobservador (CCI = 0,991; IC95%, 0,988-0,993) e interobservadores (CCI = 0,990; IC95%, 0,987-0,992) por lo que respecta a la determinación del QFR. El QFR mostró una concordancia mejor con la FFR (CCI = 0,96; IC95%, 0,95-0,96) que con el iFR (CCI = 0,79; IC95%, 0,75-0,82) y el cociente Pd/Pa (CCI = 0,52; IC95%, 0,44-0,58). En la figura 2 se muestran los gráficos de dispersión de puntos en los que se aprecia la relación entre el QFR y los demás índices angiográficos y fisiológicos.
Gráficos de dispersión de puntos en los que se aprecia la relación entre el cociente de flujo cuantitativo (QFR) y los demás índices angiográficos y fisiológicos. A: QFR y porcentaje de estenosis del diámetro (%DS). B: QFR y cociente Pd/Pa. C: QFR y reserva fraccional de flujo (FFR). D: QFR e índice diastólico instantáneo sin ondas (iFR). Pd/Pa: cociente de presión coronaria en reposo distal/aórtica.
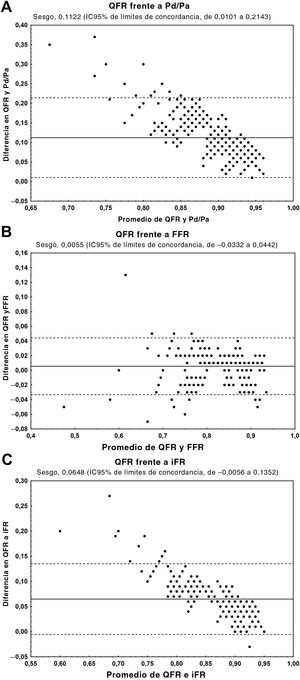
El QFR mostró una concordancia muy buena con la FFR (diferencia media, 0,0055; IC95%, −0,0332 a 0,0442) y buena concordancia con el iFR (diferencia media, 0,0648; IC95%, −0,0056 a −0,1352) (figura 3). Sin embargo, hubo un claro sesgo en el cociente Pd/Pa y en el iFR (no en la FFR).
Análisis de Bland-Altman que muestra la diferencia media absoluta entre el QFR y otros índices fisiológicos, junto con el IC95%. A: QFR y Pd/Pa. B: QFR y FFR. C: QFR e iFR. FFR: reserva fraccional de flujo; IC95%: intervalo de confianza del 95%; iFR: índice diastólico instantáneo sin ondas; Pd/Pa: cociente de presión coronaria en reposo distal/aórtica; QFR: cociente de flujo cuantitativo.
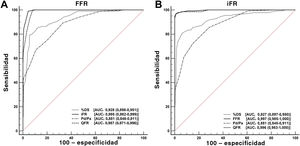
El QFR mostró mejores exactitud diagnóstica (el 98,6 frente al 94,2%; p <0,001) y función discriminante (AUC, 0,996 frente a 0,987; p <0,001) cuando se usó el iFR como referencia en vez de la FFR. Las funciones discriminantes del iFR, el QFR, el cociente Pd/Pa en reposo y el %DS con una FFR ≤ 0,80 como referencia fueron significativas (p <0,001 para todas las comparaciones) y se presentan en la figura 4A. Las funciones discriminantes de la FFR, el QFR, el cociente Pd/Pa en reposo y el %DS con un iFR ≤ 0,89 como referencia fueron significativas (p <0,001 para todas las comparaciones), excepto la del QFR frente a la FFR (p =0,38), y se presentan en la figura 4B. El rendimiento diagnóstico del QFR se muestra en la tabla 3.
Exactitud diagnóstica general (área bajo la curva en el análisis de las características operativas del receptor) del cociente de flujo cuantitativo, el cociente Pd/Pa y el porcentaje de estenosis del diámetro para detectar una reserva fraccional de flujo ≤ 0,80 (A) y un índice diastólico instantáneo sin ondas ≤ 0,89 (B). %DS: porcentaje de estenosis del diámetro; AUC: área bajo la curva; FFR: reserva fraccional de flujo; iFR: índice diastólico instantáneo sin ondas; Pd/Pa: cociente de presión coronaria en reposo distal/aórtica; QFR: cociente de flujo cuantitativo.
Comparación del rendimiento diagnóstico y la función discriminante del QFR utilizando la FFR y el iFR como referencias
| QFR con la FFR como referencia | QFR con el iFR como referencia | |||
|---|---|---|---|---|
| Valor | IC95% | Valor | IC95% | |
| Sensibilidad | 100 | 96,6-100 | 95,6 | 90,8-98,4 |
| Especificidad | 92,2 | 88,6-94,9 | 100 | 98,7-100 |
| VPP | 81,8 | 75,4-86,9 | 100 | |
| VPN | 100 | 97,9 | 95,5-99,0 | |
| Exactitud diagnóstica | 94,2 | 91,5-96,3 | 98,6 | 96,9-99,5 |
FFR: reserva fraccional de flujo; IC95%: intervalo de confianza del 95%; iFR: índice diastólico instantáneo sin ondas; QFR: cociente de flujo cuantitativo; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Los valores expresan porcentajes.
Los resultados principales de nuestro estudio son los siguientes: a) el QFR mostró una concordancia mejor con la FFR que con el iFR o el cociente Pd/Pa; b) el QFR mostró una exactitud diagnóstica y una función discriminante mejores cuando se utilizó como referencia el iFR, y c) el QFR puede tener las mismas limitaciones que otros índices basados en los valores de presión para la evaluación de la EC en los pacientes con EA grave. Es importante señalar que nuestro estudio es uno de los primeros en comparar el rendimiento del QFR con el de otros índices hiperémicos y no hiperémicos en la EC en el contexto de la EA grave.
Más de la mitad de los pacientes con EA grave que requieren un tratamiento quirúrgico o percutáneo presentan una EC concomitante1–3. La evaluación de la gravedad de la EC resulta difícil en este contexto, ya que los índices invasivos, tanto hiperémicos como no hiperémicos, no han sido plenamente validados en los pacientes con EA grave. En consecuencia, la evaluación de una EC intermedia en los pacientes con EA es una cuestión que continúa abierta. Además, evitar una intervención coronaria percutánea a ese subgrupo de pacientes, a los que a menudo se practica un TAVI o incluso una intervención quirúrgica, puede mejorar los resultados clínicos. Las guías actuales sobre la revascularización miocárdica recomiendan la revascularización de los pacientes con EA si la estenosis coronaria afecta a segmentos proximales con una estenosis superior al 70% (en la evaluación visual) o tienen programado un reemplazo quirúrgico o un TAVI15. El motivo de esta recomendación puede ser la fisiología coronaria compleja existente en el contexto de una EA grave. En esta situación, los gradientes de presión intracoronaria a través de las lesiones pueden verse influidos por una presión telediastólica del ventrículo izquierdo elevada como consecuencia de una reducción del área del orificio valvular o una disminución de la reserva de flujo coronario a causa de una disfunción microcirculatoria en presencia o incluso en ausencia de placas ateroescleróticas no significativas16. Además, no hay evidencia que respalde la revascularización coronaria guiada por la fisiología para los pacientes con una EA grave.
Los estudios de evaluación de la fisiología coronaria en presencia de una EA grave han producido resultados inesperados y contradictorios. En algunos estudios se observó que los valores de FFR obtenidos son similares a los observados después del TAVI17–19. En cambio, algunos datos indicaron que la FFR podría subestimar las estenosis coronarias intermedias en presencia de una EA grave y que los valores del iFR pueden estar en gran parte inalterados tras el tratamiento de la EA, aunque hay poca evidencia sobre el uso del iFR como parámetro de referencia20–23. La adopción amplia de la FFR puede continuar siendo problemática en esta población, ya que muchos operadores pueden mostrarse cautos en el uso de fármacos hiperémicos para evitar posibles efectos hemodinámicos adversos en presencia de una EA. Los costes adicionales, el aumento de la cantidad de contraste y la prolongación de la intervención diagnóstica pueden ser también factores que contribuyan a la baja penetración de la determinación de FFR/iFR en los pacientes ancianos con EA.
Así pues, el concepto del QFR para la determinación de la gravedad de la EC puede resultar muy atractivo para superar estas limitaciones e inquietudes. Se ha descrito que el QFR, que se basa en la dinámica de fluidos computacional, es muy exacto en la evaluación de la EC intermedia10,24–27. Sin embargo, los datos existentes sobre el rendimiento del QFR en el contexto de la EA grave son escasos. En un estudio realizado por Mejía-Rentería et al.27, el QFR mostró un buen rendimiento diagnóstico para determinar la relevancia funcional según la FFR de las estenosis coronarias en los pacientes en espera de un TAVI, con un AUC de 0,88 y una concordancia en la clasificación del 81%. Tiene interés señalar que, en nuestro estudio, el QFR mostró mejores resultados de exactitud diagnóstica (el 98,6 frente al 94,2%; p <0,001) y función discriminante (AUC, 0,996 frente a 0,987; p <0,001) cuando se empleó como referencia el iFR (en vez del FFR).
Esta observación puede deberse a diversos mecanismos, como el remodelado de microvasos, la sobrecarga de presión del ventrículo izquierdo y la hipertrofia causante de compresión de los vasos coronarios pequeños, en especial durante el estado de hiperemia16,28,29. En los pacientes con una EA grave, a pesar de las presiones ventriculares más elevadas, la presión existente en la parte proximal de la arteria coronaria en la sístole es inferior a la que se da en la parte distal de la arteria debido a la presencia de un gradiente de presión ventricular-aórtica. En estas circunstancias, la presión coronaria proximal es inferior en la diástole y la reducción de la presión en la parte distal de la arteria coronaria se ve deteriorada a causa de los patrones de relajación diferentes que se producen en el ventrículo izquierdo hipertrofiado16. Además, durante el estrés, la capacidad del corazón con EA de aumentar el flujo coronario se ve limitada debido a que está actuando ya con un rendimiento próximo al máximo16. Alcanzar una hiperemia máxima en presencia de una EA puede resultar difícil en algunos pacientes, por lo que la exactitud de la FFR puede ser limitada30–32. Teóricamente, la interacción de una válvula aórtica con una estenosis grave, una presión telediastólica del ventrículo izquierdo elevada, un ventrículo izquierdo hipertrofiado y el remodelado negativo asociado de la microcirculación coronaria pueden amortiguar la respuesta a la adenosina, con la consiguiente falta de hiperemia máxima30–32. Además, la fiabilidad de la FFR en la evaluación de la isquemia miocárdica parte del supuesto de que la presión y el flujo están estrechamente relacionados con las resistencias microvasculares que se reducen durante la hiperemia30–32. Sin embargo, por tal motivo la hiperemia puede no ser adecuada en los pacientes con EA33.
Este es el motivo por el que pensamos que los índices no hiperémicos pueden ser mejores para la evaluación de la isquemia de los pacientes con EA y por el que el QFR (en tanto que índice no hiperémico) mostró una mejor concordancia diagnóstica con el iFR. Sin embargo, por estas mismas razones, es posible que el QFR tenga las mismas limitaciones que muestran los índices invasivos en los pacientes con una EA grave.
En nuestro estudio, se observa una concordancia excelente del QFR con la FFR y el iFR, mejor incluso que la del estudio QASTA de Mejía-Rentería et al.27. Su mediana de diámetro del vaso de referencia fue de 2,8mm (con un 25% de los vasos de menos de 2,5 mm), mientras que en nuestros datos es de 3,4mm, lo cual indica la presencia de más lesiones en más segmentos distales con irrigación de menos cantidad de miocardio en el estudio QASTA en comparación con las localizaciones más proximales de nuestro estudio. Además, la media del %DS fue del 58,6% en nuestro estudio frente al 48% del estudio QASTA. A pesar de una gravedad fisiológica igualmente leve (FFR, 0,84 frente a 0,85), los porcentajes de lesiones con una FFR <0,80 y un QFR <0,80 fueron del 26,0 y el 31,7% en nuestro estudio, frente al 40 y el 46% en el estudio QASTA. Estos aspectos pueden asociarse con una mejor concordancia del QFR con la FFR/iFR en nuestros resultados. En otro estudio publicado por Sejr-Hansen et al.34, se evaluó el rendimiento diagnóstico del QFR antes del TAVI y se utilizaron como referencia los valores de FFR e iFR tras el TAVI. El QFR previo al TAVI mostró una mejor exactitud diagnóstica al emplear la FFR posterior al TAVI como referencia, en comparación con el iFR posterior al TAVI (el 83% [IC95%, 68%-97%] y el 52% [IC95%, 30%-74%] respectivamente; p=0,008). En otro estudio de Mejía-Rentería et al.35 en el que se analizaron 300 arterias coronarias, el QFR mostró una reducción del rendimiento diagnóstico en comparación con la FFR en presencia de una resistencia microvascular elevada. En cambio, no se dispone de datos de valoración de la EC con un cociente de ciclo completo o cociente Pd/Pa en reposo o con otros índices no hiperémicos en presencia de una EA. Recientemente, Stähli et al.36 han presentado datos de 516 vasos empleados para comparar el rendimiento diagnóstico del QFR y el cociente Pd/Pa en comparación con la FFR. El QFR mostró una exactitud diagnóstica superior a la del cociente Pd/Pa en reposo y la de los índices anatómicos.
Además, otro problema que aparece en el horizonte es el del tratamiento de los pacientes con una EA grave. La revascularización de las lesiones con una gravedad confirmada en estos pacientes a los que se practica un TAVI continúa siendo una cuestión controvertida. El ensayo aleatorizado ACTIVATION, recientemente presentado, no respaldó la revascularización para los pacientes de TAVI durante el estudio diagnóstico37. No obstante, continúa habiendo muchas preguntas pendientes de respuesta para resolver el problema de la evaluación de la fisiología de la lesión y el correspondiente tratamiento en el contexto de la EA grave.
LimitacionesNuestro estudio tiene varias limitaciones. No se determinó la reserva de flujo coronario. Los gráficos de Bland-Altman confirmaron un claro sesgo en la comparación del QFR con el cociente Pd/Pa y el iFR (no con la FFR). El sesgo observado probablemente tenía relación con la diferente técnica de medición. En general, los valores medios observados fueron más altos con el cociente Pd/Pa y el iFR que con la FFR, con una menor variabilidad en los valores del cociente Pd/Pa y el iFR que en los del FFR. Así pues, las diferencias existentes entre estos parámetros podrían ser muy superiores en las lesiones significativas que en las no significativas. Además, no se evaluaron la fisiología coronaria y el QFR después del tratamiento de la EA.
CONCLUSIONESEl QFR muestra una buena concordancia con la FFR y el iFR. Además, la exactitud diagnóstica y la función discriminante podrían ser incluso mejores cuando se emplea como referencia el iFR, presumiblemente por la naturaleza compleja de la fisiología coronaria en la evaluación de la EC de los pacientes con una EA grave. Por otra parte, el QFR podría tener las mismas limitaciones que los índices invasivos en los pacientes con una EA grave.
- –
Varios estudios han intentado resolver los resultados inesperados y contradictorios de la evaluación de la fisiología coronaria en presencia de una EA.
- –
El QFR es un nuevo método no invasivo para evaluar la fisiología coronaria.
- –
Sin embargo, no se dispone de datos sobre el QFR en pacientes con estenosis aórtica y EC.
- –
Solo 2 estudios similares han abordado recientemente la determinación del QFR en el contexto de una EA grave.
- –
Se compara el rendimiento diagnóstico del QFR con los del cociente de presión coronaria en reposo distal/aórtica (Pd/Pa), la reserva fraccional de flujo (FFR) y el índice diastólico instantáneo sin ondas (iFR), así como con la de los índices angiográficos.
- –
El QFR mostró una concordancia mejor con la FFR que con el iFR y el cociente Pd/Pa.
- –
Además, el QFR mostró una exactitud diagnóstica y una función discriminante mejores cuando se utilizó como referencia el iFR en vez de la FFR.
Este estudio contó con el apoyo de una subvención del Centro Nacional de Ciencia (solicitud número: 2018/02/X/NZ5/02648).
CONTRIBUCIÓN DE LOS AUTORESDiseño del estudio: P. Kleczynski. Obtención de los datos: P. Kleczynski, L. Rzeszutko, J. Legutko. Análisis estadístico: A. Dziewierz. Interpretación de los datos: P. Kleczynski, A. Dziewierz, J. Legutko. Preparación del manuscrito: P. Kleczynski, A. Dziewierz, L. Rzeszutko, D. Dudek, J. Legutko. Búsqueda bibliográfica: P. Kleczynski, J. Legutko. Obtención de fondos: P. Kleczynski.
CONFLICTO DE INTERESESLos autores declaran no tener conflictos de intereses.