La menor prevalencia de diabetes mellitus tipo 2 (DM2) en pacientes con hipercolesterolemia familiar heterocigota (HFHe) podría explicar por qué la DM2 no siempre se ha descrito como un predictor de enfermedad cardiovascular (ECV) en estos pacientes. El objetivo del presente estudio fue evaluar los aspectos clínicos y genéticos de pacientes con HFHe y DM2 del registro de dislipidemias de la Sociedad Española de Arteriosclerosis.
MétodosLos pacientes con HFHe se clasificaron según la presencia/ausencia de DM2. Se compararon las características clínicas, bioquímicas y genéticas de ambos grupos.
ResultadosDe los 2.301 casos de hipercolesterolemia primaria del registro, se incluyeron 1.724 casos con el diagnóstico cierto o probable según la Dutch Lipid Clinic Network para la hipercolesterolemia familiar. Los pacientes con HFHe y DM2 presentaron una tasa más elevada de ECV y un perfil lipídico menos favorable, con niveles más elevados de colesterol total (366,9±86,7 mg/dl frente a 342,0±74,7 mg/dl; diferencia media 24,894; IC95%, 5,840-43,949) y colesterol no-unido a lipoproteínas de alta densidad (316,9±87,8 mg/dl frente a 286,4±75,4 mg/dl; diferencia media 30,500; IC95%, 11,211-49,790). No se encontraron diferencias significativas entre los grupos con respecto al tipo de mutación (p=0,720). Después de ajustar por los principales factores de riesgo, el análisis de regresión logística confirmó una relación entre la DM2 y la ECV (OR=2,01; IC95%, 1,18-3,43; p=0,010).
ConclusionesLos pacientes con HFHe y DM2 presentan una tasa más elevada de ECV y un perfil lipídico menos favorable, independientemente del tipo de mutación. La diabetes mellitus es un factor asociado a la presencia de ECV en estos pacientes.
Palabras clave
La hipercolesterolemia familiar heterocigota (HFHe), causada por mutaciones en los genes que codifican el receptor de lipoproteínas de baja densidad (LDL), la apolipoproteína (apo) B, la proproteína convertasa subtisilina/kexina tipo 9 (PCSK9) o la apoE1, da lugar a una elevación de las concentraciones de colesterol unido a LDL (cLDL) que produce una mayor incidencia de eventos cardiovasculares2. Se considera que estos pacientes tienen un riesgo cardiovascular elevado según las guías clínicas europea y estadounidense3,4. Además, la reciente guía de la American Association of Clinical Endocrinologists y el American College of Endocrinology considera que la enfermedad cardiovascular (ECV) establecida y la hipercolesterolemia familiar (HF) o la diabetes constituyen una categoría de riesgo cardiovascular extremo y recomiendan como objetivo terapéutico en estos casos una concentración de cLDL <55 mg/dl5.
Sin embargo, la ECV parece ser muy diversa en los pacientes con HFHe, incluso en los que tienen la misma mutación patogénica6. A este respecto, la International Aterosclerosis Society propuso unos criterios específicos para definir un fenotipo de pacientes con HFHe grave7 con un probable aumento del riesgo cardiovascular. La estratificación del riesgo en la HFHe es una cuestión importante; sin embargo, estos criterios propuestos no parecen resolver el problema8,9. Por consiguiente, es esencial identificar a los pacientes con HF que tienen mayor riesgo de ECV, con objeto de facilitar la toma de decisiones clínicas respecto a la indicación para el uso de tratamientos hipolipemiantes agresivos como los inhibidores de PCSK9.
Por otra parte, la evidencia disponible indica una disminución del riesgo de diabetes mellitus tipo 2 (DM2) en los pacientes con HFHe en comparación con la población general, aunque todavía no se conoce por completo el mecanismo exacto de este posible efecto protector10,11. Aunque la DM2 es un factor independiente predictivo de ECV en la población general12,13, es posible que no ocurra así en la población con HFHe. Así, aunque la DM2 fue un factor de riesgo cardiovascular independiente en la Columbia Británica (Canadá)14, la cohorte de HF holandesa15 y el registro CASCADE-FH de Estados Unidos16, esta observación no pudo reproducirse en otras cohortes de HF como las de Quebec (Canadá)17, Utah (Estados Unidos)18, Brasil19, Australia20 y Grecia21. En un registro español22, aunque la DM2 se consideró un factor pronóstico en el análisis univariante, no se incluyó en el análisis final, probablemente debido a la baja prevalencia del deterioro del metabolismo de la glucosa en los pacientes con HFHe.
Esto puede explicarse, al menos en parte, por la baja incidencia del deterioro del metabolismo de la glucosa en esta población concreta. En cambio, en un reciente estudio de metanálisis y revisión sistemática en el que se evaluó la asociación de factores de riesgo con la ECV en pacientes con HFHe, el tabaquismo, la hipertensión y la DM2 explicaron más de una cuarta parte del riesgo de ECV en los pacientes con HFHe23.
El presente estudio tiene como objetivo evaluar las características bioquímicas y genéticas de los pacientes con HFHe y DM2 comparadas con las de aquellos sin DM2 en el amplio registro de dislipemia de la Sociedad Española de Arteriosclerosis.
MÉTODOSProtocolo del estudioEl registro de dislipemia de la Sociedad Española de Arteriosclerosis se creó en 2013 como registro online en el que 50 unidades de lípidos certificadas, distribuidas por toda España, introducen casos con diferentes formas de hiperlipemias primarias. Estas unidades de lípidos son los centros del Servicio de Salud de España a los que se remite a la mayor parte de los casos de hiperlipemia familiar para su tratamiento clínico. El registro fue aprobado por un comité de ética central para la inclusión de datos clínicos anonimizados (Comité Ético de Investigación Clínica de Aragón, Zaragoza, España) ateniéndose a las guías éticas de la Declaración de Helsinki. No fue necesario que los pacientes firmaran un documento de consentimiento informado, ya que los datos se obtuvieron de un registro nacional oficial; sin embargo, a partir de septiembre de 2018, se ha obtenido el consentimiento por escrito de los participantes según lo establecido en las instrucciones emitidas por el Comité de Ética. Los datos mínimos para la inclusión de los casos en el registro son los siguientes: edad, sexo, tabaquismo, antecedentes personales de hipertensión, diabetes mellitus y ECV con la edad del primer evento, índice de masa corporal, perímetro de cintura, perfil lipídico completo que incluye las concentraciones de colesterol total, cLDL, triglicéridos y colesterol unido a lipoproteínas de alta densidad (cHDL) sin tratamiento hipolipemiante en el momento del diagnóstico, y parámetros lípídicos y bioquímicos en el momento de la inclusión en el registro. La ECV se define en el registro como una enfermedad coronaria (infarto de miocardio, síndrome coronario agudo con estenosis> 50% de una arteria coronaria principal y revascularización coronaria), ictus (isquémico o hemorrágico), aneurisma aórtico o isquemia de extremidad inferior (claudicación intermitente con un índice tobillo/brazo <0,90 o revascularización de arterias de extremidades inferiores). La DM2 se define como una glucemia en ayunas> 125mg/dl o el empleo de un tratamiento con medicación hipoglucemiante.
Los criterios de inclusión en el presente estudio fueron los siguientes: pacientes de edad ≥ 18 años con una HFHe probable (6-8 puntos) o determinada (> 8 puntos) según los criterios de la Dutch Lipid Clinic Network24 y disponibilidad de los datos mínimos completos del registro, como la información sobre antecedentes familiares de hipercolesterolemia y ECV prematura, antecedentes personales de xantomas tendinosos y arco corneal antes de los 45 años, estudio genético de LDLR, APOB o PCSK9, edad de inicio del tratamiento con estatinas y edad al diagnóstico de la DM2.
Se clasificó a los pacientes con HFHe según la presencia o ausencia de DM2 en el momento de la inclusión en el registro. Se compararon las características clínicas, bioquímicas y genéticas de los 2 grupos.
Los criterios de exclusión fueron los siguientes: HF homocigota y datos no disponbles sobre antecedentes familiares o personales de ECV, tratamiento hipolipemiante, edad de inicio de la DM2 o ausencia de análisis genético.
Análisis bioquímicoSe obtuvieron muestras de sangre tras una noche en ayunas (> 10 h) y se procesaron para los análisis de laboratorio el mismo día. Se determinaron localmente mediante métodos enzimáticos las concentraciones en suero de colesterol total, triglicéridos y cHDL. La concentración de cLDL en suero se calculó con la fórmula de Friedewald.
Análisis genéticoSe aisló ADN a partir de muestras de sangre total por métodos estándares y se efectuaron análisis de detección sistemática de mutaciones en LDLR, APOB y PCSK9 mediante la Lipochip Plataforma (Progenika Biopharma S.A., Bilbao, España). Esta plataforma concreta consta de 2 pasos consecutivos: el primero es un análisis con la plataforma LIPOchip para la detección de las mutaciones puntuales más frecuentes en España del gen LDLR y del exón 26 del APOB, así como de las variantes del número de copias (CNV) existentes para el LDLR. Cuando el LIPOchip producía un resultado negativo (no se encontraba ninguna mutación), se determinaban las secuencias de codificación de los genes LDLR, APOB (dominio de unión) y PCSK9, las fronteras de exón-intrón y las secuencias intrónicas proximales cortas, con un sistema GS Junior (Roche Diagnostics Corporation, Basilea, Suiza)25.
Análisis estadísticoLos datos se expresan en forma de media±desviación estándar para las variables continuas. Las variables cualitativas se expresan en forma de porcentajes y frecuencias. Se utilizó la prueba de la t de Student para evaluar las diferencias entre 2 medias. Se aplicó la prueba de la χ2 o la prueba exacta de Fisher para evaluar el grado de asociación entre las variables cualitativas. Se utilizó un análisis de regresión logística y se calcularon los valores de odds ratio (OR) y sus intervalos de confianza del 95% (IC95%) para determinar si, tras un ajuste respecto a las variables restantes que influían en la presencia de ECV, la existencia de un deterioro del metabolismo de la glucosa (que incluía el diagnóstico de DM2, la glucemia en ayunas y la glucohemoglobina [HbA1c]) se asociaba con la presencia de una ECV en los pacientes con HFHe. El modelo inicial fue un modelo sin ajustar; el segundo modelo se ajustó por la edad y el sexo masculino; el tercer modelo se ajustó por la edad, el sexo masculino, el tabaquismo y las concentraciones de cHDL, y el último modelo se ajustó por la edad, el sexo masculino, el tabaquismo, las concentraciones de cHDL y el índice de masa corporal. Se consideró estadísticamente significativo un valor de p bilateral <0,05. Los análisis se realizaron con el programa SPSS (versión 19.0 para Windows, SPSS, Chicago, Illinois, Estados Unidos).
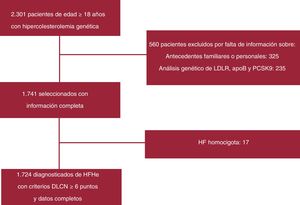
RESULTADOSDe los 2.301 pacientes con hipercolesterolemia primaria incluidos en el registro, finalmente se incluyó en el estudio a 1.724 con un diagnóstico probable o determinado según la puntuación de la Dutch Lipid Clinic Network (figura 1). La media de edad de la cohorte del estudio fue 52,2±15,4 años, y 822 pacientes (47,7%) eran varones, con una media de índice de masa corporal de 25,9±4,5. Un total de 87 (5%) de los 1.724 pacientes incluidos en el análisis final cumplían los criterios de DM2 (tabla 1).
Diagrama de flujo del estudio para los pacientes incluidos finalmente en el análisis. apo: apolipoproteína; DLCN: Dutch Lipid Clinic Network; HF: hipercolesterolemia familiar; HFHe: hipercolesterolemia familiar heterocigota; LDLR: receptor de lipoproteínas de baja densidad; PCSK9: proproteína convertasa subtilisina/kexina tipo 9.
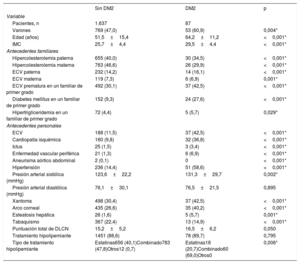
Características clínicas de los pacientes con hipercolesterolemia familiar heterocigota incluidos en el estudio
| Sin DM2 | DM2 | p | |
|---|---|---|---|
| Variable | |||
| Pacientes, n | 1.637 | 87 | |
| Varones | 769 (47,0) | 53 (60,9) | 0,004* |
| Edad (años) | 51,5±15,4 | 64,2±11,2 | <0,001* |
| IMC | 25,7±4,4 | 29,5±4,4 | <0,001* |
| Antecedentes familiares | |||
| Hipercolesterolemia paterna | 655 (40,0) | 30 (34,5) | <0,001* |
| Hipercolesterolemia materna | 763 (46,6) | 26 (29,9) | <0,001* |
| ECV paterna | 232 (14,2) | 14 (16,1) | <0,001* |
| ECV materna | 119 (7,3) | 6 (6,9) | 0,001* |
| ECV prematura en un familiar de primer grado | 492 (30,1) | 37 (42,5) | <0,001* |
| Diabetes mellitus en un familiar de primer grado | 152 (9,3) | 24 (27,6) | <0,001* |
| Hipertrigliceridemia en un familiar de primer grado | 72 (4,4) | 5 (5,7) | 0,029* |
| Antecedentes personales | |||
| ECV | 188 (11,5) | 37 (42,5) | <0,001* |
| Cardiopatía isquémica | 160 (9,8) | 32 (36,8) | <0,001* |
| Ictus | 25 (1,5) | 3 (3,4) | <0,001* |
| Enfermedad vascular periférica | 21 (1,3) | 6 (6,9) | <0,001* |
| Aneurisma aórtico abdominal | 2 (0,1) | 0 | <0,001* |
| Hipertensión | 236 (14,4) | 51 (58,6) | <0,001* |
| Presión arterial sistólica (mmHg) | 123,6±22,2 | 131,3±29,7 | 0,002* |
| Presión arterial diastólica (mmHg) | 76,1±30,1 | 76,5±21,5 | 0,895 |
| Xantoma | 498 (30,4) | 37 (42,5) | <0,001* |
| Arco corneal | 435 (26,6) | 35 (40,2) | <0,001* |
| Esteatosis hepática | 26 (1,6) | 5 (5,7) | 0,001* |
| Tabaquismo | 367 (22,4) | 13 (14,9) | <0,001* |
| Puntuación total de DLCN | 15,2±5,2 | 16,5±6,2 | 0,050 |
| Tratamiento hipolipemiante | 1451 (88,6) | 78 (89,7) | 0,795 |
| Tipo de tratamiento hipolipemiante | Estatinas656 (40,1)Combinado783 (47,8)Otros12 (0,7) | Estatinas18 (20,7)Combinado60 (69,0)Otros0 | 0,006* |
DLCN: Dutch Lipid Clinic Network; DM2: diabetes mellitus tipo 2; ECV: enfermedad cardiovascular; IMC: índice de masa corporal.
Salvo otra indicación, los valores expresan n (%) o media±desviación estándar.
Las tasas de hipercolesterolemia paterna y materna fueron más altas en los pacientes con un perfil de glucosa normal que en los que tenían DM2. Sin embargo, las tasas de ECV prematura y de DM en un familiar de primer grado fueron relativamente mayores en el grupo de HFHe con DM2.
En comparación con los pacientes con HFHe sin DM2, los que tenían DM2 eran con mayor frecuencia varones (el 60,9 frente al 47,0%; p=0,004) y de más edad (64,2±11,2 frente a 51,5±15,4 años; p <0,001) y tenían un índice de masa corporal más alto (29,5±4,4 frente a 25,7±4,4; p <0,001).
Estos pacientes tenían también unas tasas de ECV más elevadas (el 42,5 frente al 11,5%; p <0,001) con independencia del área afectada por la enfermedad (coronaria, cerebrovascular o extremidades inferiores) y unas tasas más altas de hipertensión (el 58,6 frente al 14,4%; p <0,001). En los pacientes con DM2 eran también más frecuentes los xantomas (el 42,5 frente al 30,4%; p <0,001) y el arco corneal (el 40,2 frente al 26,6%; p <0,001) en comparación con lo observado en los pacientes sin DM. La tasa de aneurismas de la aorta abdominal fue inferior en los pacientes con HFHe que tenían DM2 en comparación con aquellos con perfil de glucemia normal (0 frente al 0,1%; p <0,001). Las demás características clínicas se muestran en la tabla 1.
Parámetros bioquímicosEl evento cardiovascular fue previo al inicio del tratamiento hipolipemiante en 140 casos; de ellos, 21 (15%) tenían DM2. Se analizaron también los parámetros bioquímicos de los pacientes con HFHe con y sin tratamiento hipolipemiante.
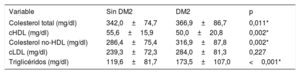
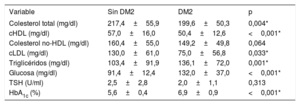
Según lo indicado por los resultados bioquímicos sin tratamiento hipolipemiante, los pacientes con DM2 y HFHe presentaron un perfil lipídico menos favorable, con concentraciones superiores de colesterol total (366,9±86,7 frente a 342,0±74,7mg/dl; p=0,011) y de colesterol no-HDL (316,9±87,8 frente a 286,4±75,4mg/dl; p=0,002). Además, las concentraciones de cHDL fueron inferiores (50,0±20,8 frente a 55,6±15,9mg/dl; p=0,002) y las de triglicéridos fueron superiores (173,5±107,0 frente a 119,6±81,7mg/dl; p <0,001) a las observadas en el grupo de pacientes con normoglucemia. No hubo diferencias entre los grupos en cuanto a las concentraciones de cLDL (tabla 2).
Perfil lipídico sin tratamiento hipolipemiante de los pacientes con hipercolesterolemia familiar heterocigota incluidos en el estudio
| Variable | Sin DM2 | DM2 | p |
|---|---|---|---|
| Colesterol total (mg/dl) | 342,0±74,7 | 366,9±86,7 | 0,011* |
| cHDL (mg/dl) | 55,6±15,9 | 50,0±20,8 | 0,002* |
| Colesterol no-HDL (mg/dl) | 286,4±75,4 | 316,9±87,8 | 0,002* |
| cLDL (mg/dl) | 239,3±72,3 | 284,0±81,3 | 0,227 |
| Triglicéridos (mg/dl) | 119,6±81,7 | 173,5±107,0 | <0,001* |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; DM2: diabetes mellitus tipo 2.
Los valores expresan media±desviación estándar.
Se analizaron también los resultados de los análisis de sangre de los pacientes que estaban siendo tratados con medicación hipolipemiante (tabla 3). En esta situación, las concentraciones de colesterol total (217,4±55,9 frente a 199,6±50,3mg/dl; p=0,004) y de cLDL (130,0±61,0 frente a 75,0±56,8mg/dl; p=0,033) fueron significativamente superiores en el grupo sin DM2 que en los pacientes con DM2.
Parámetros analíticos de laboratorio actuales de los pacientes con hipercolesterolemia familiar heterocigota incluidos en el estudio
| Variable | Sin DM2 | DM2 | p |
|---|---|---|---|
| Colesterol total (mg/dl) | 217,4±55,9 | 199,6±50,3 | 0,004* |
| cHDL (mg/dl) | 57,0±16,0 | 50,4±12,6 | <0,001* |
| Colesterol no-HDL (mg/dl) | 160,4±55,0 | 149,2±49,8 | 0,064 |
| cLDL (mg/dl) | 130,0±61,0 | 75,0±56,8 | 0,033* |
| Triglicéridos (mg/dl) | 103,4±91,9 | 136,1±72,0 | 0,001* |
| Glucosa (mg/dl) | 91,4±12,4 | 132,0±37,0 | <0,001* |
| TSH (U/ml) | 2,5±2,8 | 2,0±1,1 | 0,313 |
| HbA1c (%) | 5,6±0,4 | 6,9±0,9 | <0,001* |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; DM2: diabetes mellitus tipo 2; HbA1c: glucohemoglobina; TSH: tirotropina.
Los valores expresan media±desviación estándar.
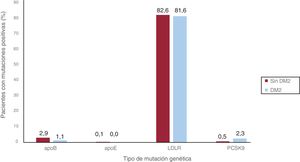
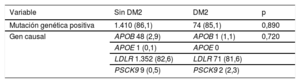
Un total de 74 (85,1%) pacientes con DM2 y 1.410 (86,1%) pacientes sin DM2 presentaban una mutación patogénica relacionada con la HFHe (p=0,890). La mutación en LDLR fue la más frecuente, y se dio en el 81,6 y el 82,6% de los pacientes con y sin DM2 respectivamente. Los demás resultados del estudio genético de los pacientes incluidos se detallan en la tabla 4 y la figura 2.
Análisis genético de los pacientes incluidos
| Variable | Sin DM2 | DM2 | p |
|---|---|---|---|
| Mutación genética positiva | 1.410 (86,1) | 74 (85,1) | 0,890 |
| Gen causal | APOB 48 (2,9) | APOB 1 (1,1) | 0,720 |
| APOE 1 (0,1) | APOE 0 | ||
| LDLR 1.352 (82,6) | LDLR 71 (81,6) | ||
| PSCK9 9 (0,5) | PSCK9 2 (2,3) |
APO: apolipoproteína; DM2: diabetes mellitus tipo 2; LDLR: receptor de lipoproteínas de baja densidad; PCSK9: proproteína convertasa subtilisina/kexina tipo 9.
Los valores expresan n (%).
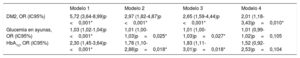
Se evaluó también la asociación entre el deterioro del metabolismo de la glucosa y la ECV en los pacientes con HFHe (tabla 5). Tras un ajuste respecto a varios factores de riesgo como la edad, el sexo masculino, el tabaquismo, las concentraciones de cHDL, la hipertensión y el índice de masa corporal, se observó una asociación significativa entre la DM2 y la ECV (OR=2,01; IC95%, 1,18-3,43; p=0,010).
Análisis de regresión logística en el que se evalúa la asociación entre el deterioro del metabolismo de la glucosa y la enfermedad cardiovascular en pacientes con hipercolesterolemia familiar heterocigota
| Modelo 1 | Modelo 2 | Modelo 3 | Modelo 4 | |
|---|---|---|---|---|
| DM2, OR (IC95%) | 5,72 (3,64-8,99)p <0,001* | 2,97 (1,82-4,87)p <0,001* | 2,65 (1,59-4,44)p <0,001* | 2,01 (1,18-3,43)p=0,010* |
| Glucemia en ayunas, OR (IC95%) | 1,03 (1,02-1,04)p <0,001* | 1,01 (1,00-1,03)p=0,025* | 1,01 (1,00-1,03)p=0,027* | 1,01 (0,99-1,02)p=0,105 |
| HbA1c, OR (IC95%) | 2,30 (1,45-3,64)p <0,001* | 1,78 (1,10-2,88)p=0,018* | 1,83 (1,11-3,01)p=0,018* | 1,52 (0,92-2,53)p=0,104 |
cHDL: colesterol unido a lipoproteínas de alta densidad; DM2: diabetes mellitus tipo 2; HbA1c: glucohemoglobina; IC95%: intervalo de confianza del 95%; OR: odds ratio.
Modelo 1: sin ajustar.
Modelo 2: ajustado por la edad y el sexo masculino.
Modelo 3: ajustado por la edad, el sexo masculino, el tabaquismo y las concentraciones de cHDL.
Modelo 4: ajustado por la edad, el sexo masculino, el tabaquismo, las concentraciones de cHDL y el índice de masa corporal.
La evidencia reciente demuestra que la ECV en los pacientes con HFHe ha mejorado sustancialmente con el tratamiento actual, de tal manera que la prevalencia de la ECV es un tercio de lo descrito antes de la era de las estatinas26. Sin embargo, la ECV en la HFHe es extremadamente heterogénea. Aunque los factores de riesgo específicos de HFHe, como el tipo de mutación y la presencia de xantomas tendinosos, se han descrito ya con anterioridad27, parece que los factores de riesgo cardiovascular clásicos también tienen un papel a la hora de explicar las diferencias en la aparición de la ECV en la población con HF7.
En el presente estudio, los pacientes con HFHe y DM2 presentaron mayores tasas de hipertensión y de ECV, que incluye cardiopatía isquémica, ictus y enfermedad vascular periférica, pero con una tasa inferior de aneurisma aórtico abdominal. Además, mostraron también un perfil lipídico menos favorable, con concentraciones superiores de colesterol total, colesterol no-HDL y triglicéridos y cifras inferiores de cHDL. Por último, la frecuencia y el tipo de mutación genética fueron similares en ambos grupos, de tal manera que las mutaciones del gen LDLR fueron las observadas con más frecuencia en esta cohorte.
La DM2 es un factor de riesgo cardiovascular establecido, que se asocia con un aumento del riesgo de enfermedad coronaria, cerebral y vascular periférica28. Así pues, no es de extrañar que, en la cohorte analizada aquí, la tasa de ECV fuera mayor en los pacientes con un deterioro del metabolismo de la glucosa que en los que no tenían DM2. En coherencia con estos resultados, Yanagi et al.29 observaron también un aumento del 87 y el 59% en la prevalencia de enfermedad coronaria en pacientes con HF e intolerancia a la glucosa o DM2 en comparación con el 43% en los pacientes con un perfil de glucosa normal.
Además, en consonancia con lo observado en el presente estudio, los datos recientes de la cohorte de HF de Canadá indican que los pacientes con HF diabéticos constituyen una población con alto riesgo cardiovascular debido a la concomitancia de factores de riesgo cardiometabólicos17. Como han indicado también otros estudios previos30,31, otros factores asociados con la resistencia a la insulina, como la edad más avanzada, el aumento del índice de masa corporal y la presión arterial elevada, se dieron con más frecuencia en el grupo de DM2 en el presente estudio y es probable que también tengan su papel en el mayor riesgo cardiovascular existente en esta población concreta.
Dado que la dislipemia aterógena es la anomalía lipídica característica en la DM2, parece razonable que, en la presente cohorte, las concentraciones de cHDL fueran inferiores y las de triglicéridos fueran superiores en el grupo de pacientes con DM2. No obstante, las concentraciones de cLDL fueron comparables en los 2 grupos, lo cual concuerda también con lo indicado por otros estudios29,32. Por otra parte, de manera coherente también con lo indicado por los resultados del presente estudio, un estudio anterior publicado por nuestro grupo, en el que se incluyó a 354 pacientes con una HFHe probable y 1.378 con una HFHe determinada, observó que la concentración de cLDL no era un factor de riesgo asociado con la prevalencia de la DM233. De igual modo, en otros estudios prospectivos no se observó una relación directa entre las concentraciones de cLDL y el aumento del riesgo de diabetes34,35.
Por lo que respecta al perfil lipídico tras el inicio del tratamiento hipolipemiante, como ya se ha mencionado en «Resultados», las concentraciones de colesterol total y de cLDL fueron significativamente mayores en el grupo sin DM2 que en los pacientes con DM2. Es probable que esto pueda explicarse por el mayor porcentaje de uso de tratamiento hipolipemiante en el grupo de pacientes con un deterioro del metabolismo de la glucosa.
Alrededor del 85% de los pacientes con y sin DM2 tenían una mutación genética causante de la HFHe; sin embargo, no se observaron diferencias entre los grupos por lo que respecta a la frecuencia o la distribución del tipo de gen afectado. Estos resultados concuerdan con los de un estudio realizado con el mismo registro de pacientes, en el que no se observaron diferencias en la prevalencia de DM2 en función de la presencia de determinadas mutaciones genéticas causantes de HFHe, como las de los genes LDLR, APOB y PCSK933.
Sin embargo, a diferencia de los resultados antes descritos, otros estudios han observado una posible asociación causal entre las mutaciones causantes de la HFHe y modificaciones del riesgo de sufrir alteraciones del metabolismo glucémico. Por ejemplo, Besseling et al.10 observaron menor prevalencia de DM2 en los pacientes con un resultado negativo de mutación del gen LDLR y una asociación dependiente de la dosis en comparación con los pacientes con un defecto del gen LDLR o una mutación del gen APOB, lo cual indica una posible relación entre la gravedad de la alteración genética y la protección contra la DM2. De igual modo, Saavedra et al.36 llegaron a la conclusión de que la variante InsLEU del gen PCSK9 se asociaba no solo con un menor riesgo de eventos coronarios, sino también a un aumento de la aparición de prediabetes y DM. En resumen, las mutaciones causantes de HFHe se han relacionado tanto con un aumento como con un descenso de la alteración del metabolismo glucémico, si bien el presente estudio no observó ninguna asociación entre la presencia de DM2 y determinadas mutaciones genéticas. Así pues, dados los resultados contradictorios existentes en este campo, serán necesarios nuevos estudios para confirmar una posible relación entre el tipo de mutación causante de la HFHe y la alteración del perfil glucémico.
Por último, y de manera coherente con los resultados antes mencionados, se observó una asociación positiva entre el deterioro del metabolismo de la glucosa (que incluye la DM2, la glucemia en ayunas y la HbA1c) y la ECV en los pacientes con HFHe, lo que confirma nuevamente la estrecha relación existente entre ambas cosas.
El presente estudio tiene ciertas limitaciones. En primer lugar, dado que se trataba de un estudio de observación, con un diseño transversal, no pudo inferirse ninguna relación causal de los resultados. El número de pacientes con DM2 e HFHe fue relativamente bajo en comparación con lo observado en la población general de España (el 5 frente al 13,8% de los mayores de 18 años y el 29,8% en la franja de 65-71 años)37, lo cual concuerda con el posible efecto protector de la HFHe respecto al riesgo de diabetes. Por lo que respecta a la población incluida, los participantes procedían del registro nacional de un país mediterráneo, en el que son de prever unas tasas de enfermedad coronaria inferiores a las de otras poblaciones de todo el mundo, si bien con una alta prevalencia de DM237. Además, todos los participantes incluidos en el estudio procedían del registro de dislipemia de la Sociedad Española de Arteriosclerosis. Así pues, se trata de pacientes tratados y seguidos en unidades de lípidos especializadas, siguiendo un protocolo estandarizado y, por consiguiente, los presentes resultados no son extrapolables al conjunto de la población española.
CONCLUSIONESEn el presente estudio, los pacientes con HFHe y DM2 presentaron unas tasas de hipertensión y de ECV superiores, así como un perfil lipídico menos favorable. Se confirmó la existencia de una asociación positiva entre el deterioro del metabolismo de la glucosa y la ECV en los pacientes con HFHe. No se identificaron diferencias entre los grupos por lo que respecta a la presencia o la distribución de las diferentes mutaciones genéticas causantes de la HFHe. Los futuros estudios en este campo serán útiles para identificar posibles diferencias entre los pacientes con un diagnóstico de HFHe que presentan o no un deterioro del metabolismo de la glucosa.
FINANCIACIÓNEste artículo no ha contado con ninguna financiación.
CONFLICTO DE INTERESESJ.F. Ascaso declara pagos personales de Sanofi, Mylan, Ferrer y Novo Nordisk, sin relación con el trabajo presentado; J. Pedro-Botet declara un apoyo no económico de Astra-Zeneca, Esteve, Merck, Mylan y Sanofi-Aventis, sin relación con el trabajo presentado; X. Pintó declara subvenciones de FIS-ISCIII y CIBER-ISCIII, pagos personales de Amgen, Abbott, Sanofi, Lacer, Rubió y Esteve, sin relación con el trabajo presentado; P. Valdivielso declara pagos personales de Amgen, Sanofi y MSD, subvenciones y pagos personales de Ferrer, y pagos personales de Esteve, sin relación con el trabajo presentado. Los demás autores no declaran conflictos de intereses en relación con este trabajo.
- –
Los pacientes con HFHe presentan un aumento del riesgo cardiovascular.
- –
Los pacientes con HFHe tienen una tasa de DM2 inferior.
- –
La DM2 no siempre se ha descrito como factor de riesgo cardiovascular en esos pacientes.
- –
Los pacientes con HFHe y DM2 tienen un riesgo de ECV superior.
- –
Los pacientes con HFHe y DM2 tienen un perfil lipídico menos favorable.
- –
No se observaron diferencias respecto a mutaciones genéticas específicas en los pacientes con HFHe con y sin DM2.
- –
La DM2 se asocia con la presencia de ECV en estos pacientes.
Damos las gracias al personal de las clínicas de lípidos españolas por la inclusión de los casos en el registro de dislipemia de la Sociedad Española de Arteriosclerosis y a Christine O’Hara por la revisión de la versión inglesa del manuscrito.