Evaluar la capacidad de la tomografía computarizada con multidetectores en el diagnóstico de la disfunción ventricular izquierda de origen coronario y valorar su exactitud diagnóstica comparándola con la combinación de coronariografía invasiva y resonancia magnética.
MétodosSe estudió a 40 pacientes consecutivos con disfunción ventricular izquierda de origen no filiado mediante coronariografía invasiva y resonancia con contraste. A todos ellos se les realizó además un estudio de tomografía computarizada con multidetectores incluyendo presencia de calcio coronario y su cuantificación, coronariografía y valoración tisular del miocardio.
ResultadosLa sensibilidad y la especificidad de la presencia de calcio coronario para identificar la disfunción ventricular izquierda de origen coronario fueron del 100 y el 31% respectivamente. Si se considera un score de calcio por Agatston>100, la especificidad sube al 58% manteniendo la sensibilidad del 100%. Los valores de sensibilidad y especificidad de la coronariografía por tomografía computarizada con multidetectores fueron del 100 y el 96% respectivamente; para la identificación de áreas de necrosis en la adquisición precoz, del 57 y el 100% y en la adquisición tardía, del 84 y el 96%. Para identificar a los pacientes coronarios con necrosis, la sensibilidad y la especificidad fueron del 92 y el 100% respectivamente.
ConclusionesDe todas las herramientas diagnósticas disponibles en tomografía computarizada con multidetectores, la coronariografía es la que muestra mayor exactitud diagnóstica para determinar el origen coronario de la disfunción ventricular. La combinación del estudio coronariográfico y el estudio tisular del miocardio tras el contraste permite obtener en un solo examen información similar a la de la combinación de cateterismo y resonancia con contraste.
Palabras clave
Dada la alta prevalencia de enfermedad coronaria (EC) entre los pacientes con insuficiencia cardiaca (IC) y disfunción sistólica ventricular izquierda (DSVI), el estudio etiológico debe excluir EC subyacente1. La IC asociada a miocardiopatía dilatada o a miocardiopatía isquémica (MI) pueden ser clínicamente indistinguibles, especialmente en los pacientes sin síntomas de angina ni ondas Q de necrosis en el electrocardiograma (ECG) o con bloqueo completo de rama izquierda del haz de His en el ECG que impidan su identificación2. El diagnóstico definitivo de MI se basa en la demostración de EC obstructiva mediante coronariografía que aunque tiene un riesgo bajo de complicaciones, pueden ser serias3, por lo que puede ser preferible una aproximación no invasiva al diagnóstico de EC, sobre todo en pacientes sin síntomas isquémicos ni antecedentes de infarto de miocardio previo.
La mayoría de las aproximaciones no invasivas en el diagnóstico etiológico de la miocardiopatía subyacente en pacientes con IC y DSVI, como la ecocardiografía o los estudios de medicina nuclear, no permiten obviar la necesidad de realizar coronariografía en estos pacientes. Así, los estudios de medicina nuclear, aunque muestran una sensibilidad aceptable, especialmente si se combinan estudios de perfusión y contractilidad de estrés, su especificidad es muy baja4. Del mismo modo, los estudios de ecocardiografía Doppler para detectar anomalías de la contractilidad segmentaria muestran una sensibilidad similar que los estudios de medicina nuclear, con mejor especificidad, especialmente si se emplea dobutamina5, 6. Sin embargo, el bloqueo de rama izquierda, hallazgo bastante habitual, asociado a movimiento anómalo septal limita su uso habitual.
La resonancia magnética cardiaca (RMC) permite combinar el estudio de la función contráctil total y segmentaria (como en ecocardiografía Doppler y medicina nuclear) y la perfusión miocárdica (como la medicina nuclear). Además, las adquisiciones tardías tras la administración del contraste permiten visualizar segmentos miocárdicos con zonas de necrosis. La detección de estas mediante el realce tardío de gadolinio (RTG) ha demostrado una excelente precisión diagnóstica para identificar a pacientes con IC y EC subyacente, incluso en pacientes con a priori baja probabilidad de cardiopatía isquémica7, 8.
Existen pocos estudios que hayan valorado la exactitud diagnóstica de la tomografía computarizada en pacientes con DSVI, ya sea mediante la identificación de calcificaciones coronarias9, 10, la detección de lesiones coronarias11, 12, 13, 14 o la detección de áreas de necrosis de forma similar a la RMC pero utilizando compuestos yodados como agentes de contraste14. Sin embargo, hasta ahora, ningun trabajo ha valorado la rentabilidad diagnóstica de todas estas herramientas en un mismo grupo de enfermos.
Los objetivos de este trabajo son determinar el valor diagnóstico individual de cada una de las herramientas disponibles en tomografía computarizada con multidetectores (TCMD) para identificar la DSVI de origen coronario (detección de calcio coronario, identificación de lesiones coronarias significativas y detección de áreas de necrosis) y valorar la exactitud diagnóstica de la combinación de la coronariografía y la detección de necrosis en el mismo examen mediante TCMD para identificar a los pacientes con DSVI de origen coronario, tomando como referencia la coronariografía invasiva y la detección de necrosis con RMC.
MÉTODOSEn este estudio prospectivo se incluyó a 40 pacientes (24 varones y 16 mujeres) con una media de edad de 61 (39-85) años y diagnóstico reciente de IC con confirmación ecocardiográfica de DSVI (fracción de eyección<40%) y dilatación del ventrículo izquierdo (diámetro telediastólico > percentil 95% en función de la superficie corporal) de origen no filiado. Sólo se incluyó a los pacientes sin EC conocida ni sospechada por clínica, ondas Q de necrosis en ECG o datos de laboratorio (elevación significativa de marcadores biológicos de necrosis miocárdica). También se excluyó a los pacientes con otras causas de miocardiopatía: miocardiopatía infiltrativa, miocardiopatía hipertrófica, miocarditis o valvulopatía significativa. Todos los pacientes estaban en ritmo sinusal y hemodinámicamente estables.
Se excluyó a los pacientes con contraindicación formal para la administración de contraste yodado: antecedentes de alergia al contraste yodado o insuficiencia renal crónica (creatinina sérica > 1,5mg/dl) o para la realización de la resonancia magnética: claustrofobia intensa, clips cerebrales, marcapasos o desfibrilador.
El estudio fue aprobado por el comité ético de nuestro centro y todos los pacientes otorgaron su consentimiento informado por escrito.
Resonancia magnética cardiacaSe empleó un imán de 1,5 T (Magnetom Sonata®; Siemens, Erlangen, Alemania). Las secuencias de cine se obtuvieron con sincronía cardiaca y en apnea utilizando secuencias de precesión libre en estado estacionario (steady-state free precession [SSFP]) en ejes largos (2, 3 y 4 cámaras) y en ejes cortos (grosor de corte, 8 mm; separación entre cortes, 2 mm) cubriendo desde anillo mitral hasta ápex. Se empleó como agente de contraste gadobenato de dimeglumina 0,5 M (0,15M/kg) administrado en vena periférica.
Para el estudio de perfusión se empleó una secuencia SSFP con sincronía cardiaca obteniendo al menos cuatro cortes en eje corto y uno en eje largo. Las imágenes para el estudio del RTG se obtuvieron empleando secuencias de eco de gradiente 2D y 3D (turbo-FLASH: fast low angle shot) con pulso de inversión-recuperación a los 8-10min tras la administración del contraste para obtener, al igual que para el estudio funcional, cortes en eje corto y eje largo. El tiempo de inversión para anular la señal del miocardio y detectar las áreas con RTG se ajustó en función del tiempo transcurrido. Opcionalmente se emplearon además secuencias SSFP.
Para el análisis del RTG se empleó el modelo de segmentación miocárdica estandarizado de 17 segmentos15.
Los patrones de RTG que se analizaron fueron: a) ausencia de RTG; b) RTG intramiocárdico lineal o focal (fibrosis), y c) RTG subendocárdico o transmural (necrosis).
Tomografía computarizada con multidetectoresSe empleó un tomógrafo de 64 detectores con un tiempo de rotación completa de 330ms (LightSpeed VCT®, GE; Milwaukee, Wisconsin, Estados Unidos) obteniendo 64 cortes, con grosor de 0,625mm y cobertura de 40mm por rotación, lo que permite adquirir un volumen que incluye el corazón en un tiempo medio de apnea de 6s.
El estudio de las calcificaciones coronarias se realizó en vacío (sin contraste) con sincronía cardiaca (grosor de corte, 2,5mm; 120kV y 430mA).
Para el estudio coronariográfico se empleó contraste yodado no iónico (Iomeron® 400, Bracco, Italia), adaptando el volumen al peso del paciente, inyectado en la vena antecubital con una velocidad de infusión de 5ml/s e iniciando la adquisición con la llegada del contraste a la aorta ascendente. En general se emplearon 70ml para pacientes con peso < 70kg y hasta 120ml para aquellos con peso > 70kg.
La adquisición se realizó de forma sincronizada con el ECG utilizando entre 100 y 120kV y hasta 750mA de corriente efectiva en función de la superficie corporal. Se empleó, además, modulación de dosis de radiación (dosis de radiación máxima en fases diastólicas y reducción en la sístole).
Pese a que la mayoría de los pacientes estaban en tratamiento crónico con bloqueadores beta, se administró una dosis adicional de 1-2,5mg de atenolol intravenoso a 12 pacientes por presentar frecuencias cardiacas > 65lat/min antes del inicio de la prueba.
Tras la adquisición, se reconstruyeron de forma retrospectiva, utilizando un algoritmo segmentado (resolución temporal, 165ms), las fases del ciclo cardiaco (de 0 al 90% con incrementos sucesivos del 10%), con el fin de obtener las reconstrucciones en la fase con menor artefacto de movimiento cardiaco. El análisis de las imágenes se realizó en una estación de trabajo (Advantage Work Station 4,3®, General Electric Medical System, Milwakee, Wisconsin, Estados Unidos) con un software específico para el estudio cardiaco. Para el estudio coronario se emplearon reconstrucciones MPR (multiplane reformat) curvo, MIP (maximun intensity projection) y 3D-VR (volume rendering). Se empleó el modelo de segmentación coronaria estándar de 16 segmentos estandarizado16.
A partir de la adquisición con contraste que se utiliza para reconstruir el árbol coronario, se reconstruyeron imágenes en ejes largos (2, 3 y 4 cámaras) y eje corto (de base a ápex) en fases sistólicas y diastólicas para identificar áreas miocárdicas con hipoatenuación de señal (zonas de necrosis) utilizando el mismo modelo de segmentación miocárdica que en la RMC15.
De 8 a 10min tras la administración de contraste, se repitió la adquisición (mismo volumen) para valorar áreas miocárdicas que presenten realce tardío de yodo (RTY). Para esta adquisición se utilizó un voltaje menor (80 kV ), con sincronía cardiaca y reduciendo la corriente efectiva a una diástole más corta con el fin de lograr una mejor relación señal/ruido y disminuir la dosis efectiva de radiación. Se reconstruyeron imágenes en ejes largos (2, 3 y 4 cámaras) y eje corto (de base a ápex) con grosor de corte de al menos 8mm, utilizando una ventana de tejidos blandos y utilizando la misma segmentación miocárdica descrita15.
Un evaluador experimentado analizó todos los estudios. La dosis media estimada de radiación de todo el protocolo fue de 1.462±274mGy/cm (25±5mSv) aplicando el coeficiente de conversión para el tórax (×0,017).
Coronariografía invasivaSe realizó tras el estudio con TCMD y RMC (intervalo medio, 22±10 días) con un equipo Coroskop Plus/TOP® (Siemens, Múnich, Alemania) mediante una punción de la arteria femoral y cateterización selectiva coronaria y realizando las proyecciones angiográficas habituales. El análisis de las imágenes fue realizado por el hemodinamista responsable del procedimiento y se determinó visualmente la presencia de lesiones en los vasos, de la misma manera que con la TCMD empleando el mismo modelo de segmentación coronaria16.
Definición de miocardiopatía isquémicaPara el diagnóstico de DSVI isquémica (de origen coronario) se consideraron como referencia los resultados de la coronariografía invasiva cuando cumplían los criterios establecidos por Felker et al17: lesión de tronco común de la coronaria izquierda o del segmento proximal de la descendente anterior > 75% o lesión > 75% en dos o tres vasos.
Diagnóstico de disfunción sistólica ventricular izquierda de origen coronario por tomografía computarizadaSe evaluaron las siguientes posibilidades de diagnóstico de EC mediante TCMD comparándolas con el diagnóstico de DSVI coronaria según los resultados de la coronariografía invasiva: la presencia de calcificación coronaria (como marcador indirecto de lesión coronaria significativa), la identificación de lesiones coronarias significativas que cumplían los criterios de Felker et al17 (con contraste), la identificación de áreas de necrosis en la misma adquisición que las coronarias como áreas de hipoatenuación de señal en el miocardio y la identificación de áreas de necrosis en la adquisición tardía mediante la presencia de yodo en el miocardio (RTY).
Por otro lado, según los resultados combinados de la coronariografía-TCMD y del RTY, se establecieron cuatro grupos:
• Grupo 1: pacientes que cumplen criterios coronariográficos de disfunción ventricular sistólica isquémica y que presentan RTY subendocárdico o transmural (necrosis).
• Grupo 2: pacientes que no cumplen criterios coronariográficos de DSVI y no presentan RTY subendocárdico o transmural aunque puedan presentar RTY intramiocárdico lineal o focal (fibrosis).
• Grupo 3: pacientes que no cumplen criterios coronariográficos de DSVI y presentan RTY subendocárdico o transmural (necrosis).
• Grupo 4: pacientes que cumplen criterios coronariográficos de DSVI y no presentan RTY subendocárdico o transmural.
Estos cuatro grupos se compararon con los mismos cuatro grupos establecidos por la información obtenida de la coronariografía invasiva y del RTG-RMC.
Análisis estadísticoEl análisis estadístico se realizó mediante el paquete de software estadístico para ciencias sociales (SPSS v. 17.0 para Windows, SPSS Inc., Chicago, Illinois, Estados Unidos).
Mediante el test de Kolmogorov-Smirnov, se comprobó la normalidad en la distribución de las variables cuantitativas. Todas las variables continuas y normales se expresaron como media±desviación estándar y el resto, como porcentajes.
Para determinar la exactitud diagnóstica de la TCMD en el diagnóstico de la DSVI, se utilizó una tabla de contingencia de 2×2, tomando como estándar la coronariografía invasiva convencional. Se obtuvieron estimaciones puntuales para la sensibilidad, la especificidad y la exactitud diagnóstica de la prueba utilizando los métodos habituales para la inferencia sobre proporciones18.
Del mismo modo, se compararon los cuatro grupos establecidos según los resultados de la coronariografía invasiva y del RTG-RM con los cuatro grupos establecidos mediante resultados de la coronariografía-TCMD y RTY-TCMD.
Finalmente, se analizó la concordancia entre los dos observadores experimentados mediante el índice kappa de Cohen para la clasificación por grupos.
RESULTADOSLa Tabla 1 muestra las características de la población estudiada.
Tabla 1. Características de la población del estudio (n=40)
| Edad (años) | 61; 65,7±10,1 |
| Sexo, n (%) | |
| Varones | 24 (60) |
| Mujeres | 16 (40) |
| FRCV (%) | |
| Hábito tabáquico | 43 |
| Hipertensión | 55 |
| Dislipemia | 33 |
| Diabetes mellitus | 30 |
| SC | 1,9 (1,4-2,3) |
| ECG | |
| BRIHH (%) | 48 |
| Ecocardiografía | |
| DTDVI (mm) | 65±7 (56-79) |
| DTSVI (mm) | 55±9 (37-74) |
| FEVI (%) | 28±8 (15-40) |
| Asincronía (%) | 43 |
| CF NYHA, n/N (%) | |
| I | 3/40 (7) |
| II | 19/40 (48) |
| III | 15/40 (38) |
| IV | 3/40 (7) |
| Cateterismo | |
| TCI, ADA prox., ≥ 2 vasos > 75%, n/N (%) | 14/40 (35) |
| RMC | |
| VTDVI (ml/m 2 ) | 139 (100-255) |
| VTSVI (ml/m 2 ) | 103 (51-210) |
| FEVI (%) | 27 (10-40) |
ADA: arteria descendente anterior; BRIHH: bloqueo de rama izquierda del haz de His; CF: clase funcional; DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; ECG: electrocardiograma; FEVI: fracción de eyección del ventrículo izquierdo; FRCV: factores de riesgo cardiovascular; NYHA: New York Heart Association; RMC: resonancia magnética cardiaca; SC: superficie corporal; TCI: tronco coronario izquierdo; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo.
En los 40 pacientes se completaron todas las exploraciones, y todos los estudios de TCMD fueron interpretables. Se clasificó al 35% (14/40) como DSVI isquémica por cumplir los criterios coronariográficos de Felker et al17 en la coronariografía invasiva.
Se obtuvieron unos valores de sensibilidad y especificidad para la presencia de calcio coronario en la identificación de la DSVI coronaria del 100 y el 31% respectivamente. Si se considera un score de calcio por Agatston > 100, la especificidad sube al 58% manteniendo la sensibilidad del 100%.
Los valores de sensibilidad y especificidad de la coronariografía por TCMD para identificar la DSVI coronaria fueron del 100 y el 96% respectivamente, mientras que para la identificación de áreas de necrosis mediante la hipoatenuación de señal en la adquisición precoz, fueron del 57 y el 100% y mediante el RTY en la adquisición tardía, del 84 y el 96%.
La Tabla 2 resume estos resultados.
Tabla 2. Valores diagnósticos de los diferentes recursos de la tomografía computarizada con multidetectores
| VP | VN | FP | FN | Sensibilidad | Especificidad | VPP | VPN | |
| Calcio coronario | 14 | 8 | 18 | 0 | 100 (96-100) | 31 (11-50) | 44 (25-62) | 100 (94-100) |
| Score calcio > 100 | 14 | 15 | 11 | 0 | 100 (96-100) | 58 (37-79) | 56 (35-77) | 100 (97-100) |
| Coronariografía | 14 | 25 | 1 | 0 | 100 (96-100) | 96 (87-100) | 93 (77-100) | 100 (98-100) |
| Hipoatenuación | 8 | 26 | 0 | 6 | 57 (28-87) | 100 (98-100) | 100 (94-100) | 81 (66-96) |
| Realce tardío de yodo | 12 | 25 | 1 | 2 | 86 (64-100) | 96 (87-100) | 92 (74-100) | 93 (81-100) |
FN: falsos negativos; FP: falsos positivos; VN: verdaderos negativos; VP: verdaderos positivos; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Se presentan los valores diagnósticos en porcentaje y entre paréntesis el intervalo confianza del 95%.
Comparando los grupos establecidos por TCMD (coronariografía-TCMD y RTY-TCMD) con los determinados por coronariografía invasiva-RTG-RMC (Tabla 3), se identificó correctamente a 12 de los 13 pacientes del grupo 1 (κ=0,94; p<0,001), 24 de los 25 del grupo 2 (κ=0,95; p<0,001) y el único paciente del grupo 3. Se clasificó incorrectamente a 2 de los 3 pacientes incluidos en el grupo 4 (κ=0,48; p<0,001). Es decir, todos los pacientes «isquémicos» por cumplir criterios coronariográficos con necrosis o el único paciente con necrosis pero sin cumplir criterios coronariográficos (lo que podríamos denominar «isquémico no reconocido») fueron identificados correctamente por TCMD. La TCMD identificó erróneamente a 2 pacientes en el grupo 4 (con criterios coronariográficos pero sin necrosis). De estos 2 casos, 1 cumplía criterios coronariográficos de DSVI coronaria pero no se identificó la necrosis por TCMD, y en el otro se sobrestimó la gravedad de las lesiones coronarias por intensa calcificación (Tabla 3). La sensibilidad y la especificidad para identificar a los pacientes isquémicos por coronariografía no invasiva y con necrosis (grupo 1) fueron del 92% (intervalo de confianza del 95% [IC95%], 74-100%) y el 100% (IC95%, 88-100%) (Figura 1), y para todos los pacientes coronarios por coronariografía no invasiva con o sin necrosis (grupos 1 y 4), del 100% (IC95%, 96-100%) y el 96% (IC95%, 87-100%) respectivamente. El único paciente «isquémico no reconocido», es decir, sin lesiones coronarias pero con necrosis, fue correctamente identificado por ambas técnicas (Figura 2).
Tabla 3. Clasificación de pacientes con disfunción ventricular izquierda según los datos coronariográficos y la detección de necrosis
| DSVI TCMD | DSVI cateterismo y RMC | Total | |||
| Grupo 1 | Grupo 2 | Grupo 3 | Grupo 4 | ||
| Grupo 1 | 12 | 0 | 0 | 0 | 12 |
| Grupo 2 | 0 | 24 | 0 | 0 | 24 |
| Grupo 3 | 0 | 0 | 1 | 0 | 1 |
| Grupo 4 | 1 * | 1 * | 0 | 1 | 3 |
| Total | 13 | 25 | 1 | 1 | 40 |
DSVI: disfunción sistólica ventricular izquierda; RMC: resonancia magnética cardiaca; TCMD: tomografía computarizada con multidetectores.
Grupo 1: pacientes «isquémicos» por cumplir criterios coronariográficos y con necrosis; Grupo 2: pacientes «no isquémicos» por no cumplir criterios coronariográficos y sin necrosis; Grupo 3: el único paciente «no isquémico» que no cumplía criterios coronariográficos pero tenía necrosis, correctamente identificado por ambas técnicas; Grupo 4: pacientes «isquémicos» por cumplir criterios coronariográficos y sin necrosis.
* Falsos positivos por TCMD.
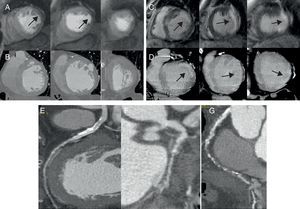
Figura 1. Paciente del grupo 1: lesiones significativas en arteria circunfleja (F) y oclusión de la coronaria derecha (G) además de lesión calcificada, moderada en la descendente anterior media (E). Defecto de perfusión de primer paso (flechas) en la resonancia magnética cardiaca (A) sin que se detecten zonas de hipoatenuación en la tomografía computarizada con multidetectores (B). Realce tardío de gadolinio en segmentos laterales (flechas) (C) y su correspondencia en forma de realce tardío de yodo en la tomografía computarizada con multidetectores (D).
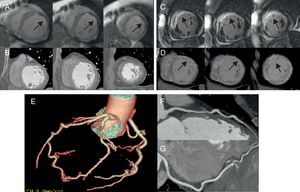
Figura 2. Paciente del grupo 3: sin lesiones coronarias (E-G). Presenta defecto de perfusión en el primer paso (flechas) en la resonancia magnética cardiaca (A) sin que se detecte hipoatenuación en la tomografía computarizada con multidetectores (B) y con necrosis extensa (flechas) en la resonancia magnética cardiaca (C) y su correspondencia en la tomografía computarizada con multidetectores (D).
Seis pacientes del grupo 2 mostraron RTG intramiocárdico compatible con fibrosis y todos ellos fueron identificados mediante el RTY (Figura 3).
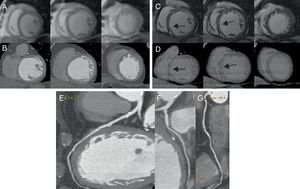
Figura 3. Paciente del grupo 2: sin lesiones coronarias significativas (E-G) sin defectos de perfusión en la resonancia magnética cardiaca (A) ni zonas de hipoatenuación en la tomografía computarizada con multidetectores (B) y con fibrosis septal (flechas) en la resonancia magnética cardiaca (C) y su correspondencia en la tomografía computarizada con multidetectores (D), pero sin necrosis.
Se analizó la concordancia entre dos observadores experimentados, y se obtuvieron unos valores excelentes (κ=0,77 en la identificación de pacientes con DSVI de etiología coronaria con necrosis [grupo 1] y κ=0,89 en la identificación de los pacientes con DSVI de etiología coronaria con y sin necrosis [grupos 1 y 4]).
DISCUSIÓNEn este trabajo evaluamos, por primera vez en la literatura, la eficacia diagnóstica de todas las herramientas diagnósticas disponibles con TCMD para filiar la etiología coronaria de la DSVI en un mismo grupo de pacientes.
En los últimos años se ha publicado por separado el valor diagnóstico del calcio coronario y de la coronariografía y sólo en un trabajo la combinación de la coronariografía y caracterización tisular mediante el RTY.
Así, un trabajo publicado hace más de 10 años valoró la capacidad diagnóstica del calcio coronario para identificar la DSVI de origen coronario, ya que es un marcador de aterosclerosis coronaria9. Los autores refieren una sensibilidad del 99% y una especificidad del 83%, aumentando el valor de esta última proporcionalmente al score que se considere hasta llegar al 100% si se establece un punto de corte > 220 por Agatston. Otro estudio más reciente ha demostrado que un score de calcio coronario de cero excluye la posibilidad de EC que justifique la DSVI10. En nuestro estudio obtenemos una sensibilidad del 100%, es decir, todos los pacientes con DSVI isquémica presentaban calcificaciones coronarias, aunque con una especificidad muy baja, que mejora algo si ponemos como punto de corte un score de calcio > 100, que identifica al menos una aterosclerosis coronaria moderada. Con esta simple exploración que no requiere contraste y poca radiación, podríamos descartar como de origen coronario a los pacientes con disfunción ventricular que no presenten calcificaciones coronarias, aunque su presencia no asegure que vayamos a encontrar lesiones coronarias que justifiquen la DSVI.
Un pequeño número de trabajos han valorado la coronariografía por TCMD en el diagnóstico etiológico de la disfunción ventricular comparándola con la coronariografía invasiva, ya sea en un análisis por segmento coronario y/o por paciente. Estos trabajos, que incluyen en total a 357 pacientes con disfunción ventricular, muestran unos valores para la sensibilidad entre el 98 y el 100% y para la especificidad, entre el 92 y el 99%, similares a los obtenidos en población sin DSVI11, 12, 13, 14. Nuestro trabajo obtiene también unos valores diagnósticos excelentes (sensibilidad, 100%; especificidad, 96%), con la peculiaridad de que se asegura que las lesiones coronarias detectadas justifiquen la disfunción ventricular izquierda (cumplen los criterios de Felker et al17).
El empleo del RTG-RMC en el estudio etiológico de la disfunción ventricular ha demostrado que existe un porcentaje de pacientes, entre el 10 y el 15% según trabajos, que presentan necrosis con coronarias sin lesiones significativas en el cateterismo7, 8, 19, 20. Estos pacientes, que serían etiquetados como «no isquémicos» por la información coronariográfica, sin embargo presentan un pronóstico similar al de los «isquémicos» que sí cumplen los criterios coronariográficos de Felker et al, como ha demostrado nuestro grupo21. Estudios experimentales con tomografía computarizada realizados en el contexto de infartos agudos han demostrado que el contraste yodado presenta una cinética similar a la del gadolinio, y puede identificar las zonas del infarto como áreas con hipoatenuación de señal en la adquisición precoz con contraste o mediante el realce tardío del contraste en una adquisición tardía, habitualmente 10 min después de su administración22. Estudios en humanos han confirmado la buena correlación existente entre la resonancia magnética y la tomografía computarizada para detectar las zonas con infarto tanto en la adquisición precoz como en la tardía23, 24.
Un solo estudio publicado ha valorado en pacientes con DSVI la combinación de la coronariografía y la presencia de necrosis por tomografía computarizada comparándola con la coronariografía invasiva y el RTG-RMC14, obteniendo como en nuestro trabajo una excelente concordancia. En este trabajo sobre una muestra de 71 pacientes hubo dos falsos negativos (uno con fibrosis y otro con necrosis) atribuidos a la mala calidad del estudio y tres falsos positivos al detectar RTY con patrón de necrosis que no se confirmó con el RTG-RMC, que los autores atribuyeron a artefactos por estructuras óseas adyacentes y/o movimiento. En nuestro estudio sólo tuvimos un falso negativo en el grupo 1 al identificar correctamente las lesiones coronarias pero no las áreas de necrosis y un falso positivo en el grupo 4 al sobrestimar la gravedad de las lesiones coronarias, que sirven para demostrar las limitaciones potenciales de la TCMD. La primera, bien conocida, es sobrestimar lesiones coronarias en presencia de calcificación extensa. La segunda, parte de una limitación técnica, y es que, aunque la cinética del yodo es similar a la del gadolinio, no es posible anular la señal del miocardio como en la RMC mediante un pulso de inversión, lo que dificulta la identificación de las zonas de necrosis, especialmente las de pequeño tamaño. Curiosamente, se detectaron correctamente todas las zonas de fibrosis intramiocárdicas mediante TCMD, posiblemente debido a la buena relación señal/ruido que se consigue porque estas zonas del septo quedan aisladas del contraste intraventricular.
LimitacionesLos resultados de este trabajo deben interpretarse considerando que se trata de una muestra reducida y seleccionada de pacientes, por cuanto el equipo utilizado de 64 detectores limita su empleo en casos de frecuencias cardiacas elevadas y arritmias. Actualmente están disponibles dispositivos con mayor número de detectores, que permiten realizar estudios interpretables en pacientes con frecuencias cardiacas elevadas e incluso en fibrilación auricular, así como mejoras en los detectores o tomógrafos de doble fuente que permiten una mejor caracterización tisular.
CONCLUSIONESLa TCMD a través de todos sus recursos permite identificar la etiología isquémica de la DSVI; la coronariografía-TCMD es la que muestra mayor exactitud diagnóstica cuando se la compara con el cateterismo. Si se añade la información tisular que ofrece la TCMD, nuestros resultados indican que es posible utilizar la TCMD como alternativa a la aproximación diagnóstica habitual con el uso del cateterismo y la resonancia con contraste.
FINANCIACIÓNEste trabajo ha sido financiado en parte por la beca de la Fundación Española del Corazón y Fuente Liviana 2009 de la Sociedad Española de Cardiología. F. Ridocci ha recibido una ayuda del Instituto de Salud Carlos III Programa Intensificacion Actividad Invetigadora 2010.
CONFLICTO DE INTERESESNinguno.
Recibido 31 Mayo 2011
Aceptado 11 Julio 2011
Autor para correspondencia: Unidad de Imagen Cardiaca, ERESA, Consorcio Hospital General Universitario de Valencia, Avda. Tres Cruces 2, 46014 Valencia, España. jestornell@eresa.com