Las estatinas son fármacos que reducen la concentración plasmática de colesterol unido a lipoproteínas de baja densidad, con demostrada eficacia en la prevención cardiovascular primaria y secundaria. Pueden clasificarse según su capacidad hipolipemiante; se consideran de alta potencia o intensidad las que logran una reducción aproximada del 50%. También ejercen acciones que no parecen explicarse únicamente por la reducción de colesterol y se cree que están relacionadas con otras propiedades (antioxidantes, antiinflamatorias, antitrombóticas…) asociadas a su acción sobre las proteínas G. Se han estudiado estos posibles efectos extralipídicos en diferentes enfermedades cardiovasculares y otras enfermedades, como sepsis, cáncer, demencia, etc., pero aún no hay datos definitivos que justifiquen la ampliación de las indicaciones terapéuticas de las estatinas más allá de la reducción del colesterol.
Palabras clave
colesterol unido a lipoproteínas de alta densidad
colesterol unido a lipoproteínas de baja densidad
3-hidroxi-3-metilglutaril-coenzima A
proteína C reactiva
Las estatinas son los fármacos hipolipemiantes por excelencia, y uno de los grupos farmacológicos más recetados en el mundo. Constituyen uno de los pilares de la prevención cardiovascular, tanto primaria como secundaria1. Su acción primordial se basa en su capacidad para reducir la concentración plasmática de colesterol unido a lipoproteínas de baja densidad (cLDL), lo que se consigue con todas las estatinas disponibles, pero en diferente magnitud según su potencia hipolipemiante2.
Además de su principal mecanismo de acción, también hay evidencia de que poseen otras propiedades, más allá de la reducción del cLDL, que podrían ser útiles tanto en la prevención y el tratamiento de la enfermedad aterosclerótica, su diana fundamental, como en otras afecciones3.
Las acciones antioxidantes, antiinflamatorias, antitrombóticas o antiproliferativas, entre otras, se traducirían en una reducción de la morbimortalidad en diferentes escenarios clínicos cardiovasculares y no cardiovasculares, no justificables únicamente por la reducción de cLDL4.
Los datos obtenidos tanto de registros poblacionales y ensayos clínicos como de investigación básica muestran múltiples posibles mecanismos de acción de las estatinas, que en muchos casos se están evaluando en ensayos aleatorizados a gran escala, cuyos resultados se espera poder trasladar a la práctica clínica.
Efecto hipolipemiante de las estatinas. concepto de alta potenciaLa eficacia hipolipemiante de las estatinas radica en su capacidad de reducir la biosíntesis intracelular hepática del colesterol y la concentración en plasma de cLDL. Su mecanismo de acción se basa en la inhibición competitiva, parcial y reversible de la enzima hepática 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) reductasa, que cataliza la conversión de la HMG-CoA a mevalonato, precursor del colesterol (figura 1); al disminuir la producción de colesterol intracelular, los hepatocitos aumentan la expresión de receptores de las LDL, lo que causa un mayor aclaramiento del cLDL del plasma. Las estatinas también disminuyen el ensamblaje y la síntesis de lipoproteínas de muy baja densidad (VLDL), con lo que se reducen los triglicéridos plasmáticos y, por un mecanismo poco conocido, producen un ligero aumento del colesterol unido a lipoproteínas de alta densidad (cHDL)2.
Actualmente, en España se comercializan siete estatinas: lovastatina, pravastatina, simvastatina, fluvastatina, atorvastatina, rosuvastatina y pitavastatina. Comparten todas ellas la vía oral, una absorción en torno al 30% y una baja biodisponibilidad (5–51%). El metabolismo de las estatinas es fundamentalmente hepático, si bien hay diferencias en cuanto a la vía metabólica: la lovastatina, la simvastatina y la atorvastatina se metabolizan a través del CYP450 3A4, mientras que la fluvastatina lo hace a través de la isoenzima CYP2C9. La pravastatina, la rosuvastatina y la pitavastatina no se metabolizan a través del citocromo P450. La pravastatina y la rosuvastatina son las estatinas más hidrófilas y se metabolizan a través de unas enzimas presentes en el hepatocito. Las estatinas reducen el cLDL en dependencia de la dosis, entre un 20 y un 50–60%, siguiendo la conocida regla del 6%, beneficio que se consigue sobre la reducción del cLDL al duplicar la dosis, y con efecto inconstante y variable en el cHDL, que aumenta un 4–10%, y los triglicéridos, que descienden un 10–30%3.
Dependiendo de la capacidad reductora del cLDL plasmático, las estatinas se pueden clasificar en tres grupos según su potencia o intensidad hipolipemiante: baja, moderada o alta. Baja potencia es una reducción < 30%; moderada, entre el 30 y el 50%, y alta intensidad cuando se logra, en promedio, una disminución de cLDL > 50%. En este último grupo, según la reciente guía del American College of Cardiology/American Heart Association (ACC/AHA)5, se incluirían la rosuvastatina en dosis diaria de 20mg y la atorvastatina en dosis de 40 y 80mg.
Hay extensa evidencia de la eficacia de estas estatinas de alta potencia o alta intensidad en la prevención cardiovascular en muy diferentes escenarios clínicos. En los últimos 15 años se han publicado diversos ensayos, cuyos resultados se han traducido en cambios en las recomendaciones de las guías de práctica clínica de las principales sociedades científicas6. Sin hacer una revisión detallada, se comentan algunos de estos estudios de innegable trascendencia.
Así, en el estudio MIRACL7, publicado en 2001, la dosis de atorvastatina de 80mg frente a placebo demostró una reducción significativa de episodios isquémicos en las primeras 16 semanas cuando se iniciaba precozmente el tratamiento hipolipemiante, entre 24 y 96 h tras el síndrome coronario agudo (SCA), independientemente de las cifras de cLDL, cuyos valores medios basal y final eran 124 y 72mg/dl (reducción media del 42%). También en pacientes con SCA se llevó a cabo el estudio PROVE-IT8, que comparó 40mg de pravastatina frente a 80mg de atorvastatina, iniciando el tratamiento hipolipemiante dentro de los 10 días posteriores al episodio agudo; el valor basal de cLDL era 106mg/dl, y la estatina de alta potencia lo redujo a 62mg/dl de media (frente a 95mg/dl en el grupo de pravastatina). El estudio se había diseñado para demostrar la no inferioridad de la pravastatina; no se cumplieron los criterios de equivalencia, pero sí se demostró la superioridad de atorvastatina en el objetivo primario, con un reducción del riesgo relativo del 16%. Se obtuvieron resultados similares en más de 10.000 pacientes con enfermedad coronaria estable incluidos en el estudio TNT9, en los que una dosis alta (80mg) de atorvastatina comparada con dosis baja (10mg), tras un seguimiento de 4,9 años, con una diferencia en el cLDL de 101 a 77mg, consiguió una reducción de riesgo absoluta del 2,2% y relativa del 22% en el objetivo primario: muerte por enfermedad coronaria, infarto no mortal, resucitación tras parada cardiaca e ictus, mortal o no.
La otra estatina considerada de alta intensidad, la rosuvastatina, también se ha estudiado en diferentes poblaciones y contextos clínicos. En prevención primaria, en el estudio JUPITER10, 20mg de rosuvastatina, en personas aparentemente sanas sin hiperlipemia pero con elevación de proteína C reactiva (PCR), produjeron una reducción significativa del objetivo primario (infarto de miocardio, ictus, revascularización, hospitalización por angina inestable o muerte cardiovascular), tras un seguimiento de 1,9 años; la concentración plasmática de cLDL disminuyó en la medida esperada por la potencia de esta dosis, aproximadamente un 50%, y además hubo una reducción de la PCR del 37%. En la misma situación clínica evaluada en el estudio MIRACL7 en pacientes ingresados por SCA, el estudio LUNAR11 comparó la eficacia de la rosuvastatina en dos dosis: 40 y 20mg, frente a 80mg de atorvastatina, y se inició el tratamiento en las primeras 48 h tras un SCA. Tras un seguimiento de 12 semanas, la dosis de rosuvastatina 40mg fue más eficaz que la de atorvastatina 80mg en la reducción del cLDL (el 46,8 frente al 42,7%; p=0,02) y en el aumento del cHDL (el 11,9 frente al 5,6%; p<0,001), y la dosis de 20mg de rosuvastatina mostró una reducción de cLDL equivalente (42%) y mayor aumento de cHDL (el 9,7%; p<0,01) comparado con atorvastatina 80mg.
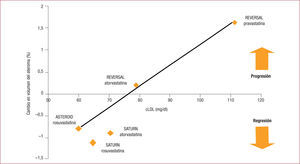
No solo se ha estudiado el efecto de estas estatinas en la aparición de eventos clínicos, sino también su influencia en la evolución de la aterosclerosis y, por lo tanto, la posibilidad de detener o al menos retrasar el proceso fisiopatológico que subyace a la mayoría de las manifestaciones clínicas cardiovasculares. Hace ya una década, Nissen et al12 publicaron el estudio REVERSAL, en el que una dosis de 80mg de atorvastatina, comparada con 40mg de pravastatina, redujo la progresión de las placas de ateroma. Los pacientes tratados con la segunda presentaron progresión de aterosclerosis coronaria, mientras que no hubo modificaciones en la «carga de ateroma» en los que recibieron la estatina de alta intensidad. En cambio, en el estudio ASTEROID13, la dosis de 40mg de rosuvastatina sí produjo regresión de la aterosclerosis, y se comprobó por coronariografía cuantitativa la reducción porcentual del diámetro de las estenosis y el aumento luminal de las arterias coronarias. El estudio SATURN14, mediante ultrasonografía intravascular (IVUS), mostró una regresión significativa de la aterosclerosis coronaria tras 2 años de tratamiento con atorvastatina 80mg o rosuvastatina 40mg. En la mayoría de los pacientes, ambos fármacos indujeron regresión similar en el porcentaje del volumen de ateroma (PAV) (p=0,07): el 63,2% con atorvastatina y el 68,5% con rosuvastatina, y significativamente mayor con rosuvastatina (el 71,3 frente al 64,7%; p=0,02) en el volumen total de ateroma (TAV) (figura 2).
Los beneficios demostrados por las estatinas, sobre todo las de alta intensidad, con frecuencia superan las expectativas, ya sea por la precocidad con que se manifiestan o por ser estos superiores a lo esperado por su efecto hipolipemiante15. En los últimos años multitud de resultados clínicos y de investigación básica apoyan la existencia de efectos beneficiosos extralipídicos de las estatinas, más allá de la reducción del cLDL16.
Efectos extralipídicos de las estatinasLos efectos extralipídicos de las estatinas se consideran efectos pleotrópicos. El zoológo alemán Ludwig Hermann Plate acuñó el término pleotropismo en 1910, que deriva del griego pleiotrop (pleio, «más numeroso», y trop, «cambio») y significa «que afecta a más de una característica». En genética, la pleotropía es el fenómeno por el cual un solo gen origina efectos fenotípicos o caracteres distintos y no relacionados. Los efectos pleotrópicos de las estatinas serían los no atribuibles a la reducción del cLDL17.
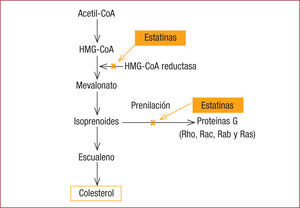
Estos efectos pleotrópicos se explican por el mecanismo de acción de las estatinas, ya que, al inhibir la HMG-CoA reductasa, también interfieren en la formación de isoprenoides a partir del mevalonato. Como consecuencia, la prenilación de las proteínas G (Rho, Rac, Rab y Ras) se reduce (figura 3). La prenilación de estas moléculas es necesaria para su anclaje a la membrana celular y que puedan ejercer su mecanismo de acción relacionado con la migración, la diferenciación y la proliferación celular. A través de estos potenciales efectos en las proteínas celulares, las estatinas pueden tener una serie de propiedades antiateroscleróticas y antitrombóticas, como la inhibición del crecimiento de la célula muscular lisa, de la adhesión celular, de la activación plaquetaria y de la secreción de PCR, entre otras18,19.
La disfunción endotelial es un precursor de aterosclerosis. Por lo tanto, mejorar la función endotelial contribuirá de forma indiscutible a la protección vascular. Se han descrito múltiples acciones de las distintas estatinas en diferentes contextos, clínicos y experimentales, que participarían en este fenómeno vasculoprotector independientemente de la reducción del cLDL. En la tabla 1 se resumen algunos de los principales mecanismos de la mejoría de la función endotelial y las propiedades antioxidantes, antiinflamatorias y antitrombóticas atribuidas a las estatinas18.
Principales mecanismos de los efectos pleotrópicos atribuidos a las estatinas
| Función endotelial |
| ↑ Producción y biodisponibilidad de óxido nítrico |
| ↓ Síntesis de endotelina-1 |
| ↑ Perfusión miocárdica en segmentos isquémicos |
| ↑ Respuesta vasodilatadora a la acetilcolina |
| Propiedades antioxidantes |
| ↓ Generación de especies reactivas de oxígeno |
| ↓ Expresión y actividad vascular de oxidasa |
| ↓ Actividad de la xantina-oxidasa |
| Inhibición de la peroxidación lipídica |
| ↓ Expresión génica de angiotensina I y su receptor |
| Propiedades antiinflamatorias |
| ↑ Estabilidad de la placa ateromatosa |
| ↑ Biodisponibilidad de óxido nítrico |
| Inhibición de interleucina 6 |
| ↓ Proteína C reactiva (PCR) |
| ↓ Acumulación de macrófagos en la placa ateromatosa |
| Inhibición de la producción de metaloproteinasas por los macrófagos activados |
| Propiedades antitrombóticas |
| Inhibición de agregación plaquetaria |
| Mantenimiento del equilibrio entre factores hemostáticos, protrombóticos y fibrinolíticos |
| Acción antitrombótica: ↓ expresión del factor tisular, ↓ formación de trombina y factores procoagulantes (fibrinógeno) |
| Acción profibrinolítica: ↓ concentraciones plasmáticas de inhibidor 1 del activador del plasminógeno (PAI-1) |
Se ha estudiado la acción de las estatinas y la posible influencia de sus efectos pleotrópicos en diferentes enfermedades cardiovasculares20. Aunque es indiscutible la influencia de la reducción del cLDL plasmático, parece que también podrían intervenir estos otros mecanismos en las siguientes situaciones:
Prevención primaria cardiovascularDatos del estudio JUPITER10 corroboran que las estatinas pueden atenuar la respuesta inflamatoria, ya que 20mg de rosuvastatina provocaron un descenso de la PCR del 37%. Se estudió una población sin indicación de tratamiento con estatinas por sus concentraciones de cLDL, pero con elevación de un biomarcador de inflamación como es la PCR. Al cabo de 1,9 años, cuando se interrumpió el ensayo clínico, el objetivo final primario (infarto de miocardio no mortal, ictus no mortal, hospitalización por angina inestable, revascularización y muerte por causa cardiovascular) había disminuido casi a la mitad.
Enfermedad coronariaSe trata de la enfermedad de la que se ha acumulado más evidencia sobre la eficacia de las estatinas, con cientos de miles de pacientes incluidos en ensayos clínicos y millones de pacientes en todo el mundo que toman estos fármacos. En todas las fases de la enfermedad, aguda y crónica, así como en los procedimientos de revascularización percutánea y quirúrgica, el tratamiento con estatinas se ha demostrado beneficioso no solo por la reducción del cLDL, sino también por hallazgos que indican mejoría de la función endotelial, como la mayor regulación de la sintasa del óxido nítrico, disminución de la inflamación sistémica y vascular vía activación de las células T y estabilización de las placas ateroscleróticas; se aprecia un incremento en la perfusión microvascular y una disminución de las moléculas de adhesión21. Hay trabajos experimentales que muestran que la administración de rosuvastatina con anterioridad al daño isquémico reduce el tamaño del infarto a través de un mecanismo independiente de la disminución del colesterol, pero que involucra al óxido nítrico17. Un hallazgo interesante en estos pacientes a los que frecuentemente se realizan coronariografías es que la administración de estatinas parece prevenir la nefropatía por contraste, por el aumento de la producción de óxido nítrico y la disminución de radicales libres21. En el escenario del SCA, tanto en el estudio MIRACL7 como en el PROVE-IT-TIMI 228 se detectó una notable mejoría en los marcadores de inflamación y oxidación (disminución de la PCR, CD40-ligando y contenido de fosfolípidos oxidados en las apolipoproteínas B-100). También en los estudios de regresión de placa REVERSAL12 y SATURN14 se encontró relación directa entre el tratamiento con estatina de alta intensidad y un descenso significativo de la PCR.
Insuficiencia cardiacaAunque los ensayos clínicos que evaluaron el tratamiento con estatinas en pacientes diagnosticados de insuficiencia cardiaca no demostraron beneficios, sí parece que las estatinas podrían ser eficaces en su prevención en fases previas. En estudios experimentales, varios mecanismos podrían actuar sobre los factores causales del desarrollo de insuficiencia cardiaca; las estatinas limitan la hipertrofia cardiaca vía Rho y Ras, inhiben la activación de las metaloproteasas, ejercen efectos antifibróticos y antiapoptóticos, inhiben la inducción de hipertrofia derivada de la angiotensina II (A-II) y promueven la movilización de células progenitoras, con lo que se induce angiogénesis, a lo que se sumaría la mayor disponibilidad de óxido nítrico21.
Enfermedad cerebrovascularAlgunos ensayos clínicos con estatinas de alta intensidad, como SPARCL22 con 80mg de atorvastatina y JUPITER10 con 20mg de rosuvastatina, han mostrado una reducción del riesgo de ictus isquémicos. También los pacientes en tratamiento previo con estatinas parecen presentar ictus de menor gravedad y con mejor pronóstico. Aunque no se conocen con exactitud las causas, se cree que puede deberse a aumento de la circulación colateral o a un efecto neuroprotector directo. Recientemente se ha estudiado el efecto antioxidante de 20mg de rosuvastatina a corto plazo tras un ictus, y se ha visto que ejerce una acción antioxidante dependiente de la reducción del cLDL, pero también inhibe la peroxidación lipídica por mecanismos independientes (reducción de marcador de estrés oxidativo: malondialdehído [MDA])23.
Arteriopatía periféricaHay datos de ensayos clínicos que demuestran, al evaluar la respuesta dilatadora mediada por flujo y la pletismografía de oclusión venosa, que las estatinas mejoran la función endotelial en la circulación periférica; también parece que su acción reguladora de la producción de moléculas de adhesión celular reduciría la carga aterosclerótica en los diferentes territorios arteriales, e incluso que confieren protección a los pacientes con aneurisma de aorta abdominal, frenando su expansión gracias a su efecto en las metaloproteasas de la matriz celular que evitan el remodelado negativo de la pared arterial21.
Hipertensión arterialLas estatinas pueden inducir reducción de la presión arterial, entre otros mecanismos, porque disminuyen la expresión de los receptores tipo I de la A-II, potentes vasopresores a través de la producción de aldosterona y porque in vitro han mostrado aumento de la actividad del sistema parasimpático. Desde el punto de vista clínico, hay cierta controversia, pues en algunos metanálisis se ha confirmado que pueden reducir las cifras de presión arterial (PA) sistólica en 2–4mmHg y en 2mmHg la diastólica, mientras que en otros estudios no han mostrado cambios significativos21.
Fibrilación auricularEl mecanismo exacto por el que las estatinas podrían evitar la aparición de fibrilación auricular (FA) no está bien establecido, aunque se invocan sus efectos antiateroscleróticos, antiinflamatorios y antioxidantes, además de la prevención de la disfunción endotelial y la activación neurohormonal, así como por acción en la permeabilidad de las membranas y los canales iónicos. Experimentalmente se ha demostrado que podrían contrarrestar los efectos arritmogénicos de la A-II mediante la reducción de LDL oxidadas que regulan los receptores de A-II; también su acción sobre las metaloproteinasas de la matriz intervendría regulando el remodelado estructural que provoca dilatación y fibrosis. Al igual que sucede en la hipertensión arterial (HTA), los resultados de los ensayos clínicos de prevención de FA con estatinas en distintas situaciones clínicas no son concluyentes, por lo que no está claro si los mecanismos teóricamente beneficiosos pueden ser clínicamente relevantes24,25.
Trombosis venosaLas estatinas reducen la reactividad plaquetaria mediante mecanismos independientes del colesterol. Experimentalmente se sabe que regulan al alza la sintasa del óxido nítrico endotelial (eNOS) plaquetaria (antiagregante plaquetario) y que son capaces de inhibir la expresión del receptor de la trombina PAR-1 (receptor activado por proteasas tipo 1) en la superficie de las plaquetas21. En clínica, el estudio JUPITER10 demostró que el tratamiento con rosuvastatina se asociaba a una reducción de las tromboembolias venosas.
Efectos extralipídicos no cardiovascularesEs lógico pensar que las propiedades extralipídicas de las estatinas, sus acciones antiinflamatoria, antitrombótica y antioxidante, puedan tener también efectos beneficiosos en otros órganos y sistemas del organismo, aparte del cardiovascular. Hay un interés creciente en evaluar su potencial terapéutico en múltiples enfermedades, entre las que podemos destacar las sepsis, los tumores y el deterioro cognitivo.
SepsisTeóricamente, las estatinas tienen varios efectos que protegen el endotelio vascular, reducen el daño inflamatorio y pueden modular la respuesta inmunitaria. Su amplio espectro de acción antiinflamatoria, anticoagulante y profibrinolítica las hace muy atractivas en la prevención y el tratamiento de las sepsis, situación de extrema gravedad en la que han fracasado otros enfoques terapéuticos más individuales. Hay evidencia prometedora del impacto de las estatinas en estos pacientes, pero la mayoría son análisis retrospectivos de ensayos clínicos, muy heterogéneos en el número de pacientes, la gravedad de la enfermedad, el tipo y dosis de estatina, el momento de exposición al fármaco y los objetivos analizados. Actualmente están en marcha ensayos diseñados para evaluar el tiempo hasta la estabilidad clínica o hasta la recuperación del shock. Lo ideal sería un gran estudio sobre mortalidad que ofreciera evidencia definitiva sobre la protección de las estatinas y que reforzara el papel de los efectos pleotrópicos en esta situación clínica26.
CáncerLa inhibición de la HMG-CoA reductasa que las estatinas producen reduce la prenilación de las proteínas G (Rho, Rac, Rab y Ras), importantes mediadores del crecimiento y la diferenciación celular. También las estatinas ejercen acciones proapoptóticas, antiangiogénicas e inmunomoduladoras que pueden prevenir la progresión tumoral. Datos de estudios observacionales y metanálisis han mostrado que estos fármacos parecen reducir el riesgo de presentar ciertos tipos de cáncer (prostático y digestivos) y también que pueden mejorar su pronóstico en algunos casos. Lo que sí parece demostrado es que no aumenta la aparición de tumores, como se había sospechado a partir de resultados de algunos ensayos clínicos. Otro hallazgo interesante es que podrían mitigar efectos adversos de la quimioterapia, concretamente los cardiotóxicos. Están en curso ensayos clínicos aleatorizados que investigan la acción de las estatinas en prevención primaria del cáncer, en prevención de recurrencias y en reducción de la mortalidad cuando se combinan con quimioterapia convencional27.
Deterioro cognitivoLa sospecha inicial sobre una posible relación de las estatinas con el desarrollo de deterioro cognitivo y pérdida de memoria no se ha confirmado y los datos más recientes apuntan incluso a un efecto beneficioso de este grupo farmacológico en la prevención de la demencia28. Las propiedades antiinflamatorias y la inhibición de la migración leucocitaria a través de la barrera hematoencefálica podrían enlentecer la atrofia cerebral29. En experimentación animal, se ha demostrado que la rosuvastatina protege del daño por isquemia-reperfusión tanto en la limitación del tamaño del infarto como en parámetros funcionales, a través de la atenuación del estrés oxidativo y la inflamación30. Como en las demás afecciones, se necesitarían estudios clínicos a gran escala que pudieran demostrar estos beneficios.
ConclusionesLas estatinas, mediante la inhibición de la enzima HMG-CoA reductasa, reducen la producción hepática de colesterol, lo que también causa un aumento de la expresión de receptores de LDL con mayor aclaramiento de colesterol del plasma y, por lo tanto, disminución del cLDL plasmático.
La reducción del cLDL en plasma se relaciona proporcionalmente con la reducción de eventos cardiovasculares, en prevención tanto primaria como secundaria. El descenso es de mayor magnitud si se emplean estatinas de alta potencia hipolipemiante, que son las que reducen el cLDL al menos un 50%.
La inhibición de la enzima HMG-CoA reductasa también interfiere en la formación de isoprenoides, por lo que se reduce la acción de las proteínas G encargadas del crecimiento de la célula muscular lisa, la adhesión celular, la activación plaquetaria y la secreción de PCR.
A través de estos potenciales efectos en las proteínas celulares, las estatinas pueden tener una serie de efectos extralipídicos o pleotrópicos. Entre ellos destacan la mejoría de la función endotelial y las propiedades antioxidantes, antiinflamatorias y antitrombóticas, que se acompañarían de beneficios más allá de los debidos al descenso del cLDL.
Hay evidencia clínica y experimental de los efectos pleotrópicos de las estatinas en las enfermedades cardiovasculares y también en otras patologías, aunque con resultados que aún no se consideran definitivos como para traducirse en un cambio en la práctica clínica.
En la actualidad, la utilización de las estatinas debe hacerse únicamente por su efecto hipolipemiante, y seleccionar las de alta potencia (rosuvastatina o atorvastatina a las dosis adecuadas) en la mayoría de los casos de prevención secundaria, y en prevención primaria cuando se necesita una reducción mayor del 50% para alcanzar el objetivo deseado.
Conflicto de interesesNinguno.
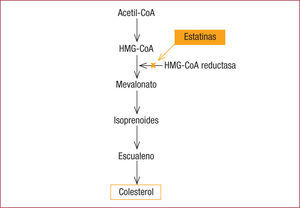


 HMG-CoA (3-hidroxi-3-metilglutaril-coenzima A) reductasa bloquea la producción de mevalonato, precursor del colesterol.' title='Mecanismo de acción de las estatinas: la inhibición de la enzima
HMG-CoA (3-hidroxi-3-metilglutaril-coenzima A) reductasa bloquea la producción de mevalonato, precursor del colesterol.' title='Mecanismo de acción de las estatinas: la inhibición de la enzima  cLDL) y cambios en el volumen de ateroma en los estudios REVERSAL12, ASTEROID13 y SATURN14.' title='Relación entre la reducción de colesterol unido a lipoproteínas de baja densidad (
cLDL) y cambios en el volumen de ateroma en los estudios REVERSAL12, ASTEROID13 y SATURN14.' title='Relación entre la reducción de colesterol unido a lipoproteínas de baja densidad (