El síndrome coronario agudo es el paradigma de la enfermedad aterosclerótica cardiaca y conlleva un amplio conjunto de fenómenos que circundan la eclosión que significa la placa complicada. Inflamación, espasmo, agregación, trombosis y ulterior fibrosis vienen a coincidir, y los fármacos en principio diseñados solo para reducir el colesterol circulante resultan fundamentales a la hora de aplacar todo el remolino de activaciones inadecuadas. Las estatinas, pues, sobrepasan su inicial objetivo, para erigirse en pieza clave en la estabilización del proceso. Numerosos estudios avalan la importancia de su administración en el momento crítico, y cada vez disponemos de más evidencia de que el paciente debe recibirlas más precozmente, justo en el momento que se diagnostica el proceso, incluso antes del intervencionismo, y a dosis altas y empleando estatinas potentes, de eficacia contrastada.
Palabras clave
óxido nítrico sintasa endotelial
infarto agudo de miocardio
intervencionismo coronario percutáneo
síndrome coronario agudo
síndrome coronario agudo sin elevación de ST
La enfermedad coronaria aterosclerótica es un proceso que se instaura lentamente, en el que las lesiones progresan a lo largo de muchos años, pero que se expresa frecuentemente de modo abrupto en forma de síndrome coronario agudo (SCA). Se ha demostrado en multitud de estudios que el tratamiento hipolipemiante, concretamente con estatinas, evita la progresión de la enfermedad hacia el episodio agudo1, lo que tiene sentido, puesto que el colesterol está inmerso en la génesis de las placas. Pero no parecería, en teoría, que este tratamiento pudiese tener un efecto decisivo justo inmediatamente después de producirse el SCA, cuando la placa ya se ha complicado, está rota y están interviniendo fenómenos de agregación plaquetaria, vasospasmo y trombosis. El presente artículo revisa las propiedades de las estatinas y analiza su comportamiento cuando se administran a los pacientes que sufren un SCA.
Lípidos en el curso del síndrome coronario agudoUno de los aspectos llamativos y que merece atención es que la concentración de colesterol durante el SCA desciende2 y, pese a ello, la síntesis de colesterol, evaluada por la medición de su precursor, el latosterol sérico, presenta un aumento significativo. Aunque la explicación más plausible sería que el descenso se debería al intenso ayuno a que se ven sometidos los pacientes cuando ingresan en un centro hospitalario por un SCA, especialmente de ingesta grasa, este punto es muy controvertido.
Este descenso en la fase más crítica del SCA conduce a que, cuando se determinan las concentraciones, lo que suele ocurrir en el hospital cuando se ha superado la fase hiperaguda, el clínico obtiene unos datos que no reflejan el estado habitual de su paciente, lo que puede inducir a errores de interpretación y prescripción.
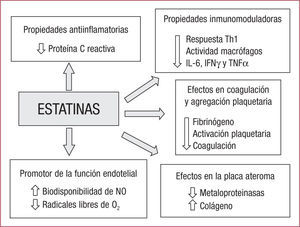
Efectos pleotrópicos de las estatinasLas estatinas son inhibidores de la HMG-CoA reductasa, con lo que reducen la síntesis hepática de colesterol, pero una de las claves del tratamiento con estatinas en el SCA reside en que estos fármacos logran algo más que reducir el colesterol, ya que también se ha demostrado que, entre otras muchas propiedades, estabilizan las placas al aumentar el contenido de colágeno en las que son inestables3, reducen la activación de los macrófagos y la expresión de las metaloproteinasas de la matriz4, reducen el fibrinógeno plasmático5 y factores trombogénicos en general6 y revierten la tendencia a un exceso de agregación plaquetaria7,8. Este conjunto de acciones que ejercen las estatinas se ha venido a llamar efectos pleotrópicos (figura). En biología la pleotropía (del griego pleio, «muchos», y tropo, «cambios») es el fenómeno por el cual un solo gen causa efectos fenotípicos o caracteres distintos y no relacionados; por analogía, en este caso, la pleotropía se refiere a los fenómenos no relacionables directamente con la esencia misma de las estatinas, que en este caso sería el descenso del colesterol.
La administración de estatinas a los sujetos con SCA podría tener dos objetivos diferentes; por un lado, la estabilización de la placa complicada y los fenómenos implicados en ella, lo que significaría un beneficio cortoplacista; por otro lado, se perseguiría simultáneamente un beneficio a más largo plazo, al impedir la progresión de esa y todas las placas presentes o futuras del árbol coronario y de todo el sistema vascular en su conjunto.
De todas las propiedades atribuidas a las estatinas en su papel estabilizador y protector, más allá de la propia reducción de las cifras de colesterol unido a lipoproteínas de baja densidad (cLDL) mediante la inhibición de la enzima HMG-CoA reductasa, a las que se ha dado más importancia son las que ejercen en la función endotelial y la actividad inflamatoria vascular9. Este efecto beneficioso estaría determinado por su efecto potenciador de la actividad de la óxido nítrico (NO) sintasa endotelial (eNOS) y simultáneamente por su efecto inhibidor de las enzimas de la superfamilia de las GTPasas, que ejercen una acción inhibitoria sobre el NO. El incremento de la biodisponibilidad del NO conllevaría una mejora de la función endotelial y una reducción de la inflamación vascular10. En el estudio prospectivo a doble ciego RECIFE, se aleatorizó a 60 pacientes con SCA a recibir 40mg de pravastatina o placebo durante 6 semanas. El objetivo primario era evaluar el efecto de la reducción rápida de colesterol en la reactividad vascular endotelial mediante ultrasonografía, la vasodilatación y el flujo braquial tras un SCA. En ambos grupos, la vasodilatación dependiente del flujo era similar antes de la aleatorización, y no se observaron variaciones significativas en el grupo de placebo tras 6 semanas. No obstante, en el grupo tratado con pravastatina se documentó un incremento del flujo de hasta el 42%, no relacionado con el descenso en las cifras de colesterol. Estos resultados podrían tener especial relevancia para la prevención de eventos cardiovasculares en las primeras semanas tras un SCA11. Por otra parte, las primeras evidencias de las propiedades antiinflamatorias de las estatinas provienen de un análisis retrospectivo del estudio CARE, donde se documentó una reducción de los marcadores proinflamatorios, como la proteína C reactiva, en los pacientes que recibían pravastatina12. Más recientemente, Link et al13 demostraron los efectos inmunomoduladores de las estatinas en un estudio prospectivo a doble ciego que aleatorizó a 35 pacientes con SCA a recibir 20mg de rosuvastatina o placebo. En el grupo que recibía tratamiento con estatinas, se objetivó a las 72 h una inhibición de la respuesta Th1 con una disminución del número de linfocitos capaces de producir interferón gamma (IFNγ) frente a placebo (el 44 frente al 2%; p=0,0318), así como un descenso en las concentraciones plasmáticas de citocinas proinflamatorias interleucina (IL) 6, factor de necrosis tumoral alfa (TNFα) e IFNγ a las 72 h (rosuvastatina: −60%, −36%, −47% frente a placebo: −48%, +13%, +21%; p=0,035, p=0,001 y p=0,001 respectivamente).
Impacto clínico de las estatinas en la fase aguda del síndrome coronario agudoTeniendo en cuenta los efectos pleotrópicos de las estatinas en el endotelio vascular y la respuesta antiinflamatoria, se han diseñado numerosos ensayos clínicos con el objetivo de validar estos resultados en la práctica clínica en el contexto del SCA.
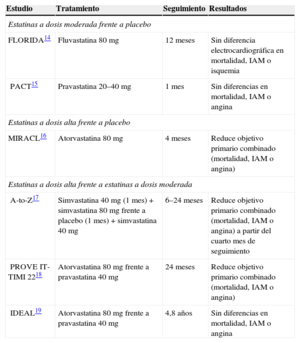
En el estudio FLORIDA14, se aleatorizó a 540 pacientes con SCA con elevación del segmento ST (SCACEST) a recibir fluvastatina 80mg/día o placebo en los primeros 15 días tras el evento agudo, con un seguimiento al año. Al final del estudio, a pesar de la reducción significativa en las cifras de cLDL (el 21 frente al 9%; p<0,001), no se detectaron diferencias significativas en el objetivo primario combinado de mortalidad, infarto agudo de miocardio (IAM) o isquemia valorada por ECG (el 33 frente al 36%; p=0,34). No obstante, el estudio presentaba dos limitaciones importantes, como el pequeño tamaño de la cohorte y el retraso en el inicio del tratamiento (la mediana de inicio de fluvastatina fue de 8 días), lo que pudo influir en los resultados negativos del estudio.
En el estudio PACT15, se aleatorizó a 3.408 pacientes con IAM o angina inestable a recibir pravastatina 20–40mg/día o placebo, iniciando el tratamiento en las primeras 24 h y con un seguimiento al mes. Al final del estudio, a pesar de una cohorte de mayor tamaño y el inicio precoz del tratamiento, no se observó una reducción significativa en el objetivo primario combinado de muerte, IAM o angina recurrente (el 11,6 frente al 12,4%; p > 0,05).
Ambos estudios compartían la característica de que se administraban estatinas a dosis moderadas que consiguieron resultados con tendencia favorable al grupo de las estatinas, aunque sin llegar a la significación estadística.
En el estudio MIRACL16, se aleatorizó a 3.086 pacientes con SCA sin elevación del segmento ST (SCASEST) a recibir dosis altas de estatinas (atorvastatina 80mg/día) o placebo, con un inicio precoz (entre 24 y 96 h) y un seguimiento de 4 meses. El estudio demostró una reducción significativa en la incidencia de eventos cardiovasculares mayores (MACE) en el grupo tratado con dosis altas de estatinas respecto al grupo control (odds ratio [OR] = 0,84; intervalo de confianza del 95% [IC95%], 0,7–1; p=0,048), especialmente a expensas de una reducción en el número de hospitalizaciones por angina recurrente.
Estatinas en la fase aguda del síndrome coronario agudo
| Estudio | Tratamiento | Seguimiento | Resultados |
|---|---|---|---|
| Estatinas a dosis moderada frente a placebo | |||
| FLORIDA14 | Fluvastatina 80mg | 12 meses | Sin diferencia electrocardiográfica en mortalidad, IAM o isquemia |
| PACT15 | Pravastatina 20–40mg | 1 mes | Sin diferencias en mortalidad, IAM o angina |
| Estatinas a dosis alta frente a placebo | |||
| MIRACL16 | Atorvastatina 80mg | 4 meses | Reduce objetivo primario combinado (mortalidad, IAM o angina) |
| Estatinas a dosis alta frente a estatinas a dosis moderada | |||
| A-to-Z17 | Simvastatina 40mg (1 mes) + simvastatina 80mg frente a placebo (1 mes) + simvastatina 40mg | 6–24 meses | Reduce objetivo primario combinado (mortalidad, IAM o angina) a partir del cuarto mes de seguimiento |
| PROVE IT-TIMI 2218 | Atorvastatina 80mg frente a pravastatina 40mg | 24 meses | Reduce objetivo primario combinado (mortalidad, IAM o angina) |
| IDEAL19 | Atorvastatina 80mg frente a pravastatina 40mg | 4,8 años | Sin diferencias en mortalidad, IAM o angina |
IAM: infarto agudo de miocardio.
En el estudio A-to-Z17, se aleatorizó a 4.497 pacientes a recibir una terapia con dosis altas de estatinas (simvastatina 40mg/día durante 1 mes, seguida de simvastatina 80mg/día) o a una terapia conservadora y de inicio tardío (placebo durante 4 meses seguido de simvastatina 20mg/día), con un seguimiento medio de entre 6 y 24 meses. Durante los primeros 4 meses de seguimiento no se detectaron diferencias estadísticamente significativas entre los dos grupos. No obstante, a partir del cuarto mes se observó una reducción significativa en el objetivo primario combinado de angina recurrente, IAM y muerte cardiovascular en el grupo con estatinas a dosis altas (OR=0,75; IC95%, 0,6–0,95; p=0,02).
De forma similar al estudio A-to-Z, en el estudio PROVE IT-TIMI 2218 se compararon dosis de estatinas altas y moderadas. En este ensayo clínico, se aleatorizó a 4.162 pacientes con SCA a pravastatina 40mg o atorvastatina 80mg. A los 30 días, el 4,2% de los pacientes que recibían pravastatina habían sufrido MACE, frente al 3% del grupo de atorvastatina (OR=0,72; IC95%, 0,52–0,9; p=0,46). Estas diferencias se mantuvieron en el seguimiento a los 6 meses, cuando se objetivó una reducción del riesgo del 28% (OR=0,2; IC95%, 0,8–0,9; p=0,03). Estos resultados validan el uso de estatinas potentes en la fase aguda del SCA y demuestran que se reduce la incidencia de MACE en los primeros 30 días, así como la prolongación del tratamiento intensivo en el tiempo.
Finalmente, el estudio IDEAL19 aleatorizó a 8.888 pacientes con antecedentes de IAM clínicamente estables a recibir dosis de estatinas altas (atorvastatina 80mg/día) o moderadas (simvastatina 20mg/día); tras un seguimiento medio de 4,8 años, se documentó un 9,3% de eventos cardiovasculares en el grupo de atorvastatina, frente al 10,4% registrado en el grupo de simvastatina (p=0,07). Aunque no se hallaron diferencias estadísticamente significativas, el grupo tratado con dosis altas de estatinas consiguió una menor tasa de IAM, lo que valida el uso de estatinas potentes en la prevención secundaria del SCA.
Estatinas y reducción del daño miocárdico tras intervencionismo coronario percutáneoEl intervencionismo coronario percutáneo (ICP) es el tratamiento de elección para las estenosis coronarias significativas y sintomáticas y tiene un papel fundamental en el SCA. No obstante, el daño miocárdico periprocedimiento es frecuente y un factor pronóstico que se asocia con un incremento de eventos cardiovasculares futuros20. En este sentido, numerosos estudios señalan que la administración de una dosis de carga de estatinas previa a la ICP aporta unos resultados clínicos beneficiosos con una reducción del daño miocárdico periprocedimiento. Se desconoce por qué mecanismos las estatinas confieren protección contra el daño miocárdico inducido por la ICP, aunque se ha apuntado a un efecto en la estabilización de la placa aterosclerótica, así como una reducción de las microembolizaciones distales tras la angioplastia.
En el estudio NAPLES II21, se aleatorizó a 668 pacientes con enfermedad coronaria estable sintomática que iban a ser sometidos a ICP a recibir antes una dosis de carga de atorvastatina 80mg o placebo. Los resultados demostraron una reducción significativa en la incidencia de IAM periprocedimiento en el grupo que recibió la dosis de carga de estatinas a dosis altas en las 24 h previas al ICP (el 9,5 frente al 15,8%; OR=0,56; IC95%, 0,35–0,89; p=0,014).
Resultados similares se han obtenido en el contexto del SCASEST. En el estudio ARMYDA-ACS22, que aleatorizó a 171 pacientes con SCASEST a recibir dos dosis de carga de atorvastatina a las 12h (80mg) y a las 2h (40mg) o placebo, a los 30 días de seguimiento, la incidencia de MACE fue del 5% en el grupo tratado con estatinas, frente al 17% del grupo control (p=0,01). Asimismo, Wang et al23 demostraron el beneficio de la dosis de carga de rosuvastatina previa a ICP en el SCASEST. Se aleatorizó a 125 pacientes con SCASEST a recibir rosuvastatina 20mg o placebo entre 2 y 4h antes del ICP; ambos grupos recibieron posteriormente rosuvastatina 10mg/día. Al mes de seguimiento, en el grupo tratado pre-ICP se detectó una reducción de la incidencia de MACE (el 8,1 frente al 22,2%; p<0,01).
En el SCACEST, el estudio STATIN STEMI24 aleatorizó a 171 pacientes con SCACEST a 80mg o 10mg de atorvastatina pre-ICP. Al mes de seguimiento, no se detectaron diferencias significativas en reducción de MACE en ningún grupo (el 5,8 frente al 10,6%; p=0,26). No obstante, en el grupo pretratado con atorvastatina 80mg se observó una mejora en la perfusión coronaria microvascular medida por escala TIMI y grado de blush inmediatamente posterior a ICP.
En el mismo sentido, Kim et al25 demostraron que la administración de 40mg de rosuvastatina pre-ICP en SCACEST conseguía disminuir el tamaño del infarto medido por tomografía computarizada de emisión monofotónica (SPECT) de perfusión miocárdica a los 3 días del IAM (rosuvastatina, el 19% frente a control, el 22,9%; p=0,009), debido a una mejora de la perfusión miocárdica microvascular medida por escala TIMI y grado de blush. No obstante, no se detectaron diferencias significativas en la incidencia de MACE (0 frente a 1,5%; p=0,073).
Estatinas y daño miocárdico tras intervencionismo coronario percutáneo
| Estudio | Dosis de carga | Seguimiento | Resultados |
|---|---|---|---|
| ICP electivo | |||
| NAPLES II21 | Atorvastatina 80mg frente a placebo | Estancia hospitalaria | Reducción en la incidencia de IAM periprocedimiento |
| Tratamiento crónico con estatinas e ICP electivo/SCASEST | |||
| ARMYDE-RECAPTURE28 | Atorvastatina 80mg (12 h) y atorvastatina 20mg (2 h) frente a placebo | 30 días | Reducción en mortalidad, IAM o ICP recurrente |
| ICP en SCASEST | |||
| ARMYDA-ACS22 | Atorvastatina 80mg (12 h) y atorvastatina 20mg (2 h) frente a placebo | 30 días | Reducción en la incidencia de MACE |
| Wang et al23 | Rosuvastatina 20mg frente a placebo | 30 días | Reducción en la incidencia de MACE |
| ICP en SCACEST | |||
| STATIN STEMI24 | Atorvastatina 80mg frente a atorvastatina 10mg | 1 mes | Sin diferencias en MACE |
| Kim et al25 | Rosuvastatina 40mg frente a placebo | 30 días | Disminución del tamaño del infarto. Sin diferencias en MACE |
| Metanálisis sobre estatinas en SCA | |||
| Navarese et al26 | Estatina pre-ICP frente a estatina post-ICP frente a sin estatina | 30 días | Reducción del riesgo de IAM, eventos cardiacos y cerebrovasculares en el grupo tratado con estatinas pre-ICP |
IAM: infarto agudo de miocardio; ICP: intervencionismo coronario percutáneo; MACE: eventos cardiacos mayores.
De sumo interés es el reciente metanálisis de Navarese et al26, que pone de relieve la importancia no solo de administrar estatinas a los pacientes con SCA sometidos a intervencionismo coronario –a los 30 días y frente a placebo, la tasa de IAM con estatinas descendía significativamente (OR=0,67; IC95%, 0,53–0,84), con tendencia a menor mortalidad (0,06)–, sino también el momento de administración de la estatina, dado que si esta se administraba antes del procedimiento, la OR descendía a 0,38 (IC95%, 0,24–0,59; p<0,0001), mientras que la diferencia no era significativa si se administraba tras el intervencionismo (p=0,28).
En caso de que los pacientes estuviesen recibiendo ya estatinas, pero no una estatina potente a dosis alta, la «recarga» (volver a dar una dosis de carga alta) antes del intervencionismo es una indicación de clase IIb y nivel de evidencia B en la guía europea27, pues en 2011 se basaba fundamentalmente en el estudio ARMYDA-RECAPTURE28, pero la publicación del reciente metanálisis podría elevar el nivel de evidencia a A.
Seguridad y tolerabilidadLos inhibidores de la HMG-CoA reductasa son fármacos seguros y bien tolerados. No obstante, la administración de estatinas a altas dosis y a largo plazo podría suponer un incremento en el riesgo de efectos adversos, como elevación significativa de transaminasas o miopatías. En este sentido, en el estudio A-to-Z17, el grupo que recibió una terapia intensiva con estatinas (simvastatina 40mg/día durante 4 meses, seguida de simvastatina 80mg/día) presentó un incremento en la incidencia de miopatía con valores de creatincinasa 10 veces por encima de la normalidad respecto al grupo control (el 0,4 frente al 0,001%; p=0,2). De la misma forma, en el estudio MIRACL16, el grupo que recibía dosis altas de atorvastatina presentó un incremento en la incidencia de toxicidad hepática con valores de transaminasas 3 veces por encima de la normalidad respecto al grupo control (el 2,5 frente al 0,6%; p<0,001), hechos que obligaron a suspender el tratamiento en 3 pacientes.
La mayor incidencia de miopatía y toxicidad hepática observada en los ensayos clínicos cuando se administran dosis altas de estatinas obliga a realizar una monitorización clínica y analítica durante el seguimiento del paciente, aunque en la práctica la posibilidad de un efecto adverso clínicamente relevante en cuanto a consecuencias clínicas decisivas para el paciente es escasísima, por no decir remota.
Futuro. Estudios en marchaActualmente hay en marcha numerosos estudios que evalúan los efectos de estatinas potentes a altas dosis, administradas en el contexto de un síndrome coronario agudo. A continuación se destaca tres estudios por sus características diferenciales y el importante volumen de pacientes incluidos.
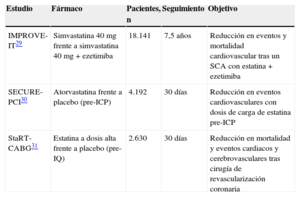
Un estudio de sumo interés es el IMPROVE-IT29, que acaba de ser comunicado en el Congreso de la American Heart Association de noviembre de 2014, pero no está publicado. Se trata de un estudio multicéntrico, aleatorizado y a doble ciego que ha aleatorizado a 18.141 pacientes con SCA a recibir tras el evento agudo 40mg de simvastatina o una combinación de simvastatina 40mg y ezetimiba 10mg al día. De hecho, aunque efectuado sobre la base de estatinas, este estudio lo que verifica es el poder adicional del empleo de un inhibidor de la absorción de colesterol como la ezetimiba. El objetivo primario (reducción en mortalidad cardiovascular e incidencia de eventos cardiacos y cerebrovasculares a 7 años) ha sido favorable al brazo de ezetimiba (HR=0,936; IC95%, 0,887–0,988; p=0,016). Este hallazgo refuerza la «teoría lipídica», es decir, reducir el colesterol mejora el pronóstico con independencia del método empleado.
En fase aún de inclusión destaca el estudio brasileño SECURE-PCI30, en el que se aleatorizó a 4.192 pacientes con SCA a recibir una dosis de carga de atorvastatina o placebo antes del ICP, con el objetivo de demostrar una reducción en la incidencia de MACE con un seguimiento corto (30 días).
Un aspecto novedoso, no claramente relacionado con el SCA pero sí en los efectos pleotrópicos de las estatinas, es su probable efecto cardioprotector en los pacientes sometidos a cirugía de revascularización coronaria. En este sentido, está en marcha el estudio StaRT-CABG31, un ensayo clínico, aleatorizado y a doble ciego, en el que se aleatoriza a 2.630 pacientes con angina estable o SCASEST a recibir estatinas a altas dosis o placebo antes de la cirugía de revascularización coronaria, con el objetivo primario de observar una reducción en la mortalidad y la incidencia de eventos cardiacos y cerebrovasculares en los 30 días posteriores a la intervención.
Ensayos clínicos en marcha con estatinas en síndrome coronario agudo
| Estudio | Fármaco | Pacientes, n | Seguimiento | Objetivo |
|---|---|---|---|---|
| IMPROVE-IT29 | Simvastatina 40mg frente a simvastatina 40mg + ezetimiba | 18.141 | 7,5 años | Reducción en eventos y mortalidad cardiovascular tras un SCA con estatina + ezetimiba |
| SECURE-PCI30 | Atorvastatina frente a placebo (pre-ICP) | 4.192 | 30 días | Reducción en eventos cardiovasculares con dosis de carga de estatina pre-ICP |
| StaRT-CABG31 | Estatina a dosis alta frente a placebo (pre-IQ) | 2.630 | 30 días | Reducción en mortalidad y eventos cardiacos y cerebrovasculares tras cirugía de revascularización coronaria |
ICP: intervencionismo coronario precutáneo; IQ: intervención quirúrgica; SCA: síndrome coronario agudo. Los resultados del IMPROVE-IT están a punto de ser publicados (véase el texto).
La medición de los efectos de la actuación con estatinas en el SCA se ha centrado en los eventos cardiovasculares y su disminución con la terapia. Sabemos que las estatinas potentes a dosis altas han resultado más eficaces que las estatinas a dosis más bajas o menos potentes1. Pero seguimos sin saber cuál es el mecanismo fundamental a través del cual las estatinas ejercen su poderoso beneficio, pues es casi imposible correlacionar efectos fisiopatológicos concretos con efectos clínicamente relevantes.
Por otra parte, tampoco sabemos cómo medir claramente el efecto a través de las reducciones del cLDL o si otros parámetros como el colesterol aterogénico, el cHDL o incluso marcadores inflamatorios (como la proteína C reactiva de alta sensibilidad) tienen algún papel en la toma de decisiones.
Finalmente, sigue la divergencia de criterios, ya abordada en otros artículos de esta monografía, entre la guía europea27, que recomienda reducir las cifras de cLDL a menos de 70mg/dl, y la guía estadounidense32, que recomienda dosis altas de estatinas potentes en todos los casos (rosuvastatina 20 o 40mg, atorvastatina 40 o 80mg), un aspecto de perpetuo debate que tiene plena vigencia en el manejo de los pacientes con SCA.
Conclusiones y recomendacionesSe ha demostrado que las estatinas tienen un papel fundamental para los pacientes con arteriopatía coronaria en general e inmersos en un SCA en particular. Todos los pacientes con SCA, con independencia de sus características, deben recibir estatinas, salvo contraindicación o intolerancia, lo que ocurre en pocos casos. Es conveniente iniciar el tratamiento lo más precozmente posible, probablemente en el mismo momento en que se atiende al paciente e incluso antes del ICP. Como la determinación de cLDL que se obtiene en la fase aguda puede no reflejar la situación habitual de los pacientes, la mejor conducta es administrar estatinas potentes y a dosis elevadas que, siguiendo la guía estadounidense, podrían ser las dosis altas de rosuvastatina (20–40mg) o de atorvastatina (40–80mg). Con ello no solo se persigue obtener un descenso rápido de los valores de cLDL, sino asimismo los efectos pleotrópicos de las estatinas, que pueden dirigirse a la estabilización de la placa causante del SCA. La guía europea de dislipemias27 aconseja administrar dosis menores a los sujetos con mayor riesgo de efectos adversos, como ancianos, pacientes con hepatopatía crónica o insuficiencia renal o con potenciales interacciones con otros fármacos de su tratamiento; aunque la prudencia debe siempre presidir cualquier actuación médica, los efectos indeseados de las estatinas y con consecuencias clínicas importantes son escasísimos.
Es imprescindible que el tratamiento con estatinas esté presente al alta del paciente, y es conveniente controlar las concentraciones lipídicas y la función hepática y renal al cabo de unas semanas del alta (4–6 semanas según la guía europea27). Los resultados del IMPROVE-IT con ezetimiba refuerzan el papel coadyuvante con las estatinas de otros fármacos hipolipemiantes.
Conflicto de interesesNinguno.