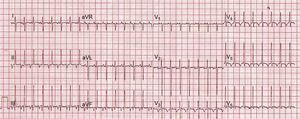
Se presenta el caso de un lactante de 4 meses (6,4 kg) remitido a nuestro centro desde otro hospital por taquicardia incesante con mala tolerancia clínica. El electrocardiograma a su llegada mostró una taquicardia regular a 190 lpm, de QRS estrecho, con ondas P claramente visibles, negativas en cara inferior, relación AV 1:1 y un intervalo RP más largo que el PR, todo lo cual indicaba taquicardia incesante recíproca de la unión o taquicardia de Coumel (figura 1). Se realizó un ecocardiograma, que mostró una disfunción ventricular izquierda grave, con fracción de acortamiento del 14%, por lo que ingresó en la unidad de cuidados intensivos neonatales.
No se consiguió controlar la taquicardia a pesar de cardioversiones eléctricas y fármacos antiarrítmicos (esmolol, amiodarona), por recurrencia inmediata. En las horas sucesivas sufrió un deterioro clínico progresivo y shock cardiogénico, sin conseguirse un gasto cardiaco adecuado a pesar de los fármacos inotrópicos. Por ello se implantó un oxigenador extracorpóreo de membrana (ECMO) como soporte hemodinámico empleando la arteria carótida y la vena yugular derecha.
Al día siguiente se realizó un estudio electrofisiológico con soporte mediante ECMO; los electrocatéteres se introdujeron por vena femoral derecha. Se confirmaron el diagnóstico mediante las maniobras de estimulación habituales y la presencia de una vía accesoria oculta medioseptal con conducción decremental.
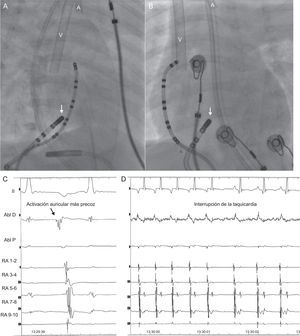
Inicialmente, la ablación se llevó a cabo en el punto con activación auricular retrógrada más precoz mediante catéter de radiofrecuencia con punta de 4 mm (Marinr 5F, Medtronic Inc.; Minneapolis, Estados Unidos). Pese a conseguirse éxito agudo transitorio, las aplicaciones estaban limitadas por temperatura (55°C) alcanzando siempre potencias muy bajas (4 W), por lo que la arritmia recurría a los pocos segundos. En ningún momento, a pesar de pequeños movimientos del catéter, se consiguieron mayores potencias. Suponiendo que se trataba de bajo flujo en la aurícula derecha, consecuencia de la extracción de sangre de la aurícula derecha por el ECMO, se introdujo un catéter de crioablación de 6 mm (7 Fr, Freezor Xtra, Medtronic Inc.; Minneapolis, Estados Unidos). Durante el criomapeo (–35°C) se produjo interrupción de la taquicardia por bloqueo retrógrado en la vía accesoria, que no afectaba a la conducción auriculoventricular (figuras 2A-2D). Por lo tanto, se aplicó crioablación (–80°C) durante 240 s. La evolución tras el procedimiento fue satisfactoria, se retiraron progresivamente el ECMO y los fármacos vasoactivos, y finalmente se le dio el alta a las 3 semanas. La fracción de eyección se normalizó completamente a los 3 meses y hasta la fecha no ha habido recurrencias.
Proyecciones radiológicas oblicua anterior derecha (A) y posteroanterior (B) que muestran la posición del catéter de crioablación en la región medioseptal (flecha), lugar donde se registraba la activación auricular más precoz (C). Durante el criomapeo en ese punto, la taquicardia se termina (D). Nótense las cánulas venosa (V) y arterial (A) en las imágenes de la escopia.
La taquicardia incesante recíproca de la unión es una forma poco común de taquicardia supraventricular, mediada por una vía accesoria de propiedades decrementales, que generalmente se localiza en la región posteroseptal. Típicamente se presenta en las primeras décadas de la vida, especialmente en lactantes y, debido a las propiedades de conducción lenta de la vía accesoria, es frecuente que tenga un carácter incesante, lo que puede ocasionar taquimiocardiopatía hasta en un 18% de los casos. Sin embargo, raramente son precisos fármacos inotrópicos o soporte hemodinámico1. En este caso, la tórpida evolución clínica, con desarrollo de shock cardiogénico refractario a fármacos, necesitó implante de ECMO.
Aunque los fármacos antiarrítmicos son el primer escalón terapéutico para el tratamiento de estas arritmias, la ablación acaba siendo necesaria en la mayoría de los casos para conseguir que no haya recurrencias a largo plazo. En centros con experiencia, se puede realizar con alta tasa de éxito y bajo riesgo de complicaciones incluso en lactantes1,2.
La radiofrecuencia es la fuente de energía más utilizada para la ablación con catéter. Para conseguir una lesión permanente, es preciso liberar de manera eficaz una potencia suficiente en el tejido. Sin embargo, cuando se realizan aplicaciones en zonas de bajo flujo (como el interior del seno coronario), no se produce un adecuado enfriamiento de la punta del catéter, lo cual hace que esta se caliente rápidamente y se alcance el límite de temperatura y no se pueda obtener potencias adecuadas. En este caso, la extracción de la sangre por la cánula venosa del ECMO era la causa de que hubiese bajo flujo en la aurícula derecha, lo que limitaba la liberación de potencia con radiofrecuencia convencional. Los catéteres de punta irrigada son la solución empleada con más frecuencia para solventar este problema3. Sin embargo, hay pocos datos experimentales o clínicos sobre los efectos de las aplicaciones con catéteres de punta irrigada en el miocardio en desarrollo, como es el caso de los niños4.
En este caso, se empleó la crioablación como fuente de energía alternativa para superar esta limitación, apoyada también en su excelente perfil de seguridad, que ha hecho que se convierta en el tratamiento de elección a la hora de tratar sustratos perinodulares en muchos centros que realizan ablación en pacientes pediátricos. Sin embargo, hay que tener en cuenta que los catéteres disponibles actualmente son rígidos y relativamente grandes, por lo que su uso en niños pequeños tiene más limitaciones5.
El presente caso aporta una nueva ventaja de la crioablación, como es la independencia del flujo circundante para la formación de una lesión efectiva, tal como sucede en pacientes que requieren soporte hemodinámico externo (ECMO).
CONFLICTO DE INTERESESF. Atienza es consultor de Medtronic.