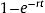El desfibrilador automático implantable (DAI) es una alternativa coste-efectiva para la prevención secundaria de la muerte súbita cardiaca, pero sigue habiendo dudas sobre su eficiencia en prevención primaria, sobre todo en pacientes con cardiopatía no isquémica.
MétodosAnálisis de coste-utilidad del DAI más tratamiento médico convencional frente a tratamiento médico convencional para la prevención primaria de arritmias cardiacas desde la perspectiva del Sistema Nacional de Salud. Se simuló el curso de la enfermedad mediante modelos de Markov en pacientes con y sin cardiopatía isquémica. Los parámetros del modelo se basaron en los resultados obtenidos mediante metanálisis de los ensayos clínicos publicados entre 1996 y 2018 en los que se comparaba el DAI con el tratamiento médico convencional, los resultados de seguridad del ensayo DANISH y el análisis de la práctica clínica habitual en un hospital terciario.
ResultadosSe estimó un beneficio del DAI sobre la muerte por cualquier causa con HR = 0,70 (IC95%, 0,58-0,85) en cardiopatía isquémica y HR = 0,79 (IC95%, 0,66-0,96) en no isquémica. La razón de coste-efectividad incremental estimada mediante análisis probabilístico fue de 19.171 euros/año de vida ajustado por calidad (AVAC) en pacientes con cardiopatía isquémica, 31.084 euros/AVAC en pacientes con miocardiopatía dilatada no isquémica y 23.230 euros/AVAC en los menores de 68 años.
ConclusionesLa eficiencia del DAI monocameral ha mejorado en la última década y este resulta coste-efectivo para los pacientes con disfunción ventricular izquierda de origen isquémico o no isquémico menores de 68 años considerando una disposición a pagar 25.000 euros/AVAC. En pacientes no isquémicos mayores, la razón de coste-efectividad incremental estimada se sitúa alrededor de los 30.000 euros/AVAC.
Palabras clave
El desfibrilador automático implantable (DAI) es efectivo para el tratamiento de arritmias ventriculares potencialmente mortales1. Más de una década después de la publicación de los primeros ensayos clínicos fundamentales2,3, la eficacia del DAI para prevención primaria de la muerte súbita cardiaca ha sido motivo de controversias a raíz de la publicación del último ensayo clínico realizado en pacientes con insuficiencia cardiaca de origen no isquémico4. Dicha controversia dio lugar a la publicación de numerosas revisiones sistemáticas y metanálisis, con la conclusión de que, comparado con el tratamiento farmacológico convencional (TMC), el DAI en prevención primaria mejora la supervivencia de los pacientes con insuficiencia cardiaca de origen isquémico5,6 o no isquémico6–17 y fracción de eyección (FE) ≤ 35%.
Según el registro oficial publicado en Revista Española de Cardiología18, el uso profiláctico de DAI representó el 62% de todas las indicaciones, con gran variabilidad entre centros, y es la indicación que más crece para los pacientes con miocardiopatía dilatada, el 63,5% de las indicaciones frente al 49,9% en pacientes con cardiopatía isquémica.
La evaluación de tecnologías sanitarias es básica para la toma de decisiones y una asignación de recursos que garantice la calidad de la provisión de servicios y la sostenibilidad del sistema19. En un informe de evaluación de tecnologías realizado en nuestro medio en 201120, se concluyó que los DAI eran una alternativa coste-efectiva para la prevención primaria en pacientes con miocardiopatía dilatada de origen isquémico que cumplían los criterios del ensayo MADIT21. En cambio, la indicación de DAI en prevención primaria no resultó coste-efectiva según una disposición a pagar 30.000 euros/año de vida ajustado por calidad (AVAC) en pacientes con criterios del MADIT II2 y miocardiopatía dilatada de origen no isquémico.
Hay evidencia22,23 de que la tasa de mortalidad por causa arrítmica y la tasa de terapias apropiadas se han reducido en los últimos años y de que varían en función de la edad y la comorbilidad, por lo que muchos pacientes con DAI nunca recibirán un shock apropiado o morirán antes de causa no arrítmica24. Un hallazgo secundario25 del estudio DANISH fue que en los análisis de subgrupos preespecificados se observó un efecto positivo del DAI en cuanto a la disminución del riesgo de mortalidad de los pacientes con disfunción ventricular no isquémica a los que se implantaba el DAI a edades más jóvenes. Por todo ello, es fundamental la selección de los pacientes cuyo beneficio esperado del DAI sea mayor, la probabilidad de complicaciones sea menor y, por lo tanto, el uso de DAI sea eficiente, sobre todo en las indicaciones de prevención primaria.
El objetivo de este estudio es evaluar el coste-utilidad del DAI en prevención primaria para pacientes con TMC, actualizando la evaluación realizada en 2011 con nueva evidencia, y establecer en qué subgrupos de pacientes sería coste-efectivo en función del tipo de cardiopatía y la edad.
MÉTODOSEvaluación económica de coste-utilidad mediante análisis de decisiones basado en modelos de Markov.
Modelo de decisiónPara estimar los costes y la supervivencia de los pacientes con TMC que reciben un DAI para prevención primaria y los que no, se utilizó un modelo de Markov. Se realizó una evaluación de coste-utilidad desde la perspectiva del Sistema Nacional de Salud (SNS) y en un marco temporal que englobaba toda la vida del paciente, aplicando una tasa de descuento del 3% anual tanto en los costes como en los beneficios. Se evaluó el TMC frente al DAI con TMC para prevención primaria de pacientes con 3 perfiles distintos: a) disfunción ventricular de origen isquémico; b) disfunción ventricular no isquémica, y c) disfunción ventricular no isquémica en pacientes de 68 años o menos (subgrupo preespecificado del estudio DANISH en el que se observó beneficio del DAI).
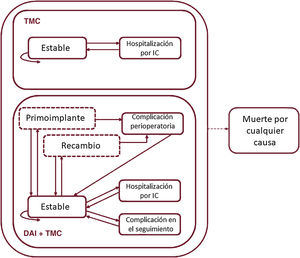
Se adaptó el modelo utilizado en una evaluación previa26 con el software TreeAge Pro (versión 2019 R2.0). Se simuló una cohorte hipotética de pacientes de 60 años con insuficiencia cardiaca en clase funcional II-III y FE<35%, con o sin antecedentes de cardiopatía isquémica, que recibían un DAI monocameral (grupo TMC+DAI) para prevención primaria o no lo recibían (grupo TMC). La figura 1 muestra los distintos estados por los que pueden transitar los pacientes en ciclos mensuales y las transiciones entre ellos. Todos los pacientes parten del estado «estable», y desde allí cada mes están en riesgo de morir por cualquier causa o de ingresar por insuficiencia cardiaca. Los pacientes en el grupo TMC+DAI, además, pueden sufrir una complicación relacionada con el dispositivo en cualquier momento o una complicación perioperatoria solamente en el primer mes o cuando haya un reemplazo de la batería (considerada a los 8 años del primoimplante).
Estructura del modelo de Markov. Los estados de salud se representan como recuadros con línea continua y los estados de transición, como recuadros en línea discontinua. Las flechas representan las transiciones entre estados. La flecha en línea discontinua significa que parte de todos los estados de salud. DAI: desfibrilador automático implantable; IC: insuficiencia cardiaca; TMC: tratamiento médico convencional.
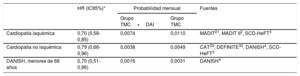
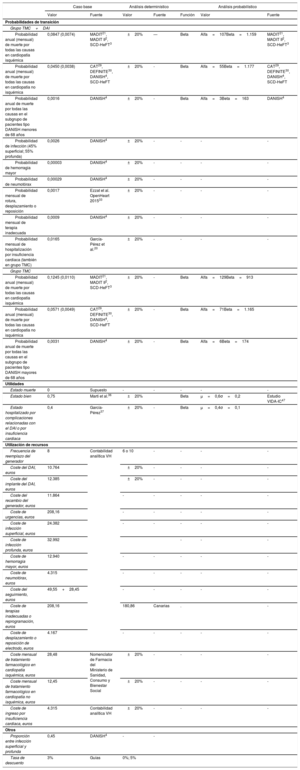
Las probabilidades de muerte en cada grupo y cada modelo se muestran en la tabla 1. Se obtuvieron a partir del resultado de una revisión sistemática y metanálisis sobre la eficacia del DAI en prevención primaria (metodología descrita en el material adicional I) actualizando la búsqueda realizada en un estudio previo20 hasta el 30 de mayo de 2018. Como resultado del metanálisis, para la estimación de la probabilidad de muerte de los pacientes isquémicos, se utilizaron los datos de eficacia de los estudios MADIT21, MADIT II2 y SCD-HeFT3 y se excluyeron los estudios CABG-Patch26, DINAMIT27 e IRIS28, puesto que se realizaron en el contexto de cirugía de revascularización coronaria o de un infarto de miocardio reciente. Para la estimación de la probabilidad de muerte de los pacientes con disfunción ventricular no isquémica, se utilizaron los datos de eficacia de los estudios CAT29, DEFINITE30, DANISH4 y SCD-HeFT3 (en la comparación con placebo, excluyendo el grupo de tratamiento con amiodarona), y se excluyeron el estudio AMIOVIRT31, que utilizó amiodarona como comparador, y el Pro-IC32, en pacientes en lista de espera para trasplante cardiaco. Se excluyó el estudio COMPANION por la imposibilidad de obtener los datos de eficacia en pacientes con y sin cardiopatía isquémica por separado.
Probabilidades basales de transición a muerte por cualquier causa
| HR (IC95%)* | Probabilidad mensual | Fuentes | ||
|---|---|---|---|---|
| Grupo TMC+DAI | Grupo TMC | |||
| Cardiopatía isquémica | 0,70 (0,58-0,85) | 0,0074 | 0,0110 | MADIT21, MADIT II2, SCD-HeFT3 |
| Cardiopatía no isquémica | 0,79 (0,66-0,96) | 0,0038 | 0,0049 | CAT29, DEFINITE30, DANISH4, SCD-HeFT3 |
| DANISH, menores de 68 años | 0,70 (0,51-0,96) | 0,0016 | 0,0031 | DANISH4 |
CAT: Cardiomyophaty Trial; DAI: desfibrilador automático implantable; DANISH: DANish trial to assess efficacy of Implantable cardioverter defibrillators in patients with non-ischemic Systolic Heart failure; DEFINITE: Defibrillators in non-ischemic Cardiomyophaty Treatment Evaluation trial; HR: hazard ratio; MADIT: Multicenter Automatic Defibrillator Implantation Trial; SCD-HeFT: Sudden Cardiac Death in Heart Failure Trial; TMC: tratamiento médico convencional.
Se estimaron las probabilidades a partir de las tasas acumuladas de todos los ensayos clínicos aleatorizados incluidos en ambos grupos de tratamiento mediante la fórmula:
Se asumió que el efecto del DAI en la probabilidad de muerte por cualquier causa es constante durante todo el marco temporal, a pesar de que los ensayos clínicos aleatorizados tienen un periodo medio de seguimiento de entre 16 y 41 meses (tabla 1 del material adicional). Para extrapolar las tasas de mortalidad a toda la vida del paciente, se realizó un ajuste por edad a partir de las tablas de mortalidad de la población española para 2017 publicadas por el Instituto Nacional de Estadística (figura 4 del material adicional). Todos los parámetros del modelo para el caso base y para los análisis de sensibilidad se resumen en la tabla 2.
Resumen de los parámetros del modelo para el caso base y análisis de sensibilidad
| Caso base | Análisis determinístico | Análisis probabilístico | |||||
|---|---|---|---|---|---|---|---|
| Valor | Fuente | Valor | Fuente | Función | Valor | Fuente | |
| Probabilidades de transición | |||||||
| Grupo TMC+DAI | |||||||
| Probabilidad anual (mensual) de muerte por todas las causas en cardiopatía isquémica | 0,0847 (0,0074) | MADIT21, MADIT II2, SCD-HeFT3 | ±20% | — | Beta | Alfa=107Beta=1.159 | MADIT21, MADIT II2, SCD-HeFT3 |
| Probabilidad anual (mensual) de muerte por todas las causas en cardiopatía no isquémica | 0,0450 (0,0038) | CAT29, DEFINITE30, DANISH4, SCD-HeFT | ±20% | - | Beta | Alfa=55Beta=1.177 | CAT29, DEFINITE30, DANISH4, SCD-HeFT |
| Probabilidad anual de muerte por todas las causas en el subgrupo de pacientes tipo DANISH menores de 68 años | 0,0016 | DANISH4 | ±20% | - | Beta | Alfa=3Beta=163 | DANISH4 |
| Probabilidad de infección (45% superficial; 55% profunda) | 0,0026 | DANISH4 | ±20% | - | - | - | - |
| Probabilidad de hemorragia mayor | 0,00003 | DANISH4 | ±20% | - | - | - | - |
| Probabilidad de neumotórax | 0,00029 | DANISH4 | ±20% | - | - | - | - |
| Probabilidad mensual de rotura, desplazamiento o reposición | 0,0017 | Ezzat et al. OpenHeart 201533 | ±20% | - | - | - | - |
| Probabilidad mensual de terapia inadecuada | 0,0009 | DANISH4 | ±20% | - | - | - | - |
| Probabilidad mensual de hospitalización por insuficiencia cardiaca (también en grupo TMC) | 0,0165 | García-Pérez et al.20 | ±20% | - | - | - | - |
| Grupo TMC | |||||||
| Probabilidad anual (mensual) de muerte por todas las causas en cardiopatía isquémica | 0,1245 (0,0110) | MADIT21, MADIT II2, SCD-HeFT3 | ±20% | - | Beta | Alfa=129Beta=913 | |
| Probabilidad anual (mensual) de muerte por todas las causas en cardiopatía no isquémica | 0,0571 (0,0049) | CAT29, DEFINITE30, DANISH4, SCD-HeFT | ±20% | - | Beta | Alfa=71Beta=1.165 | |
| Probabilidad anual de muerte por todas las causas en el subgrupo de pacientes tipo DANISH mayores de 68 años | 0,0031 | DANISH4 | ±20% | - | Beta | Alfa=6Beta=174 | |
| Utilidades | |||||||
| Estado muerte | 0 | Supuesto | - | - | - | - | - |
| Estado bien | 0,75 | Martí et al.36 | ±20% | Beta | μ=0,6σ=0,2 | Estudio VIDA-IC47 | |
| Estado hospitalizado por complicaciones relacionadas con el DAI o por insuficiencia cardiaca | 0,4 | García-Pérez37 | ±20% | - | Beta | μ=0,4σ=0,1 | |
| Utilización de recursos | |||||||
| Frecuencia de reemplazo del generador | 8 | Contabilidad analítica VH | 6 o 10 | - | - | - | - |
| Coste del DAI, euros | 10.764 | ±20% | - | - | - | - | |
| Coste del implante del DAI, euros | 12.385 | ±20% | - | - | - | - | |
| Coste del recambio del generador, euros | 11.864 | - | - | - | - | - | |
| Coste de urgencias, euros | 208,16 | - | - | - | - | - | |
| Coste de infección superficial, euros | 24.382 | - | - | - | - | - | |
| Coste de infección profunda, euros | 32.992 | - | - | - | |||
| Coste de hemorragia mayor, euros | 12.940 | - | - | - | - | - | |
| Coste de neumotórax, euros | 4.315 | - | - | - | - | - | |
| Coste del seguimiento, euros | 49,55+28,45 | - | - | - | - | - | |
| Coste de terapias inadecuadas o reprogramación, euros | 208,16 | 180,86 | Canarias | . | - | ||
| Coste de desplazamiento o reposición de electrodo, euros | 4.167 | - | - | - | - | - | |
| Coste mensual de tratamiento farmacológico en cardiopatía isquémica, euros | 28,48 | Nomenclator de Farmacia del Ministerio de Sanidad, Consumo y Bienestar Social | ±20% | - | - | - | - |
| Coste mensual de tratamiento farmacológico en cardiopatía no isquémica, euros | 12,45 | ±20% | - | - | - | - | |
| Coste de ingreso por insuficiencia cardiaca, euros | 4.315 | Contabilidad analítica VH | ±20% | - | - | - | - |
| Otros | |||||||
| Proporción entre infección superficial y profunda | 0,45 | DANISH4 | - | - | |||
| Tasa de descuento | 3% | Guías | 0%; 5% | ||||
CAT: Cardiomyophaty Trial; DAI: desfibrilador automático implantable; DANISH: DANish trial to assess efficacy of Implantable cardioverter defibrillators in patients with non-ischemic Systolic Heart failure; DEFINITE: Defibrillators in non-ischemic Cardiomyophaty Treatmetn Evaluation trial; MADIT: Multicenter Automatic Defibrillator Implantation Trial; SCD-HeFT: Sudden Cardiac Death in Heart Failure Trial; TMC: tratamiento médico convencional; VH: Vall d’Hebron.
El desglose de los costes puede verse en la tabla 4 del material adicional.
Se diferenciaron las complicaciones perioperatorias (infección superficial o profunda, hemorragia mayor, neumotórax) y las que pueden ocurrir durante todo el seguimiento (disfunción por rotura o desplazamiento o terapias inadecuadas).
Las probabilidades de complicaciones se obtuvieron de la literatura reciente. Puesto que los registros y estudios observacionales tienden a subestimar las tasas de complicaciones33, se utilizaron las tasas de complicaciones perioperatorias y la tasa mensual de terapias inadecuadas descritas en el estudio DANISH, por ser el ensayo clínico aleatorizado más reciente y por ello el más representativo de la práctica clínica actual. Las probabilidades mensuales de complicaciones mecánicas en el seguimiento (rotura, desplazamiento o reposición) se obtuvieron de los trabajos de Ezzat el al.33 y Koneru et al.34.
UtilidadesPara el cálculo de utilidades se utilizaron los mismos supuestos que se adoptaron en el estudio de 201120. La utilidad es un índice de medida de la calidad de vida basado en preferencias que va de 0 a 1, donde el 0 es la utilidad del estado «muerte» y 1, el estado de salud perfecta. Se asumió que 1 año de vida con disfunción ventricular equivale a 0,75 años con salud perfecta con base en estudios previos35,36. Se asumió que, en ausencia de complicaciones, ser portador de DAI no modifica la calidad de vida. En los estados de salud que suponen un empeoramiento del paciente, se asumió que la calidad de vida se deteriora en 0,35 puntos por año de vida durante los días que el paciente permanece hospitalizado37.
Uso de recursos y costesSe consideraron los costes directos sanitarios. Se asumió que el uso de recursos no directamente relacionados con el DAI era similar y no excesivamente alto en ambos grupos, por lo que estos costes no se contabilizaron. Sí se han contabilizado los fármacos habituales en pacientes con insuficiencia cardiaca con o sin cardiopatía isquémica, asumiendo un porcentaje de uso obtenido mediante opinión de expertos (cardiólogos clínicos y arritmólogos) del Servicio de Cardiología del Hospital Vall d’Hebron, las dosis objetivo, máximas o más habituales, y los costes según el Nomenclator de Farmacia del Ministerio de Sanidad, Consumo y Bienestar Social (tabla 2 del material adicional).
En la tabla 3 del material adicional se muestra la descripción de los eventos que definen cada estado, los supuestos que se han hecho para cada uno de ellos, los costes unitarios y las fuentes de información sobre costes. El uso de recursos en el grupo TMC+DAI se basa en la práctica habitual en el Hospital Vall d’Hebron. Los costes de hospitalización para primoimplante o recambio o en caso de complicaciones se han estimado en una muestra de 22 pacientes a partir de la contabilidad analítica del mismo centro. Los costes unitarios incluyen un 20% de costes indirectos (mantenimiento, servicios, etc.).
Los costes se expresan en euros de 2018. Cuando no se dispuso de los costes de 2018, se ajustaron por la inflación según la variación descrita por el Instituto Nacional de Estadística.
Análisis de sensibilidadPara evaluar el grado de incertidumbre de las estimaciones, se realizaron análisis de sensibilidad probabilísticos asignando distintas funciones de distribución a los parámetros: distribución beta para probabilidades y utilidades y distribuciones gamma y uniforme para la utilización de recursos. Los planos de coste-efectividad se obtuvieron mediante simulaciones de Monte Carlo de 10.000 iteraciones. En el caso base se consideró como umbral de disposición a pagar el nivel superior del intervalo determinado empíricamente por Vallejo-Torres et al.38 de 20.000-25.000 euros/AVAC, pero además se trazaron las curvas de aceptabilidad representando las probabilidades de aceptar el DAI como alternativa coste-efectiva para distintos niveles de disposición a pagar39–41.
Para valorar el impacto en el resultado en las estimaciones del modelo de cada uno de los parámetros, se realizaron análisis de sensibilidad tomando la variabilidad encontrada en la literatura o variaciones del 20%. Para los costes de intervención, los valores utilizados en el análisis de sensibilidad consideraron la variabilidad entre el Hospital Vall d’Hebron y datos facilitados por el Servicio Canario de Salud. Para el caso base, se tomó el coste del dispositivo más económico de los utilizados en el Hospital Vall d’Hebron, por lo que este parámetro se modificó solo con valores más altos en el análisis de sensibilidad. El resultado de este análisis se presenta gráficamente mediante diagramas de tornado.
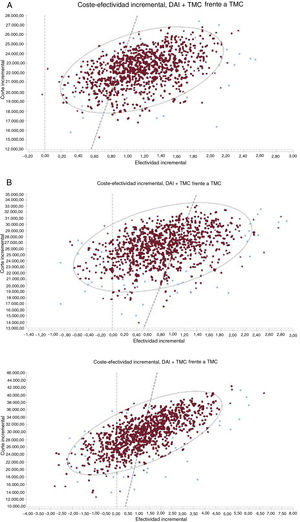
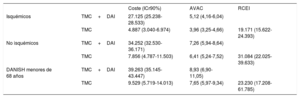
RESULTADOSEn la tabla 3 se presentan los resultados del caso base para el análisis probabilístico de las 3 situaciones analizadas. En los 3 casos, el implante de DAI representa una ganancia en AVAC y un mayor coste. Las razones de coste-efectividad incremental (RCEI) medias de TMC+DAI frente a TMC se estiman en 19.171, 31.084 y 23.230 euros/AVAC para el caso base en pacientes con cardiopatía isquémica, con cardiopatía no isquémica y pacientes tipo DANISH (con cardiopatía no isquémica) menores de 68 años respectivamente. Los puntos en los planos de coste-efectividad (figura 2) representan el resultado de la RCEI de cada una de las simulaciones de Monte Carlo. La mayoría de los puntos se sitúan en el cuadrante superior derecho, lo que indica un coste y una efectividad superiores para el grupo TMC+DAI frente a TMC en los 3 supuestos. En la cohorte de pacientes no isquémicos, la proporción de casos a la izquierda del umbral de disponibilidad a pagar de 25.000 euros/AVAC es mayor. La probabilidad de que la alternativa TMC+DAI sea coste-efectiva por encima de una disponibilidad a pagar de 25.000 euros/AVAC en pacientes con cardiopatía isquémica es del 80%, del 25% en no isquémicos y del 55% en pacientes tipo DANISH menores de 68 años (figuras 4 y 5 del material adicional).
Resultados del caso base (análisis probabilístico), TMC+DAI frente a TMC
| Coste (ICr90%) | AVAC | RCEI | ||
|---|---|---|---|---|
| Isquémicos | TMC+DAI | 27.125 (25.238-28.533) | 5,12 (4,16-6,04) | |
| TMC | 4.887 (3.040-6.974) | 3,96 (3,25-4,66) | 19.171 (15.622-24.393) | |
| No isquémicos | TMC+DAI | 34.252 (32.530-36.171) | 7,26 (5,94-8,64) | |
| TMC | 7.856 (4.787-11.503) | 6,41 (5,24-7,52) | 31.084 (22.025-39.633) | |
| DANISH menores de 68 años | TMC+DAI | 39.263 (35.145-43.447) | 8,93 (6,90-11,05) | |
| TMC | 9.529 (5.719-14.013) | 7,65 (5,97-9,34) | 23.230 (17.208-61.785) |
AVAC: años de vida ajustados por calidad; DAI: desfibrilador automático implantable; ICr90%: intervalo de credibilidad del 90%; RCEI: razón de coste-efectividad incremental; TMC: tratamiento médico convencional.
Plano coste-efectividad incremental de DAI más TMC comparado con TMC en pacientes con cardiopatía isquémica (A); cardiopatía no isquémica (B) y tipo DANISH menores de 68 años (C). La línea punteada indica el umbral de 25.000 euros/AVAC. AVAC: años de vida ajustados por calidad; DAI: desfibrilador automático implantable; TMC: tratamiento médico convencional.
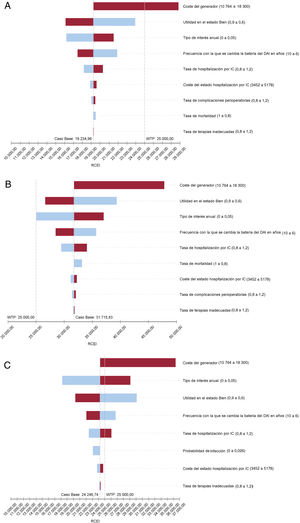
Los análisis de sensibilidad (figura 3) muestran que los 3 modelos son sensibles, aparte de a la tasa de descuento anual, el coste del dispositivo, el valor de utilidad del estado estable (a mayor valor de utilidad en el paciente con insuficiencia cardiaca en situación estable, mayor ganancia en AVAC si se evitan muertes gracias al DAI), y la frecuencia de recambio de la batería (a mayor número de recambios realizados a lo largo de una vida, mayor coste por paciente). En pacientes con cardiopatía isquémica, solamente para costes del dispositivo en el extremo superior del intervalo analizado, conduciría a una interpretación de los resultados distinta en relación con un umbral de 25.000 euros/AVAC. Otros 2 factores importantes, pero con un impacto individual menos relevante, serían variar el coste del estado de hospitalización (ya sea reduciendo el número de hospitalizaciones o su duración) o reducir a tasas despreciables la posibilidad de complicaciones graves que requieran reintervención y estancias hospitalarias largas. En el caso de los pacientes con cardiopatía de origen no isquémico, la modificación de un único parámetro no mostró una interpretación económicamente favorable al uso del DAI por debajo de un umbral de 25.000 euros/AVAC.
Resultados del análisis de sensibilidad univariante (diagrama de tornado) en pacientes con cardiopatía isquémica (A), con cardiopatía no isquémica (B) y tipo DANISH menores de 65 años (C). El valor central del diagrama es el resultado del caso base, y se observa a derecha e izquierda el impacto de la variación de parámetros al alza o a la baja. Además se señala como referencia el valor de la disponibilidad a pagar de 25.000 euros/AVAC. AVAC: año de vida ajustado por calidad; DAI: desfibrilador automático implantable; EV: evaluación; IC: insuficiencia cardiaca; RCEI: razón de coste-efectividad incremental; TMC: tratamiento médico convencional; WTP: willingness to pay (umbral de disponibilidad a pagar en euros/AVAC).
La presente evaluación económica desde la perspectiva del SNS arroja resultados parecidos a los obtenidos en la última evaluación en nuestro contexto realizada en 201119, pero con diferencias explicables por la actualización de los datos de eficacia, el consumo de recursos y los costes. El implante de DAI para prevención primaria en pacientes con cardiopatía isquémica resulta en una discreta ganancia en AVAC (1,15 para un horizonte temporal de 40 años) a un mayor coste (22.170 euros), con un RCEI de 19.278 euros/AVAC. El implante de DAI en pacientes con disfunción ventricular no debida a cardiopatía isquémica representa una menor ganancia en AVAC (0,82) a un mayor coste (26.245 euros), con un RCEI de 32.006 euros/AVAC, por encima de un umbral de 25.000 euros/AVAC. Sin embargo, el resultado en pacientes con disfunción ventricular no isquémica sería más favorable al DAI, según los datos del estudio DANISH, en pacientes más jóvenes (menores de 68 años), en los que el beneficio obtenido es algo mayor (diferencia de AVAC, 1,22) y se obtiene un RCEI cercano al umbral de 25.000 euros, de 24.142 euros/AVAC.
La selección del umbral de disposición a pagar de 25.000 euros/AVAC38 se hizo basándose en el único estudio empírico en nuestro ámbito y aceptado como referencia por la Red de Agencias de Evaluación de Tecnologías de España. Sin embargo, hay que señalar que el coste-efectividad del DAI en pacientes con disfunción ventricular de origen no isquémico se encontraría alrededor del umbral más comúnmente aceptado hasta hace poco en nuestro ámbito, de 30.000 euros/AVAC.
Las diferencias con respecto a la evaluación del 2011 radican casi exclusivamente en diferencias en el coste incremental. La ganancia de AVAC fue también discreta y muy parecida a la obtenida en el presente estudio, 0,95 en el subgrupo de pacientes isquémicos y 0,79 en el subgrupo de pacientes no isquémicos; mientras que el incremento del coste estimado fue mayor, 36.376 euros en pacientes isquémicos (RCEI, 38.371) y 52.694 euros en pacientes no isquémicos (RCEI, 52.694 euros). Esta diferencia en el coste es atribuible principalmente a la reducción del coste del dispositivo y al alargamiento de la vida media de los generadores. Dicha diferencia en el coste entre pacientes isquémicos y no isquémicos es atribuible principalmente a las diferencias en la probabilidad de muerte, que implican una mayor supervivencia del paciente no isquémico y, por lo tanto, un mayor coste acumulado en el seguimiento.
A la vista de la distribución del RCEI en el subgrupo de pacientes con disfunción ventricular de origen no isquémico según edad, existe una amplia proporción de enfermos con poca probabilidad de beneficio con el DAI, y para ellos deberían considerarse decisiones valorando que el coste de oportunidad de implantar un DAI es elevado. Aun así, en este perfil de pacientes, en los que todavía existe incertidumbre, se deberían concentrar esfuerzos para mejorar y facilitar la indicación individualizada. Existen modelos de predicción en los que otros factores, además de la FE, tienen demostrado valor predictivo del riesgo de muerte súbita, como son el diámetro telediastólico ventricular izquierdo, la inducción de taquicardia ventricular en el estudio electrofisiológico, la presencia de taquicardia ventricular no sostenida espontánea, el bloqueo de rama izquierda, la fragmentación del QRS42 y, sobre todo, la presencia, la localización y la extensión de fibrosis miocárdica43. Promover el empleo de estos modelos u otros que permitan la predicción diferencial de los riesgos de muerte súbita y no súbita para determinar en qué perfil de pacientes el implante profiláctico del DAI sería más beneficioso permitiría aumentar el beneficio en salud obtenido por cada euro invertido.
Asimismo, es importante tener en cuenta las preferencias de los pacientes en distintas circunstancias. Por ejemplo, en este análisis, como en otros, no se han tenido en cuenta los recambios al final de la vida o los casos en que se agota el generador sin que el paciente haya recibido ninguna descarga. En ambos casos, la necesidad de recambio debería valorarse de nuevo en función de su nueva expectativa de vida y sus preferencias.
LimitacionesLa estimación del coste-utilidad se basa en un modelo de decisión y, por lo tanto, su validez depende de la validez de los supuestos del modelo y sus parámetros. En último término, la validez del modelo depende de las fuentes de evidencia científica que han servido para estimar sus parámetros. La principal motivación de este estudio es añadir la evidencia actualizada desde 2011, tanto sobre eficacia como sobre costes y tasas de complicaciones. La evidencia sobre eficacia clínica se actualizó mediante revisión sistemática y metanálisis, incorporando el ensayo DANISH en el subgrupo de pacientes con disfunción ventricular de origen no isquémico. La evidencia sobre efectividad en pacientes con cardiopatía isquémica sigue siendo la misma que en 2011, por lo que puede reflejar una situación que no es totalmente acorde con la práctica clínica actual.
Asimismo, el uso de recursos y costes se basa en la opinión de expertos, el proceso asistencial y la contabilidad analítica de un solo centro, aunque pensamos que los datos reflejan mejor la realidad que los obtenidos de tarifas o de la literatura. La validez externa de la estimación del coste del dispositivo es más limitada puesto que a menudo el coste final fijado depende de la negociación del centro proveedor con la industria. En nuestra aproximación se ha optado por la opción más económica (generador monocameral de un proveedor específico), pero se han realizado análisis de sensibilidad para otros supuestos.
Aunque hay una proporción de casos en los que se implanta un dispositivo bicameral (el 14% según el registro de la SEC), se asumió que este porcentaje es menor en la indicación para prevención primaria.
Otra limitación importante es que no se ha realizado la comparación del DAI con DAI con terapia de resincronización cardiaca en los pacientes para quienes se indica el paso a dicha terapia debido a la progresión de la insuficiencia cardiaca. Hay controversia sobre si el beneficio esperable del DAI es mayor en pacientes sin indicación de TRC que en pacientes con indicación44, por lo que deberían desarrollarse modelos económicos en cuya estructura se incorpore esta posibilidad, pero requeriría obtener datos más sólidos sobre eficacia y efectividad, eventos adversos y calidad de vida en estos pacientes. Tampoco se ha tenido en cuenta la aparición de nuevas alternativas de tratamiento farmacológico como el sacubitrilo-valsartán, con eficacia demostrada y potencialmente más coste-efectivo que el DAI45,46, por lo que a la larga el número de potenciales candidatos a DAI podría verse reducido. Tampoco se han incluido en el seguimiento las consecuencias a largo plazo que pueden tener un peso distinto entre pacientes portadores y no portadores de DAI, como la posibilidad de recibir un trasplante o un dispositivo de asistencia ventricular.
CONCLUSIONESLa eficiencia del DAI monocameral ha mejorado en la última década y resulta coste-efectivo en pacientes con disfunción ventricular izquierda de origen isquémico y no isquémico menores de 68 años considerando una disposición a pagar 25.000 euros/AVAC. En pacientes no isquémicos mayores, el RCEI se sitúa alrededor de los 30.000 euros/AVAC.
- –
El DAI en prevención primaria, comparado con el tratamiento farmacológico convencional, mejora la supervivencia de los pacientes con insuficiencia cardiaca de origen isquémico y no isquémico con FE ≤ 35%.
- –
El empleo profiláctico de DAI representa más de la mitad de todas las indicaciones, y es la indicación que más crece en los pacientes con miocardiopatía dilatada.
- –
En una evaluación realizada en 2011, el DAI resultó coste-efectivo para prevención primaria en pacientes con miocardiopatía dilatada de origen isquémico con criterios del ensayo MADIT, pero no en pacientes con los criterios del MADIT II o con miocardiopatía dilatada de origen no isquémico.
- –
Considerando una disposición a pagar 25.000 euros/AVAC, el DAI resulta coste-efectivo para los pacientes con disfunción ventricular izquierda de origen isquémico.
- –
El implante de DAI en pacientes con disfunción ventricular no debida a cardiopatía isquémica representa una menor ganancia en AVAC a un mayor coste y solamente resultaría coste-efectivo por debajo del umbral de 25.000 euros/AVAC en pacientes más jóvenes (menores de 68 años), que obtienen mayor beneficio.
Este estudio ha sido financiado por el Ministerio de Sanidad, Consumo y Bienestar Social en el marco del desarrollo de las actividades del Plan Anual de Trabajo de la Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del SNS (año 2018).
CONTRIBUCIÓN DE LOS AUTORESA. Ribera, E. Giménez y G. Oristrell han elaborado el primer borrador del artículo. E. Giménez y J.R. Marsal han realizado la modelización económica. A. Ribera, J.R. Marsal, D. Osorio y M. Ballesteros han realizado el metanálisis. A. Ribera, J.R. Marsal, D. Osorio, M. Ballesteros, E. Ródenas, Y. Belahnech y R. Escalona han realizado la revisión de resúmenes y artículos a texto completo para extraer la información para la revisión sistemática. G. Oristrell, N. Rivas, I. Roca-Luque e I. Ferreira-González han participado como comité de expertos clínicos en la determinación de los parámetros del modelo económico. L. García-Pérez desarrolló el modelo económico inicial y ha participado en su adaptación actual. A. Ribera, I. Ferreira-González y M. Espallargues han promovido el estudio y participado en la obtención de financiación para su realización. Todos los autores han contribuido sustancialmente a la interpretación de los resultados obtenidos tanto en la fase de revisión sistemática y metanálisis como en la modelización económica. Todos los autores han revisado críticamente las distintas versiones del borrador y han aportado contenido intelectual importante.
CONFLICTO DE INTERESESN. Rivas ha recibido honorarios de Abbott y de Boston-Scientific, sin relación con el trabajo presentado. I. Roca-Luque ha recibido honorarios de de Abbot, Medtronic y Boston, sin relación con el trabajo presentado. E. Ródenas ha recibido una beca no condicionada de Biotronik, sin relación con el trabajo presentado.