El exceso de volumen en la insuficiencia cardiaca explica la mayoría de los síntomas y signos, y está relacionado con la progresión de la enfermedad. Es un fenómeno complejo que va más allá del incremento de presiones intravasculares, lo que dificulta su correcto diagnóstico y supone un gran reto terapéutico. En la actualidad, se recomienda un abordaje multiparamétrico que incluya datos clínicos (síntomas y signos), pruebas de imagen y biomarcadores. El presente artículo propone un enfoque terapéutico práctico de la sobrecarga hidrosalina en la insuficiencia cardiaca tanto en el ámbito hospitalario como en el ambulatorio. Este documento es una iniciativa de la Sociedad Española de Medicina Interna (SEMI) en colaboración con la Sociedad Española de Cardiología (SEC) y la Sociedad Española de Nefrología (S.E.N.).
Palabras clave
Este documento es una iniciativa de la Sociedad Española de Medicina Interna en colaboración con la Sociedad Española de Cardiología y la Sociedad Española de Nefrología. Se formó un grupo de 18 expertos en el tratamiento de pacientes con insuficiencia cardiaca (IC) (seis internistas, seis cardiólogos y seis nefrólogos), coordinado por un clínico de cada especialidad. Se seleccionó los temas principales y se distribuyó entre tres grupos de trabajo, cada uno de ellos con seis miembros, dos de cada especialidad. El grado de recomendación del documento sigue las directrices de las guías de práctica clínica1. Se evaluó, discutió y validó, por parte del grupo de expertos, los aspectos en los que no había recomendación al respecto según las guías de práctica clínica.
INTRODUCCIÓNLa expansión de volumen es un componente central en la definición del empeoramiento de la IC2. Aunque la mayoría de los pacientes con IC experimentan mejoría clínica cuando reciben diuréticos, la respuesta es heterogénea, por lo que es esencial profundizar en la fisiopatología del exceso de volumen para optimizar e individualizar su tratamiento2,3.
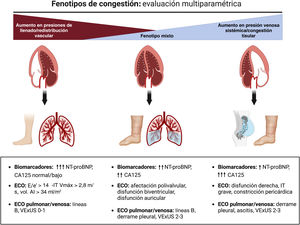
La evidencia actual sugiere que la sobrecarga hidrosalina presenta una gran diversidad en cuanto a gravedad, cantidad y distribución3. Ello se debe a su compleja fisiopatología, con múltiples y entrelazados mecanismos: anatomía y función cardiacas, cambios en la capacitancia venosa sistémica y pulmonar, función de barrera endotelial vascular, activación neurohormonal, interacción entre las presiones hidrostática y oncótica en los compartimentos capilar e intersticial, e integridad y distensibilidad del sistema linfático3. Todo lo anterior puede resultar en una desconexión entre la sobrecarga de presión y la de volumen, y dar lugar a diferentes patrones clínicos y hemodinámicos4. Así, en unos pacientes predomina la redistribución de volumen desde el territorio vascular esplácnico al pulmonar, mientras que en otros es la sobrecarga hidrosalina endovascular/intersticial. Una visión actualizada de la congestión/expansión de volumen obliga a una clasificación más exhaustiva en función del inicio (agudo frente a crónico), la distribución regional (sistémica frente a pulmonar), el compartimento de distribución (endovascular frente a intersticial), y la distinción entre clínica y subclínica5. Una óptica identificación de estos fenotipos mediante un abordaje multiparamétrico seguramente permitirá un mejor tratamiento de la IC3 (figura 1). Este enfoque, además, permitirá detectar esa congestión residual o subclínica que puede estar presente al alta hospitalaria o tras un tratamiento inicial durante una descompensación ambulatoria, y que implica un peor pronóstico para el paciente, tanto de mortalidad como de reingresos por IC. El abordaje multiparamétrico de la descongestión, complementando los signos y síntomas principalmente con la ecografía a pie de cama y parámetros analíticos (péptidos natriuréticos, antígeno carbohidrato 125, hematocrito), ha ayudado en su detección y tratamiento. Además, el tratamiento guiado por antígeno carbohidrato 125 durante la hospitalización y a nivel ambulatorio ha demostrado mejorar el pronóstico de nuestros pacientes. La ecografía pulmonar también podría ayudarnos a guiar el tratamiento en pacientes con insuficiencia cardiaca aguda (ICA), como se ha observado en ensayos clínicos aleatorizados6,7. Así pues, consideramos que los parámetros ecográficos y analíticos de descongestión podrían ser herramientas útiles para minimizar la congestión residual y guiar el tratamiento depletivo de nuestros pacientes3,5 (figura 2).
Fenotipos de sobrecarga hidrosalina. Evaluación multiparamétrica. CA125: antígeno carbohidrato 125; ECO: ecografía; IT: insuficiencia tricuspídea; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral tipo B; VExUS: ecografía de exceso venoso; Vmáx: volumen máximo; vol. AI: volumen de la aurícula izquierda.
El objetivo de este documento es resumir las recomendaciones, basadas en la evidencia científica y en la opinión de un panel de expertos, sobre el tratamiento de la sobrecarga hidrosalina, tanto en el ámbito hospitalario como en el ambulatorio, proponiendo un enfoque terapéutico práctico desarrollado por un panel de expertos de la Sociedad Española de Medicina Interna, la Sociedad Española de Cardiología y la Sociedad Española de Nefrología.
TRATAMIENTO DE LA SOBRECARGA HIDROSALINADiuréticos de asaLos diuréticos de asa constituyen la principal línea de tratamiento del exceso de volumen en la IC2. Furosemida es el fármaco más utilizado de esta familia, pero presenta una biodisponibilidad muy variable y errática por vía oral (v.o.)2. Por ello, fármacos con un mejor perfil teórico, como bumetanida o torasemida, podrían ofrecer ventajas. Sin embargo, los resultados del estudio TRANSFORM-HF no mostraron diferencias en los beneficios clínicos a largo plazo entre furosemida y torasemida8.
La mayor evidencia disponible hasta la fecha sobre la dosificación de diuréticos de asa en ICA la sustenta el estudio DOSE-HF9, en el que se compararon dos estrategias diferentes: por un lado, furosemida intravenosa (i.v.) en 2 bolos diarios frente a perfusión continua, y por otro, dosis bajas (equivalentes a la dosis oral previa del paciente) o altas (2,5 veces la dosis oral previa) de furosemida. En la comparación entre el bolo y la infusión continua, no hubo diferencias significativas en la evaluación global de síntomas ni en el cambio medio de los valores de creatinina. La estrategia de dosis altas se asoció a una tendencia no significativa a la mejoría de los síntomas, mayor diuresis, disminución de peso y pérdida neta de fluidos a las 72h, a expensas de un empeoramiento transitorio de la función renal9.
Vía de administraciónEn pacientes con ICA, la recomendación actual es utilizar un tratamiento escalonado y progresivo de diuréticos i.v. en función de la respuesta diurética, empezando con dosis altas i.v. (2 veces la dosis diaria basal oral), e ir reduciendo progresivamente hasta alcanzar la dosis mínima eficaz por v.o.2.
Además de las v.o. e i.v., también se dispone de la opción subcutánea (s.c.). Un pequeño ensayo clínico realizado en pacientes con ICA tratados de forma ambulatoria mostró que no se observaron diferencias significativas en la diuresis a las 6h entre la vía i.v. y la s.c., utilizando una nueva formulación de furosemida s.c. con pH neutro10.
También se ha constatado beneficio con furosemida convencional en estudios observacionales11,12.
Diuréticos tiacídicosLas tiacidas inhiben el cotransportador de sodio-cloruro en el túbulo contorneado distal2, eliminando agua y sodio en menor medida que los diuréticos de asa, ya que actúan en segmentos distales de la nefrona. El aumento compensatorio de la reabsorción de sodio y agua en segmentos distales por los diuréticos de asa es la razón por la que las tiacidas podrían desempeñar un papel en situaciones de resistencia a estos. Los resultados del reciente estudio CLOROTIC respaldan esta hipótesis13. En este estudio, se aleatorizó a 230 pacientes hospitalizados por ICA a pasar de recibir tratamiento con 80mg o más de furosemida v.o. a hidroclorotiacida (HCTZ) o placebo, además de un régimen protocolizado de furosemida i.v. Los pacientes que recibieron HCTZ experimentaron una mayor pérdida de peso y descongestión a las 72h, a expensas de más hipopotasemia y deterioro de la función renal, aunque, al igual que en el estudio DOSE-HF9, este hecho no se tradujo en un peor pronóstico11, a pesar de que el estudio no se diseñó ni tuvo potencia para analizar este efecto. De forma reciente, un subestudio del CLOROTIC muestra que el tratamiento diurético combinado con tiacidas es eficaz y seguro en todo el espectro de la función renal14.
AcetazolamidaAcetazolamida (ACZ) es un diurético que actúa en el tubo contorneado proximal bloqueando la enzima anhidrasa carbónica, involucrada en la conversión del dióxido de carbono y agua en ácido carbónico2. Se ha evaluado el tratamiento con ACZ pacientes con ICA congestiva refractaria a tratamiento diurético2. La evidencia más sólida y reciente proviene del ensayo clínico ADVOR, que aleatorizó a 519 pacientes con ICA y evidencia de sobrecarga hídrica15. En este estudio, la adición de ACZ i.v. al tratamiento con diuréticos de asa resultó en una mayor descongestión, natriuresis y diuresis a corto plazo, aunque no redujo las hospitalizaciones y mortalidad a corto plazo15. De este modo, ACZ i.v. (500mg/día) podría considerarse en pacientes con ICA junto con tratamiento intensivo con diuréticos de asa.
Antagonistas de los receptores mineralocorticoidesEl efecto de los antagonistas de los receptores mineralocorticoides (ARM) sobre la respuesta diurética en la ICA es controvertido2,16. El principal ensayo de ARM en ICA, el ATHENA-HF16, mostró resultados neutros. Aleatorizó a 360 pacientes a recibir espironolactona (100mg/día) frente a placebo o dosis bajas (12,5 o 25mg/día) durante 96h, junto con un diurético de asa. Aunque no se registró episodios adversos, no hubo diferencias en valores de la fracción aminoterminal del propéptido natriurético cerebral tipo B (NT-proBNP), parámetros de eficacia diurética, mortalidad o descompensación de la IC. Una posible explicación es la conversión lenta de la espironolactona a sus metabolitos activos, y que se trató a un 25% de los pacientes del grupo placebo con 25 mg de espironolactona16. En un estudio no aleatorizado donde se comparó la eficacia natriurética y diurética en pacientes con ICA y fracción de eyección del ventrículo izquierdo ≥ 50% que recibían diuréticos de asa i.v., la administración de clortalidona frente a espironolactona se asoció a una mayor natriuresis y diuresis a corto plazo17.
De este modo, se podría considerar los ARM, además de en los pacientes con disfunción ventricular izquierda (fracción de eyección del ventrículo izquierdo <40%), en aquellos con resistencia diurética pese a recibir tratamiento combinado con dosis optimizadas de diurético de asa, tiacidas o diuréticos proximales, fundamentalmente en presencia de hipopotasemia.
AcuaréticosTolvaptán es un antagonista directo del receptor de la vasopresina 2. En la ICA, se ha evaluado este fármaco, en dosis de 30mg v.o., en tres ensayos clínicos: el EVEREST18, el TACTICS-HF19 y el SECRET-HF20. Sobre tratamiento diurético estándar, en todos ellos tolvaptán consiguió una reducción de peso y una diuresis significativamente superiores a las del placebo a corto plazo. Sin embargo, su uso no se tradujo en beneficios de mortalidad o rehospitalización a medio o largo plazo18. Un subestudio del EVEREST sugiere un incremento significativo de los valores de sodio plasmático, y una mayor descongestión y reducción de episodios adversos clínicos en pacientes con hiponatremia21. Es un fármaco seguro que no produce cambios hemodinámicos significativos, y que puede administrarse de forma segura y eficaz en pacientes con enfermedad renal avanzada22. En pacientes con ICA tratados con un régimen diurético intensivo, la adición de tolvaptán podría ser una opción terapéutica cuando coexista hiponatremia.
Por último, la urea oral (15-30 g) es un fármaco con propiedades acuaréticas reconocidas23. Si bien se podría considerar una opción acuarética, se necesita estudios de intervención específicos en pacientes con IC.
Inhibidores del cotransportador de sodio-glucosa tipo 2Más allá de los beneficios cardiorrenales de los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2)24–29, su papel como diurético no parece tan relevante. Estos fármacos ejercen un efecto natriurético moderado y acuarético predominante30. Su eficacia en la ICA viene sustentada por varios ensayos clínicos cuyos objetivos primarios eran analizar el efecto de los iSGLT2 en el pronóstico, con un interés residual en su efecto diurético. El ensayo SOLOIST-WHF, que solo incluyó pacientes diabéticos, es el mayor estudio hasta la fecha que evaluó la eficacia y seguridad de sotagliflozina frente a placebo31. Este estudio mostró que sotagliflozina, iniciada antes o poco después del alta hospitalaria, resultó en un buen perfil de seguridad y un número significativamente menor de muertes por causas cardiovasculares, hospitalizaciones y visitas urgentes por IC en comparación con placebo31. El estudio EMPULSE comparó empagliflozina 10 mg/día frente a placebo en pacientes con ICA inicialmente estabilizada32. Este estudio mostró que se toleró bien el inicio de empagliflozina en este contexto, que resultó en un beneficio clínico neto significativo en los 90 días posteriores al comienzo del tratamiento32.
El estudio más importante hasta la fecha que analiza el efecto diurético de los iSGLT2 en el escenario agudo es el DAPA-RESIST33, que comparó dapagliflozina 10mg/día frente a metolazona 5-10 mg una vez al día durante un periodo de tratamiento de 3 días en pacientes hospitalizados por ICA y resistentes al tratamiento con furosemida i.v., aleatorizados antes de las 24 h de su estancia hospitalaria. El criterio de valoración principal (cambio de peso) no difirió a 5 días33, si bien se requirió una dosis total más alta de furosemida en el grupo de dapagliflozina, con una eficacia diurética menor que en el de metolazona, con un buen perfil de seguridad para dapagliflozina y menos alteraciones bioquímicas (función renal, sodio y potasio).
Con la evidencia disponible, se recomienda que, salvo contraindicación, todos los pacientes con IC crónica y aguda sean subsidiarios de tratamiento con iSGLT2. En fase aguda, con la evidencia disponible, podrían iniciarse desde las primeras horas de la reagudización, no por su potencia diurética, sino por sus beneficios en el pronóstico.
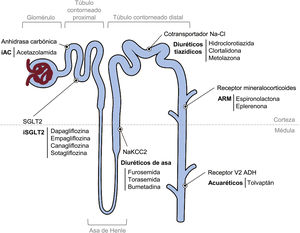
Se recoge el conjunto de los fármacos mencionados y sus propiedades en la tabla 1 del material adicional, y se representa en la figura 3.
Mecanismos de acción y niveles en los que actúan los diferentes fármacos. ADH: vasopresina; ARM: antagonistas de los receptores mineralocorticoides; iAC: inhibidores de la anhidrasa carbónica; iSGLT2: inhibidores del cotransportador sodio-glucosa tipo 2; Na-Cl: sodio-cloro; NaKCC2: cotransportador sodio, potasio, dos cloros.
La refractariedad al tratamiento diurético se asocia a un mayor riesgo de mortalidad y lesión renal aguda2,3. Es común en pacientes con fenotipo de congestión tisular predominante, donde sería teóricamente apropiado incrementar el transporte de sodio y agua al espacio endovascular.
Un ensayo clínico doble ciego que incluyó a 94 pacientes con IC refractaria con disfunción sistólica del ventrículo izquierdo34 comparó dosis altas de furosemida i.v. (500-1.000 mg/día) con las mismas dosis de furosemida más infusión de suero salino hipertónico (SSH). Los autores mostraron una mayor pérdida de peso, mayor reducción de péptidos natriuréticos, estancia hospitalaria más corta y menor riesgo de reingreso a 30 días en el grupo tratado con SSH34. El ensayo clínico SMAC-HF35, que incluyó a 1.927 pacientes con ICA, fracción de eyección del ventrículo izquierdo reducida y clase funcional iii de la New York Heart Association, mostró que los pacientes que recibieron SSH durante la hospitalización presentaron una mejor diuresis y reducción de la estancia hospitalaria, reingresos y mortalidad a 57 meses frente a aquellos que recibieron placebo, lo que demostró seguridad clínica35. Las limitaciones de este tratamiento son la necesidad de emplear dosis muy elevadas de furosemida y la heterogeneidad en la concentración de cloruro sódico utilizado, que va desde el 1,4 hasta el 7,5%. Esto sugiere que esta estrategia se debe reservar para pacientes con congestión refractaria que reciban tratamiento diurético intensivo.
Técnicas de ultrafiltración extracorpórea y diálisis peritoneal continua ambulatoriaLas guías europeas de práctica clínica más recientes recomiendan utilizar el tratamiento renal sustitutivo en pacientes con resistencia diurética y persistencia de la sobrecarga hidrosalina o con marcado deterioro de la función renal (clase de recomendación iia)1.
La ultrafiltración (UF) implica eliminar agua plasmática mediante una membrana semipermeable con gradiente de presión transmembrana36. Se puede realizar mediante las técnicas convencionales de hemofiltración, hemodiálisis y diálisis peritoneal, o con dispositivos de UF con acceso venoso periférico. Entre las potenciales ventajas de la UF, comparada con los diuréticos, destaca la mayor eliminación de sodio debido a un ultrafiltrado isotónico con el plasma (134-138 mmol/l de ultrafiltrado), en comparación con la eliminación de líquido hipotónico producida por los diuréticos, y una tasa de eliminación de líquido más controlada36. Un reciente metanálisis que incluye los principales ensayos clínicos que comparan ambas estrategias concluye que la UF es segura, pero no disminuye el riesgo de mortalidad ni de rehospitalización37.
Otra opción de UF para el abordaje más a largo plazo de la IC congestiva refractaria al tratamiento diurético es la diálisis peritoneal continua ambulatoria. En IC refractaria, ha mostrado beneficios clínicos, funcionales y pronósticos a largo plazo38. Sin embargo, no hay estudios aleatorizados al respecto.
Inótropos y vasopresoresEstos grupos farmacológicos se reservan para situaciones en los que la sobrecarga hidrosalina se acompañe de hipoperfusión periférica. Según las recomendaciones de las guías de práctica clínica, se puede considerar los inótropos en pacientes con presión arterial sistólica <90mmHg y evidencia de hipoperfusión que no responden al tratamiento estándar, para mejorar la perfusión periférica y mantener la función de los órganos (clase iib, nivel de evidencia C)1. Se podría considerar los vasopresores en pacientes con shock cardiogénico para aumentar la presión arterial y mantener la perfusión de los órganos vitales (clase iib, nivel de evidencia B)1.
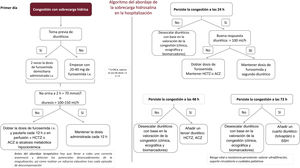
ALGORITMO TERAPÉUTICO DE LA SOBRECARGA HIDROSALINA EN LA INSUFICIENCIA CARDIACA AGUDAPaciente hospitalizadoEl tratamiento de la sobrecarga hidrosalina del paciente hospitalizado por ICA requiere una adecuada aproximación diagnóstica y etiológica (sobrecarga hídrica o redistribución vascular), una correcta valoración de la situación renal y hemodinámica sistémica, y un conocimiento de las distintas opciones terapéuticas.
En los casos en los que predomine la sobrecarga hidrosalina, se deberá administrar un tratamiento diurético intensivo, mientras que, si predomina la redistribución vascular, el tratamiento diurético tendría que ser menos intensivo, combinándose con vasodilatadores2 (tabla 2 del material adicional). En situaciones clínicas que se acompañen de hipoperfusión tisular, se debe valorar la prescripción de inótropos o vasopresores1 (tabla 2 del material adicional).
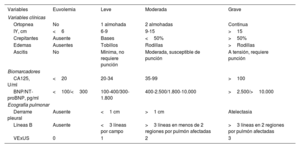
En primer lugar, se debe establecer la gravedad de la sobrecarga hidrosalina del paciente (tabla 1), y conocer si este recibe o no tratamiento diurético de forma basal y en qué dosis. La escala puntúa de 0 a 3 cada una de las 10 variables, siendo el puntaje total de 30. Para considerar la sobrecarga hidrosalina moderada o grave, se requiere la presencia de, al menos, un valor máximo de cada categoría (clínica, biomarcadores y ecográfica). El objetivo del tratamiento debe ser intentar alcanzar la euvolemia del paciente, aplicando la escala de evaluación de la sobrecarga hidrosalina (tabla 1), siendo un valor ≤ 4 el recomendable.
Grados de sobrecarga hidrosalina según un abordaje multiparamétrico
| Variables | Euvolemia | Leve | Moderada | Grave |
|---|---|---|---|---|
| Variables clínicas | ||||
| Ortopnea | No | 1 almohada | 2 almohadas | Continua |
| IY, cm | <6 | 6-9 | 9-15 | >15 |
| Crepitantes | Ausente | Bases | <50% | >50% |
| Edemas | Ausentes | Tobillos | Rodillas | >Rodillas |
| Ascitis | No | Mínima, no requiere punción | Moderada, susceptible de punción | A tensión, requiere punción |
| Biomarcadores | ||||
| CA125, U/ml | <20 | 20-34 | 35-99 | >100 |
| BNP/NT-proBNP, pg/ml | <100/<300 | 100-400/300-1.800 | 400-2.500/1.800-10.000 | >2.500/>10.000 |
| Ecografía pulmonar | ||||
| Derrame pleural | Ausente | <1 cm | >1 cm | Atelectasia |
| Líneas B | Ausente | <3 líneas por campo | >3 líneas en menos de 2 regiones por pulmón afectadas | >3 líneas en 2 regiones por pulmón afectadas |
| VExUS | 0 | 1 | 2 | 3 |
BNP: péptido natriurético cerebral; CA125: antígeno carbohidrato 125; IY: ingurgitación yugular; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral tipo B; VExUS: ecografía de exceso venoso.
El diurético fundamental para el abordaje inicial de la sobrecarga hidrosalina es furosemida por vía i.v.1,2,39 (clase i, nivel de evidencia B). En pacientes a los que no se ha tratado previamente con diuréticos, la dosis inicial idónea es de 20-40mg de furosemida i.v. en bolo1,2,39. En el caso contrario, los pacientes deberán recibir el doble de la dosis que toman habitualmente1,2,39. Se debe tener en cuenta que los pacientes con enfermedad renal crónica, especialmente aquellos con estadios más avanzados (filtrado glomerular estimado <30 ml/min/1,73 m2), van a presentar concentraciones tubulares de diurético más bajas, con la consiguiente menor respuesta, por lo que la dosis inicial debe ser entre 2 y 3 veces superior a la de los pacientes con función renal normal2.
Antes de administrar el bolo de furosemida es recomendable que el paciente miccione y vacíe la vejiga. Inmediatamente después se le debe administrar el bolo de furosemida, y extraer una muestra de orina a las 2 h, con el fin de analizar los valores de sodio en orina1. Valores de sodio en orina <70 mmol/l sugieren una respuesta diurética insuficiente a la dosis inicial administrada1,2,40. También debemos evaluar la diuresis a las 6 h, considerando una escasa respuesta diurética valores <100-150ml/h2. Si el sodio urinario a las 2h es <70 mmol/l o la diuresis a las 6h es <100ml/h, se recomienda duplicar la dosis de furosemida en bolo, que se administrará cada 12 h (también se puede iniciar una perfusión continua con la dosis total diaria, sin exceder los 400-600mg/día), siendo estas medidas prioritarias en los pacientes con disfunción renal2. El ensayo clínico PUSH-AHF mostró que el tratamiento depletivo guiado por el sodio urinario frente al abordaje estándar se tradujo en una mayor natriuresis y diuresis, sin obtener diferencias en episodios clínicos (mortalidad total u hospitalizaciones por IC) a los seis meses41.
Bloqueo secuencial de la nefronaSe recomienda añadir un segundo diurético de forma precoz, principalmente si la sobrecarga hídrica es muy patente, el paciente lleva ya tratamiento previo con altas dosis de diuréticos de forma basal y no ha respondido de forma adecuada al bolo inicial1. En este escenario, podemos emplear diuréticos de acción distal, como HCTZ o clortalidona (no hay evidencia basada en ensayos para clortalidona), o de acción proximal, como ACZ i.v. (si no es posible su administración i.v., la administraremos v.o., con menor evidencia). Se recomienda priorizar una tiacida en pacientes con tratamiento previo con furosemida ambulatoria a dosis ≥ 80mg/día13 y en ausencia de hiponatremia. Se recomienda priorizar ACZ en pacientes tratados con dosis basales más bajas de furosemida ambulatoria, y con valores elevados de bicarbonato e hipocloremia15,41. Es recomendable dar suplementos de potasio v.o. a los pacientes tratados con tiacidas, principalmente a aquellos con valores de potasio en plasma <4 mmol/l, teniendo precaución en los que tienen deterioro de la función renal.
La evaluación de la respuesta diurética se realizará de nuevo a las 24 horas2. Debería incluir la evolución clínica, diuresis, ecografía y biomarcadores. Si no hay mejoría clínica y la diuresis es <100 ml/h, se debe doblar la dosis de furosemida i.v. manteniendo el segundo diurético13,15. Si la evolución clínica y el ritmo de diuresis son adecuados (> 100ml/h), se debe mantener el tratamiento pautado. A las 48 h, haremos una evaluación multiparamétrica de la congestión. En caso de mejoría o resolución de la congestión, se procederá a una desescalada en el tratamiento depletivo. Si, por el contrario, la respuesta no es satisfactoria, se recomienda asociar un tercer diurético (tiacida o ACZ, según la elección inicial).
A las 72 h, realizaremos una nueva evaluación y repetiremos los mismos procedimientos.
En caso de persistencia de la sobrecarga hídrica, se podría considerar un cuarto diurético (acuarético) o el tratamiento diurético intensivo más infusión de SSH. Ambas estrategias serán prioritarias en el caso de hiponatremia, evitando en esta situación el empleo de tiacidas.
Cabe resaltar que los pacientes hospitalizados en tratamiento i.v. depletivo deben tener un control de constantes y balance hídrico cada 8 h, con control de peso diario, sin ser precisa una restricción estricta de sal y agua.
Si, tras tomar todas estas medidas y descartar otras causas corregibles de refractariedad, como bajo gasto o transgresión dietética durante el ingreso, el paciente aún presenta datos de sobrecarga de volumen que no se han resuelto o riesgo vital, se debe plantear el uso de técnicas de UF1,37,42. En caso de que el paciente no sea subsidiario de estos tratamientos agresivos, se aplicará medidas paliativas orientadas a disminuir los síntomas.
La figura 4 recoge el algoritmo de hospitalización expuesto.
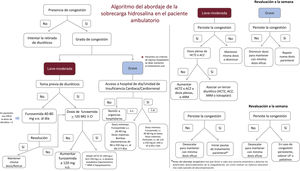
Paciente ambulatorioLa evidencia sobre el tratamiento de la sobrecarga hídrica en el ámbito ambulatorio es menor. En primer lugar, habrá que establecer la gravedad, y distribución regional y compartimental del exceso hídrico de cada paciente utilizando un abordaje multiparamétrico (figura 1). En pacientes que no muestren datos de exceso de volumen o congestión, se recomienda prescribir a la baja el tratamiento diurético de forma gradual, y solo plantear la retirada en aquellos euvolémicos que hayan permanecido al menos seis meses sin ninguna descompensación y con tratamiento diurético oral estable (40-80mg de furosemida) (clase i, nivel de evidencia B)1,43. Es muy importante la educación y empoderamiento del paciente en el abordaje del esquema diurético ambulatorio.
Siguiendo el esquema del paciente hospitalizado, en el ambulatorio también deberemos diferenciar si la sobrecarga hidrosalina es leve, moderada o grave. Para ello, debemos emplear puntuaciones de congestión que incluyan variables clínicas, biomarcadores y pruebas de imagen (tabla 1).
Los diuréticos de asa son los primeros fármacos que emplear2, sabiendo que hay que ajustar la dosis según la exposición previa a estos y la situación clínica del paciente1.
En pacientes con congestión leve o moderada sin tratamiento diurético previo, iniciaremos tratamiento con furosemida v.o. a dosis de 40-80mg/día y lo revaluaremos en una semana. Si el paciente ya tomaba diuréticos, aumentaremos la dosis de furosemida hasta 120mg/día v.o., repartidos en 2 tomas. En el caso de que ya esté tomando ≥ 120mg de furosemida v.o. al día, bloquearemos la nefrona a otros niveles, añadiendo un segundo diurético (HCTZ, ACZ o ARM). Deberá ajustarse la dosis de HCTZ a la función renal (filtrado glomerular estimado >50ml/min/1,73 m2: 25mg día; 20-50ml/min/1,73 m2: 50mg día y <20ml/min/1,73 m2: 100mg/día)13,14. La dosis inicial de ACZ será de 250mg/día v.o., siendo la dosis máxima de 500mg/día v.o.44. Se priorizará el empleo de tiacidas como segundo diurético, excepto en los pacientes con alcalosis metabólica hipoclorémica, para los que la ACZ es la primera opción45. En caso de hipopotasemia asociada, se puede valorar los ARM como ahorradores de potasio.
Ante una descongestión efectiva precoz, se retirará el segundo diurético y se mantendrá la dosis basal de furosemida. En caso de respuesta satisfactoria pero más lenta y cuando exista una cardiopatía que predisponga a mayor riesgo de congestión (por ejemplo, pacientes con regurgitación tricuspídea grave), se podría mantener la tiacida o la ACZ de manera crónica a dosis más bajas. Si, por el contrario, persiste la sobrecarga hídrica, aumentaremos la dosis del segundo diurético o, si ya está en dosis plenas, administraremos un tercer diurético (tiacidas, ACZ o ARM). En caso de hiponatremia y predominio de sobrecarga hídrica tisular, el empleo de iSGLT2 debe ser una prioridad. Cuando, además de predominio de sobrecarga de volumen tisular, coexista hiponatremia, los acuaréticos (tolvaptán 15-30mg/día o urea 15-30g/día) son fármacos para considerar. La tabla 2 recoge los escenarios en los que se debería priorizar cada tratamiento.
Escenarios en los que se recomienda priorizar un tratamiento determinado
| Escenario | Tratamiento que priorizar |
|---|---|
| Normonatremia | Tiacidas |
| Alcalosis metabólica hipoclorémica | Acetazolamida |
| Hipopotasemia | Antialdosterónicos (si FGE >30 ml/min/1,73 m2) |
| Hiponatremia | Suero salino hipertónicoTolvaptán |
| Bajo gasto | Inótropos |
FGE: filtrado glomerular estimado.
Es necesario que todo paciente en tratamiento con un régimen diurético intensivo (bloqueo múltiple de la nefrona o tratamiento parenteral) tenga un estrecho seguimiento clínico y bioquímico. Las modificaciones del tratamiento diurético en estos pacientes necesitan un control estrecho durante la semana posterior, que debe priorizar el control de la función renal y los electrolitos1. En los pacientes con congestión persistente, pese a las medidas descritas, se iniciará pauta de tratamiento parenteral en una unidad especializada, con una logística que permita su administración ambulatoria. En el caso de que no se disponga de estas unidades y no haya experiencia en el abordaje de estos pacientes por parte del equipo de atención primaria, será necesario remitirlos a urgencias hospitalarias para que reciban tratamiento parenteral.
Los pacientes con congestión grave deberán recibir tratamiento parenteral, ya sea por vía s.c., ya i.v., priorizando esta siempre que la situación clínica y logística lo permita. Las dosis de furosemida s.c. pueden oscilar entre 20-40mg/día hasta bombas elastoméricas de 80-250mg/día durante 3-5 días en los casos de mayor gravedad o con dificultad de acceso a las unidades de IC. Las dosis de furosemida i.v. pueden oscilar entre bolos de 80mg hasta la perfusión de 125mg o 250mg/día (con o sin SSH) para los casos más graves.
Los pacientes requieren de una revaluación precoz, clínica, analítica y ecográfica durante la primera semana. La tabla 3 recapitula las acciones necesarias en esta evaluación temprana. La puntuación de congestión clínica valora de 0 a 3 cada una de las 5 variables, con un puntaje máximo de 15. Sería recomendable que el paciente presentase en los controles un puntaje ≤ 2 (tabla 4).
Acciones que realizar en la revaluación precoz
| Variable | A los 7-14 días |
|---|---|
| Escala de congestión clínica | ✓ |
| POCUS | ✓ |
| VExUS | |
| LUS | |
| FGR, Na/Cl/K | ✓ |
| Hemograma | ✓ |
| CA125 | ✓ |
| PN | ✓ |
| Iones en orina | ✓ |
| UACR | ✓ |
CA125: antígeno carbohidrato 125; Cl: cloro; FGR: filtrado glomerular renal; K: potasio; LUS: ecografía pulmonar; Na: sodio; PN: péptidos natriuréticos; POCUS: ecografía a pie de cama; UACR: cociente albúmina creatinina en orina; VExUS: ecografía de exceso venoso.
Escala de congestión clínica
| Variables | Euvolemia | Leve | Moderada | Grave |
|---|---|---|---|---|
| Ortopnea | No | 1 almohada | 2 almohadas | Continua |
| Ingurgitación yugular, cm | <6 | 6-9 | 9-15 | >15 |
| Crepitantes | Ausente | Bases | <50% | >50% |
| Edemas | Ausentes | Tobillos | Rodillas | >Rodillas |
| Ascitis | No | Mínima, no requiere punción | Moderada, susceptible de punción | A tensión, requiere punción |
En general, es preferible que este tipo de abordaje parenteral se haga en un entorno ambulatorio (consulta externa, hospital de día, o unidad de IC o cardiorrenal), siempre y cuando el paciente no presente criterios de hospitalización, como disnea de reposo, insuficiencia respiratoria aguda, inestabilidad hemodinámica o ausencia de respuesta a pautas parenterales ambulatorias.
Se puede llegar finalmente a una situación de resistencia o refractariedad a las medidas adoptadas. Antes de establecer esta alteración, deberemos descartar otras causas, como son: un mal cumplimiento de las medidas higienicodietéticas, la falta de adherencia al tratamiento, la hipoperfusión renal por excesivo uso de vasodilatadores o un componente de bajo gasto en pacientes con disfunción del ventrículo izquierdo que puedan beneficiarse de tratamiento inotrópico, entre otros.
Dentro de las opciones disponibles en los pacientes resistentes a las pautas ambulatorias, se valorará el uso de técnicas de UF, como la hemodiálisis o la diálisis peritoneal, así como el soporte circulatorio. Se debe considerar el soporte circulatorio mecánico o el trasplante cardiaco en pacientes seleccionados con IC avanzada refractaria a tratamiento médico optimizado. En el caso de que el paciente no sea subsidiario de estos tratamientos, se optará por aplicar medidas paliativas para disminuir los síntomas. La figura 5 recoge el algoritmo ambulatorio expuesto.
Algoritmo del abordaje de la sobrecarga hidrosalina en pacientes ambulatorios. ACZ: acetazolamida; ARM: antagonistas de los receptores mineralocorticoides; ERCA: enfermedad renal crónica avanzada; HCTZ: hidroclorotiacida; i.v.: intravenoso; s.c.: subcutáneo; SF: solución fisiológica; SSH: suero salino hipertónico; UF: ultrafiltración; v.o.: vía oral.
El presente documento de consenso presenta varias limitaciones. En primer lugar, carece de representación de atención primaria en su elaboración. En segundo lugar, su implementación podría verse limitada en entornos de atención médica donde no se haya adoptado la valoración multiparamétrica de la sobrecarga hidrosalina. En tercer lugar, el abordaje de la IC está en constante evolución y requiere actualización continua. Por último, se necesita estudios futuros para desvelar si existen estrategias diuréticas diferenciadas entre sexo.
FINANCIACIÓNEste trabajo fue financiado, en parte, por subvenciones del Centro de Investigación Biomédica en Red en Enfermedades Cardiovasculares (CIBERCV) (subvención número 16/11/00420).
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se ha empleado inteligencia artificial en el desarrollo de este artículo.
CONTRIBUCIÓN DE LOS AUTORESP. Llàcer, G. Romero y J. Núñez: redacción del artículo y aprobación final. J. C. Trullàs, R. de la Espriella, M. Cobo, B. Quiroga, J. Casado, M. F. Slon-Roblero, J. L. Morales-Rull, J. I. Morgado, A. Ortiz, F. Formiga, M. Melendo-Viu, P. de Sequera, A. Recio, J. Díez y L. Manzano: revisión crítica del contenido intelectual del artículo y aprobación final.
CONFLICTO DE INTERESESNinguno.