El lactato y su evolución se asocian con el pronóstico de los pacientes en shock, si bien es escasa la evidencia en aquellos asistidos con oxigenador extracorpóreo de membrana venoarterial (ECMO-VA). Nuestro objetivo es evaluar su valor pronóstico en shock cardiogénico asistido con ECMO-VA.
MétodosEstudio de pacientes tratados con ECMO-VA por shock cardiogénico de indicación médica entre julio de 2013 y abril de 2021. Se calculó el aclaramiento de lactato: (lactato inicial − lactato 6 h) / lactato inicial × tiempo exacto entre ambas determinaciones.
ResultadosDe 121 pacientes, 44 (36,4%) tenían infarto agudo de miocardio; 42 (34,7%), implante intraparada; 14 (11,6%), tromboembolia pulmonar, 14 (11,6%), tormenta arrítmica y 6 (5,0%), miocarditis fulminante. A los 30 días habían fallecido 60 pacientes (49,6%); la mortalidad fue mayor con el implante intraparada que con el implante en circulación espontánea (30 [71,4%] de 42 frente a 30 [38,0%] de 79; p=0,030). Se asociaron de manera independiente con la mortalidad a 30 días la alanina aminotransferasa (ALT) antes del implante y el lactato (tanto basal como a las 6 h y el aclaramiento). Los modelos de regresión que incluían el lactato presentaron mejor capacidad predictiva de la supervivencia que las puntuaciones ENCOURAGE y ECMO-ACCEPTS, con mayor área bajo la curva ROC en el modelo con lactato a las 6 h.
ConclusionesEl lactato (basal y a las 6 h y el aclaramiento) es un predictor independiente para el pronóstico de los pacientes en shock cardiogénico asistidos con ECMO-VA que facilita una mejor estratificación del riesgo y tiene una capacidad predictiva superior.
Palabras clave
Pese a los avances en el tratamiento de los pacientes con disfunción ventricular y el uso generalizado de la angioplastia primaria, la incidencia y la mortalidad del shock cardiogénico apenas ha cambiado en los últimos 20 años1–4.
Recientemente ha tenido lugar un auge en la utilización de la asistencia circulatoria mecánica para la enfermedad cardiovascular aguda, aunque su eficacia aún no se ha probado en ensayos clínicos2–5. Los diferentes estudios comparan grupos de pacientes heterogéneos. Como consecuencia, están surgiendo esfuerzos importantes por estratificar el shock cardiogénico en niveles de gravedad para mejorar la selección de los candidatos a asistencia circulatoria. Por ello, parece especialmente interesante encontrar parámetros que guíen la toma de decisiones1–6.
La lactacidemia informa sobre la magnitud del shock y la gravedad del paciente crítico: se ha demostrado relación entre valores elevados y mortalidad7–9. No obstante, los valores aislados tienen limitaciones10,11. En los últimos años ha surgido interés por el aclaramiento de lactato10,12–19, que también se correlaciona con el pronóstico del shock, y su valor dinámico aporta información evolutiva adicional16,20. No obstante, la evidencia en el contexto del shock cardiogénico con asistencia circulatoria mecánica es escasa18,19,21.
El objetivo principal de este estudio es analizar el valor pronóstico de determinaciones de lactato aisladas (tanto antes como a las 6 h del implante) y de su aclaramiento en una muestra amplia de pacientes en shock cardiogénico de causa médica asistidos con oxigenador extracorpóreo de membrana venoarterial (ECMO-VA). El objetivo secundario es analizar el valor añadido y la capacidad predictiva del lactato (basal, a las 6 h y aclaramiento) respecto a otros determinantes.
MÉTODOSSujetos del estudioSe identificó a todos los pacientes consecutivos tratados con ECMO-VA por shock cardiogénico de indicación médica ingresados en la unidad de cuidados críticos cardiológicos de nuestro centro entre julio de 2013 y abril de 2021. Los datos basales y de eventos se recogieron y analizaron de manera retrospectiva. Se excluyó del análisis a los pacientes que no disponían de mediciones de lactato en sangre arterial al ingreso, a las 2 h y a las 6 h del implante y a los canulados por intervención de alto riesgo (ablación de taquicardia ventricular, revascularización percutánea compleja…).
Indicaciones y tratamiento de los pacientesLas indicaciones del implante de ECMO-VA fueron las siguientes: a)shock cardiogénico refractario; b) tromboembolia pulmonar en situación de shock con contraindicación para fibrinolisis, y c) parada cardiaca hospitalaria refractaria a reanimación cardiopulmonar avanzada durante más de 10 min. Como contraindicaciones absolutas, se consideraron la comorbilidad que condicione una expectativa de vida reducida, un fracaso multiorgánico establecido e irreversible y una hemorragia activa no controlable.
Una vez tomada la decisión de iniciar la asistencia con ECMO-VA, se obtuvo el consentimiento informado y el equipo de hemodinámica, disponible las 24 h todos los días, realizó el implante mediante la técnica de Seldinger guiada con ultrasonidos y fluoroscopia. Cuando las circunstancias hacían imposible trasladar al paciente al laboratorio de hemodinámica, el implante tuvo lugar a pie de cama asistido con ultrasonidos. El acceso fue femorofemoral con cánulas de 15 o 17 Fr para la de eyección y 21 o 23 Fr para la de drenaje. Siempre que fue posible, se canuló la arteria femoral superficial para perfusión anterógrada (5 o 6 Fr).
Una vez realizado el implante, los pacientes ingresaron en la unidad de cuidados críticos cardiológicos. Todos se mantuvieron en ventilación mecánica invasiva y sedoanalgesia. En los casos de implante intraparada o con shock profundo tras la parada, se aplicó hipotermia terapéutica controlando la temperatura con el calentador del ECMO-VA para un objetivo de 34°C durante 24 h en ausencia de contraindicaciones. La anticoagulación se llevó a cabo mediante infusión continua de heparina sódica, para alcanzar un cociente de tiempo de tromboplastina parcial activado de 1,5-2 junto con monitorización diaria de anti-Xa (objetivo, 0,3-0,5 U/ml).
Si tras la terapia de asistencia había recuperación de órganos que hubiesen fallado y de la función cardiaca y respiratoria, se realizaba una prueba de destete con posterior decanulación en caso de respuesta favorable. La decanulación se realizó con cirugía o con cierre vascular percutáneo mediante 2 dispositivos Perclose ProGlide (Abbott, Estados Unidos)22. Esta segunda opción fue la preferida cuando la canulación se había realizado en la sala de hemodinámica sin problemas técnicos en la zona de punción.
Definición del aclaramiento de lactatoEl aclaramiento de lactato se calculó mediante la diferencia entre el valor inicial (el más alto antes del inicio de la asistencia circulatoria) y el lactato a las 6 h, dividido entre el producto del lactato basal y el intervalo en minutos entre ambas determinaciones, según la fórmula descrita por Fuernau et al.20 diseñada para corregir la variabilidad de tiempo entre determinaciones cuando no está preespecificado. Un valor negativo refleja un incremento de lactato desde el inicio del tratamiento, mientras que un valor positivo es directamente proporcional al aclaramiento del lactato.
Recogida de datosTres investigadores recopilaron de manera retrospectiva la información contenida en la historia clínica electrónica y los registros de enfermería de cada paciente sobre variables demográficas, clínicas, relacionadas con el implante y el resultado de la terapia hasta abril de 2021. Se utilizaron las definiciones del registro de la Extracorporeal Life Support Organization (ELSO)23.
El seguimiento a largo plazo se realizó revisando retrospectivamente la historia clínica electrónica, común para los pacientes de la misma comunidad autónoma de nuestro centro. Para los demás casos (excepcionales), se contactó con el paciente o con su centro de referencia por teléfono.
Se calcularon las puntuaciones ENCOURAGE y ECMO-ACCEPTS según se describe en las respectivas publicaciones originales24,25. La actividad de protrombina <50% que puntúa para la puntuación ENCOURAGE se asumió que equivale a una razón internacional normalizada (INR)> 1,5. Se asignó a cada paciente un estadio de la clasificación de shock de la Society for Cardiovascular Angiography and Intervention (SCAI)1,6.
El estudio fue aprobado por el Comité Ético de Investigación Clínica de nuestro centro con el código ECMO19-270/19.
Análisis estadísticoLas variables cuantitativas se describieron como media±desviación estándar o mediana [intervalo intercuartílico] si la distribución no era normal. La normalidad de la distribución se evaluó mediante la prueba de Kolmogorov-Smirnov. Las variables cualitativas se describieron como número y porcentaje. Se estudiaron los predictores de mortalidad a los 30 días del inicio del ECMO-VA mediante regresión logística univariante. Puesto que los valores de lactato en determinados momentos y su aclaramiento pueden ser interdependientes, para evitar el sobreajuste del modelo se llevó a cabo el análisis multivariado con regresión logística configurando 4 modelos: sin lactato, con aclaramiento de lactato, con lactato antes del implante y con lactato a las 6 h. En todos se incluyeron las variables que obtuvieron p <0,20 en el análisis univariado junto con las variables por separado de la puntuación ENCOURAGE (excepto el lactato). Se estudió cada modelo mediante análisis de tolerancia y se confirmó la ausencia de colinealidad entre las variables incluidas, dados los valores bajos para el factor de inflación de la varianza. Se comparó el área bajo la curva (AUC) receiver-operating characteristics (ROC) de cada modelo de regresión logística mediante el estadístico C y se obtuvieron tanto el índice de reclasificación (NRI) como el índice de mejoría de la discriminación (IDI). Se compararon estas AUC-ROC con las de los sistemas de puntuación ENCOURAGE y ECMO-ACCEPTS. Mediante pasos hacia atrás, se simplificaron los 4 modelos al menor número posible de variables y se obtuvieron también las AUC-ROC para los modelos predictivos reducidos. Según el índice de Youden, se obtuvieron los puntos de corte más discriminativos del lactato antes del implante, el lactato a las 6 h y el aclaramiento con un análisis de supervivencia mediante curvas de Kaplan-Meier. También se efectuó otro análisis multivariante de la mortalidad para los 3 modelos con lactato (aclaramiento, basal y a las 6 h) mediante regresión de Cox, teniendo en cuenta el tiempo de seguimiento hasta abril de 2021. El análisis estadístico se realizó con el programa SPSS 19.0 (IBM, Estados Unidos).
RESULTADOSDe los 149 pacientes asistidos con ECMO-VA en nuestro centro entre julio de 2013 y abril de 2021, se excluyeron 28 casos de los que no se disponía de todas las mediciones necesarias para calcular el aclaramiento. La mayoría de ellos habían sido derivados desde otros centros.
Las características basales de los 121 pacientes analizados se muestran en la tabla 1. La media de edad fue 56 años; el 77% eran varones. Como reflejo de la profundidad del shock previo al implante, se recogieron las puntuaciones ENCOURAGE y ECMO-ACCEPTS. Las causas más frecuentes de canulación fueron: infarto agudo de miocardio (IAM) (44; 36,4%), intraparada (42; 34,7%), tromboembolia pulmonar de alto riesgo (14; 11,6%), tormenta arrítmica (14; 11,6%) y miocarditis fulminante (6; 5,0%) (figura 1A). En total, 83 pacientes (68,6%) recibieron simultáneamente asistencia con balón de contrapulsación intraaórtico para descarga del ventrículo izquierdo, y 12 de ellos precisaron reemplazarlo por Impella CP (Abiomed, Estados Unidos) por distensión ventricular con escasa pulsatilidad. Se colocó una cánula de perfusión distal en la arteria femoral superficial del lado de la cánula eferente del ECMO-VA en 104 pacientes (85,9%).
Características basales previas al implante del oxigenador extracorpóreo de membrana venoarterial
| Pacientes, n | 121 |
| Edad (años) | 56,3±12,1 |
| Varones | 93 (76,9) |
| Hipertensión arterial | 51 (42,1) |
| Dislipemia | 54 (44,6) |
| Diabetes mellitus | 29 (24,0) |
| Tabaquismo | 67 (55,4) |
| Índice de masa corporal | 27,9±4,8 |
| Enfermedad vascular periférica | 14 (11,6) |
| FA previa | 17 (14,0) |
| FEVI al implante (%) | 20 [10,0-35,0] |
| Estadio shock SCAI preimplante | |
| A, B | 0 |
| C | 5 (4,1) |
| D | 33 (27,3) |
| E | 83 (68,6) |
| Cardiopatía isquémica previa | 21 (17,4) |
| Implante intraparada | 42 (37,4) |
| Hipotermia terapéutica | 80 (66,1) |
| Glasgow <6 preimplante | 90 (74,4] |
| Creatinina preimplante (mg/dl) | 1,3 [1,1-1,8] |
| INR preimplante | 1,3 [1,1-1,6] |
| ALT preimplante (U/l) | 170 [75,0-364,5] |
| Bilirrubina preimplante (mg/dl) | 0,9±0,9 |
| Puntuación ENCOURAGE | |
| 0-12 | 4 (3,3) |
| 13-18 | 17 (14,0) |
| 19-22 | 22 (18,2) |
| 23-27 | 25 (20,7) |
| ≥ 28 | 53 (43,8) |
| Puntuación ECMO-ACCEPTS | 27,0 (23,0-29,0) |
| Lactato preimplante (mmol/l) | 9,4±4,6 |
ALT: alanina aminotransferasa; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; INR: razón internacional normalizada; SCAI: Society for Cardiovascular Angiography and Intervention.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
La figura 1B muestra las principales complicaciones habidas entre los 121 pacientes de la serie. Tras 30 días fallecieron 60 (49,6%). Las causas principales fueron: fracaso multiorgánico en 22 casos (36,7%); encefalopatía anóxica grave o muerte encefálica en 17 (28,3%), hemorragia incoercible en 5 (8,3%) y sepsis en 5 (8,3%). La mortalidad fue mayor con el implante intraparada que en circulación espontánea (30 [71,4%] de 42 frente a 30 [38,0%] de 79; p=0,030). En el análisis univariado se asociaron con el pronóstico el implante intraparada, la puntuación ENCOURAGE, la puntuación ECMO-ACCEPTS, la presencia de hemorragia grave, el estadio de shock según la SCAI, la ALT preimplante, el lactato pico preimplante, el lactato a las 6 h del implante y el aclaramiento de lactato (tabla 2 y figura 2). Los resultados de los 4 modelos de regresión logística multivariante se muestran en la tabla 3. El aclaramiento de lactato y sus determinaciones aisladas se asociaron de manera independiente con la mortalidad a 30 días. Los resultados del análisis multivariado mediante regresión de Cox fueron similares (tabla 4).
Resultados del análisis univariado
| Variables | Mortalidad a 30 días | OR (IC95%) | p | |
|---|---|---|---|---|
| No (n=61) | Sí (n=60) | |||
| Indicación del implante | ||||
| Infarto de miocardio en shock | 26 (42,6%) | 18 (30%) | 0,58 [0,27-1,22] | 0,15 |
| Implante intraparada | 12 (19,7%) | 30 (50,0%) | 4,08 [1,82-9,17] | 0,001 |
| Tormenta arrítmica | 8 (13,1%) | 6 (10,0%) | 0,74 [0,24-2,27] | 0,59 |
| Tromboembolia pulmonar | 6 (9,8%) | 8 (13,3%) | 1,41 [0,46-4,34] | 0,55 |
| Miocarditis | 5 (8,2%) | 1 (1,7%) | 0,19 [0,02-1,68] | 0,14 |
| Tako-tsubo | 1 (1,6%) | 0 | — | — |
| Cardiopatía congénita | 0 | 0 | — | — |
| Postrasplante cardiaco | 0 | 0 | — | — |
| Edad (años) | 54,4±13,4 | 58,1±10,4 | 1,03 [0,99-1,06] | 0,10 |
| Varones | 48 (78,7%) | 45 (75,0%) | 0,81 [0,35-1,90] | 0,63 |
| Hipertensión arterial | 23 (37,7%) | 28 (46,7%) | 1,45 [0,70-2,99] | 0,32 |
| Dislipemia | 26 (42,6%) | 28 (46,7%) | 1,18 [0,58-2,41] | 0,66 |
| Diabetes mellitus | 17 (27,9%) | 12 (20,0%) | 0,65 [0,28-1,51] | 0,31 |
| Tabaquismo | 34 (55,5%) | 33 (55,0%) | 0,97 [0,47-1,99] | 0,94 |
| IMC | 27,6±5,3 | 28,2±4,1 | 1,03 [0,96-1,11] | 0,45 |
| Enfermedad vascular periférica | 8 (13,1%) | 6 (10,0%) | 0,74 [0,24-2,27] | 0,59 |
| FA previa | 8 (13,1%) | 9 (15,0%) | 1,17 [0,42-3,27] | 0,77 |
| FEVI al implante (%) | 15,0 [10,0-30,0] | 20,0 [10,0-43,8] | 1,01 [0,99-1,03] | 0,16 |
| Estadio shock SCAI preimplante | ||||
| A | 0 | 0 | 4,64 [2,02-10,67] | 0,0001 |
| B | 0 | 0 | ||
| C | 5 (8,2) | 0 | ||
| D | 24 (39,3) | 9 (15,0) | ||
| E | 32 (52,5) | 51 (85,0) | ||
| Cardiopatía isquémica previa | 13 (21,3) | 8 (13,3) | 0,57 [0,22-1,49] | 0,25 |
| Glasgow <6 preimplante | 40 (65,6) | 50 (83,3) | 2,63 [1,11-6,21] | 0,03 |
| Creatinina preimplante (mg/dl) | 1,3 [0,9-1,5] | 1,5 [1,2-1,9] | 1,52 [0,84-2,75] | 0,16 |
| INR preimplante | 1,2 [1,0-1,5] | 1,4 [1,2-1,8] | 1,52 [0,88-2,63] | 0,14 |
| ALT preimplante (U/l) | 93 [54,5-183,5] | 298,5 [119,0-563,3] | 1,01 [1,00-1,02] | 0,01 |
| Bilirrubina preimplante (mg/dl) | 0,8±0,5 | 1,1±1,2 | 1,44 [0,88-2,35] | 0,14 |
| Isquemia grave de extremidades inferiores | 10 (16,4) | 16 (26,2) | 1,86 [0,76-4,50] | 0,17 |
| Ictus | 1 (1,6) | 5 (8,3) | 5,46 [0,62-48,16] | 0,13 |
| Hemorragia grave | 13 (21,3) | 28 (46,7) | 3,23 [1,46-7,16] | 0,004 |
| Hemolisis | 0 (0,0) | 1 (1,7) | - | - |
| Sepsis | 14 (23,0) | 7 (11,7) | 0,44 [0,17-1,19] | 0,11 |
| TDER | 2 (3,3) | 8 (13,3) | 4,54 [0,92-22,34] | 0,06 |
| Puntuación ENCOURAGE | 22,0 [16,5-28,0] | 28,0 [23,0-34,8] | 1,13 [1,06-1,19] | 0,0001 |
| Puntuación ECMO-ACCEPTS | 25,0 [23,0-28,0] | 27,0 [25,0-29,0] | 1,14 [1,00-1,29] | 0,05 |
| Lactato preimplante (mmol/l) | 7,3±4,0 | 11,5±4,3 | 1,25 [1,14-1,38] | 0,0001 |
| Lactato 6 h posimplante (mmol/l) | 3,6±2,3 | 8,6±4,7 | 1,49 [1,27-1,74] | 0,0001 |
| Aclaramiento de lactato (%/h) | 7,7±4,2 | 4,3±4,6 | 0,84 [0,76-0,92] | 0,0001 |
ALT: alanina aminotransferasa; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal; INR: razón internacional normalizada; OR: odds ratio; SCAI: Society for Cardiovascular Angiography and Intervention; TDER: tratamiento de depuración extrarrenal.
Las variables cualitativas se expresan como el porcentaje de pacientes que presentan mortalidad a los 30 días y las cuantitativas, como la media±desviación estándar o la mediana [intervalo intercuartílico] de los pacientes que presentan mortalidad a los 30 días.
Análisis multivariante de los predictores de mortalidad a 30 días
| Variables | Sin lactato | Con aclaramiento de lactato | Con lactato preimplante | Con lactato a las 6 h | ||||
|---|---|---|---|---|---|---|---|---|
| OR (IC95%) | p | OR (IC95%) | p | OR (IC95%) | p | OR (IC95%) | p | |
| Edad (años) | 2,26 (0,85-5,84) | 0,11 | 2,13 (0,77-5,90) | 0,14 | 2,24 (0,86-5,86) | 0,10 | 2,25 (0,78-6,55) | 0,14 |
| Varones | 1,31 (0,37-4,69) | 0,67 | 1,38 0,38-4,93) | 0,62 | 1,42 (0,39-5,07) | 0,59 | 1,74 (0,47-6,41) | 0,40 |
| IMC | 1,52 (0,52-4,51) | 0,45 | 1,54 (0,49-4,82) | 0,46 | 1,41 (0,45-4,41) | 0,55 | 1,25 (0,33-4,68) | 0,74 |
| Estadio shock SCAI preimplante | 2,11 (0,74-5,95) | 0,16 | 2,18 (0,67-7,03) | 0,19 | 1,44 (0,47-4,45) | 0,52 | 1,07 (0,31-3,71) | 0,92 |
| Implante intraparada | 2,36 (0,82-6,76) | 0,11 | 2,83 (0,92-8,75) | 0,07 | 1,98 (0,69-5,72) | 0,21 | 2,59 (0,81-8,32) | 0,11 |
| Creatinina preimplante (mg/dl) | 1,08 (0,39-2,98) | 0,88 | 1,11 (0,48-2,58) | 0,81 | 1,04 (0,46-2,37) | 0,92 | 1,06 (0,52-2,15) | 0,87 |
| INR preimplante | 1,22 (0,60-2,48) | 0,58 | 1,34 (0,65-2,75) | 0,43 | 1,32 (0,64-2,72) | 0,44 | 1,31 (0,59-2,90) | 0,50 |
| ALT preimplante (U/l) | 1,01 (1,00-1,02) | 0,03 | 1,00 (0,99-1,01) | 0,08 | 1,01 (1,00-1,02) | 0,03 | 1,01 (1,00-1,02) | 0,04 |
| Isquemia grave de extremidades inferiores | 1,74 (0,61-4,95) | 0,30 | 2,27 (0,78-6,64) | 0,13 | 1,50 (0,54-4,17) | 0,44 | 1,81 (0,61-5,35) | 0,28 |
| Hemorragia grave | 2,25 (0,83-6,12) | 0,11 | 2,18 (0,79-6,02) | 0,13 | 1,90 (0,71-5,13) | 0,20 | 1,88 (0,65-5,46) | 0,24 |
| TDER | 1,60 (0,37-7,06) | 0,53 | 2,44 (0,49-12,32) | 0,28 | 1,82 (0,45-7,38) | 0,41 | 2,85 (0,59-13,68) | 0,19 |
| Aclaramiento de lactato (%/h) | 0,84 (0,74-0,96) | 0,01 | ||||||
| Lactato preimplante (mmol/l) | 1,15 (1,04-1,28) | 0,01 | ||||||
| Lactato a las 6 h (mmol/l) | 1,42 (1,21-1,67) | <0,01 | ||||||
| Análisis de tolerancia (colinealidad) | FIV 1,24 | FIV 1,28 | FIV 1,29 | |||||
ALT: alanina aminotransferasa; FIV: factor de inflación de la varianza; IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal; INR: razón internacional normalizada; OR: odds ratio; SCAI: Society for Cardiovascular Angiography and Intervention; TDER: tratamiento de depuración extrarrenal.
Análisis multivariante con regresión de Cox
| Variables | Con aclaramiento de lactato | Con lactato preimplante | Con lactato a las 6 h | |||
|---|---|---|---|---|---|---|
| OR (IC95%) | p | OR (IC95%) | p | OR (IC95%) | p | |
| Edad (años) | 1,51 (0,83-1,90) | 0,19 | 1,33 (0,81-2,06) | 0,20 | 1,88 (0,90-2,35) | 0,16 |
| Varones | 1,08 [0,57-2,02) | 0,82 | 1,13 (0,61-2,08) | 0,69 | 1,24 (0,70-2,20) | 0,45 |
| Índice de masa corporal | 1,75 (0,87-3,51) | 0,12 | 1,56 (0,80-3,01) | 0,19 | 1,24 (0,94-3,88) | 0,07 |
| Estadio shock SCAI preimplante | 2,63 (1,08-6,37) | 0,03 | 2,01 (0,93-4,38) | 0,08 | 1,95 (0,80-4,78) | 0,14 |
| Implante intraparada | 1,92 (0,97-3,81) | 0,06 | 1,50 (0,78-2,88) | 0,23 | 1,61 (0,84-3,09) | 0,16 |
| Creatinina preimplante (mg/dl) | 1,17 (0,83-1,63) | 0,37 | 1,08 (0,77-1,53) | 0,64 | 1,08 (0,75-1,56) | 0,67 |
| INR preimplante | 1,00 (0,65-1,56) | 0,98 | 1,12 (0,72-1,72) | 0,62 | 1,01 (0,61-1,65) | 0,97 |
| ALT preimplante (U/l) | 1,00 (1,00-1,01) | 0,02 | 1,00 (1,00-1,01) | <0,01 | 1,00 (0,99-1,01) | 0,28 |
| Isquemia grave de extremidades inferiores | 0,92 (0,50-1,69) | 0,78 | 0,84 (0,47-1,51) | 0,56 | 0,95 (0,53-1,70) | 0,88 |
| Hemorragia grave | 1,50 (0,85-2,66) | 0,16 | 1,47 (0,85-2,52) | 0,16 | 1,64 (0,98-2,74) | 0,06 |
| TDER | 0,58 (0,24-1,40) | 0,22 | 0,78 (0,41-1,50) | 0,46 | 0,67 (0,31-1,45) | 0,31 |
| Aclaramiento de lactato (%/h) | 0,91 (0,86-0,97) | <0,01 | ||||
| Lactato preimplante (mmol/l) | 1,12 (1,05-1,19) | <0,01 | ||||
| Lactato 6 h posimplante (mmol/l) | 1,19 (1,12-1,26) | <0,01 | ||||
ALT: alanina aminotransferasa; IC95%: intervalo de confianza del 95%; INR: razón internacional normalizada; OR: odds ratio; SCAI: Society for Cardiovascular Angiography and Intervention; TDER: tratamiento de depuración extrarrenal.
Cabe mencionar que los 7 pacientes con un aclaramiento de lactato negativo tuvieron una mortalidad a 30 días del 71,4%, que fue del 90% para los 10 pacientes con aclaramiento de lactato nulo.
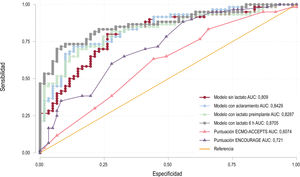
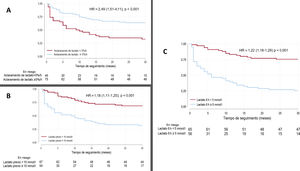
Frente al modelo sin lactato, los modelos con lactato mejoraron significativamente la capacidad pronóstica (IDI: 0,07, 0,04 y 0,14; NRI: 0,13, 0,12 y 0,18 para los modelos con aclaramiento, con lactato preimplante y con lactato a las 6 h respectivamente). El análisis de las curvas ROC para cada modelo se muestra en la figura 3. El que incluyó el lactato a las 6 h presentó mayor capacidad de predecir la mortalidad a 30 días. La comparación del AUC-ROC con los índices ENCOURAGE y ECMO-ACCEPTS se muestra en la figura 3. Los 4 modelos reducidos incluyeron solo ALT preimplante, indicación preimplante y hemorragia grave, que presentaron buenas AUC-ROC aunque ligeramente inferiores (0,79 sin lactato; 0,82 con aclaramiento; 0,81 con lactato basal y 0,85 con lactato a las 6 h). Los puntos de corte que mejor dicotomizaron la muestra fueron 5%/h para el aclaramiento, 5 mmol/l para el lactato a las 6 h y 10 mmol/l para el lactato antes del implante. La figura 4 muestra las curvas de Kaplan-Meier para estos puntos de corte.
No hubo diferencias estadísticamente significativas en la aparición de complicaciones isquémicas de las extremidades inferiores en función de la presencia de cánula de perfusión distal. Un total de 26 pacientes sufrieron isquemia; 2 de ellos sin cánula en la arteria femoral superficial, frente a 95 pacientes sin isquemia, 15 de ellos sin cánula.
DISCUSIÓNNuestro principal hallazgo es que el lactato y su evolución se asocian de manera independiente con el pronóstico de los pacientes en shock cardiogénico asistidos con ECMO-VA. Por cada aumento del 1%/h de aclaramiento de lactato, se redujo la mortalidad un 16%, y los pacientes con un aclaramiento> 5%/h mostraron una probabilidad de supervivencia 2,5 veces superior.
En una situación de hipoperfusión general tiene lugar una mayor producción de lactato por todos los órganos que resulta desproporcionada para el grado de aclaramiento que pueden soportar el hígado y los riñones26, progresivamente más disfuncionantes. Así, el lactato en sangre se acumula progresivamente y es un marcador precoz de la hipoxia tisular. De hecho, la hiperlactacidemia se correlaciona mejor con el grado de hipoperfusión que la presión arterial media, que al principio se mantiene debido a la hiperactivación simpática. Así, la hipoperfusión no es un mero problema macrocirculatorio, sino un fenómeno microvascular y metabólico más complejo que perpetúa el círculo vicioso desencadenando mayor respuesta inflamatoria, disfunción endotelial, coagulopatía, vasoplejía y fracaso multiorgánico11.
No obstante, la lactacidemia aislada tiene múltiples limitaciones. El valor de normalidad varía según la causa del shock, la comorbilidad de base, la variabilidad metabólica interindividual o el grado de daño hepático y renal, que pueden producir hiperlactacidemias desproporcionadas para la hipoperfusión tisular existente10,11.
En los últimos años está surgiendo especial interés por el comportamiento dinámico de los valores de lactato en sangre10–19,21.
El aclaramiento se ha estudiado sobre todo en el shock no cardiogénico. Elevaciones de lactato persistentes se han relacionado con la mortalidad con mayor robustez que las determinaciones únicas12–15. Destaca el estudio de Nguyen et al.10, donde el aclaramiento a las 6 h fue la única variable que se relacionó de manera independiente con la mortalidad entre 111 pacientes con shock séptico.
En el contexto de la enfermedad cardiovascular aguda, hay menos información publicada y es controvertida. Sin embargo, todo parece apuntar a que la elevación persistente del lactato también confiere peor pronóstico. En este sentido, destacan 2 estudios. De una parte, el de Atanná et al.17, donde un aclaramiento <10% a las 12 h en 51 pacientes en shock tras un IAM fue un predictor independiente de mortalidad precoz. Por otro lado, el de Fuernau et al.20, un subestudio del ensayo IABP-SHOCK II, encuentra una asociación significativa entre la mortalidad a los 30 días y el lactato (basal, 8 h y aclaramiento). El lactato a las 8 h mostró mayor capacidad predictiva, y se propuso un valor de corte <3,1 mmol/l como el que mejor discrimina a los supervivientes.
Dentro del shock cardiogénico en asistencia con ECMO-VA, cabe destacar 2 trabajos, los de Slottosch et al.18 y Mungan et al.19, con pacientes en su mayoría posquirúrgicos. Ambas series incluyeron a pacientes en shock profundo, como refleja una media de lactato al implante alrededor de 10 mmol/l y unas tasas de mortalidad que rondan el 60%. Pese a ello, se demuestra que el aclaramiento también es un útil predictor de supervivencia a las 12 h del implante en la serie de Slottosch18 y a las 2 h en la de Mungan19. Del resto de variables registradas, solo la edad se asoció de manera independiente con la supervivencia.
Por otra parte, la serie de Scolari et al.21 presenta los resultados de 43 pacientes con asistencia circulatoria mecánica (el 58% con ECMO-VA). Son pacientes menos graves, con lactato al implante alrededor de 6 mmol/l y esta vez en su mayoría de causa médica (el 44% con IAM y el 23% con insuficiencia cardiaca). Por lo tanto, una serie más parecida a esta, aunque cierta proporción de pacientes posquirúrgicos, medias de lactato más bajas, menor puntuación ENCOURAGE promedio y menos implantes intraparada. Destaca una mortalidad del 72% a los 30 días y que el aclaramiento de lactato a las 6 h se asoció con la supervivencia.
La lactacidemia también presenta valor pronóstico en los casos intraparada o posparada. En el estudio de Masyuk et al.27, de 112 pacientes con shock posparada cardiaca con asistencia circulatoria mecánica, la lactacidemia basal> 10 mmol/l se asoció con una mortalidad> 95%. En nuestro medio, el lactato preoperatorio fue un fuerte predictor de eventos inmediatos tras el trasplante cardiaco para los pacientes en asistencia circulatoria del trabajo de Couto et al.28.
En los últimos años se han dirigido esfuerzos a una mejor selección de candidatos a la asistencia circulatoria para evitar la futilidad en los casos extremos, pero también complicaciones innecesarias en los menos graves. A raíz de diferentes cohortes de pacientes en shock cardiogénico asistidos con ECMO-VA, se han elaborado escalas de puntuación con el objetivo de delimitar categorías pronósticas. Los ejemplos más importantes son las puntuaciones ENCOURAGE (limitada a pacientes con IAM), ECMO-ACCEPTS y SAVE, aunque esta última no incluye implante intraparada y sus variables están diseñadas inicialmente para ECMO venovenoso24,25,29.
No obstante, estos modelos predictivos solo evalúan características previas al implante. En este sentido, recientemente se ha publicado la puntuación VA-ECMO PREDICT30 que, de forma análoga al aclaramiento de lactato, cuenta con un carácter dinámico y de fácil aplicabilidad, a diferencia de otros modelos estáticos, y mostró mayor capacidad predictiva en una cohorte de validación externa que otras puntuaciones como SAVE, APACHE, SOFA o SAPS.
Nuestro estudio aporta la primera experiencia comunicada en nuestro medio sobre la asistencia con ECMO-VA en shock cardiogénico. A diferencia de los estudios mencionados, se trata de shock cardiogénico de causa médica. En la mayoría de los implantes intraparada había un síndrome coronario agudo subyacente. Hay que destacar que ningún implante se indicó por shock tras cardiotomía o trasplante cardiaco ni por cardiopatía congénita, etiologías con diferentes pronósticos según la puntuación SAVE29.
En los pacientes que habían fallecido a los 30 días fue más frecuente el daño hepático. En cambio, la insuficiencia renal aguda no se asoció estadísticamente con la mortalidad. En series similares, como la de Fuernau et al.20, el daño de órganos no mostró mejor correlación con la supervivencia que el lactato o su aclaramiento y, en algunos casos, como en el estudio de Scolari et al.21 no fue un predictor independiente.
Las principales complicaciones de nuestra cohorte son similares a las ya descritas sobre la asistencia con ECMO-VA2. Cardiólogos intervencionistas llevaron a cabo todos los implantes mediante acceso percutáneo, con una tasa de complicaciones isquémicas similar a las de otras series2. La presencia de cánula de perfusión distal no se asoció con menores tasas de isquemia en las extremidades inferiores, aunque con posible sesgo de selección. Cabe destacar los resultados en términos de mortalidad (50%), dados el grado de complejidad y la gravedad del shock. Cohortes más antiguas, como las de validación de las puntuaciones ECMO-ACCEPTS25, ENCOURAGE24, VA-ECMO PREDICT30 o SAVE29 y los estudios de Slottosch et al.18, Mungan et al.19, Scolari et al.21 o Rosselló et al.31, registraron mayor mortalidad.
Los modelos de regresión logística con lactato basal, a las 6 h o el aclaramiento presentaron mejor poder discriminativo que el modelo que no incluyó el lactato; el AUC-ROC de la lactacidemia a las 6 h fue la que mostró mayor capacidad predictiva, unos resultados similares a los obtenidos por Scolari et al.21 y Fuernau et al.20. La mortalidad fue dramáticamente superior en los pacientes con aclaramiento de lactato negativo o nulo. Esta asociación se mantuvo para todos los subgrupos diagnósticos, incluido el implante intraparada, pese a ser un subgrupo con gran mortalidad, determinada principalmente por el daño neurológico.
A la luz de la evidencia previa y de nuestros resultados, resulta central la determinación seriada del lactato arterial de los pacientes en shock cardiogénico:
- 1.
La cifra inicial es útil para estratificar el riesgo y decidir el tipo de asistencia circulatoria en función de la profundidad del shock (cardiogénico puro o mixto cardiometabólico). Así, pacientes con lactacidemias> 5 mmol/l20 pueden estar en estadios más avanzados (D o E de la SCAI) y no responder a una asistencia aislada del ventrículo izquierdo1,3,6. En este sentido, parece cada vez más recomendable guiar las decisiones en casos dudosos por la evaluación hemodinámica mediante catéter de Swan-Ganz1–5,31.
- 2.
Conseguir el mayor aclaramiento posible en fases iniciales es un objetivo prioritario del tratamiento del shock cardiogénico, puesto que refleja que se ha restaurado la perfusión tisular adecuada.
- 3.
Identificar rápidamente a los pacientes que no alcanzan el adecuado aclaramiento para descartar complicaciones que cursan típicamente con hiperlactacidemia (lesión vascular, isquemia intestinal, sepsis o hemorragia concomitantes) o plantear una escalada de la asistencia si persiste la congestión pulmonar debida a la distensión ventricular con baja pulsatilidad (implante de Impella o asistencia ventricular quirúrgica).
En la actualidad no se encuentra bien definido en qué momento puede ser de mayor utilidad medir el aclaramiento del lactato: los más utilizados arbitrariamente son tras 6, 8 y 12 h. En futuros estudios sería interesante disponer de más mediciones para comparar los aclaramientos en diferentes puntos. Por otra parte, pueden existir pequeñas variaciones en las horas o las cifras de lactato introducidas por los investigadores. No obstante, desde que se inició el programa de ECMO-VA en nuestro centro, se ha sistematizado el registro en la historia clínica de las lactacidemias en momentos preestablecidos y se ha corregido la diferencia temporal entre las 2 determinaciones según la fórmula de Fuernau et al.20. Además, este es un trabajo descriptivo, aunque esta es una limitación muy frecuente en el área de los cuidados críticos. Por otro lado, no fue posible recoger de modo fiable otros valores como el pH y el bicarbonato de cada paciente, lo que habría permitido calcular la puntuación VA-ECMO PREDICT. Por último, hay que destacar que no se ha realizado validación externa de los hallazgos.
CONCLUSIONESEl lactato (basal, a las 6 h y aclaramiento) es un factor pronóstico independiente en los pacientes en shock cardiogénico asistidos con ECMO-VA que permite estratificar mejor el riesgo y presenta la mayor capacidad predictiva.
FINANCIACIÓNNo se ha recibido financiación.
CONTRIBUCIÓN DE LOS AUTORESDiseño y concepción del estudio: J. Martínez-Solano, I. Sousa-Casasnovas, J. García-Carreño. Recogida y adquisición de los datos: J. Martínez-Solano, I. Sousa-Casasnovas, J. García-Carreño, M. Juárez-Fernández, F. Díez-Delhoyo, R. Sanz-Ruiz, C. Devesa-Cordero, J. Elízaga-Corrales. Coordinación y presentación ante el comité ético: I. Sousa-Casasnovas, F. Fernández-Avilés, M. Martínez-Sellés. Redacción del artículo, aportaciones relevantes: J. Martínez-Solano, I. Sousa-Casasnovas, J. García-Carreño, M. Juárez-Fernández, F. Díez-Delhoyo, R. Sanz-Ruiz, C. Devesa-Cordero, J. Elízaga-Corrales, F. Fernández-Avilés, M. Martínez-Sellés. Análisis estadístico: J. Martínez-Solano, J.M. Bellón-Cano, M. Martínez-Sellés. F. Fernández-Avilés y M. Martínez-Sellés: contribución similar.
CONFLICTO DE INTERESESNo existen.
- –
La lactacidemia ha mostrado valor pronóstico en los pacientes en shock. Está surgiendo especial interés por el beneficio adicional que aporta el valor dinámico del aclaramiento de lactato respecto a determinaciones aisladas.
- –
El aclaramiento de lactato y la lactacidemia a las 6 h se asocian con la supervivencia de los pacientes en shock cardiogénico asistidos con ECMO-VA, situación con escasa información disponible. En consecuencia, puede constituir un objetivo precoz de la terapia que permite identificar rápidamente complicaciones o la necesidad de escalar la asistencia circulatoria.