Se han presentado datos contradictorios respecto al uso de bivalirudina como estrategia de anticoagulación durante las intervenciones coronarias percutáneas, puesto que aporta beneficios teóricos en cuanto a las complicaciones hemorrágicas, pero preocupa el posible aumento del riesgo de trombosis del stent. Se realizó un metanálisis actualizado para evaluar la eficacia y la seguridad de la bivalirudina comparada con la heparina no fraccionada en pacientes sometidos a intervenciones percutáneas por síndromes coronarios agudos.
MétodosSe realizó una búsqueda de artículos en la literatura médica y en actas de reuniones científicas importantes. El objetivo principal de eficacia fue la mortalidad total a 30 días. Los objetivos secundarios fueron evaluar trombosis del stent y hemorragias mayores. Se llevó a cabo un análisis preespecificado según la forma de presentación clínica.
ResultadosSe incluyeron 12 ensayos aleatorizados con un total de 32.746 pacientes (el 52,5% asignados aleatoriamente a bivalirudina). La mortalidad fue del 1,8%, sin que se apreciaran diferencias entre la bivalirudina y la heparina (odds ratio = 0,91; intervalo de confianza del 95%, 0,77-1,08; p = 0,28; p para la heterogeneidad = 0,41). Se obtuvieron resultados similares en los pacientes con infarto de miocardio sin y con elevación del segmento ST. Se observó una tasa de trombosis del stent significativamente superior con bivalirudina (odds ratio = 1,42; intervalo de confianza del 95%, 1,09-1,83; p = 0,008; p para la heterogeneidad = 0,09). La bivalirudina se asoció a una reducción significativa de la tasa de hemorragias mayores (odds ratio = 0,60; intervalo de confianza del 95%, 0,54-0,75; p < 0,00001; p para la heterogeneidad < 0,0001) que, sin embargo, estaba relacionada con la diferencia existente en el uso de inhibidores de la glucoproteína IIb/IIIa (r = –0,02 [–0,033 a –0,0032]; p = 0,02) y no se tradujo en un efecto favorable en supervivencia.
ConclusionesEn pacientes sometidos a intervenciones coronarias percutáneas, la bivalirudina, comparada con la heparina, no se asoció a una reducción de la mortalidad, pero sí a un aumento de trombosis del stent. La reducción de las complicaciones hemorrágicas observada con el uso de bivalirudina no se tradujo en un efecto beneficioso en la supervivencia, en cambio estuvo influida por una diferencia en el uso de inhibidores de la glucoproteína IIb/IIIa.
Palabras clave
La creciente complejidad con que se presentan los pacientes ingresados por síndrome coronario agudo (SCA) está haciendo que el manejo del tratamiento antitrombótico sea cada vez más difícil, y exige mantener un equilibrio continuo entre los riesgos de hemorragia y de complicaciones trombóticas1–3.
Se ha propuesto el uso de bivalirudina como estrategia alternativa a la heparina no fraccionada (HNF) para la anticoagulación durante las intervenciones coronarias percutáneas (ICP), puesto que aporta varias ventajas teóricas, como su actividad frente a la trombina ligada al coágulo, la inhibición de la activación plaquetaria inducida por la trombina, la breve semivida en plasma y una menor dependencia de la eliminación renal4.
Además, los primeros estudios realizados indicaban que la bivalirudina puede proporcionar una efectividad similar a la de la HNF, pero con una reducción significativa de las complicaciones hemorrágicas5,6. Sin embargo, en estos ensayos no se incluyó a pacientes con SCA, en los que el equilibrio entre episodios hemorrágicos e isquémicos es más complejo.
En este contexto, los ensayos clínicos más recientes y los análisis combinados de diversos estudios7–9 indican que la bivalirudina podría asociarse a un riesgo de trombosis del stent e infarto de miocardio aún más elevado, además de no aportar ventaja alguna en reducción de las complicaciones hemorrágicas. Además, han planteado la hipótesis de que las diferencias observadas con la bivalirudina en cuanto a las hemorragias podrían estar condicionadas por los episodios de hemorragia relacionados con el sitio de punción o por un mayor uso de inhibidores de la glucoproteína IIb/IIIa (GPIIb/IIIa) asociados a la HNF.
Por ello, se ha llevado a cabo el ensayo MATRIX10, en el que se comparó la bivalirudina con la HNF en pacientes con SCA asignados aleatoriamente a ICP por vía radial o femoral, y que no mostró ventaja alguna con el uso de bivalirudina por lo que respecta a los objetivos de valoración isquémicos, hemorrágicos o combinados. En consecuencia, el objetivo del presente estudio es llevar a cabo el metanálisis más amplio realizado hasta el momento para evaluar la seguridad y la eficacia de la bivalirudina en comparación con la HNF durante la ICP, con la inclusión de los datos de los ensayos aleatorizados más recientes en el contexto del SCA.
MÉTODOSElegibilidad y estrategia de búsquedaSe llevó a cabo una búsqueda bibliográfica mediante búsquedas formales en bases de datos electrónicas (MEDLINE, Cochrane y EMBASE) para identificar estudios clínicos y resúmenes de sesiones científicas, y se realizó una búsqueda en las páginas web de TCT11, EuroPCR12, ACC13, AHA14 y ESC15 para identificar presentaciones orales o presentaciones de diapositivas de expertos del periodo comprendido entre enero de 1990 y septiembre de 2015. Los términos de búsqueda utilizados fueron los siguientes: «bivalirudin and acute coronary syndrome» o «bivalirudin versus heparin» o «bivalirudin and trial». No se aplicó ninguna restricción respecto al idioma de publicación.
Extracción de los datos y evaluación de la validezLos datos los extrajeron de manera independiente 2 investigadores. En el caso de que los datos fueran incompletos o no estuvieran claros, se contactó con los autores siempre que fue posible. Las discrepancias se resolvieron mediante consenso. La gestión de los datos se realizó según el principio de intención de tratar.
Parámetros de valoraciónEl objetivo principal de eficacia fue la mortalidad total a los 30 días de seguimiento. El objetivo secundario fue la aparición de una trombosis del stent a los 30 días. El objetivo principal de seguridad fue la aparición de hemorragias mayores (según la definición establecida en el protocolo) en los primeros 30 días siguientes a la aleatorización. Se llevó a cabo un metanálisis preespecificado según la forma de presentación clínica del paciente (SCA sin elevación del segmento ST o infarto agudo de miocardio con elevación del segmento ST [IAMCEST]).
Análisis de los datosEl análisis estadístico se llevó a cabo con el programa informático de uso libre Review Manager 5.23 y con el programa SPSS 17.0. Se utilizaron como estadísticas de resumen los valores de odds ratio (OR) y sus intervalos de confianza del 95% (IC95%). Se calculó la OR conjunta utilizando un modelo de efectos fijos. Se empleó la prueba de Breslow-Day para examinar la evidencia estadística de heterogeneidad entre los estudios (p < 0,1). Se aplicó asimismo un modelo de efectos aleatorios para confirmar los resultados (modelo de efectos aleatorios de DerSimonian y Laird). La calidad del estudio la evaluaron los mismos investigadores mediante una puntuación que, según lo descrito en una publicación anterior16, se expresó en una escala ordinal en la que se asignaba 1 punto a la presencia de cada una de las siguientes características: a) declaración de los objetivos; b) criterios de inclusión y exclusión explícitos; c) descripción de la intervención; d) métodos objetivos de seguimiento; e) disponibilidad de datos sobre los episodios del objetivo evaluado; f) análisis de la potencia estadística; g) descripción de los métodos estadísticos; h) diseño multicéntrico; i) comentario de las retiradas del estudio, y j) información detallada sobre el tratamiento médico. Se llevó a cabo un análisis de metarregresión para evaluar lo siguiente: la relación entre los beneficios en cuanto a mortalidad con la bivalirudina en comparación con la HNF y el perfil de riesgo de los pacientes (expresado en forma de log de la OR de la mortalidad respecto al grupo de control); la influencia de la mortalidad en la reducción de las complicaciones hemorrágicas observada con la bivalirudina (expresada en forma de log de la OR de los episodios hemorrágicos en el grupo de bivalirudina en comparación con el grupo de control); la reducción de las hemorragias con bivalirudina y el perfil de riesgo de los pacientes (expresado como log de la OR de los episodios hemorrágicos en el grupo de control). El estudio se llevó a cabo ateniéndose a la guía Quality of Reporting of Meta-Analyses (PRISMA)17.
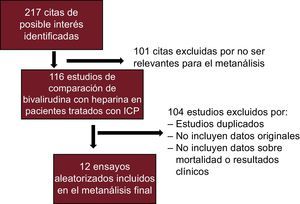
RESULTADOSEstudios elegiblesSe incluyeron finalmente un total de 12 ensayos clínicos aleatorizados5,7,8,10,18–25, con una población total de 32.746 pacientes (figura 1). Se excluyó un estudio debido a que incluía solo un 24% de pacientes con infarto agudo de miocardio sin elevación del segmento ST (IAMSEST)26. En la tabla 1 se presentan las características detalladas de los ensayos incluidos. En ellos, se asignó aleatoriamente a 17.189 pacientes (52,5%) a bivalirudina y 15.557 (47,5%) a HNF con o sin una previsión de uso de inhibidores de la GPIIb/IIIa. En un ensayo se administró fondaparinux antes de la intervención al 100% de los pacientes participantes22. Como se muestra en la tabla 2, la media de edad era 61,9 ± 2,1 años, con un 19,5% de pacientes diabéticos y un 13,9% con insuficiencia renal. El uso de inhibidores de la GPIIb/IIIa fue del 15,1% en el grupo de bivalirudina (excluidos en 3 ensayos5,19,25) y del 49,7% en el grupo de HNF (planificado en un 100% en 5 ensayos)7,18,19,23,25. Seis ensayos se realizaron en pacientes con IAMCEST8,10,13,15,16,18, mientras que 8 ensayos se centraron en pacientes con SCA (angina inestable [AI]/IAMSEST)5,7,10,19,22-25. Se obtuvieron datos de seguimiento a los 30 días en 10 ensayos7,8,10,18–21,23–25, durante la hospitalización en 25,22 y en 1 se realizó un seguimiento 48 h después del alta25.
Características de los estudios incluidos
| Estudio | Periodo de inclusión | Tipo | Población en estudio | Criterios de inclusión | Criterios de exclusión | Puntuación de calidad |
|---|---|---|---|---|---|---|
| ACUITY7 | 2003-2005 | ECA multicéntrico | SCA | • Edad > 18 años; • Síntomas de AI durante > 10 min en las 24 h previas y al menos uno de: a) depresión o elevación transitoria de nueva aparición del segmento ST ≥ 1 mm; b) elevación de troponinas I o T o de CK-MB, o c) enfermedad coronaria conocida | • IAMCEST • Shock • Diátesis hemorrágica o episodio de hemorragia mayor < 2 semanas • Trombocitopenia • Aclaramiento de creatinina < 30 ml/min • Administración reciente de abciximab, warfarina, fondaparinux, fármacos fibrinolíticos, bivalirudina o 2 o más dosis de HBPM • Alergia a fármacos del estudio o al contraste yodado que pudiera no permitir una premedicación adecuada | 10 |
| HAS5 | 1993-1994 | ECA multicéntrico | AI, angina tras infarto de miocardio | • Dolor torácico • Edad > 21 años • Angioplastia urgente por AI • Consentimiento informado por escrito | • Creatinina sérica > 3,0 mg/dl • Tratamiento trombolítico en las 24 h previas • Aterectomía coronaria, implante de stent o angioplastia con láser programadas • Intervención de angioplastia en etapas programada • Embarazo • Intolerancia al ácido acetilsalicílico o la heparina | 9 |
| EUROMAX8 | ND | ECA multicéntrico | IAMCEST | • Mujeres no embarazadas y varones • Edad ≥ 18 años • Síntomas con un diagnóstico de presunción de IAMCEST < 12 h • Cualquiera de las siguientes: elevación del segmento ST ≥ 1 mm en dos derivaciones contiguas en el ECG, sospecha de BRIHH de nueva aparición o depresión del segmento ST ≥ 1 mm en al menos 2 derivaciones en V1-V3 con una onda T terminal positiva; intención de practicar una ICP primaria < 2 h después del primer contacto médico | • Diátesis hemorrágica o enfermedad hemática o antecedentes de masa intracerebral, aneurisma, malformación arteriovenosa, ictus hemorrágico, hemorragia intracraneal o hemorragia < 2 semanas • Cirugía < 2 semanas • Warfarina (no si se sabe que INR < 1,5) • HNF, HBPM o bivalirudina antes de la aleatorización • Tratamiento trombolítico < 48 h • Contraindicaciones absolutas o alergia que no se puede premedicar al contraste yodado o cualquiera de las medicaciones del estudio • Contraindicaciones para la angiografía • Embarazo o madre en periodo de lactancia • Aclaramiento de creatinina < 30 ml/min o diálisis • Inclusión previa en este u otros estudios • Falta de disponibilidad de hospital con medios para ICP primaria • Peso corporal estimado > 120 kg | 10 |
| HORIZONS-AMI18 | 2005-2008 | ECA multicéntrico | IAMCEST | • Edad ≥ 18 años • Tiempo de evolución de los síntomas entre 20 y 720 min • Elevación del segmento ST ≥ 1 mm en al menos 2 derivaciones contiguas, BRIHH de nueva aparición o infarto de miocardio de cara posterior verdadero | • Contraindicaciones para los fármacos en estudio • Administración previa de tratamiento trombolítico, bivalirudina, IGP, HBPM o fondaparinux en el presente ingreso • Uso de warfarina • Antecedentes de diátesis hemorrágica, coagulopatía, trombocitopenia inducida por heparina, masa intracerebral, aneurisma, malformación arteriovenosa o ictus hemorrágico previo • Ictus o AIT < 6 meses o cualquier déficit neurológico permanente • Negativa a recibir transfusiones de sangre • Hemorragia gastrointestinal o genitourinaria < 2 meses • Cirugía mayor < 6 semanas • Recuento de plaquetas conocido < 100.000/μl o hemoglobina < 100 g/l • Cirugía electiva programada • Implante de stent coronario < 30 días • Esperanza de vida < 1 año | 11 |
| ISAR-REACT 419 | ND | ECA multicéntrico | Angina o AI con marcadores cardiacos positivos | • Angina > 20 min o episodios recurrentes en un plazo de 48 h • Aumento de biomarcadores cardiacos • Estenosis coronaria que requiere ICP | • Infarto agudo de miocardio < 48 h • Shock cardiogénico • Pericarditis • Enfermedad maligna u otras comorbilidades con esperanza de vida < 1 año • Hemorragia activa o diátesis o antecedentes de hemorragia • Cualquier antecedente de hemorragia intracraneal o anomalías intracraneales estructurales • Negativa a recibir transfusiones • Presión arterial > 180/110 mmHg a pesar del tratamiento • ICP en etapas programadas en un plazo de 30 días o ICP en los 30 días previos • Hemoglobina < 100 g/l, recuento de plaquetas < 100 × 109/l o > 600 × 109/l • FG < 30 ml/min o creatinina sérica > 30 mg/l • Alergia o intolerancia a cualquiera de los fármacos del estudio o al acero inoxidable o a los medios de contraste • Embarazo • Cumarina en un plazo de 7 días • Inhibidores de la GPIIb/IIIa < 14 días, HNF en un plazo de 4 h, HBPM < 8 h y bivalirudina < 24 h | 10 |
| BRAVE-420 | 2009-2013 | ECA multicéntrico | IAMCEST | • Pacientes que acuden antes de transcurridas 24 h desde el inicio de los síntomas, con un dolor torácico de duración ≥ 20 min y con elevación del segmento ST ≥ 0,1 mV en al menos dos derivaciones de extremidades adyacentes o ≥ 0,2 mV en al menos dos derivaciones precordiales contiguas o un BRIHH de nueva aparición • Consentimiento informado por escrito | • Edad < 18 años • Shock cardiogénico o RCP prolongada • Hemorragia activa, diátesis hemorrágica, coagulopatía • Antecedentes de hemorragia gastrointestinal o genitourinaria en los 2 meses previos • Negativa a recibir transfusiones de sangre • Cirugía mayor en las últimas 6 semanas • Antecedentes de hemorragia intracraneal o anomalías estructurales • Sospecha de disección aórtica • AIT previo, ictus previo • Trombocitopenia inducida por heparina • Administración previa de trombolíticos, bivalirudina, HBPM o fondaparinux para el infarto de miocardio de calificación para el estudio • Anomalías hematológicas relevantes conocidas: hemoglobina < 100 g/l, recuento de plaquetas < 100 × 109/l • Uso de derivados de cumarina en los últimos 7 días • Tratamiento crónico con AINE (excepto ácido acetilsalicílico), inhibidores de COX-2, prasugrel, ticagrelor • Esperanza de vida < 1 año • Hepatopatía grave • Insuficiencia renal con FG < 30 ml/min y/o diálisis • Alergia conocida a las medicaciones del estudio • Inclusión previa en este ensayo • Mujeres gestantes, con potencial fértil y prueba de embarazo positiva o en fase de lactancia materna • Incapacidad de colaborar plenamente en la aplicación del protocolo del estudio | 10 |
| HEAT-PPCI21 | 2012-2013 | ECA monocéntrico | IAMCEST | • Pacientes con IAMCEST con activación de la vía ICP primaria | • Hemorragia activa en el momento de la presentación inicial • Factores que impiden la administración de tratamiento antiplaquetario oral • Intolerancia/contraindicación para la medicación del ensayo • Inclusión previa en este ensayo | 8 |
| SWITCH III22 | ND | ECA multicéntrico | Pacientes con IAMSEST tratados inicialmente con fondaparinux a los que se aplica una estrategia invasiva inicial | • Edad > 18 años • SCA sin elevación persistente del segmento ST que cumple ≥ 1 de los siguientes criterios: elevación de CK-MB o troponinas I o T (por encima del límite superior de la normalidad), o ECG indicativo de isquemia (elevación del segmento ST no persistente) • ICP programada • Disposición a cumplir las exigencias del estudio y firma voluntaria de un documento de consentimiento informado • Angioplastia ≥ 1 arteria coronaria con lesiones diana de estenosis < 100% • Tratamientos como ácido acetilsalicílico (dosis según la asistencia estándar en cada centro), clopidogrel con dosis de carga de 600 mg si no está en tratamiento crónico con clopidogrel 75 mg) | • Elevación del segmento ST en las 48 h previas • Peso > 400 libras (181,2 kg) o < 110 libras (50 kg) • Pacientes tratados con dosis distintas de 2,5 mg de fondaparinux subcutáneo o cualquier tratamiento con HBPM, inhibidores de la GPIIb/IIIa o bivalirudina en las 24 h previas • Tratamiento con HNF ≤ 90 min antes de la administración de fondaparinux • Diátesis hemorrágica conocida, tratamiento con warfarina o hemorragia activa en los 6 meses previos • Diagnóstico de endocarditis bacteriana aguda • Shock cardiogénico o necesidad de implantar bomba de balón intraaórtico • Ictus mayor/menor o AIT en los 6 meses previos • Disfunción renal (creatinina ≥ 3,0 mg/dl), trasplante renal, pacientes con angioplastia en los 30 días previos • Contraindicación HBPM, HNF o bivalirudina • Embarazadas o en fase de lactancia • Enfermedad de la coronaria principal izquierda sin protección, con estenosis ≥ 50% • Pacientes que requieren ICP en etapas • Trombo visualizado en la angiografía | 9 |
| BRIGHT23 | 2012-2013 | ECA multicéntrico | Pacientes con IAMCEST/IAMSEST programados para ICP inmediata de urgencia | • Edad 18-80 años • IAMCEST en un plazo de 12 h tras el inicio de los síntomas o en 12-24 h si hay dolor torácico persistente, elevación persistente del segmento ST o BRIHH de nueva aparición • IAMSEST en las 72 h siguientes al inicio de los síntomas • ICP inmediata de urgencia programada • Consentimiento informado por escrito antes del cateterismo | • Trombolisis en un plazo de 72 h • Shock cardiogénico • Uso de cualquier anticoagulante en las 48 h previas a la aleatorización • Hemorragia activa o diátesis hemorrágica • Hemoglobina < 100 g/l o recuento de plaquetas < 100 × 109/l • Aclaramiento de creatinina < 30 ml/min • Alergia conocida a los fármacos o dispositivos del estudio (incluida la trombocitopenia inducida por heparina) | 9 |
| TENACITY24 | 2011 | ECA monocéntrico | SCA | • ICP de riesgo moderado o alto: pacientes tratados con ICP electiva o urgente, con un SCA actual o reciente (< 1 mes; incluida la ICP primaria, pero no la de rescate), presencia o antecedentes de insuficiencia cardiaca, depresión de la función ventricular, enfermedad vascular periférica o diabetes mellitus insulinodependiente. Los pacientes podían ser incluidos también si la ICP incluía un tratamiento de una anatomía coronaria compleja | • Abciximab en un plazo de 14 días, tratamiento trombolítico en un plazo de 12 h o tirofibán, eptifibatida o HBPM en un plazo de 10 h | 8 |
| PROTECT-TIMI 3025 | 2003-2004 | ECA multicéntrico | SCA | • Edad 18-80 años • Hospitalización por AI/IAMSEST con molestias torácicas o equivalente anginoso en reposo > 10 min, compatibles con SCA, con al menos una característica de alto riesgo (es decir, diabetes mellitus, un resultado positivo de troponinas cardiacas T o I o CK-MB, desviación del segmento ST > 0,5 mm o puntuación TIMI de riesgo • ICP de una arteria coronaria nativa | • Hipertensión que no responde al tratamiento • IAMCEST en un plazo de 24 h • ICP en las 2 semanas previas • Defecto de conducción intraventricular, marcapasos • Hipertrofia ventricular izquierda o cualquier otro signo electrocardiográfico que pudiera hacer que el ECG continuo no fuera interpretable • Shock cardiogénico • Antecedentes de diátesis hemorrágica o signos de hemorragia activa en los últimos 30 días • Antecedentes de ictus hemorrágico en cualquier momento o ictus o AIT de cualquier etiología en los últimos 30 días • Recuento de plaquetas < 100.000/μl • Cirugía mayor en las 6 semanas previas • Uso de cualquier HBPM en las 12 h previas • Tratamiento con cualquier inhibidor de la GPIIb/IIIa en los 30 días previos o tratamiento simultáneo o previsto • Tratamiento simultáneo con warfarina • Aclaramiento de creatinina estimado < 30 ml/min • Tratamiento de reestenosis en el stent o previsión de ICP o ICP en etapas en un plazo de 48 h | 9 |
| MATRIX10 | Octubre de 2011-noviembre de 2014 | ECA multicéntrico | SCA o IAMCEST | En el caso del SCA: • Historia clínica compatible con isquemia de nueva aparición o agravamiento de la existente, que se produce en reposo o con actividad mínima • Inclusión en un plazo de 7 días de los síntomas más recientes • Angiografía coronaria planificada con indicación para ICP; al menos dos de los siguientes factores: edad ≥ 60 años; troponinas T o I o CK-MB por encima del límite superior de la normalidad; alteraciones del ECG compatibles con isquemia, es decir, depresión del segmento ST ≥ 1 mm en dos derivaciones contiguas, inversión de la onda T > 3 mm o cualquier desviación dinámica del segmento ST En caso de IAMCEST: • Dolor torácico > 20 min con elevación del segmento ST ≥ 1 mm en al menos dos derivaciones contiguas o con BRIHH de nueva aparición o depresión del segmento ST ≥ 1 mm en al menos dos derivaciones de V1-V3, con onda T terminal positiva • Ingreso en las 12 h tras el inicio de los síntomas o entre 12 y 24 h después del inicio con isquemia persistente o tratamiento fibrinolítico previo | • Pacientes que no pueden dar su consentimiento informado o con esperanza de vida < 30 días • Alergia o intolerancia a la bivalirudina o la HNF • Tratamiento con HBPM en las 6 h previas • Tratamiento con cualquier inhibidor de la GP en los 3 días previos • Contraindicaciones absolutas o alergia no premedicable al contraste yodado o cualquiera de las medicaciones del estudio, incluidos el ácido acetilsalicílico y el clopidogrel • Contraindicaciones para la angiografía, como enfermedad vascular periférica grave, entre otras • Si se conoce, un aclaramiento de creatinina < 30 ml/min o dependencia de diálisis • Inclusión previa en este estudio o ICP en los 30 días previos | 10 |
AI: angina inestable; AINE: antiinflamatorios no esteroideos; AIT: accidente isquémico transitorio; BRIHH: bloqueo de rama izquierda del haz de His; CK-MB: banda miocárdica de la creatincinasa; COX-2: ciclooxigenasa 2; ECA: ensayo clínico aleatorizado; ECG: electrocardiograma; FG: filtrado glomerular; GP: glucoproteína; GPIIb/IIIa: glucoproteína IIb/IIIa; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; INR: razón internacional normalizada; ND: no disponible; RCP: reanimación cardiopulmonar; SCA: síndrome coronario agudo; TIMI: Thrombolysis In Myocardial Infarction.
Manifestaciones clínicas de los pacientes de los estudios incluidos
| Estudio | Fármaco de estudio y diseño | Dosis bivalirudina | Dosis HNF | Bivalirudina (n) | HNF (n) | Seguimiento máximo (días) | Bivalirudina (media de edad) | HNF (media de edad) | Bivalirudina, varones (%) | HNF, varones (%) | Bivalirudina, DM (%) | HNF, DM (%) | Bivalirudina, inhibidores de la GP (%) | HNF inhibidores de la GP (%) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ACUITY7 | Bivalirudina periintervención o bivalirudina periintervención + inhibidores de la GPIIb/IIIa programados durante 12-18 h | 0,75 mg/kg en infusión en bolo de 1,75 mg/kg/h durante el tiempo que dura la intervención | Bolo de 60 UI/kg más infusión de 12 UI/kg/h | 5.228 | 2.561 | 365 | 63 | 63 | 74 | 73 | 28 | 28 | 53 | 97 |
| HAS5 | Bivalirudina periintervención en comparación con HNF | 1,0 mg/kg de peso corporal, seguido de una infusión en 4 h de 2,5 mg/kg/h y una infusión en 14-20 h de 0,2 mg/kg/h | Dosis en bolo de 175 U/kg seguido de infusión en 18-24 h a una velocidad de 15 U/kg/h | 2.161 | 2.151 | 180 | 63 | 62 | 77 | 78 | 21 | 21 | 0 | 0 |
| EUROMAX8 | Bivalirudina periintervención en comparación con heparina (uso provisional de inhibidores de la GPIIb/IIIa) | 0,75 mg/kg e infusión de 1,75 mg/kg/h durante al menos 4 h después de la ICP | 100 UI/kg o 60 UI con un inhibidor de la GPIIb/IIIa o enoxaparina | 1.089 | 1.109 | 30 | 61 | 62 | 73,7 | 77,6 | 11,7 | 15,3 | 11,5 | 69,1 |
| HORIZONS-AMI18 | Bivalirudina periintervención en comparación con HNF + inhibidores de la GPIIb/IIIa programados | 0,75 mg/kg e infusión de 1,75 mg/kg/h | Bolo de 60 UI/kg para alcanzar un TCA de 200-250 s | 1.800 | 1.802 | 1095 | 59,8 | 60,7 | 77,1 | 76,1 | 16,5 | 17,3 | 7,2 | 94,5 |
| ISAR-REACT 419 | Bivalirudina en comparación con HNF + abciximab programado | 0,75 mg/kg de bivalirudina, seguida de infusión de 1,75 mg/kg/h durante el tiempo que dura la intervención | Bolo de 70 U/kg de HNF | 860 | 861 | 365 | 67,5 | 67,5 | 76,9 | 76,8 | 28,3 | 29,8 | 0 | 100 |
| BRAVE-420 | Bivalirudina periintervención + prasugrel en comparación con HNF + clopidogrel (uso provisional de inhibidores de la GPIIb/IIIa) | 0,75 mg/kg, seguido de infusión de 1,75 mg/kg/h durante el tiempo que dura la intervención (ajuste por ERC) | Bolo de 70-100 U/kg de HNF | 271 | 277 | 30 | 61,4 | 61,4 | 76 | 79 | 17 | 15 | 3 | 6,1 |
| HEAT-PPCI21 | Bivalirudina periintervención en comparación con HNF (rescate de inhibidores de la GPIIb/IIIa) | Bolo de 0,75 mg/kg + infusión de 1,75 mg/kg/h durante el tiempo que dura la intervención | 70 U/kg de peso corporal antes de la intervención | 915 | 914 | 28 | 62,9 | 63,6 | 71,5 | 73,1 | 12,6 | 15,1 | 13,5 | 15,5 |
| SWITCH III22 | Bivalirudina periintervención en comparación con HNF (uso provisional de inhibidores de la GPIIb/IIIa) | Bolo de 0,75 mg/kg + infusión de 1,75 mg/kg/h durante el tiempo que dura la intervención | Bolo de 60 U/kg, ajustado para alcanzar y mantener un TCA > 200 s | 51 | 49 | Durante la hospitalización | 63,3 | 62,2 | 72,5 | 63,3 | 13,7 | 20,4 | 3,9 | 12,2 |
| BRIGHT23 | Bivalirudina periintervención en comparación con HNF (rescate de inhibidores de la GPIIb/IIIa) | Bolo de 0,75 mg/kg + infusión de 1,75 mg/kg/h | Heparina 100 U/kg en bolo + dosis adicional si TCA < 200 s | 735 | 1.459 | 365 | 57,3 | 58,2 | 82,7 | 81,9 | 22,9 | 21,4 | 4,4 | 52,8 |
| TENACITY24 | Bivalirudina periintervención + inhibidores de la GPIIb/IIIa programados en comparación con HNF + inhibidores de la GPIIb/IIIa programados | Bolo de 0,75 mg/kg + infusión de 1,75 mg/kg/h | 50 U/kg | 185 | 198 | 30 | – | – | – | – | – | – | 100 | 100 |
| PROTECT-TIMI 3025 | Bivalirudina periintervención frente a eptifibatida más HNF/enoxaparina | Bolo de 0,75 mg/kg + infusión de 1,75 mg/kg/h | Doble bolo de eptifibatida (180 μg/kg en infusión i.v. durante 18-24 h más un bolo de dosis reducida de HNF (50 U/kg) o 0,5 mg/kg | 284 | 573 | 48 h tras el alta | 59,7 | 60 | 68,3 | 66 | 44,4 | 36,5 | 0 | 99 |
| MATRIX10 | Bivalirudina periintervención frente a HNF (uso provisional de inhibidores de la GPIIb/IIIa, rescate solo en el grupo de bivalirudina) | Bivalirudina 0,75 mg/kg de peso corporal en bolo, seguido de infusión de 1,75 mg/kg/h hasta finalizar la ICP, y luego interrupción o prolongación (dosis plena hasta 4 h o dosis reducida de 0,25 mg/kg/h durante > 6 h) según la asignación | 70-100 U/kg (o 50-70 U/kg para pacientes tratados con inhibidores de la GPIIb/IIIa) | 3.610 | 3.603 | 30 | 65,4 | 65,4 | 75,7 | 75,7 | 22,6 | 21,8 | 4,6 | 25,9 |
DM: diabetes mellitus; ERC: enfermedad renal crónica; HNF: heparina no fraccionada; GP: glucoproteína; GPIIb//IIIa: glucoproteína IIb/IIIa; i.v.: intravenosa; TCA: tiempo de coagulación activado.
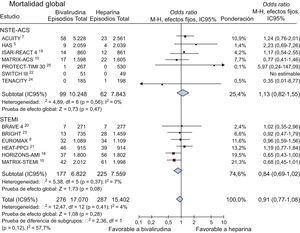
Se dispuso de datos sobre mortalidad total de 32.472 pacientes (99,1%). Se produjo la muerte de 563 (1,7%). Como se indica en la figura 2, no se observaron diferencias de mortalidad entre la bivalirudina y la HNF (el 1,6% [276 de 17.070] frente al 1,8% [287 de 15.402]; OR = 0,91; IC95%, 0,77-1,08; p = 0,28; p para la heterogeneidad = 0,41).
Bivalirudina en comparación con heparina no fraccionada en relación con la mortalidad total (en 30 días) con los valores de odds ratio y sus intervalos de confianza del 95%. El tamaño de los cuadrados es aproximadamente proporcional al peso estadístico de cada ensayo. IC95%: intervalo de confianza del 95%.
Se obtuvieron resultados similares en los pacientes con AI/IAMSEST (el 0,96% [99 de 10.248] frente al 0,8% [62 de 7.843]; OR = 1,13; IC95%, 0,82-1,55; p = 0,47; p para la heterogeneidad = 0,56) y en los pacientes con IAMCEST (el 2,6% [177 de 6.822] frente al 3% [225 de 7.559]; OR = 0,84; IC95%, 0,69-1,02; p = 0,08; p para la heterogeneidad = 0,37; p para la interacción = 0,12).
La ausencia de diferencias de mortalidad con el empleo de bivalirudina se confirmó al aplicar al análisis un modelo de efectos aleatorios (OR = 0,91; IC95%, 0,76-1,09; p = 0,31; p para la heterogeneidad = 0,41), sin que hubiera diferencia alguna en los pacientes con SCA sin elevación del segmento ST y aquellos con IAMCEST.
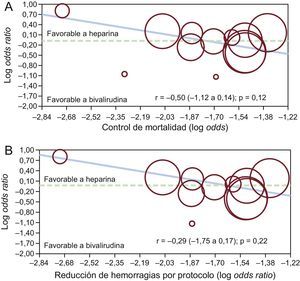
En el análisis de metarregresión no se observó una relación significativa entre los efectos beneficiosos en la mortalidad obtenidos con la bivalirudina en comparación con la HNF, y el perfil de riesgo de los pacientes o la reducción de las complicaciones hemorrágicas (r = –0,50 [–1,12 a 0,14]; p = 0,12, y r = –0,29 [–0,75 a 0,17]; p = 0,22) (figuras 3A y B respectivamente). La falta de influencia de la reducción de las complicaciones hemorrágicas en la supervivencia se observó de manera similar en los pacientes con AI/IAMSEST (r = –1,05 [–2,5 a 0,40]; p = 0,16) y aquellos con IAMCEST (r = –0,94 [–1,19 a 3,08]; p = 0,39).
Análisis de metarregresión de efectos fijos para el riesgo (odds ratio) de mortalidad con bivalirudina frente a heparina no fraccionada, según el perfil de riesgo de los pacientes (A) o la reducción de las hemorragias mayores con bivalirudina (B). El tamaño de los círculos corresponde al peso estadístico de cada estudio.
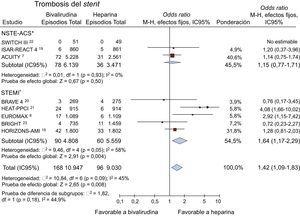
Se dispuso de datos relativos a la trombosis del stent de 19.977 pacientes (60,8%), procedentes de 8 estudios7,8,13–18. Se produjo trombosis del stent en 264 (1,3%) pacientes. La bivalirudina aumentó significativamente el riesgo de trombosis del stent (el 1,5% [168 de 10.947] frente al 1% [96 de 9.030]; OR = 1,42; IC95%, 1,09-1,83; p = 0,008; p para la heterogeneidad = 0,09) (figura 4).
Bivalirudina comparada con heparina no fraccionada en relación con las trombosis del stent (en 30 días) con los valores de odds ratio y sus intervalos de confianza del 95%. El tamaño de los cuadrados es aproximadamente proporcional al peso estadístico de cada ensayo. IC95%: intervalo de confianza del 95%; OR: odds ratio. *No se dispone de los datos del ensayo MATRIX10 según la forma de presentación clínica.
Al aplicar al análisis un modelo de efectos aleatorios, se confirmó una tendencia similar en cuanto a la bivalirudina (OR = 1,46; IC95%, 0,97-2,19; p = 0,07; p para la heterogeneidad = 0,09).
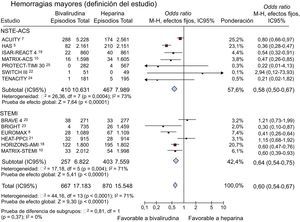
Complicaciones hemorrágicas mayores (según la definición del protocolo)Aplicando la definición del protocolo, se registraron hemorragias en los primeros 30 días tras la aleatorización en 32.731 pacientes (99,9%). Presentaron hemorragia mayor 1.537 pacientes (4,7%), con una reducción significativa de los episodios entre los pacientes tratados con bivalirudina en comparación con los tratados con HNF (el 3,9% [667 de 17.183] frente al 5,6% [870 de 15.548]; OR = 0,60; IC95%, 0,54-0,75; p < 0,00001; p para la heterogeneidad < 0,0001) (figura 5). Se obtuvieron resultados similares en los pacientes con SCA sin elevación del segmento ST (el 3,9% [410 de 10.361] frente al 5,8% [467 de 7.089]; OR = 0,58; IC95%, 0,50-0,67; p < 0,00001; p para la heterogeneidad = 0,0004) o con IAMCEST (el 3,7% [257 de 6.822] frente al 5,3% [403 de 7.559]; OR = 0,64; IC95%, 0,54-0,75; p < 0,00001; p para la heterogeneidad = 0,004; p para la interacción = 0,37).
Bivalirudina frente a heparina no fraccionada en relación con las complicaciones por hemorragia mayor según la definición del protocolo (en 30 días), con los valores de odds ratio y sus intervalos de confianza del 95%. El tamaño de los cuadrados es aproximadamente proporcional al peso estadístico de cada ensayo. IC95%: intervalo de confianza del 95%; OR: odds ratio.
Los resultados se confirmaron al aplicar al metanálisis un modelo de efectos aleatorios (OR = 0,60; IC95%, 0,46-0,77; p < 0,0001; p para la heterogeneidad < 0,0001).
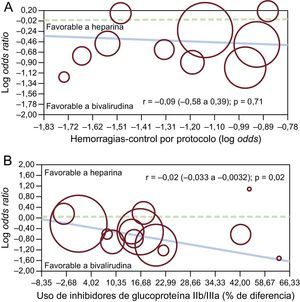
En el análisis de metarregresión, no se observó una relación significativa entre los beneficios aportados por bivalirudina en complicaciones hemorrágicas en comparación con HNF y los perfiles de riesgo de los pacientes (r = –0,09 [–0,58 a 0,39]; p = 0,71), mientras que sí se identificó una asociación positiva entre la reducción de los episodios hemorrágicos con bivalirudina y la diferencia en el porcentaje de uso de inhibidores de la GPIIb/IIIa (r = –0,02 [–0,033 a –0,0032]; p = 0,02) (figuras 6A y B).
Análisis de metarregresión de efectos fijos para el riesgo (odds ratio) de hemorragia mayor con bivalirudina frente a heparina no fraccionada según el perfil de riesgo de los pacientes (A) o la diferencia en el porcentaje de uso de inhibidores de la glucoproteína IIb/IIIa en los dos grupos (B). El tamaño de los círculos corresponde al peso estadístico de cada estudio.
Este es el más amplio metanálisis para evaluar la efectividad y la seguridad de la bivalirudina en comparación con la HNF en pacientes a los que se practica una angioplastia coronaria en el contexto de un SCA o un IAMCEST. El principal resultado es que la bivalirudina no reduce la mortalidad, en comparación con la HNF, pero aumenta las trombosis del stent. Sin embargo, la bivalirudina se asocia a una reducción significativa de las complicaciones hemorrágicas mayores, que se debe principalmente a lo observado en los ensayos en los que se utilizó un tratamiento antitrombótico más agresivo, con inhibidores de la GPIIb/IIIa en combinación con HNF, aunque esta reducción no se tradujo en beneficio en supervivencia.
La ICP es actualmente la estrategia más ampliamente elegida para el tratamiento de la enfermedad coronaria27, incluso ante las anatomías coronarias más complejas, y especialmente en el contexto de un IAMCEST, en el que la revascularización ha proporcionado una drástica mejora de los resultados clínicos en estos pacientes28–30. Los tratamientos antitrombóticos han tenido una contribución importante en la mejora de la perfusión del miocardio y en la prevención de las complicaciones trombóticas después de la ICP31–33. Sin embargo, el progresivo envejecimiento de la población y la creciente frecuencia de comorbilidades en los pacientes hospitalizados por un SCA hacen que el manejo de los fármacos antiagregantes plaquetarios y la anticoagulación resulten más complejos y requieran establecer un equilibrio entre el riesgo de trombosis y las complicaciones hemorrágicas34.
En los últimos años, la bivalirudina ha surgido como estrategia anticoagulante alternativa a la HNF durante la ICP. En el primer ensayo clínico aleatorizado (HAS [Hirulog Angioplasty Study])5 en el que se comparó la bivalirudina con la heparina en más de 4.000 pacientes tratados con ICP por un SCA reciente, la bivalirudina fue como mínimo igual de eficaz que la HNF en la prevención de episodios isquémicos y aportó también una reducción del riesgo de hemorragias.
Se obtuvieron resultados similares en el ensayo ACUITY7, en el que la bivalirudina produjo una reducción significativa de las complicaciones hemorrágicas mayores en la población tratada con ICP, aunque aumentó ligeramente la tasa de recurrencias de infarto de miocardio.
Se describieron unos efectos beneficiosos análogos en el ensayo HORIZONS-AMI18, en el que, a pesar de la mayor frecuencia de trombosis del stent, la bivalirudina redujo la mortalidad entre los pacientes tratados con ICP primaria, lo cual indica que los pacientes con IAMCEST de riesgo más elevado podrían ser los que obtuvieran el máximo efecto beneficioso del empleo de bivalirudina.
En consecuencia, las expectativas respecto al uso de la bivalirudina eran altas, al presentarla como el tratamiento más seguro, sobre todo en los contextos de uso en que hay mayor riesgo hemorrágico.
Sin embargo, el ensayo NAPLES-III35, en el que se incluyó a pacientes electivos tratados con ICP que tenían una puntuación de riesgo hemorrágico elevada, no ha mostrado un efecto beneficioso claro con el empleo de bivalirudina en vez de HNF. Se han obtenido resultados similares en el ensayo más amplio ISAR-REACT-36, en el que participaron pacientes tratados de manera electiva y pacientes inestables con troponina negativa y, a pesar de usarse la dosis más alta de HNF (140 UI/kg), se observó solo una reducción débil de los episodios de hemorragia mayor TIMI (Thrombolysis In Myocardial Infarction) con el empleo de bivalirudina.
De hecho, los pacientes con SCA a menudo tienen un riesgo de complicaciones hemorrágicas más alto que los pacientes con una enfermedad coronaria estable, y ello conduce a un peor resultado clínico36. Sin embargo, los efectos favorables de la bivalirudina en las complicaciones hemorrágicas se han puesto en duda en los ensayos más recientes que incluyeron a pacientes inestables, como los estudios SWITCH-III, BRAVE-4 y HEAT-PPCI20–22, y en los registros de la práctica clínica real. Concretamente, MacHaalany et al37 no han observado diferencias en los eventos adversos clínicos netos y las complicaciones isquémicas o hemorrágicas con el empleo de bivalirudina en comparación con la HNF, puesto que tanto una como otra redujeron las complicaciones isquémicas y hemorrágicas en los pacientes tratados con ICP por vía femoral, pero no en los tratados por vía radial, lo cual indica una posible interacción con la hemorragia en el lugar de acceso que influya en los resultados de la bivalirudina.
Además, en un metanálisis reciente, Cavender et al38 han mostrado claramente que los efectos favorables de la bivalirudina en las hemorragias mayores se observaban solo cuando se utilizaron inhibidores de la GPIIb/IIIa predominantemente solo en el grupo de estudio con HNF, de otro modo no tenían una influencia significativa en las hemorragias. Además, en este metanálisis, al compararlo con el empleo tradicional de HNF, un régimen basado en el uso de bivalirudina aumentó el riesgo de infarto de miocardio y trombosis del stent, lo cual confirmaba la alarma en cuanto a la seguridad que había aparecido ya en ensayos clínicos previos.
Con el objetivo de definir la seguridad y la efectividad de la bivalirudina en la ICP y esclarecer el papel del lugar de acceso y de los tratamientos concomitantes, el ensayo MATRIX10 ha incluido recientemente a más de 7.000 pacientes con SCA o IAMCEST en una doble aleatorización a bivalirudina o HNF y a ICP transradial o transfemoral. El estudio obtuvo resultados negativos para los objetivos de eventos cardiovasculares adversos mayores y episodios clínicos adversos netos, y no se observó que la bivalirudina fuera significativamente superior a la HNF a los 30 días, sino que mostró unas tasas de infarto de miocardio y trombosis del stent superiores a lo esperado. Además, no hubo una interacción significativa con la vía de acceso vascular.
Sin embargo, dado que el ensayo MATRIX incluyó tanto a pacientes con IAMCEST como con SCA sin IAMCEST, está pendiente de determinar si alguno de los subgrupos de pacientes definidos según la forma de presentación del SCA puede obtener un mayor efecto beneficioso con el uso de bivalirudina.
Teniendo en cuenta los resultados relevantes de este amplio ensayo reciente, el presente estudio es el metanálisis más actualizado de comparación de bivalirudina y HNF en pacientes tratados con ICP por un SCA, e incluye un subanálisis preespecificado según la forma de presentación.
Los resultados principales concuerdan con los de los estudios previos, que no muestran una diferencia de mortalidad entre las dos pautas de tratamiento antitrombótico. Tal como se preveía, la bivalirudina redujo significativamente la tasa de complicaciones hemorrágicas mayores, pero esta reducción no se tradujo en un efecto beneficioso en cuanto a la mortalidad. Además, la reducción observada en las complicaciones hemorrágicas mostró una relación significativa con la tasa de uso de inhibidores de la GPIIb/IIIa asociado al uso de HNF.
Así pues, a la vista de estos resultados, y teniendo en cuenta las posibles preocupaciones de seguridad por el mayor riesgo de revascularización urgente del vaso diana o trombosis del stent que se asocia al uso de bivalirudina10,38, y que no se ha resuelto con el empleo de una infusión de bivalirudina más prolongada tras la ICP, debe recomendarse el uso de las estrategias que están más validadas y requieren menor esfuerzo económico, como las estrategias tradicionales basadas en la HNF, para los pacientes con SCA a los que se practica una ICP.
LimitacionesLa primera limitación del presente estudio es la falta de un seguimiento prolongado. Sin embargo, la bivalirudina es un fármaco de administración intravenosa con un inicio de acción muy rápido y una semivida corta, por lo que produce sus efectos solo en el periodo periintervención. De hecho, incluso en los ensayos con un seguimiento más largo, las diferencias en cuanto a los objetivos cardiovasculares se alcanzaron en el primer mes tras la aleatorización18. Uno de los ensayos incluyó principalmente a pacientes con IAMCEST (el 87,7 frente al 12,3% de pacientes con IAMSEST)23. Dado que no fue posible obtener los datos en función de la forma de presentación, se combinó este estudio con los ensayos realizados en pacientes con IAMCEST.
Además, por lo que respecta al objetivo de trombosis del stent, se tuvo que excluir el ensayo MATRIX10 debido a que no disponía de datos por separado según la forma de presentación clínica. Sin embargo, los resultados obtenidos en la población general de este ensayo son coherentes con la observación de un aumento del riesgo de trombosis del stent en el grupo de bivalirudina, a pesar de administrarla en infusión prolongada.
Otra limitación es la variedad de protocolos de administración de la bivalirudina, de tal manera que en 2 ensayos se utilizó una infusión amplia tras la ICP8,10, así como las diferencias de posología de la HNF en los grupos de control, hasta el punto de que en dos ensayos incluso se permitió el uso de enoxaparina8,25. No obstante, en la mayoría de los estudios incluidos, la administración de la HNF se realizó a dosis similares, de entre 60 y 75 U/kg.
CONCLUSIONESEn los pacientes con SCA tratados con ICP, la bivalirudina no se asocia a una reducción de la mortalidad en comparación con la HNF y aumenta el riesgo de trombosis del stent. Además, la reducción de las complicaciones hemorrágicas observada con bivalirudina depende estrictamente de la tasa de uso de inhibidores de la GPIIb/IIIa y no se traduce en un efecto beneficioso en cuanto a la supervivencia.
CONFLICTO DE INTERESESNinguno.
- -
Las complicaciones hemorrágicas son el talón de Aquiles de los tratamientos antitrombóticos durante las ICP.
- -
Recientemente se han puesto en duda las ventajas descritas anteriormente en cuanto a la reducción del riesgo hemorrágico con el uso de bivalirudina durante la ICP, por posibles interacciones con la vía de acceso vascular y las estrategias concomitantes con antiagregantes plaquetarios.
- -
En el reciente ensayo MATRIX, la bivalirudina no aportó un efecto beneficioso en cuanto a la seguridad en comparación con la HNF y se asoció a tasas de infarto de miocardio y trombosis del stent mayores que lo esperado.
- -
Se presenta el más amplio metanálisis para evaluar la seguridad y la eficacia de la bivalirudina en comparación con la HNF, con la inclusión de los datos de los ensayos aleatorizados más recientes en el contexto del SCA.
- -
El principal resultado es que la bivalirudina no aporta un efecto beneficioso en reducción de la mortalidad en comparación con la HNF y que aumenta las trombosis del stent.
- -
Sin embargo, la bivalirudina se asocia a una reducción significativa de las complicaciones hemorrágicas mayores, que se debe principalmente a los ensayos en que se utilizó un tratamiento antitrombótico más agresivo con administración de inhibidores de la GPIIb/IIIa solo en combinación con la HNF, que no se tradujo en un efecto beneficioso en cuanto a la supervivencia.