La toma de decisiones clínicas sobre la anticoagulación de pacientes ancianos con fibrilación auricular (FA) requiere que se considere no solo la incidencia de eventos embólicos y hemorrágicos, sino también el riesgo de muerte tras esos efectos adversos. Nuestro objetivo es analizar el balance con respecto a la mortalidad entre los eventos embólicos y hemorrágicos en pacientes ancianos con FA.
MétodosSe analizó a todos los pacientes de 75 o más años de un área de salud española diagnosticados de FA entre 2014 y 2017 (n=9.365). El riesgo de muerte se estimó utilizando modelos de Cox que incluyeron los episodios embólicos y hemorrágicos como variables dependientes del tiempo.
ResultadosDurante una mediana de seguimiento de 4,0 años, los eventos se asociaron con mayor mortalidad, tanto los embólicos (HR=2,39; IC95%, 2,12-2,69) como los hemorrágicos (HR=1,79; IC95%, 1,64-1,96). El riesgo de muerte fue un 33% mayor después de una embolia que después de una hemorragia (rRR=1,33; IC95%, 1,15-1,55), aunque con accidente isquémico transitorio el riesgo fue menor que con hemorragia (rRR=0,79; IC95%, 0,63-0,99). La mortalidad tras una hemorragia intracraneal fue similar que tras una embolia mayor (RR=1,00; IC95%, 0,75-1,29).
ConclusionesEn los pacientes de edad avanzada con FA, los eventos embólicos parecen estar asociados con una mayor mortalidad que las hemorragias extracraneales, salvo los accidentes isquémicos transitorios. Con hemorragia intracraneal, el riesgo de muerte es similar al de una embolia mayor.
Palabras clave
La anticoagulación oral (ACO) reduce la frecuencia de eventos embólicos en los pacientes con fibrilación auricular (FA), si bien esta mejora se contrarresta por un aumento de las hemorragias. Se ha considerado tradicionalmente que las hemorragias son un precio aceptable por la ACO, si bien recientemente se ha demostrado que influyen de manera independiente en la mortalidad1.
La edad avanzada influye en muchos aspectos de la evaluación de riesgos y beneficios de la anticoagulación en pacientes con FA. Las guías de práctica clínica clasifican a todos los pacientes de 75 años o más como pacientes con alto riesgo de sufrir un ictus isquémico, con indicación para la anticoagulación tras una adecuada evaluación del riesgo hemorrágico2. No obstante, tomar una decisión con respecto al tratamiento profiláctico con antitrombóticos para estos pacientes plantea un dilema a muchos médicos, ya que los pacientes ancianos son un grupo heterogéneo, cuya enfermedad se complica por la presencia de factores funcionales y sociales que contribuyen a su vulnerabilidad, que sufren varias enfermedades y requieren polimedicación3. Aunque en los estudios y los ensayos observacionales se muestra que los beneficios de la ACO se amplían a los segmentos de mayor edad de la población con FA4, los datos reales muestran invariablemente que la tasa de prescripción de ACO está en relación inversa con la edad5. En consecuencia, hay que entender mejor los perfiles de riesgo de los pacientes para reducir la brecha entre los hallazgos epidemiológicos y la práctica clínica.
Mientras las incidencias de eventos embólicos y hemorrágicos dominan la decisión de prescribir anticoagulación a los pacientes con FA, la gravedad de tales episodios también debería incorporarse a la toma de decisiones clínicas para cada uno de los pacientes, en especial los complejos como los ancianos. Es crucial entender las implicaciones pronósticas de los eventos embólicos, sobre todo el ictus isquémico, en relación con los resultados de los eventos hemorrágicos para ayudar a los médicos a seleccionar a los pacientes candidatos a ACO. No obstante, el impacto a largo plazo de las hemorragias en pacientes con FA se ha investigado en menor medida que el de los eventos embólicos6. Asimismo, el efecto en la mortalidad tras un episodio embólico según su gravedad sigue sin estar claro. En este estudio, que se basa en un amplio registro de pacientes con FA, se compara el impacto relativo de los eventos embólicos y hemorrágicos en la mortalidad por cualquier causa.
MÉTODOSPoblación del estudioLa cohorte del estudio estaba formada por todos los pacientes de 75 años o más del área sanitaria de Vigo (Pontevedra, España) a los que se diagnosticó FA entre enero de 2014 y diciembre de 2017 (registro CardioCHUVI-AF_75; ClinicalTrials.gov Identificador: NCT04364516). Las historias clínicas electrónicas se revisaron meticulosamente para confirmar el diagnóstico de FA y recopilar datos sobre las variables clínicas basales y la estrategia terapéutica. En todos los pacientes, el diagnóstico de FA solo se confirmó cuando se basaba en un electrocardiograma. El estudio se llevó a cabo según los principios de la Declaración de Helsinki y fue aprobado por el comité de ética local (Comité autonómico de ética en la investigación de Galicia, código HAC-ACO-2018-01, registro 2018/258). No se requirió el consentimiento informado para el presente estudio.
ResultadosEn este estudio de seguimiento retrospectivo, el objetivo principal era la mortalidad por cualquier causa durante el seguimiento. Se inició tras la evaluación clínica inicial del paciente por FA entre enero de 2014 y diciembre de 2017, y se extendió hasta junio de 2020. Las defunciones se clasificaron como cardiovasculares o no cardiovasculares. La muerte cardiovascular se definió como muerte debida a infarto agudo de miocardio, muerte súbita cardiaca, muerte por insuficiencia cardiaca, ictus, intervenciones cardiovasculares, hemorragia cardiovascular u otras causas cardiovasculares7. El objetivo de este estudio es evaluar la relación existente entre la mortalidad y: a) cualquier evento embólico, y b) cualquier evento hemorrágico. Los eventos embólicos fueron: ictus isquémico, accidente isquémico transitorio (AIT), embolia pulmonar y embolia sistémica. Tanto la embolia pulmonar como la sistémica se clasificaron como embolias no cerebrales (que no afectan al sistema nervioso central [SNC]). La embolia mayor incluye la combinación de ictus isquémico y embolia no cerebral7. Los eventos hemorrágicos se clasificaron según el informe de la International Society on Thrombosis and Haemostasis (ISTH) como hemorragia mayor (HM) y hemorragia no mayor (HNM) clínicamente relevante8,9. Según la localización, la HM se clasificó como hemorragia intracraneal (HIC) o HM no intracraneal (HMNI). En el epígrafe «Definición y clasificación de los episodios adversos» del material adicional se detalla más información sobre la definición de cada uno de los eventos embólicos y hemorrágicos.
Análisis estadísticosLas variables basales se recopilaron en función de si tuvo lugar una embolia o un episodio hemorrágico durante el seguimiento. Los datos continuos expresan media±desviación estándar y se compararon mediante la prueba de la t de Student para datos independientes. Los datos categóricos expresan cifras absolutas (y relativas) y se compararon con la prueba de la χ2. Mediante diagramas de Venn se ilustró la relación entre eventos hemorrágicos y embólicos.
El riesgo de muerte por cualquier causa se investigó mediante el modelo de riesgos proporcionales de Cox. Todos los modelos descritos a continuación incluían eventos embólicos y hemorrágicos como indicadores binarios dependientes del tiempo, así como variables de confusión significativas como covariables. Se analizaron las variables demográficas, antropométricas, clínicas, ecocardiográficas y analíticas, así como el tratamiento farmacológico, como posibles factores de confusión (tabla 1 del material adicional). Se seleccionó el modelo mejor ajustado en función del criterio de información de Akaike. Se obtuvieron los cocientes de riesgos instantáneos (hazard ratio [HR]) y los valores de p para el riesgo de muerte por cualquier causa asociados con los eventos hemorrágicos y embólicos. El riesgo de episodios recurrentes se modeló teniendo en cuenta la primera aparición de un evento de cada tipo, mientras que los de distinta gravedad (HNM seguida de HIC) se consideraron covariables independientes. En el caso de los pacientes que sufrieron un evento hemorrágico y uno embólico, se contaron ambos episodios y se consideró predictor de mortalidad a cada uno por separado como (es decir, los modelos incluían covariables para los eventos hemorrágico y embólico). El riesgo relativo de los eventos embólico y hemorrágico se calculó a partir de los mismos modelos, y se expresó como la razón de riesgo relativo (rRR)10.
Se hicieron otros análisis para investigar la naturaleza dependiente del tiempo de la mortalidad asociada con los eventos hemorrágicos y embólicos como una función del tiempo transcurrido desde el episodio, para lo cual se usó el método de supervivencia de Royston y Parmar, con modelos paramétricos y flexibles de supervivencia. La forma funcional de la relación entre el riesgo de muerte ajustado y el tiempo transcurrido desde el evento hemorrágico o embólico se ajustó con polinomios fraccionarios y se representó la curva resultante junto con el intervalo de confianza del 95% (IC95%) de la media.
Todas las pruebas fueron bilaterales, y la significación estadística se estableció con p <0,05. Todos los análisis se hicieron con la versión 15 del software STATA (StataCorp., Estados Unidos).
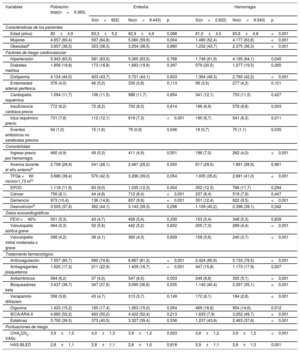
RESULTADOSSe estudió a 9.365 pacientes de 75 años o más con un diagnóstico confirmado de FA. Un total de 7.557 pacientes recibieron anticoagulantes (80,7%); de estos, 6.360 con antagonistas de la vitamina K (84,2%), 1.070 con anticoagulantes orales de acción directa (NACO) (14,1%) y 127 con heparina (1,7%). En el caso de los pacientes tratados con antagonistas de la vitamina K, la proporción con razón internacional normalizada (INR) en el intervalo terapéutico (entre 2 y 3) fue del 45,2%. El 30,2% de los pacientes tratados con NACO recibieron una dosis inapropiada. Durante una mediana de seguimiento de 4,0 [intervalo intercuartílico, 2,1-5,2] años, 2.822 pacientes (30,1%) sufrieron eventos hemorrágicos y 922, embólicos (9,8%). En la tabla 1 se resumen las características basales de los pacientes que tuvieron eventos hemorrágicos y embólicos durante el seguimiento.
Características demográficas y clínicas basales por aparición de embolia y hemorragia
| Variables | Población total(n=9.365) | Embolia | Hemorragia | ||||
|---|---|---|---|---|---|---|---|
| Sí(n=922) | No(n=8.443) | p | Sí(n=2.822) | No(n=6.543) | p | ||
| Características de los pacientes | |||||||
| Edad (años) | 83±4,9 | 83,3±5,2 | 82,9±4,9 | 0,088 | 81,0±4,5 | 83,8±4,8 | <0,001 |
| Mujeres | 4.657 (60,4) | 597 (64,8) | 5.060 (59,9) | 0,004 | 1.480 (52,4) | 4.177 (63,8) | <0,001 |
| Obesidada | 3.607 (38,5) | 353 (38,3) | 3.254 (38,5) | 0,880 | 1.232 (43,7) | 2.375 (36,3) | <0,001 |
| Factores de riesgo cardiovascular | |||||||
| Hipertensión | 5.943 (63,5) | 581 (63,0) | 5.365 (63,5) | 0,768 | 1.748 (61,9) | 4.195 (64,1) | 0,045 |
| Diabetes mellitus | 1.856 (19,8) | 173 (18,8) | 1.683 (19,9) | 0,397 | 579 (20,5) | 1.277 (19,5) | 0,265 |
| Dislipemia | 4.124 (44,0) | 403 (43,7) | 3.721 (44,1) | 0,833 | 1.364 (48,3) | 2.760 (42,2) | <0,001 |
| Enfermedad arterial periférica | 376 (4,0) | 46 (5,0) | 330 (3,9) | 0,113 | 99 (3,5) | 277 (4,2) | 0,101 |
| Cardiopatía isquémica | 1.094 (11,7) | 106 (11,5) | 988 (11,7) | 0,854 | 341 (12,1) | 753 (11,5) | 0,427 |
| Insuficiencia cardiaca previa | 772 (8,2) | 72 (8,2) | 700 (8,3) | 0,614 | 196 (6,9) | 576 (8,8) | 0,003 |
| Ictus isquémico previo | 731 (7,8) | 112 (12,1) | 619 (7,3) | <0,001 | 190 (6,7) | 541 (8,3) | 0,011 |
| Eventos embólicos no cerebrales previos | 94 (1,0) | 15 (1,6) | 79 (0,9) | 0,046 | 19 (0,7) | 75 (1,1) | 0,035 |
| Comorbilidad | |||||||
| Ingreso previo por hemorragia | 460 (4,9) | 49 (5,3) | 411 (4,9) | 0,551 | 198 (7,0) | 262 (4,0) | <0,001 |
| Anemia durante el año anteriorb | 2.708 (28,9) | 241 (26,1) | 2.467 (29,2) | 0,050 | 817 (29,0) | 1.891 (28,9) | 0,961 |
| TFGe <60 ml/min/1,73 m2c | 3.686 (39,4) | 570 (42,3) | 3.296 (39,0) | 0,054 | 1.005 (35,6) | 2.681 (41,0) | <0,001 |
| EPOC | 1.118 (11,9) | 83 (9,0) | 1.035 (12,3) | 0,004 | 352 (12,5) | 766 (11,7) | 0,294 |
| Cáncer | 756 (8,1) | 44 (4,8) | 712 (8,4) | <0,001 | 237 (8,4) | 519 (7,9) | 0,447 |
| Demencia | 973 (10,4) | 136 (14,8) | 837 (9,9) | <0,001 | 351 (12,4) | 622 (9,5) | <0,001 |
| Desnutriciónd | 3.505 (37,4) | 362 (44,1) | 3.143 (39,3) | 0,298 | 1.109 (40,2) | 2.396 (39,1) | 0,342 |
| Datos ecocardiográficos | |||||||
| FEVI <40% | 501 (5,3) | 43 (4,7) | 458 (5,4) | 0,330 | 153 (5,4) | 348 (5,3) | 0,839 |
| Valvulopatía aórtica grave | 494 (5,3) | 52 (5,6) | 442 (5,2) | 0,602 | 205 (7,3) | 289 (4,4) | <0,001 |
| Valvulopatía mitral moderada o grave | 398 (4,2) | 38 (4,1) | 360 (4,3) | 0,839 | 158 (5,6) | 240 (3,7) | <0,001 |
| Tratamiento farmacológico | |||||||
| Anticoagulación | 7.557 (80,7) | 690 (74,8) | 6.867 (81,3) | <0,001 | 2.424 (85,9) | 5.133 (78,5) | <0,001 |
| Antiagregantes plaquetarios | 1.620 (17,3) | 211 (22,9) | 1.409 (16,7) | <0,001 | 447 (15,8) | 1.173 (17,9) | 0,007 |
| Antiarrítmicos | 584 (6,2) | 37 (4,0) | 547 (6,5) | 0,003 | 249 (8,8) | 335 (5,1) | <0,001 |
| Bloqueadores beta | 3.437 (36,7) | 347 (37,6) | 3.090 (36,6) | 0,535 | 1.140 (40,4) | 2.297 (35,1) | <0,001 |
| Verapamilo-diltiazem | 356 (3,8) | 43 (4,7) | 313 (3,7) | 0,149 | 172 (6,1) | 184 (2,8) | <0,001 |
| Digoxina | 1.423 (15,2) | 160 (17,4) | 1.263 (15,0) | 0,054 | 469 (16,6) | 954 (14,6) | 0,012 |
| IECA/ARA-II | 4.885 (52,2) | 463 (50,2) | 4.422 (52,4) | 0,213 | 1.633 (7,9) | 3.252 (49,7) | <0,001 |
| Estatinas | 3.700 (39,5) | 373 (40,5) | 3.327 (39,4) | 0,536 | 1.237 (43,8) | 2.463 (37,6) | <0,001 |
| Puntuaciones de riesgo | |||||||
| CHA2DS2-VASc | 3,9±1,2 | 4,0±1,3 | 3,9±1,2 | 0,003 | 3,8±1,2 | 3,9±1,2 | <0,001 |
| HAS-BLED | 2,8±1,1 | 2,8±1,1 | 2,8±1,0 | 0,818 | 2,9±1,1 | 2,8±1,0 | 0,001 |
ARA-II: antagonistas del receptor de la angiotensina II; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 [doble], diabetes, ictus [doble], enfermedad vascular, edad 65-74 años y sexo [mujer]; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HAS-BLED: hipertensión, función renal/hepática anómala, ictus, antecedentes de hemorragia o predisposición, razón internacional normalizada lábil, edad avanzada, consumo simultáneo de alcohol y drogas; IECA: inhibidores de la enzima de conversión de la angiotensina; TFGe: tasa de filtrado glomerular estimada.
Los datos expresan n (%) para las variables discretas y media±desviación estándar para las variables continuas.
Según la Organización Mundial de la Salud, se considera anemia una concentración de hemoglobina <12,0g/dl en mujeres y <13,0g/dl en varones. No se incluyó la anemia posterior a un traumatismo o una intervención quirúrgica.
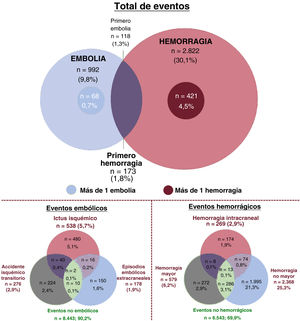
La mayoría de los eventos hemorrágicos fueron HNM (n=2.368; el 83,9% del total de eventos hemorrágicos) y la mayoría de las embolias fueron ictus isquémicos (n=538; el 58,3% del total de eventos embólicos) (información ampliada en la tabla 2 del material adicional). Se registraron HIC en 269 pacientes (2,9%). En el 4,5% de los pacientes (n=421) tuvo lugar más de un episodio hemorrágico, mientras que en el 0,7% (n=68) ocurrieron múltiples embolias (figura 1). Los pacientes que sufrieron hemorragia e ictus isquémico durante el seguimiento fueron el 3,1% (n=291), en proporciones similares entre los que sufrieron un episodio hemorrágico (1,8%) o una embolia (1,3%) como primer evento.
Distribución de los eventos hemorrágicos y embólicos en la población del estudio. El diagrama de Venn muestra a los pacientes que sufren hemorragias (en rojo) y embolias (en azul). Los círculos más pequeños representan a los pacientes que sufren más de un evento durante el seguimiento. La intersección representa a los pacientes que sufren embolias y hemorragias durante el seguimiento.
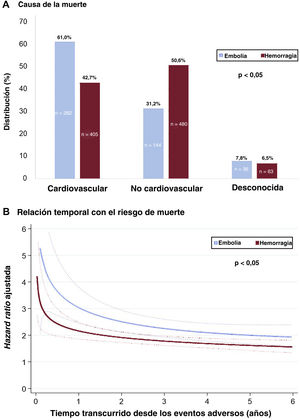
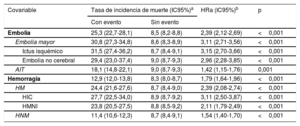
Fallecieron 3.146 pacientes (33,6%). Tanto los eventos hemorrágicos como los embólicos se asociaron con mayor riesgo de muerte (tabla 2). En los pacientes que sufrieron cualquier tipo de hemorragia (HM y HNM clínicamente relevante), el riesgo de muerte fue un 79% mayor que para los que no (HR ajustada [HRa] = 1,79; IC95%, 1,64-1,96; p <0,001). Aunque el mayor riesgo de muerte se daba después de una HIC (HRa = 3,11; IC95%, 2,50-3,87; p <0,001), la HNM clínicamente relevante también se asoció con un aumento significativo del riesgo de muerte (HRa = 1,54; IC95%, 1,40-1,70; p <0,001). Para los pacientes que sufrieron un evento embólico, el aumento del riesgo de muerte fue el doble (HRa = 2,39; IC95%, 2,12-2,69; p <0,001). El mayor riesgo de muerte después de una embolia fue con un ictus isquémico (HRa = 3,11; IC95%, 2,50-3,87; p <0,001) y el menor, con un AIT (HRa = 1,42; IC95%, 1,15-1,76; p <0,001). Tras una embolia, la mayor parte de las muertes fueron cardiovasculares (61,0%), mientras que tras un episodio hemorrágico la mayoría fueron no cardiovasculares (50,6%) (figura 2A). Tanto tras una hemorragia como una embolia, el riesgo de muerte fue mayor en los primeros meses después del evento; el riesgo se disipaba tras el primer año, pero siguió manteniendo un impacto pronóstico importante durante varios años (figura 2B).
Asociación entre el riesgo de muerte y los eventos embólicos y hemorrágicos
| Covariable | Tasa de incidencia de muerte (IC95%)a | HRa (IC95%)b | p | |
|---|---|---|---|---|
| Con evento | Sin evento | |||
| Embolia | 25,3 (22,7-28,1) | 8,5 (8,2-8,8) | 2,39 (2,12-2,69) | <0,001 |
| Embolia mayor | 30,8 (27,3-34,8) | 8,6 (8,3-8,9) | 3,11 (2,71-3,56) | <0,001 |
| Ictus isquémico | 31,5 (27,4-36,2) | 8,7 (8,4-9,1) | 3,15 (2,70-3,66) | <0,001 |
| Embolia no cerebral | 29,4 (23,0-37,4) | 9,0 (8,7-9,3) | 2,96 (2,28-3,85) | <0,001 |
| AIT | 18,1 (14,8-22,1) | 9,0 (8,7-9,3) | 1,42 (1,15-1,76) | 0,001 |
| Hemorragia | 12,9 (12,0-13,8) | 8,3 (8,0-8,7) | 1,79 (1,64-1,96) | <0,001 |
| HM | 24,4 (21,6-27,6) | 8,7 (8,4-9,0) | 2,39 (2,08-2,74) | <0,001 |
| HIC | 27,7 (22,5-34,0) | 8,9 (8,7-9,2) | 3,11 (2,50-3,87) | <0,001 |
| HMNI | 23,8 (20,5-27,5) | 8,8 (8,5-9,2) | 2,11 (1,79-2,49) | <0,001 |
| HNM | 11,4 (10,6-12,3) | 8,7 (8,4-9,1) | 1,54 (1,40-1,70) | <0,001 |
AIT: accidente isquémico transitorio; HIC: hemorragia intracraneal; HM: hemorragia mayor; HMNI: hemorragia mayor no intracraneal; HNM: hemorragia no mayor; HRa: hazard ratio ajustada; IC95%: intervalo de confianza del 95%.
Por último se aplicaron ajustes por características influyentes significativas: edad, sexo femenino, obesidad, factores de riesgo cardiovascular (hipertensión, diabetes mellitus, dislipemia), arteriopatía periférica, insuficiencia cardiaca previa, eventos embólicos previos (ictus isquémico y embolia extracraneal), comorbilidades (anemia durante el año anterior, tasa de filtrado glomerular estimada por la ecuación Chronic Kidney Disease Epidemiology Collaboration [CKD-EPI] <60ml/min/1,73 m2, enfermedad pulmonar obstructiva crónica, antecedentes de cáncer, demencia, riesgo de desnutrición según un Controlling Nutritional Status [CONUT] ≥ 3 puntos), datos ecocardiográficos (fracción de eyección del ventrículo izquierdo <40%, valvulopatías aórtica y mitral graves), tratamientos farmacológicos (anticoagulantes, antiagregantes plaquetarios, antiarrítmicos, bloqueadores beta, verapamilo-diltiazem, digoxina, inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de la angiotensina II y estatinas) y las puntuaciones de riesgo (CHA2DS2-VASc y HAS-BLED).
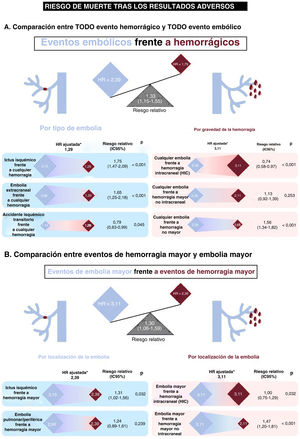
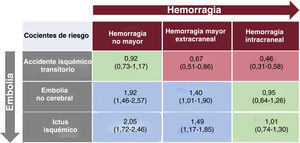
En la figura 3A se muestra gráficamente el impacto relativo en la mortalidad de un episodio embólico frente a uno hemorrágico. El riesgo relativo de muerte era un 33% mayor para los pacientes que sufrieron una embolia que en los que sufrieron un evento hemorrágico (2,39 frente a 1,79; rRR = 1,33; IC95%, 1,15-1,55; p <0,001). El aumento del riesgo de muerte observado después de un evento embólico, comparado con uno hemorrágico, también se mantuvo al limitar los análisis a los pacientes con eventos adversos graves (figura 3B). Al comparar uno a uno los distintos eventos embólicos con los hemorrágicos, el riesgo de muerte tras un evento adverso fue siempre mayor con los embólicos que con los hemorrágicos, salvo en el caso de la HIC (mayor riesgo que con un AIT y un riesgo similar que con embolia mayor) y el AIT (menor riesgo que con HM y similar que con HNM) (figura 4). También se evaluó el impacto en el riesgo de muerte de la ACO en el momento de los eventos hemorrágico o embólico (tabla 3 del material adicional). El riesgo relativo de muerte en el caso de una embolia comparado con un evento hemorrágico fue similar para los pacientes con ACO y los que no los tomaban (rRR = 1,34; IC95%, 1,13-1,60; p <0,001; y rRR = 1,23; IC95%, 0,97-1,57; p=0,084; p para interacción = 0,686), sin diferencias entre los pacientes con antagonistas de la vitamina K y los tratados con NACO (figura 1 y figura 2 del material adicional).
Impacto diferencial de los eventos embólicos frente a los hemorrágicos en la mortalidad. A: los rombos azules representan la magnitud (HR ajustada) del impacto en la mortalidad de los distintos tipos de eventos embólicos y los rombos rojos, lo mismo para los distintos tipos de gravedad de la hemorragia; se proporciona la estimación del riesgo relativo (proporción de la HR) para cada comparación. B: la comparación se centra únicamente en los eventos graves; la hemorragia mayor (HM) incluye la HIC y la hemorragia mayor no intracraneal (HMNI). La embolia mayor incluye el ictus isquémico, la embolia pulmonar y la embolia arterial periférica. HIC: hemorragia intracraneal; HR: hazard ratio; IC95%: intervalo de confianza del 95%. *Las estimaciones del impacto de los eventos en la mortalidad se derivan de un modelo multivariante (véase la tabla 1).
Estimaciones del riesgo relativo (cocientes de las hazard ratio) de muerte para la comparación entre distintos eventos embólicos y hemorrágicos en función de su gravedad. Las estimaciones del impacto de los eventos en la mortalidad se derivan de un modelo multivariante en el que cada episodio se consideró por separado como un indicador binario de la mortalidad dependiente del tiempo, además de las demás covariables (véase el ajuste multivariante en la tabla 1).
Según nuestro conocimiento, este es el primer estudio observacional en condiciones reales que compara el impacto pronóstico de las embolias y las hemorragias en la mortalidad de una cohorte de pacientes ancianos con FA. Los resultados principales son los siguientes: a) tanto los eventos embólicos como los hemorrágicos se relacionan con un mayor riesgo de muerte; b) los eventos embólicos tienen mayor valor pronóstico de mortalidad que los hemorrágicos, ya sean los eventos graves como en general, aunque este valor depende de los tipos de embolia o hemorragia; c) la mortalidad por AIT fue menor que por HM, y la mortalidad por HIC fue similar que por embolia mayor (ictus isquémico o embolia no cerebral); d) la principal causa de muerte tras un evento adverso es distinta con las embolias que con las hemorragias (no cardiovasculares); e) la evolución temporal del riesgo asociado de muerte fue similar con ambos tipos de evento, y el riesgo es mayor poco después del evento y disminuye tras el primer año, aunque con impacto pronóstico significativo durante varios años.
En el presente estudio, los eventos embólicos casi triplicaron el riesgo de muerte de los pacientes con FA, y la mayoría de ellos fallecieron dentro del primer año después del episodio. Aunque los eventos embólicos se asociaron con un peor pronóstico a largo plazo, la mayor mortalidad tras un evento adverso se da con el ictus isquémico. En numerosos estudios se ha documentado un elevado riesgo de muerte a causa de un ictus isquémico relacionado con FA, incluso a largo plazo6,11. En la cohorte con FA del estudio ATRIA, el 40% de los pacientes que sufrieron un ictus isquémico fallecieron en el plazo 1 año tras el ictus6. En este estudio, con una cohorte de pacientes más coetánea, se observó una tasa de incidencia de muerte tras ictus isquémico de 31,5/100 pacientes/año y tras un AIT, 18,1/100 pacientes/año. La relación entre el AIT y la mortalidad se ha documentado en otros sitios, con una disminución de la supervivencia a corto y largo plazo del 5% el primer año y el 20% durante los 10 años siguientes12,13. A diferencia del riesgo y de las secuelas de la embolia cerebral, que están bien caracterizados, se sabe mucho menos sobre los resultados asociados con los eventos embólicos no cerebrales en la FA. A partir de los datos agrupados retrospectivamente de 4 ensayos aleatorizados publicados, Bekwelem et al.14 mostraron que la mortalidad a 30 días fue similar entre los pacientes que sufrieron eventos embólicos sistémicos o ictus. Estos resultados de los ensayos clínicos se confirmaron en poblaciones en condiciones reales y los hallazgos se mantuvieron durante el seguimiento a largo plazo. En el presente estudio, las HRa de las mortalidades con ictus isquémico y con embolia no cerebral fueron similares. En consecuencia, e incluso a pesar de que los estudios observacionales y los ensayos aleatorizados se han basado casi por completo en la prevención del ictus, tanto el ictus isquémico como las embolias no cerebrales (sistémica y pulmonar) deberían considerarse por igual como eventos de embolia mayor.
En contraste con el énfasis puesto en el pronóstico asociado con los eventos embólicos, pocos estudios han informado de la supervivencia a largo plazo tras una hemorragia en el contexto de la FA. En estudios previos se ha demostrado que es la HIC lo que mayormente determina malos resultados en los pacientes que reciben ACO15 y, como resultado, el riesgo de HMNI debería tener un efecto relativamente pequeño en las decisiones sobre el tratamiento con ACO en la FA. Aunque es verdad que las hemorragias extracraneales derivan en hospitalizaciones, intervenciones invasivas y suspensión del tratamiento antitrombótico, el impacto funcional a largo plazo de tales hemorragias se considera en general muy inferior al de la HIC o el ictus isquémico. No obstante, datos recientes del ensayo ARISTOTLE mostraron que tanto la HMNI como la HNM clínicamente pertinente se relacionan con un riesgo considerablemente aumentado de morir a los 30 días16,17. Se confirmó que no solo la HIC se asocia de manera independiente con un riesgo de muerte considerablemente mayor, sino también la HM y la HNM. Cabe destacar que estos resultados muestran de manera clara que el efecto negativo de la hemorragia en la supervivencia persiste mucho más allá del episodio inicial, lo que demuestra que las tasas de mortalidad a 30 días son una estimación conservadora del efecto de la hemorragia en la supervivencia.
Aparte de mirar el pronóstico particular de embolias y hemorragias, este estudio equilibra por primera vez el riesgo de muerte a largo plazo asociado con las embolias y las hemorragias. Esta estrategia es especialmente interesante cuando se evalúa el riesgo de muerte y es crucial cuando se toman decisiones sobre ACO, sobre todo en poblaciones complejas con alto riesgo de eventos embólicos y hemorrágicos (p. ej., pacientes ancianos). Se constata que el peso de la mortalidad debida a un evento embólico (excepto el AIT) es mayor que por un evento hemorrágico (excepto la HIC). Esto coincide con la percepción subjetiva. Devereaux et al.18 revelaron que tanto los pacientes como los médicos están dispuestos a aceptar un riesgo de HNI mucho mayor a cambio de que conlleve una reducción del riesgo de ictus.
La elección de la ACO para pacientes con FA depende en mayor grado de equilibrar una reducción en la incidencia de los eventos embólicos esperados tras la ACO con una incidencia de hemorragias aumentada. El beneficio clínico neto es un objetivo que se ha hecho popular para dar cuenta tanto de la eficacia como de las hemorragias. No obstante, existe un riesgo intrínseco de interpretación errónea cuando los elementos son heterogéneos en cuanto a importancia, número de eventos o magnitud del efecto terapéutico. En este contexto, es imaginable que, si la HNM y el ictus isquémico van en direcciones distintas pero la HNM ocurre con mayor frecuencia, el beneficio clínico neto se decantará por el tratamiento con un menor número de eventos, independientemente de su importancia clínica. Así pues, en los estudios que tienen por objetivo jerarquizar o ponderar los eventos según su importancia clínica, es muy importante minimizar los desequilibrios resultado de diferencias en la dirección y la magnitud de cada uno de los elementos del criterio de valoración10. Aunque hasta la fecha las pruebas sobre cómo ponderar los diversos tipos de hemorragia en los objetivos combinados frente a los distintos tipos de embolia son escasas. Los resultados de este estudio podrían ser útiles, ya que indican un modo más objetivo de ponderar los eventos embólicos y hemorrágicos. Los datos sobre la mortalidad esperada de las embolias asociadas con FA, frente a eventos hemorrágicos, son esenciales cuando se evalúan los resultados de los ensayos clínicos y se intenta mejorar cómo los médicos y los pacientes seleccionan el tratamiento antitrombótico para la FA. Los médicos deberían informar a los pacientes sobre los riesgos de muerte asociados con las embolias y las hemorragias para facilitar la toma de decisiones compartida sobre la anticoagulación, en especial para pacientes complejos como los ancianos. Los resultados de este estudio pueden modificar los umbrales —tanto de los médicos como de los pacientes— sobre el exceso de riesgo hemorrágico que se considera aceptable con los tratamientos antitrombóticos y la reducción del riesgo embólico que se estima necesaria para justificar el tratamiento con ACO.
Limitaciones y fortalezas del estudioEl presente estudio refleja la experiencia en condiciones reales de una gran cohorte extrahospitalaria formada por pacientes ancianos con FA seguidos durante más de 4 años. La población es de pacientes no seleccionados con un riesgo de muerte y de sufrir hemorragia probablemente mayor que el de los pacientes no seleccionados de la práctica clínica. Los episodios del presente estudio se validaron mediante una revisión de las historias clínicas, lo que reduce el posible riesgo de clasificación errónea asociado con la dependencia de los códigos administrativos únicamente. El análisis se basó en una definición de hemorragia muy aceptada y reproducible, que tiene en cuenta su gravedad para comparar los riesgos relativos de muerte. No solo se tiene en cuenta la gravedad de los eventos hemorrágicos, sino también la gravedad y el tipo de los eventos embólicos. Cabe destacar que, a diferencia de la mayoría de los estudios sobre el impacto pronóstico de las hemorragias, los resultados no se limitaron a 30 días. Se analizó la relación temporal con la mortalidad en un seguimiento medio de 4 años. Por último, se proporcionaron datos apropiados sobre cómo varía la mortalidad en función de la exposición a la ACO. En conjunto, estos factores confieren un alto valor clínico a los resultados.
Este estudio también tiene una serie de limitaciones. En primer lugar, las inherentes a su naturaleza observacional y retrospectiva. En segundo lugar, la interrelación entre hemorragias, embolias y mortalidad es muy compleja, y no fue posible explicar todos los posibles factores implicados en su relación causal. En este sentido, se carece de datos sobre cómo la transformación de un ictus isquémico a hemorragia explica el exceso de riesgo de muerte con la embolia mayor frente a la HM extracraneal. En tercer lugar, no hay datos sobre los sangrados clínicamente no relevantes, aunque es poco probable que esto cambie los resultados, ya que tales hemorragias no parecen relacionados con un peor pronóstico en cuanto a mortalidad19. Cuarto, no hay datos sobre los cambios terapéuticos en la anticoagulación tras el evento embólico o hemorrágico. Por último, se centró la atención en la mortalidad como objetivo primario; no se exploraron otros objetivos interesantes, como el impacto de los eventos embólicos y hemorrágicos en la calidad de vida.
CONCLUSIONESLos eventos embólicos y hemorrágicos influyen considerablemente en la mortalidad de los pacientes ancianos con FA, con similar evolución temporal. Los eventos embólicos se relacionan con mayor riesgo de muerte que la hemorragia extracraneal, salvo por los AIT, que tienen un mejor pronóstico. En el caso de la HIC, el riesgo de muerte es similar que con embolia mayor. Estos resultados pueden ayudar a los médicos a interpretar el perfil de riesgos y beneficios de los fármacos anticoagulantes.
FINANCIACIÓNDaiichi Sankyo, Bayer, Boehringer Ingelheim y Pfizer han financiado este estudio.
CONTRIBUCIÓN DE LOS AUTORESS. Raposeiras-Roubín: diseño del estudio, análisis de los datos, redacción del manuscrito y presentación del artículo. E. Abu-Assi: diseño del estudio, análisis de los datos y revisión crítica del artículo. M. Cespón Fernández: obtención de los datos y revisión crítica del artículo. S. Blanco Prieto: obtención de los datos y revisión crítica del artículo. C. Barreiro Pardal: obtención de los datos y revisión crítica del artículo. P. Domínguez-Erquicia: obtención de los datos y revisión crítica del artículo. M. Melendo Viu: obtención de los datos y revisión crítica del artículo. C. Bonanad Lozano: análisis de los datos y revisión crítica del artículo. X. Rosselló: análisis de los datos y revisión crítica del artículo. B. Ibáñez: diseño del estudio y revisión crítica del artículo. A. Íñiguez Romo: diseño del estudio y revisión crítica del artículo.
CONFLICTO DE INTERESESE. Abu-Assi es editor asociado de Revista Española de Cardiología. Se ha seguido el procedimiento editorial de la Revista para asegurar la gestión imparcial del artículo.
- –
Tanto los eventos embólicos como los hemorrágicos se relacionan con un peor pronóstico en pacientes con fibrilación auricular. El impacto en la mortalidad se ha confirmado a corto y a largo plazo, sobre todo en el caso de los eventos embólicos. No obstante, ¿qué eventos tienen mayor impacto en la mortalidad: las embolias o las hemorragias?
- –
Este es el primer estudio que compara la mortalidad a largo plazo asociada con eventos embólicos frente a hemorrágicos en una población de pacientes ancianos con fibrilación auricular. Se llevó a cabo un análisis comparativo del impacto en la mortalidad según los tipos de embolia y hemorragia. En general, los eventos embólicos se relacionarían con un mayor riesgo de muerte que los hemorrágicos. Esto debería llevar a una reflexión sobre la necesidad de considerar la anticoagulación para los pacientes ancianos independientemente de su edad.